垂体促性腺激素腺瘤3例
樊帆 何小静 李晓冬 张媛
功能性促性腺激素腺瘤(Functional gonadotroph adenomas,FGAs)是一种罕见的垂体良性肿瘤,分泌有活性的卵泡刺激素(FSH)和/或黄体生成素(LH),临床以分泌活性的FSH垂体腺瘤多见。FGAs的临床症状包括多囊卵巢综合征(PCOS)、不孕症、月经不调、女性卵巢过度刺激综合征(OHSS)、男性睾丸肥大和性功能障碍[1]。其确切的发病机制不明,术前诊断困难,多因颅内压迫症状就诊,发现时已为大腺瘤。若充分认识可早期识别FGAs,避免不必要的妇科手术,减小脑部手术风险。现将本院收治的3例FGAs结合文献复习报道如下。
病例资料
病例1,患者女性,30岁,主因“发现双侧卵巢增大10个月,明显增大伴腹痛2周”于2016年5月3日入院。既往8年前于“孕14周、自然流产”后出现双侧乳房溢乳,未给予治疗。5年前发现“甲状腺功能减退症”,规律服用“左甲状腺素钠片”75 ug/d。3年前因“阴道大量出血”行“刮宫术”,病理为子宫内膜单纯性增生,给予醋酸甲地孕酮片120 mg Tid。因双乳溢乳规律服用溴隐亭。2年前查垂体MRI,考虑垂体瘤,定期复查,垂体瘤体积逐渐增大。垂体MRI(2016-05):考虑垂体瘤(2.96 cm×0.82 cm×1.2 cm)。10个月前查体发现双卵巢增大,具体大小不详,定期复查。两周前出现腹痛,间断性,可忍受,查妇科超声示:双卵巢内暗区待诊(左9.99 cm×7.23 cm×5.78 cm,右9.55 cm×6.27 cm×5.31 cm),雌二醇(E2)2 302 pg/mL,于2016年5月3日入院。
入院检查:一般状况良好,甲状腺Ⅰ度肿大,无复视、视野缺损等表现。
辅助检查:性激素:PRL 24.54 ng/mL、E21 823 pg/mL、FSH 6.89 mIU/mL、LH 0.72 mIU/mL。甲状腺功能:TSH 4.64 mIU/L、T33.67 pmol/L、T417.00 pmol/L、甲状腺过氧化物酶抗体172 IU/mL、抗甲状腺球蛋白抗体167 IU/mL。妇科超声示:子宫体前位,大小约6.34 cm×7.22 cm×5.11 cm,子宫内膜厚约0.76 cm,左卵巢大小约9.99 cm×7.23 cm×5.78 cm,右卵巢大小约9.55 cm×6.27 cm×5.31 cm,双卵巢内均可见多个强回声分隔,分隔内见环状强回声。甲状腺超声:(1)甲状腺回声增粗;(2)甲状腺双叶低回声病变。垂体核磁平扫:垂体柄弯曲并向右侧偏移,大小约2.96 cm×0.82 cm×1.20 cm,视交叉上移,鞍内可见一大小约1.7 cm×1.0 cm×1.2 cm团块样强化,病变包绕部分左侧颈内静脉(图1)。
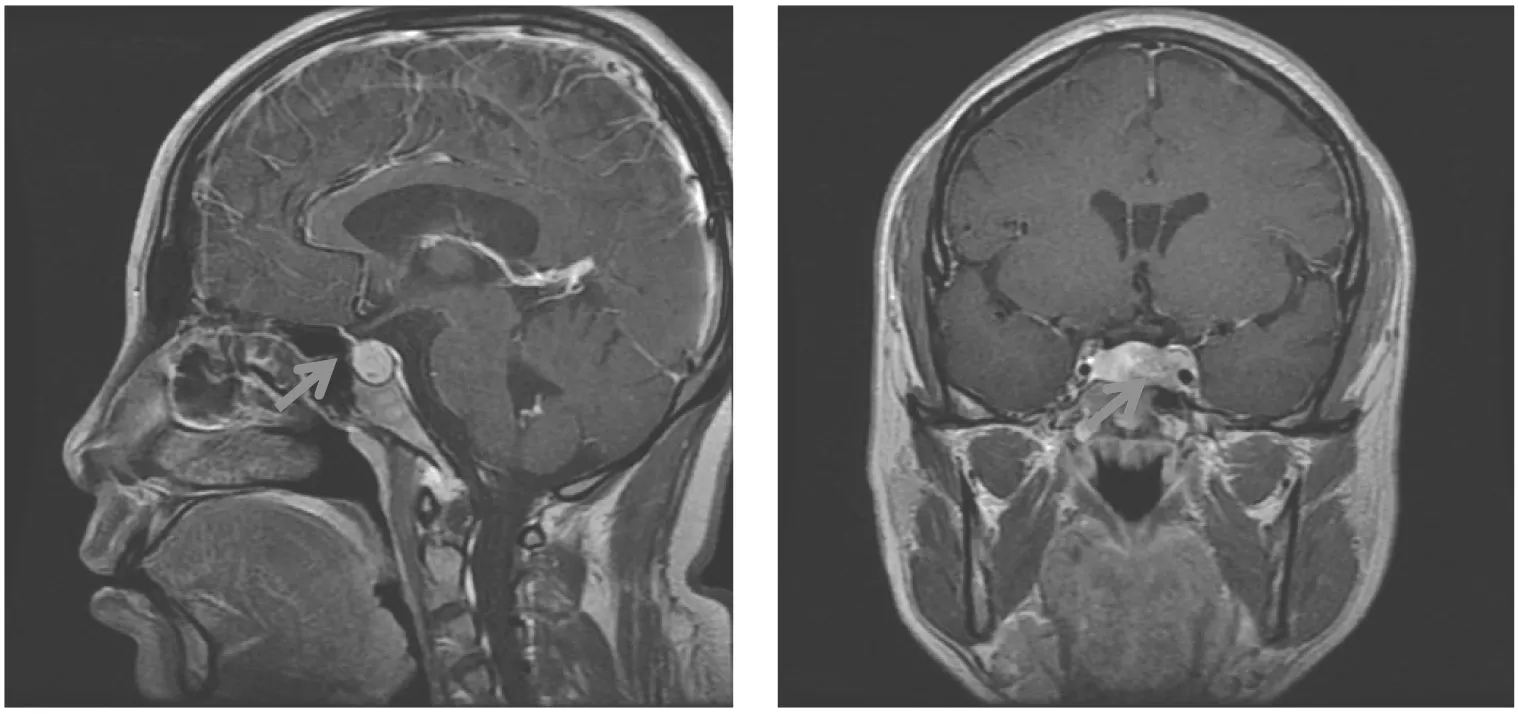
注:箭头指垂体占位图1 患者1垂体MRI
入院诊断:1.双侧卵巢增大原因待诊;2.甲状腺功能减退症;3.垂体瘤。
治疗:考虑患者卵巢增大与垂体瘤可能相关,于2016年5月19日行“神经内镜下经鼻蝶鞍垂体瘤切除术”。术后病理结回报:垂体腺瘤,免疫组化结果显示:CD56(+)、CgA(+)、CKpan(-)、GFAP(-)、Ki67(+约1%)、S-100(个别+)、Syn(+)、Vimentin(-)。术后1~10个月患者月经及激素水平恢复正常,卵巢囊肿逐渐缩小。术后11个月因经期延长再次诊刮,病理:子宫内膜非典型增生,伴多灶鳞化,给予醋酸甲地孕酮分散片80 mg/d口服3个月,3个月后复查宫腔镜,诊刮病理示:腺体萎缩,聚藻腺上皮嗜酸性化生,间质蜕膜样变;予左炔诺孕酮宫内缓释系统放置。术后14个月复查超声双侧卵巢再次增大,雌激素水平上升,考虑复发,于2017年8月29日于北京天坛医院行垂体瘤伽马刀治疗(周边剂量14 Gy,中心剂量28 Gy)。
病例2,患着女性,43岁,主因“双卵巢肿物剥除术后半年,复发3个月”于2017年12月4日入院。6月前因“经期延长2年,发现卵巢肿物1年”于当地医院行“腹腔镜下双侧卵巢囊肿剔除术”,术后病理:(左、右)卵巢滤泡囊肿。3个月前就诊于本院妇科复查B超示:左卵巢大小约6.77 cm×4.13 cm,内4/5为暗区,暗区内见多条强回声分隔,右卵巢大小约2.75 cm×2.25 cm。垂体核磁平扫+增强:垂体右侧份异常强化结节,大小约0.4 cm×0.8 cm,考虑垂体瘤(图2)。双卵巢囊肿病理本院会诊结果:(左右侧)均考虑滤泡囊肿;北医三院病理会诊结果:(左、右卵巢)符合囊性颗粒细胞瘤。近3个月雌激素水平波动于523.13 pg/mL~554.00 pg/mL,为求进一步治疗入院。

注:箭头指垂体占位图2 患者2垂体MRI
入院后复查妇科超声:左卵巢大小约6.79 cm×4.15 cm,内4/5为暗区,暗区内见多条强回声分隔,右卵巢大小约5.48 cm×3.19 cm,内4/5为暗区,暗区内见一条强回声分隔。
行“腹腔镜下右侧附件切除术+左输卵管系膜囊肿剥除术+盆腔粘连松解术”,术后病理结果:(右侧附件)经详细取材及对多个囊性肿物囊壁的观察,病变符合多发性滤泡囊肿;(左侧输卵管系膜囊肿)良性残件性囊肿。术后复查激素:E265.00 pg/mL、PRL 31.54 ng/mL。术后2个月复查激素E2679.00 pg/mL、PRL 40.26 ng/mL。
于2018年2月6日入住本院神经外科,予“神经内镜下经鼻蝶鞍垂体瘤切除术”,术后病理回报:(鞍区占位)结合常规形态学及免疫组化结果,符合良性神经内分泌肿瘤,结合部位考虑为垂体腺瘤,具体类型请结合血清学检查;免疫组化结果:TIF-1(-),S-100(-),SK混(+),Ki-67(3%+),CgA(+),CD56(部分阳性)。术后复查E257.0 pg/mL,术后1个月复查E224.88 pg/mL、PRL 7.20 ng/mL;B超:左卵巢内可探及大小约1.7 cm×0.5 cm囊实性回声。术后5个月复查E217.06 pg/mL、PRL 5.10 ng/mL;B超:左卵巢可见,大小形态未见明显异常。患者术后月经正常来潮。
病例3,患者女性,31岁,主因“月经不规律伴溢乳2年”于2020年1月20日入院。患者2年前无明显诱因出现月经不规律、推迟、量少,伴溢乳,无头晕、头痛、恶心乏力,无肢体无力,无大小便失禁。当时就诊于河北阜平医院,查妇科超声示:卵巢多囊,予保守治疗,病情未见好转。2月前于阜平医院行卵巢囊肿切除术,术后复查性激素:E2687 pg/mL、PRL 85.77 ng/mL,为求于进一步治疗2020年1月20日收入本院。
入院检查:神清语利。双侧瞳孔正大等圆,颈软无抵抗。心肺腹未见明显异常。四肢张力反射正常,病理征阴性。
垂体MR提示:鞍区及鞍上异常信号,考虑垂体大腺瘤,建议MR强化扫描。
于2020年3月12日在全麻下行神经内镜下经鼻蝶鞍垂体肿瘤切除术,手术顺利。术后病理回报:垂体腺瘤。免疫组化:THS(-)、FSH(+)、GH(灶+)、LH(-)、ACTH(弱+)、prolactin(+)。术后复查激素:PRL 35.81 ng/mL、E2776 pg/mL。复查头颅CT:颅内情况平稳。
讨论
FGAs是一种罕见的垂体良性肿瘤,在女性群体中好发于育龄期妇女,偶可见于青春期及绝经后女性[2]。第一例FGAs的报道是在1995年[3],至今全球仅报道了34例FGAs[4]。据估计,FGA的患病率为所有无功能垂体瘤和性腺营养腺瘤的2.9%~8.1%[5]。
与其他有特征性的垂体功能腺瘤不同,FGAs的临床症状和体征往往是模棱两可的。常见的症状包括PCOS、不孕症、月经不调、溢乳、女性OHSS、男性睾丸肥大和性功能障碍[1]。OHSS是辅助生殖过程的典型并发症,它与垂体促性腺激素腺瘤过度产生FSH有关[6]。OHSS会导致腹腰围增加,卵巢囊肿体积增加,以及腹痛和盆腔疼痛,这可以是慢性的也可以是急性的[7]。育龄期FGAs患者常因下腹部疼痛不适、月经异常或溢乳就诊而进行内分泌检查,所以相比较于男性来说,诊断相对较早。男性的症状如睾丸肥大和性功能障碍,他们在就诊时往往会归因于一些其他的诊断,如衰老、前列腺功能障碍或心血管疾病等,这些症状有时可以通过一些其他的药物来掩盖或治疗,从而延误了FGAs的诊断和治疗[1]。
FGAs的诊断首先要考虑患者的临床特点。OHSS多见于辅助生殖技术超排卵患者中,卵巢过度刺激而产生多个囊肿,毛细血管通透性增加,体液渗出,这可能导致腹水或水肿[8]。FGAs患者表现的OHSS与促排卵过程中应用促性腺激素类似物导致的OHSS不同,常仅表现为双侧卵巢多囊样增大,无腹水、电解质紊乱及血液浓缩等表现。第二个独特特征是患者的内分泌状况,多数FGAs病例表现为FSH水平正常或轻度升高,LH水平降低,E2水平增高,前两例病例均呈现典型的激素特点,应怀疑性腺腺瘤,并进行脑MRI或计算机断层扫描CT。FGAs患者中,高水平E2可以刺激PRL水平升高,且增大的肿瘤压迫垂体柄,多巴胺的抑制性调节受阻,而引起高PRL血症,临床表现为溢乳,病例1和3均有溢乳症状。此外,因高水平E2的存在,应高度警惕子宫内膜病变的发生,如病例1中患者反复出现子宫内膜病变。
由于FGAs临床表现多样,缺乏特异性,在诊疗的各个环节,需特别注意与原发性甲状腺功能减退症、PCOS、卵巢肿瘤的鉴别。
原发性甲状腺功能减退症是一种全身性内分泌疾病,也可以引起女性患者双侧卵巢的多囊样改变,影响生育功能。病例1中患者虽然存在甲状腺功能减退症,但其TSH水平仅轻度升高,虽然并不能完全排除卵巢多囊样改变与此相关,但垂体手术后患者卵巢囊肿逐渐缩小,考虑还是FGAs所致。
PCOS是导致月经异常及不孕的常见原因,其生化表现通常为雄激素增高及FSH/LH比值降低,卵巢体积仅轻度增大,囊肿直径通常不超过1 cm[9],而FGAs患者盆腔影像学显示双侧卵巢多囊性增大(通常>5 cm)[10]。双侧卵巢上多个囊肿的存在也是OHSS的一个特征,但不是多囊卵巢的一个特征[11]。另外,当发现FSH/LH比值升高及高雌激素血症时,及时进行垂体筛查十分必要。
卵巢囊性颗粒细胞瘤较罕见,仅占卵巢恶性肿瘤的2.0%~5.0%,单侧多发,多数可分泌E2,少量分泌雄激素。病理诊断中卵巢囊性颗粒细胞瘤标本中发现Call-Exne小体较易诊断,其次细胞核大深染、出现核沟或核折叠呈现“咖啡豆”样表现及较少的黄素化表现也是鉴别要点[12]。其与卵巢滤泡囊肿的鉴别较困难,卵巢滤泡囊肿镜下内层覆颗粒细胞且层数较少,外层被覆均一的卵泡膜细胞层,少见或无细胞异质性[13]。病例2第一次病理会诊结果与第二次不符,考虑可能是标本陈旧原因,外层卵泡膜细胞退化消失,仅剩胶原残留所致,可见卵巢囊性颗粒细胞瘤与卵巢滤泡囊肿容易混淆导致误诊。FGAs在光学显微镜下显示:大多数促性腺激素腺瘤由较一致的高的极向性细胞组成,肿瘤细胞形成窦隙状排列的血管周围假“菊形团”样结构,另一种呈不常见的乳头状排列。特征性免疫组织化学染色表现为呈片状、不均匀分布的阳性区域与阴性区域相互交错[14]。FGAs与卵巢囊肿的鉴别至关重要。有文献报道,1例卵巢囊肿剥除术后复发患者由于前期误诊误治导致卵巢功能损伤而提前绝经。故育龄女性发生持续的多发性卵巢囊肿时,应进行详细的内分泌及影像学检查,避免不必要的卵巢手术[15]。
治疗FGAs的主要目的是去除垂体肿瘤,故以手术治疗为主。经蝶窦切除是首选的初步治疗方法。切除肿瘤可以改善内分泌功能障碍,改善视力障碍,改善性和生殖功能,并提供决定性的病理诊断。通过切除垂体腺瘤可消退扩大的多囊卵巢和恢复正常的月经周期,而无需对卵巢进行干预[16]。另外,当出现严重OHSS时,被认为是一种相对的外科紧急情况,考虑到附件扭转的不可预测的风险,特别是在卵巢囊肿的情况下,手术不应被过度延迟,以防耽误治疗时机[7]。基于目前的病例报道来看,FGAs患者术后2 ~ 5年病情相对稳定,随着时间的延长存在肿瘤再生和复发的病例,如Pentz-Vidovíc等人发现患者在手术后6年肿瘤复发[17],复发的诱因尚未确定,复发的患者需重复手术、放疗,目前无疗效可观的药物治疗。术后随访是监测内分泌功能和检测肿瘤复发的当务之急[1],因此做好术后的随访工作也是必不可少的关键步骤。
总之,FGAs的诊断需综合考虑临床特征、内分泌及病理结果。加强临床医生对此病的认识,早诊断早治疗,避免对卵巢囊肿进行不必要的手术,改善肿瘤压迫症状,改善激素分泌后遗症,尽早恢复患者生育能力。

