应用磁热疗法治疗膝骨关节炎的疗效观察及机制

摘要:目的 结合传统热疗理念与磁感应技术,原创性用磁热疗法治疗膝骨关节炎(knee osteoarthritis, KOA)并探索其机制,以建立具有现代医学特色的KOA治疗新方法。方法 建立大鼠原发性KOA模型,并构建以涡旋磁氧化铁纳米环为平台的高效磁热疗介质,在低强度磁场条件下对KOA病灶部位进行精准控温加热,通过痛觉、膝关节组织病理学、膝关节形态和MicroCT显微骨结构变化等临床指标检测及血清炎症因子含量测定等,观察磁热治疗KOA的疗效及机制。结果 经磁热治疗后大鼠的机械痛阈值相比模型组提高了约48.9%,关节囊和滑膜组织充血、水肿及软骨表面磨损程度较模型组均明显减轻,Mankin及OARSI评分分别降低了约33%和20%,MicroCT结果显示软骨下骨的硬化程度有所改善,血清中炎症因子含量降低。结论 利用涡旋磁氧化铁纳米环设计并构建高效磁热疗纳米制剂,应用于KOA的治疗有确切疗效,其机制与抑制炎症因子有关。
关键词:膝骨关节炎;磁热疗法;涡旋磁氧化铁纳米环;MicroCT
中图分类号:R318
文献标志码:A
DOI:10.7652/jdyxb202305018
收稿日期:2023-01-06
修回日期:2023-06-29
基金项目:陕西省自然科学基础研究计划(No.2021JM-476);陕西省中医药管理局-资助类项目(No.2021-ZZ-JC007);陕西省中医药管理局-骨退行性疾病中西医结合防治“双链融合”中青年科研创新团队(No.2022-SLRH-LJ-001);陕西中医药大学-校级课题(No.2023-GP-002)
Supported by the Natural Science Basic Research Program of Shaanxi Province (No.2021JM-476), the Shaanxi Administration of Traditional Chinese Medicine (No.2021-ZZ-JC007, 2022-SLRH-LJ-001), and Shaanxi University of Chinese Medicine (No.2023-GP-002)
通信作者:高飞,讲师.E-mail:gaofei@sntcm.edu.cn;袁普卫,教授.E-mail:spine_surgeon@163.com
网络出版地址:https://kns.cnki.net/kcms2/detail/61.1399.R.20230718.1343.004.html (2023-07-19)
The curative effect and mechanism of magnetic hyperthermia
in the treatment of knee osteoarthritis
GAO Fei1, DU Longlong2, WANG Tong2, LI Xuefeng2, ZHONG Yuke2,
GAO Qimeng2, CHEN Rui2, YUAN Puwei2, ZHAO Lingyun3
(1. Institute of Integrated Medicine, Shaanxi University of Chinese Medicine, Xianyang 712046;
2. The Affiliated Hospital, Shaanxi University of Chinese Medicine, Xianyang 712000;
3. School of Materials Science amp; Engineering, Tsinghua University, Beijing 100084, China)
ABSTRACT: Objective We combined the concept of traditional medicine with magnetic induction technology, originally brought up the research concept of magnetic hyperthermia to cure KOA, explored the mechanism and constructed a new treatment of KOA with modern medical features. Methods Through establishing a primary KOA model in rats and constructing" ferrimagnetic vortex domain iron oxide nanorings (FVIOs) as a platform for highly efficient magnetic hyperthermia agent, the lesions of KOA were heated accurately under the low-intensity magnetic field. We confirmed the curative effect through the results of pain perception, histopathology, knee joint morphology and microscopic bone structure and the content of serum inflammatory factor, to study the therapeutic mechanism of magnetic hyperthermia for KOA. Results Compared with the model group, the recovery of mechanical pain threshold after magnetic hyperthermia improved by approximately 48.9%; the degree of hyperemia and edema of joint capsule and synovial tissue and the wear degree of joint cartilage surface, were significantly reduced; the Mankin and OARSI scores decreased by about 33% and 20%, respectively; the MicroCT results indicated that the degree of hardening of the subchondral bone also improved; the expression of inflammatory factors in the serum was reduced. Conclusion In this study, we utilized the FVIOs as a high-efficiency magnetic hyperthermia platform for the treatment of KOA. The efficacy of magnetic hyperthermia on KOA is clarified, and the mechanism is related to the inhibition of inflammatory factors.
KEY WORDS: knee osteoarthritis; magnetic hyperthermia; ferrimagnetic vortex domain iron oxide nanoring; MicroCT
膝骨关节炎(knee osteoarthritis,KOA)是中老年人常见、多发且较难治愈的一种慢性退行性疾病,占骨关节炎总发病率的80%以上[1-2]。流行病学调查显示,我国约1/3中老年人患有KOA,超过1亿的人群受累于KOA所带来的困扰[3]。KOA起病隐匿,若缺乏有效干预,终末期往往发展成为严重关节功能障碍,严重影响患者生活质量[4]。因此,探索安全有效的治疗手段,提高KOA的临床疗效,对改善中老人生活质量及减轻社会医疗负担具有重要意义。
目前KOA临床治疗方式主要包括口服、关节腔注射药物及手术等,大多数治疗主要集中在缓解疼痛和改善关节功能,但往往存在药物不良反应、潜在手术风险和较高的医疗费用[5]。近年来,热疗被广泛应用于KOA的临床治疗中,常见的包括热敷、熏蒸及蜡疗等[6-7]。研究表明,适度热疗(40~45 ℃)可改善局部血液流变学和血液动力学性质,加快病理性废物的去除;同时,抑制细胞和体液介导的免疫炎症反应,有效改善慢性疼痛等症状[8]。尽管疗效确切,但热疗的应用也面临一些瓶颈问题,如温度不易控制,而且随着与热源之间距离的增大,温度急剧降低,无法对膝关节深层病灶进行有效加热。特别是热疗时通过温热刺激对局部免疫炎症反应产生影响的机制及其物理热特性与疗效间的量效关系均仍未完全明晰。因此,采用精准可控、安全高效的热疗手段对KOA进行治疗,并从量效关系等方面展开研究,具有基础研究和临床应用的双重意义。
随着生物医学工程及纳米材料等领域的迅速发展,特别是氧化铁材料介导磁场而出现的磁热疗技术,在肿瘤等重大疾病的治疗中已实现了临床转化[9]。该技术基于“磁性材料在交变磁场下升温”的原理,将磁性介质植入患者病灶部位并暴露于磁场时,由于磁介质的磁滞损耗等作用,将磁场能量转化为热量,迅速在病灶区域形成中高温区,达到精准施治的目的[10]。相比传统热疗,磁热疗法安全性高,温度精准可控,且无组织穿透深度限制,可实现靶向病灶区域的精准热疗[11-12]。此外,磁热疗热辐射如锥形向外发散,与传统热疗类似,为其效仿传统热疗治疗KOA的研究思路奠定了理论基础。同时,WANG等[13]在采用磁热疗对脊椎损伤动物进行治疗时发现,TNF-α、IL-1β等炎性因子的表达明显降低,模型动物关节损伤的恢复能力提高。该结果表明,磁热疗相比传统热疗优势明显,且具有调节免疫炎症的作用。
因此,本研究针对传统热疗方式的不足,利用具有优异磁学性能的涡旋磁纳米环设计出高效磁热疗介质,在低强度磁场条件下实现对病灶区域精准温控热疗。通过建立原发性KOA动物模型,从组织病理、软骨下骨显微结构等方面评估磁热疗法在KOA治疗中的疗效和优势,并检测TNF-α、IL-1β及MMP-13等炎性因子的含量,初步探讨磁热疗法对KOA免疫炎症的相关调节机制。
1 材料与方法
1.1 实验材料及仪器设备
氯化铁六水化合物、三辛胺等常规化学试剂均购自Sigma-Alrich公司,聚乙二醇衍生物(DSPE-PEG-5000)购自上海西宝生物科技有限公司,ELISA试剂盒购买自上海碧云天生物技术研究所。仪器设备:扫描电镜(SEM,FA2004,日本蔡司),透射电镜(TEM,Tecnai G2F20S-TWIN,美国FEI),振动样品磁强计(VSM,Model 735,美国LakeShore),卧式石英管式炉(OTF-1200X,沈阳科晶自动化设备公司),磁感应加热设备(SPZ-10-II,深圳双平电源技术有限公司)及MicroCT小动物活体扫描系统(Skyscan 1276,比利时Bruker)等。
1.2 涡旋磁纳米环(FVIOs)的合成及表面修饰
FVIOs的合成按文献报道方法[14]。首先通过水热法合成α-Fe2O3:0.8 mL FeCl3·6H2O(0.5 mol/L)水溶液、0.7 mL NH4H2PO4(0.02 mol/L)水溶液和38.5 mL去离子水混合于50 mL水热反应釜,220 ℃反应48 h后,乙醇和水洗3次,80 ℃烘干,得到α-Fe2O3纳米环粉末。称量一定量的α-Fe2O3放于卧式石英管式炉,以200 标况毫升每分(standard-state cubic centimeter per minute,sccm)流量通入5% H2/95% Ar,380 ℃还原3 h,得到FVIOs。
FVIOs的水相分散采用油酸包覆-配体交换的方法,将DSPE-PEG-5000连接在FVIOs表面[15]。将5 mL三辛胺及0.8 g油酸装入三口烧瓶中,通入Ar并升温至120 ℃,加入20 mg FVIOs,升温至280 ℃,保温0.5 h,得到FVIOs-油酸并分散于氯仿中。将100 mg DSPE-PEG-5000溶于6 mL 氯仿中,加入分散于氯仿中的FVIOs(20 mg),氯仿挥发后加水离心,将沉淀分散于水中;1 000 r/min 离心10 min,取上清并用0.22 μm的滤膜过滤,储存待用。
1.3 FVIOs的体外及体内磁热性能测试
FVIOs在交变磁场下的磁热转换效率一般用比吸收速率(SAR)进行评估。测定溶液在磁场下的升温曲线,通过温度-时间的指数函数曲线中初始阶段的最大斜率(ΔT/Δt)计算SAR[14]。计算公式:SAR=ΔTΔt1mFe(式中,T表示温度,t为时间,mFe为溶液中Fe的质量分数)。
体外测试:在离心管中分别加入1 mL不同Fe含量(0.125、0.25、0.5 mg/mL)的FVIOs溶液,通过磁感应加热设备(SPZ-10-Ⅱ)对溶液进行加热,1.5 s记录1次温度。磁场参数为320 kHz、390 kHz、480 kHz;120 Oe。
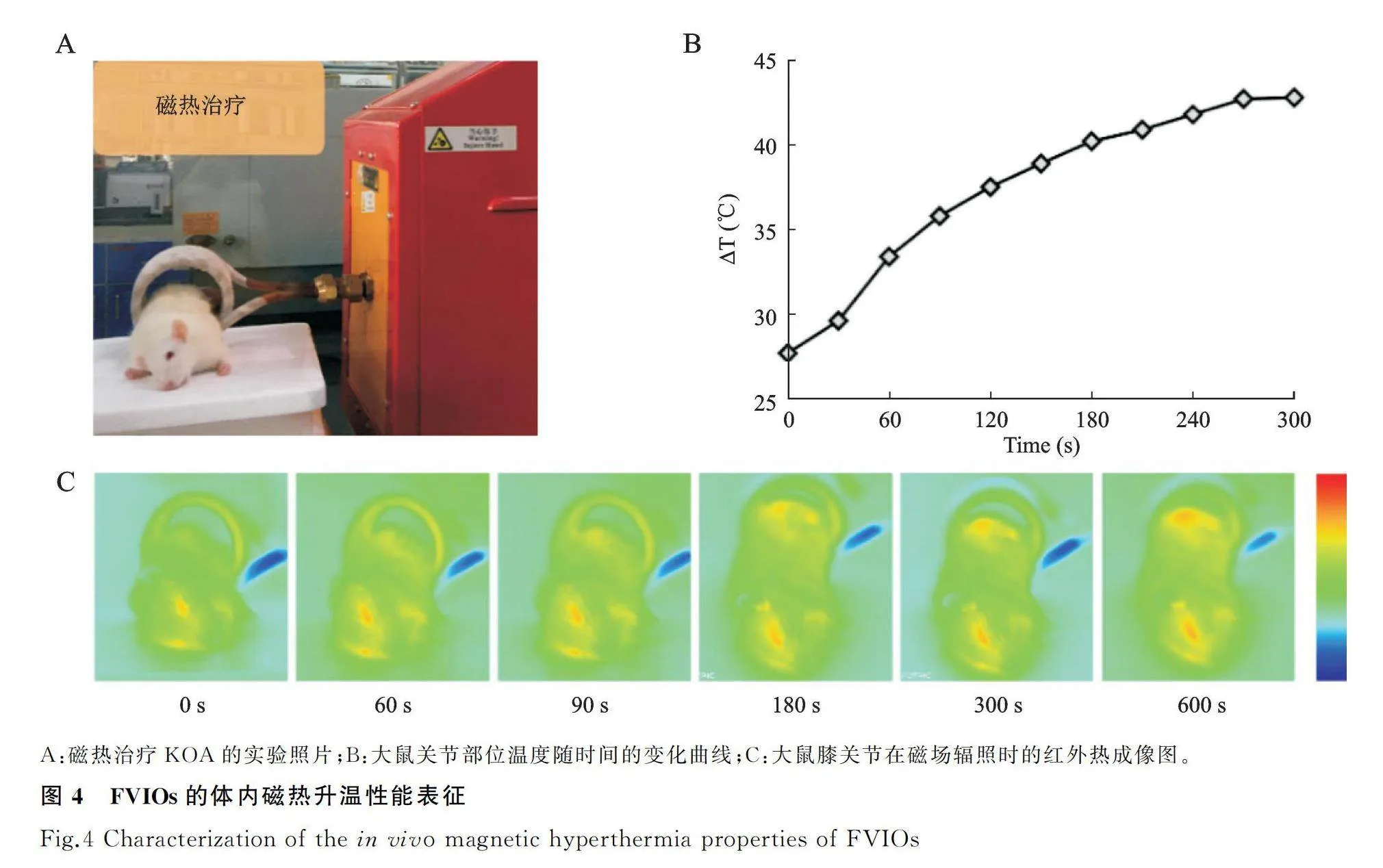
体内测试:动物行异氟烷麻醉后,将50 μL(0.25 mg/mL)FVIOs/生理盐水混悬液进行关节腔介入,15 min后将大鼠置于交变磁场下辐照20 min,采用红外热成像仪记录关节部位的升温曲线。磁场参数为390 kHz,120 Oe。
1.4 KOA动物模型建立及评价指标
本研究所涉及的动物实验均严格依照陕西中医药大学实验动物管理及伦理委员会规章的指导实施。5月龄雌性大鼠,采用双侧卵巢切除法建立原发性KOA动物模型[16]。模型组大鼠麻醉后侧位固定,背部开口,分离肤—筋膜—肌肉,在脂肪团附近找到卵巢,在其下方结扎并剪下卵巢。将脂肪组织放回并缝合,涂抹红霉素软膏并肌内注射青霉素;假手术组手术时不切除卵巢,其余同模型组。术后4周,假手术组和模型组各随机选取4只大鼠进行模型评价。测量膝关节直径变化,并通过HE染色观察KOA大鼠建模前后膝关节形态、软骨及软骨下骨的骨质变化。
1.5 实验分组及干预方式
先将大鼠随机分为假手术组和造模组(假手术组10只,造模组30只);模型组行卵巢切除术后4周,按随机数表法分为模型组、磁热介质组及磁热治疗组(每组各10只),进行相应干预。假手术组和模型组继续饲养6周后取材;磁热介质组在进入干预周期的第1天关节腔内注射1次磁热介质(5 mg/kg),磁热介质组饲养6周后取材;磁热治疗组在第1天注射磁热介质后,于第3天、第7天及第14天各治疗1次(磁场参数390 kHz,120 Oe),6周后取材。
1.6 大体情况观察
观察大鼠的精神、活动、毛发光泽、对外源刺激的反应、食粮食水等;采用冰袋刺激患肢,观察动物的闪躲等反应;监测大鼠体质量变化。
1.7 机械性痛阈值(PWT)测定
采用Electronic von Frey在造模前(0 d)、造模期间(7 d)、造模结束(14 d)以及干预周期开始的第7、21、28、35、42天进行测定。将大鼠置于底为网格的有机玻璃格子内,适应20 min。打开Electronic von Frey并调零,压力传感器上的探针尖端垂直于测定点,逐渐增加压力,当大鼠表现缩足或舔舐反应时,电子显示屏上的数字即为机械性痛阈(g)。分别测量5次,其平均值为PWT。
1.8 ELISA检测血清中炎症因子
干预周期结束后,将大鼠麻醉后仰卧位固定,腹主动脉取血,将血液样本放置于4 ℃冰箱中24 h,离心取血清,采用ELISA法检测血清中TNF-α、MMP-13、IL-6及IL-1β的含量。
1.9 膝关节组织病理分析及关节退变评分
腹主动脉取血,小鼠死亡后,取左后下肢膝关节全关节标本,于40 g/L多聚甲醛溶液中固定48 h,100 g/L EDTA脱钙30 d后,进行石蜡包埋、切片、HE及番红固绿染色,观察胫骨平台内、外侧中央负重区的骨组织钙化层和软骨下骨病理改变情况。根据改进的Mankin’s评分及OARSI分级对关节软骨进行评分。
1.10 软骨下骨MicroCT分析
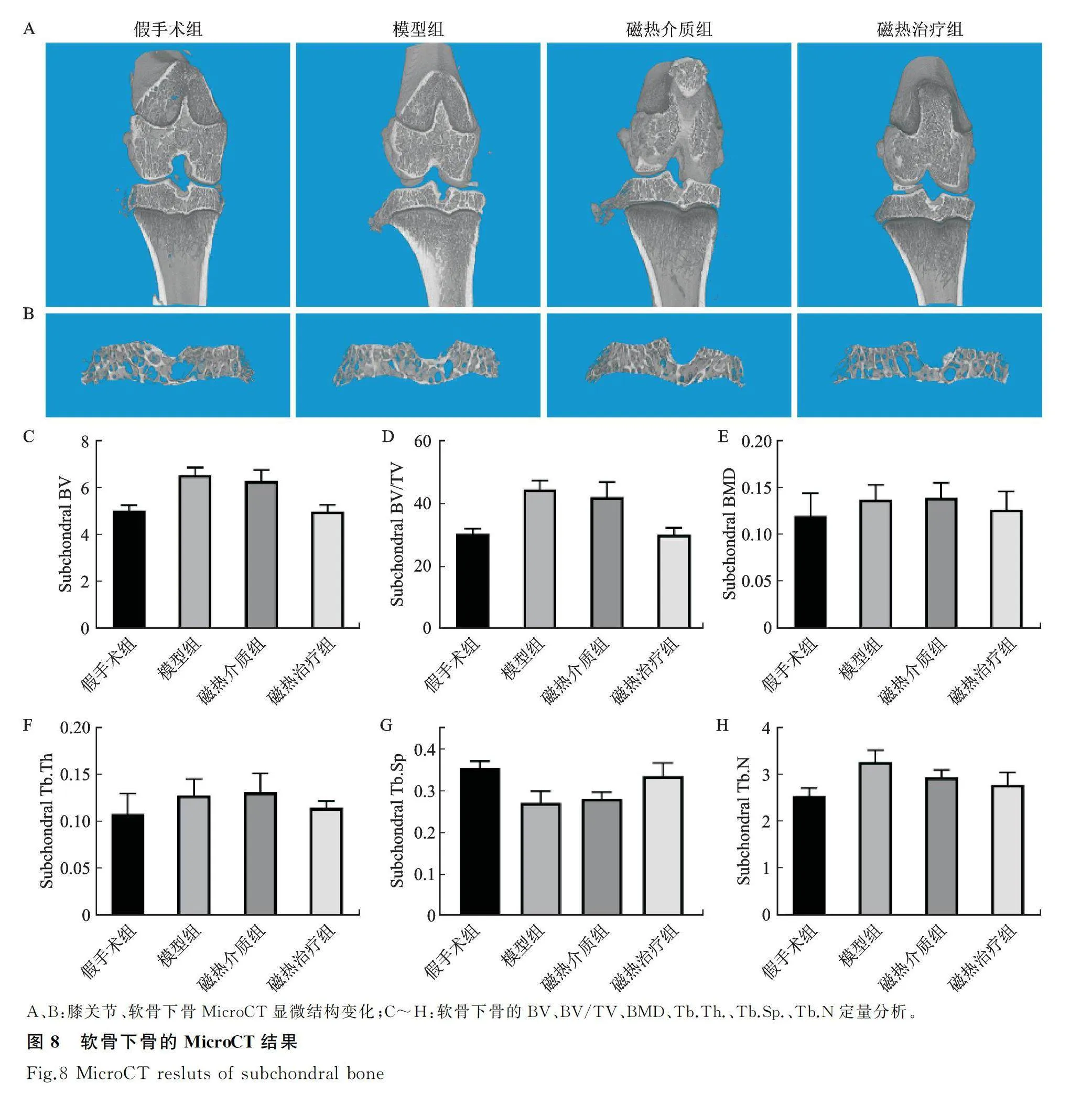
扫描电压60 V,电流200 μA,0.5 mm 铝过滤器,曝光时间550 ms,扫描分辨率为8 μm。应用三维重建处理软件NRecon及Data Viewer进行重建及选区,并采用CT Analyzer对图像中相同位置的软骨及软骨下骨区域进行定量分析。具体分析指标包括:软骨下骨体积(bone volume, BV, mm3)、软骨下骨体积分数(bone volume to tissue volume, BV/TV, %)、软骨下骨密度(bone mineral density, BMD, g/cm3)、软骨下骨小梁厚度(trabecular thickness, Tb.Th., mm)、骨小梁分离度(trabecular separation, Tb.Sp., mm)及软骨下骨小梁的数量(trabecular number, Tb.N., 1/mm)。
1.11 统计学分析
釆用SPSS 22分析软件,本研究所有相关实验检测均重复3次,对组间比较采用Student-Newman-Keuls (SNK),多个时间点的数据采用重复测量的方差及Bonferroni事后检验。以P<0.05认为差异有统计学意义。
2 结果
2.1 FVIOs的表征
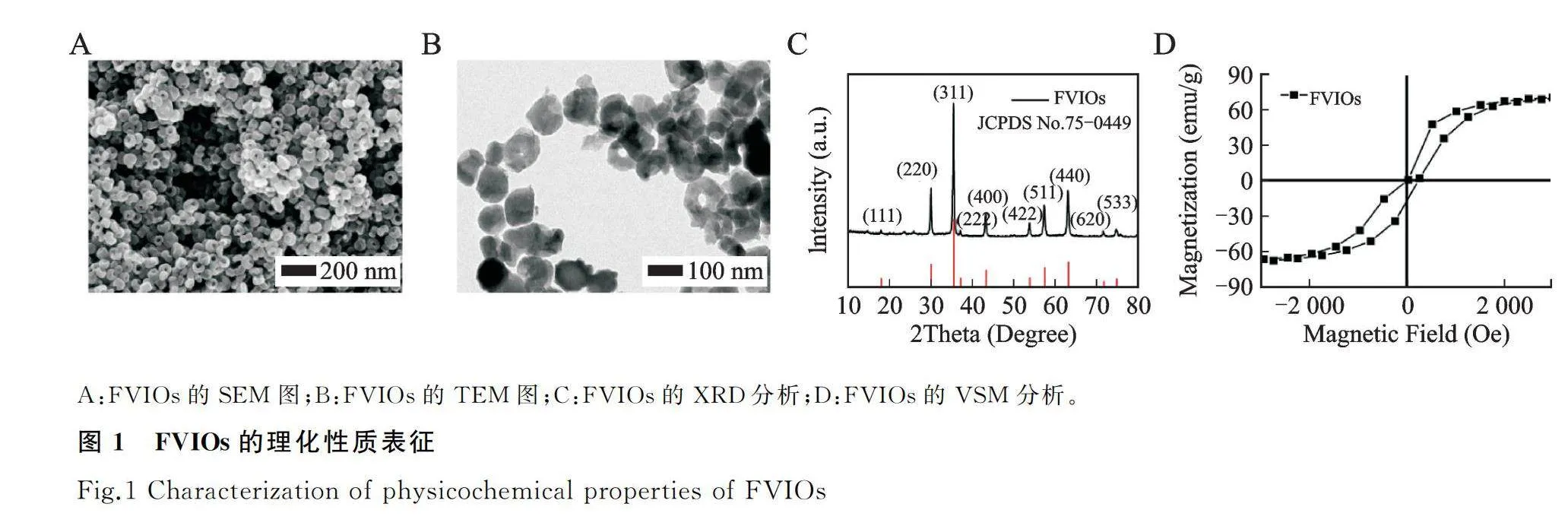
FVIOs的SEM及TEM图观察结果(图1A、图1B)显示,其具有统一的环状形貌,平均外径约70 nm,高约50 nm,内外径比约为0.6,属于稳定的涡旋磁畴区域[14]。XRD分析(图1C)显示FVIOs为立方反尖晶石结构的Fe3O4相(JCPDS No.75-0449)。VSM磁学表征(图1D)表明FVIOs有较大的磁滞面积和饱和磁化强度值(约70 emu/g),同时有很弱的矫顽力和剩磁。
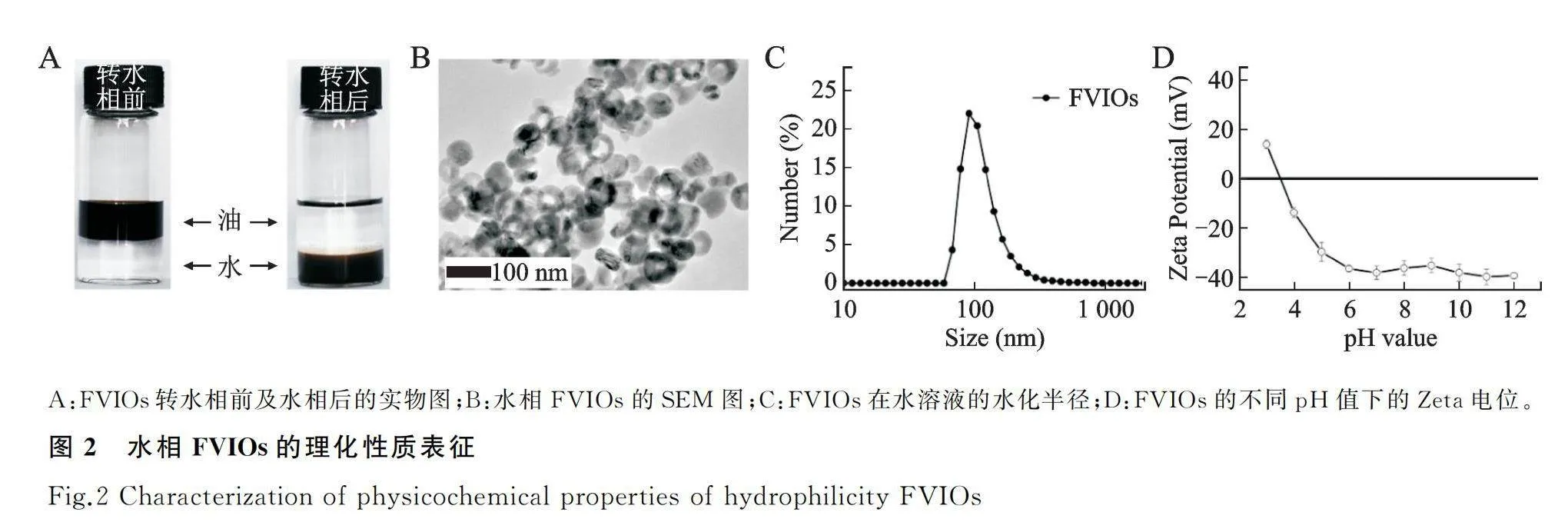
DSPE-PEG-5000修饰后的FVIOs可均匀分散至水相中(图2A)。TEM观察显示转水处理后的FVIOs形貌未发生明显变化(图2B)。其水动力学直径约为141 nm,略大于TEM尺寸(图2C),这可能是因为表面包覆的高分子层的影响。在pH>6时,Zeta电位稳定在-40 mV左右(图2D)。上述结果表明,经过聚乙二醇衍生物修饰后的FVIOs在水相中都具有良好的分散性,适于生物医学应用。
2.2 FVIOs的体外及体内升温性能
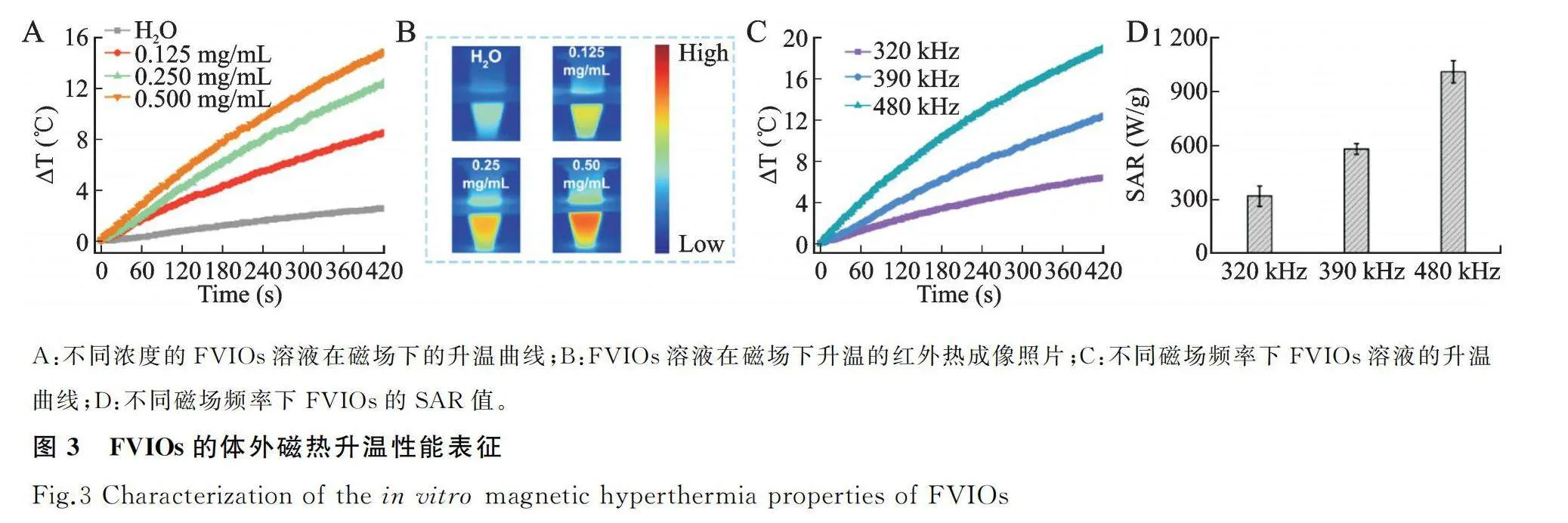
对不同浓度的FVIOs溶液在一定磁场条件下(频率390 kHz,强度120 Oe)的升温性能的测试结果显示,0.5 mg/mL的FVIOs作用时,在AMF下辐照7 min,温度15 ℃,而去离子水在同样磁场条件下几乎不升温(图3A)。红外热成像结果显示,FVIOs溶液温度分布比较均匀,且与光纤所测温度的变化趋势一致(图3B)。不同磁场条件下(320、390、480 kHz;120 Oe)确定浓度的FVIOs溶液(0.25 mg Fe/mL)升温曲线显示,磁场频率320 kHz时辐照7 min,FVIOs溶液仅可升温6.36 ℃,磁场调至480 kHz,溶液可升温18.87 ℃(图3C)。表明FVIOs升温速率随磁场频率的增强而增大。FVIOs的磁热转换效率(SAR)计算结果显示,在320、390、480 kHz时分别为310、607、1 085 W/g,也随着磁场频率的增高而升高(图3D)。
FVIOs的体内升温性能测试过程(图4A)和采用红外热成像仪记录的大鼠关节部位的温度随时间的变化观察结果(图4B)显示,注射FVIOs后,关节部位的温度在3~4 min后升到热疗所需温度(gt;41 ℃)。对应不同时间点的红外热成像图结果显示(图4C),大鼠的关节部位在3 min后即可升至41 ℃以上,并保持约10 min左右。在该过程中大鼠未出现其他不良症状,也证明了该方法应用于KOA治疗的安全性。
2.3 KOA模型及磁热疗的疗效评价
2.3.1 一般情况观察
假手术组大鼠皮毛顺滑光亮,对外源刺激反应迅速,喜活动,冰袋刺激膝关节后未出现明显扭动躲闪或保持肢体静立;模型组及磁热介质组大鼠对外源刺激反应缓慢,加强刺激后出现短距离跛行,懒食,造模处膝关节肿胀,活动少,冰袋刺激患肢出现剧烈扭动、抗拒躲闪;磁热治疗组大鼠的膝关节肿胀程度较模型组减轻,冰袋刺激患处膝关节后,闪躲与肢体抗拒扭动行为较模型组减缓。
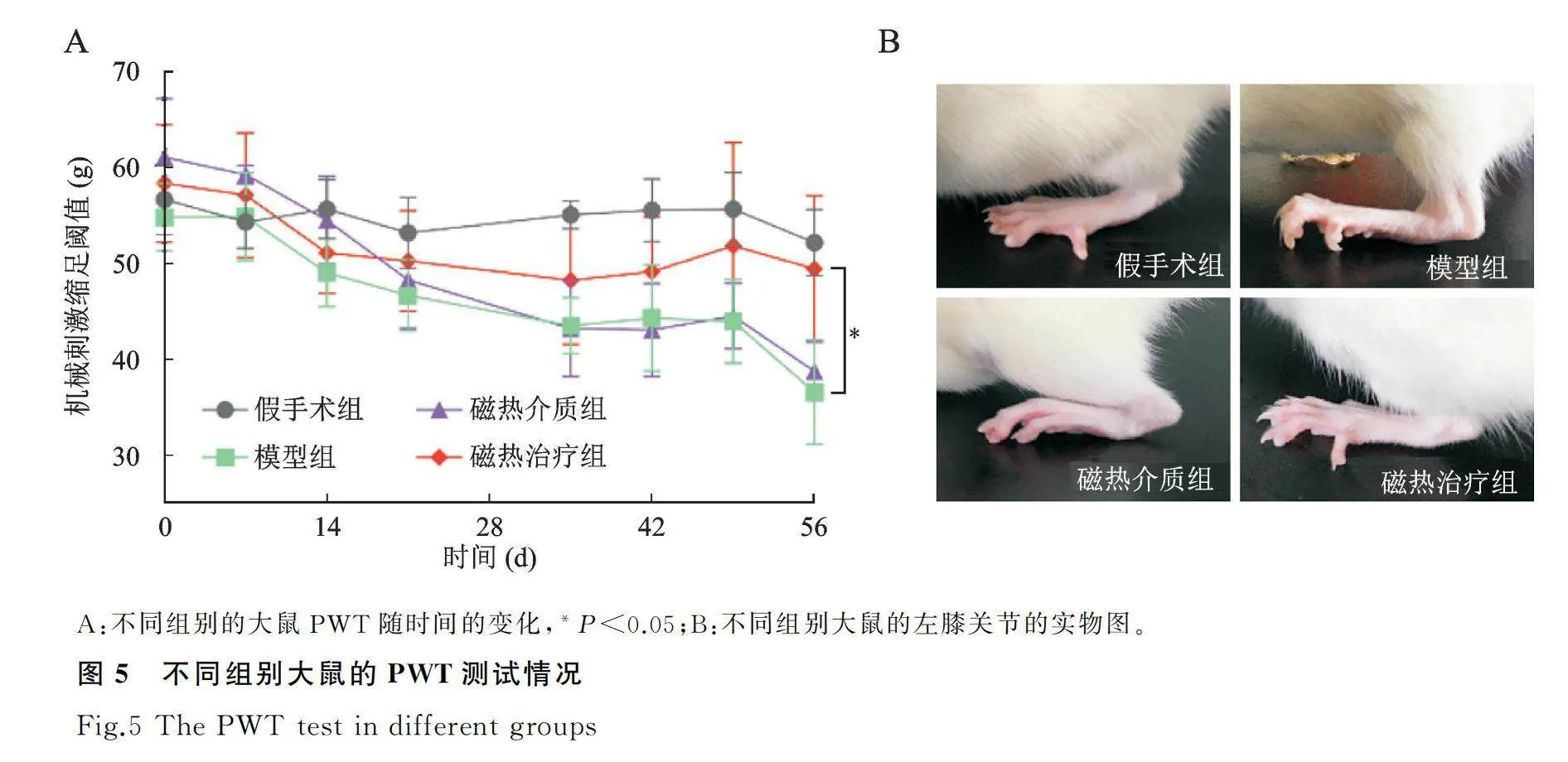
2.3.2 PWT结果
疼痛是KOA最主要症状和评价标准之一,不同组别动物在不同时间点的PWT结果显示(图5),造模后的4周内,各组动物的PWT都有较为明显的下降,与假手术组相比,模型组在造模后PWT明显降低,呈现机械痛敏状态;与模型组相比,磁热治疗组的机械痛阈值提高了约48.9%;观察各组动物取材前左后肢的活动状态,结果显示,模型组的左后肢着地有时会出现不稳,但磁热治疗组的症状得到一定的缓解。
2.3.3 膝关节骨标本形态学大体观察结果
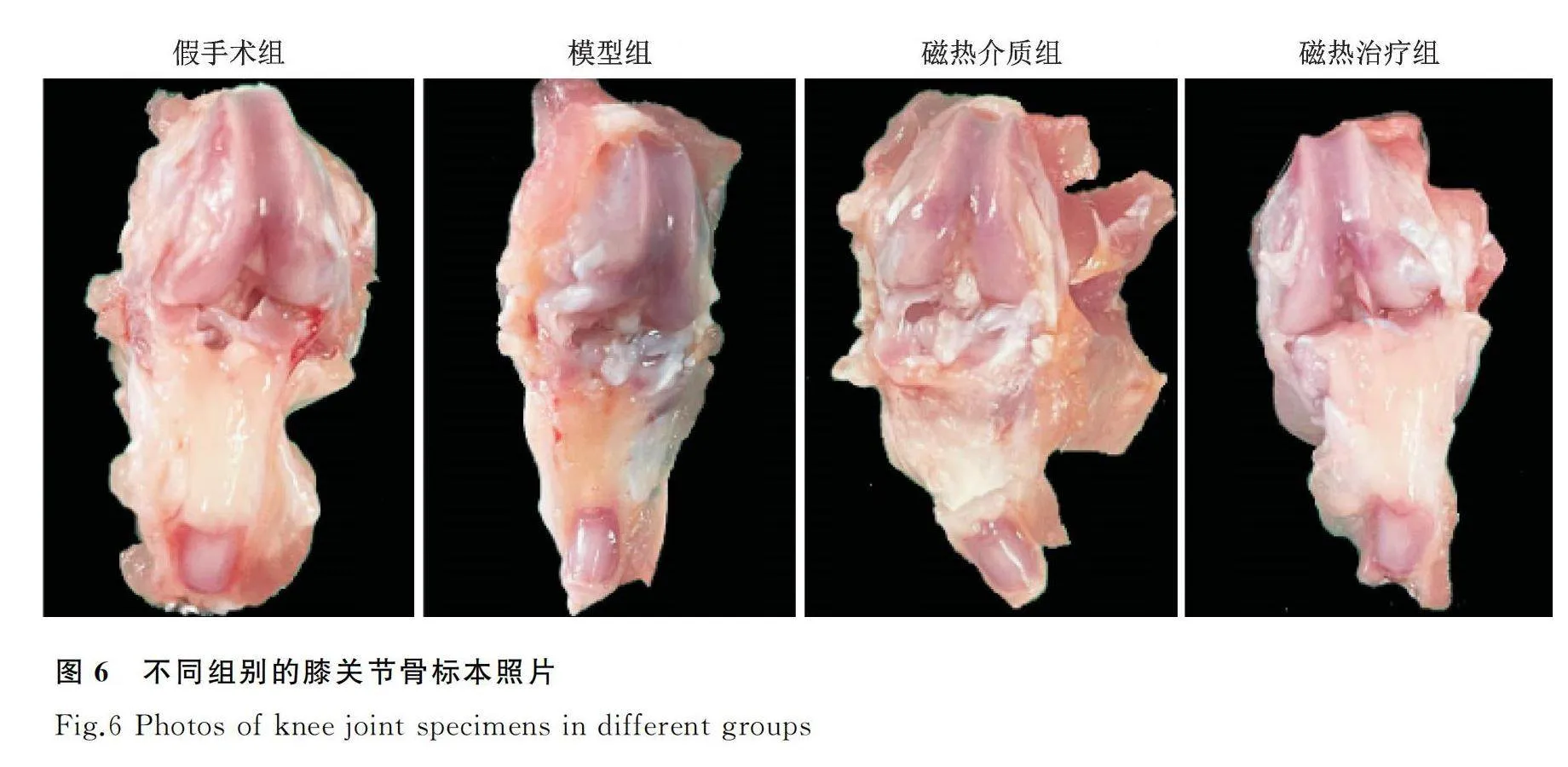
假手术组膝关节的关节表面软骨结构完整,表面光滑平坦透亮,髌骨下及关节囊的滑膜形态正常,呈透明淡红色,关节液透明清亮;模型组的关节表面软骨结构基本完整,但软骨明显变薄且颜色发暗,关节囊和滑膜有一定程度增厚,呈微黄色,关节液显著增多且有气泡,少数内侧平台稍不平;磁热介质组与模型组情况类似,但磁热治疗组的关节囊和滑膜组织充血、水肿程度较模型组均明显减轻,软骨表面基本完整,呈乳白色,关节液略增多,部分内侧平台软骨颜色灰白(图6)。
2.3.4 膝关节HE及番红-固绿染色及评分结果
各组膝关节HE及番红-固绿染色结果(图7)显示,假手术组的关节软骨表面平滑,结构清晰,潮线完整,滑动层、过渡层、辐射层及钙化层均能看出明显的界限;模型组关节软骨膜表层发生破坏,部分缺失有裂隙,部分区域达到钙化层,软骨基质溶解,切线层部分缺失,移行层均变薄,各层次界限不清,存在空陷窝,潮线明显不完整;磁热介质组的关节软骨表面与模型组类似,也有比较明显的破坏和裂隙,软骨基质溶解,切线层、移行层均变薄;磁热治疗组的关节软骨表面磨损程度明显减轻,软骨表层下方的扁平细胞较模型组增多,软骨基质较模型组及磁热介质组有部分修复,移行层、辐射层等其他层次相对清晰,潮线完整性也有所改善;分析显示,磁热治疗组的Mankin及OARSI评分均低于模型及磁热介质组。
2.3.5 软骨下骨MicroCT结果
采用MicroCT对各组软骨下骨进行3D分析的结果表明,与假手术组相比,模型组出现软骨下骨分布不均的骨增生和骨量增多,磁热介质组也出现了部分硬化的现象,但磁热治疗组大鼠的软骨下骨未出现明显的骨增生和骨量增多,同时,胫骨和股骨的骨表面不均匀和关节间隙变窄的情况有所减缓;对3D分析相关参数的定量结果比较发现,与假手术组相比,模型组的BV、BV/TV、Tb.Th.及Tb.N.上升明显,Tb.Sq.明显下降,磁热治疗组的BV、BV/TV、Tb.Th.以及Tb.N.未出现明显的上升趋势,而Tb.Sp也保持较高水平(图8)。这表明磁热治疗能够通过维持软骨下骨的微观结构,延缓KOA的进展。
2.3.6 血清ELISA检测结果
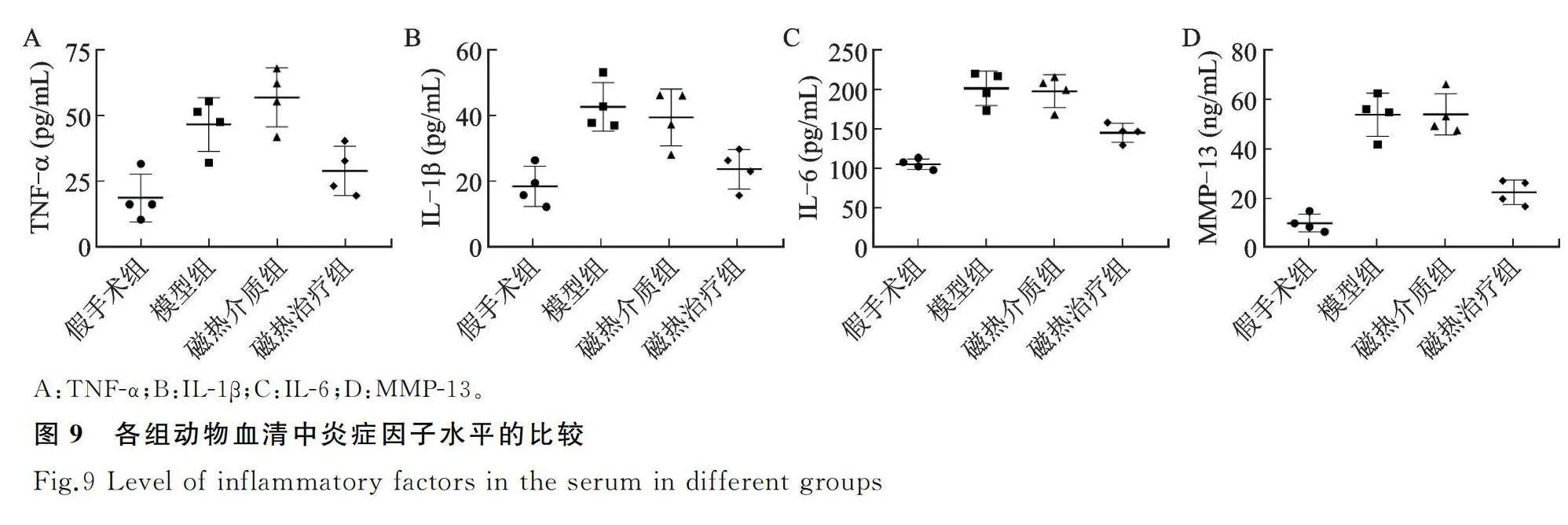
ELISA检测发现,与假手术组相比,模型组与磁热介质组血清中TNF-α、IL-1β、IL-6、MMP-13等炎症因子含量明显升高;磁热治疗组虽略高于假手术组,但相比模型及磁热介质两组均有所降低(图9)。
3 讨论
KOA是骨关节炎中最常见的疾病之一,以关节软骨退变为主,伴有软骨下骨及关节边缘骨质增生。其起病隐匿,以关节疼痛等症状为主,若缺乏有效干预,终末期往往发展成为严重关节功能障碍,严重影响患者生活质量[1-3]。目前大多数临床治疗手段以缓解症状为主,且都存在不良药物反应、潜在手术风险及较高医疗费用等问题[17]。热疗在临床中一直以来都有较为广泛的应用,其利用物理“热效应”改善病变部位的血运和局部病理状态[18]。但传统热疗方式往往存在操作较为复杂、热量无法有效控制、热传导效率低等问题。相比于传统热疗,磁热疗安全性高,组织穿透力强,温度可控且易于保持,可对病灶局部实施靶向精准治疗,这是其他传统热疗方式所不具备的特殊优势,数年前已在美国及部分欧洲国家开展肿瘤相关的临床研究,并在组织工程、脑神经调控及免疫治疗等多个生物医学领域有较为广泛的应用[19]。因此,采用磁热疗这种温度可控、安全高效精准的热疗手段对KOA进行治疗,改善传统热疗方式的不足,具有重要的研究意义。
磁热治疗中的关键是磁热介质的热效率,即磁性纳米颗粒在交变磁场下的磁感应升温能力。本研究采用具有涡旋磁畴的FVIOs作为治疗介质,独特的磁学性质决定了FVIOs可以形成稳定的磁溶胶的同时,在交变磁场下具有高的磁热转换能力[14]。其物理原理源自交变磁场下涡旋态到洋葱态的磁反转过程,FVIOs被迅速磁化,具有较大的磁滞曲线面积。该材料的SAR大于1 000 W/g,比传统顺磁纳米材料的磁热效率(仅300 W/g)高3倍以上[11]。高SAR值意味着达到相同磁热疗温度时所需治疗剂量要低很多。以磁热温度升高20 ℃为例,FVIOs的使用剂量仅为0.25 mg/L,远低于目前临床肿瘤治疗中氧化铁纳米材料动辄几十,甚至上百毫克/毫升的使用量[20]。纳米材料在体内使用的生物安全性问题与治疗剂量有直接的相关性,因此,较低的治疗剂量进一步保证了该疗法在治疗中的安全性。
磁热疗的精准可控性具体体现在温度可以通过磁介质浓度和磁场参数进行调节。在相同的磁场条件下,颗粒浓度越高升温能力越强;随着交变磁场频率的提高,磁介质的升温性能也会随之提高。例如,在320 kHz时,0.5 mg Fe/mL的FVIOs溶液在320、390、480 kHz的交变磁场下辐照7 min,可分别升温6.3、12.1、18.7 ℃。由于磁场的频率和强度需要保持在人体允许的安全范围内,因此,通过对磁介质使用剂量和磁场条件的有效控制,即可达到对温度的精准控制。
本实验采用5月龄雌性大鼠及双侧卵巢切除法(OVX)建立原发性KOA动物模型,前期研究证实OVX与KOA有很强相关性:随着大鼠年龄及体质量的增加,至5月龄时约80%的大鼠出现关节软骨面不平以及滑膜的轻度炎症等一系列早期的KOA的病理特征,对5月龄大鼠进行双侧卵巢切除4周后制备自发性KOA模型成功率可达90%以上。
滑膜和软骨的炎症与关节疼痛、疾病严重程度以及KOA的进展密切相关,KOA模型动物骨赘中会产生更多的IL-6、IL-8和MMP-13等炎症因子,并通过相关信号通路的转导,参与软骨下骨的骨重塑,影响KOA的发生及发展。因此,有效阻断这一炎症过程是治疗KOA的重要途径和方法。通过对磁热治疗后大鼠的活动能力、毛发光泽、对外源刺激的反应等进行大体观察,其膝关节肿胀程度均较模型组减轻,对外源刺激的闪躲与肢体抗拒扭动行为较模型组明显减缓;同时,磁热治疗组大鼠的机械痛阈值的恢复提高了约48.9%,表明磁热疗法在缓解模型动物的宏观痛觉方面有一定的疗效。膝关节整体的HE、番红固绿的染色结果也表明,磁热治疗组动物的软骨钙化、变薄等现象较模型组有明显改观,滑膜增生不明显,炎性细胞浸润较少,潮线完整性也有所改善。同时,各组改良的Mankin及OARSI对关节软骨组织学半定量结果表明,相比模型组,磁热治疗组的得分分别降低了约33%和20%,结合软骨下骨MicroCT的分析结构,这与磁热治疗后大鼠关节矿化作用的减弱密切相关,也可能与磁热对软骨下骨中炎症信号转导的抑制相关。
本研究对磁热治疗KOA的疗效机制进行了初步探究发现,磁热治疗组动物血清中TNF-α、IL-1β、IL-6及MMP-13等炎症因子的含量明显降低,提示可能基于对促炎细胞因子的抑制,以减轻局部及系统炎症,起到对软骨关节的保护作用。
综上所述,本研究利用涡旋磁氧化铁纳米环设计并构建高效磁热疗纳米制剂应用于KOA的治疗,通过痛觉、组织病理学、膝关节形态和显微骨结构变化等临床指标检测,明确了涡旋磁纳米环介导的磁热疗对KOA的疗效,结合炎症在KOA疾病防治中的关键作用,对磁热疗法防治KOA的生物学机制进行初步研究。本研究以临床需求为向导,以新型氧化铁纳米材料构建的磁热疗介质为模型展开研究,其结果可为高效热疗纳米制剂的构建提供理论基础,为基于纳米材料的KOA多学科综合治疗提供新的选择。该研究有望为开发高效的KOA治疗策略提供有益的理论和实践依据,具有较大的理论研究意义和临床应用转化前景。
参考文献:
[1] SHARMA L. Osteoarthritis of the knee[J]. N Engl J Med,2021, 384(1):51-59.
[2] HUNTER D J, BIERMA-ZEINSTRA S. Osteoarthritis[J]. Lancet, 2019, 393(10182):1745-1759.
[3] 梅轶芳. 中国骨关节炎流行病学研究现状及规范[J]. 中国实用内科杂志,2019, 39(8):663-665.
MEI Y F. Discussion on the status quo and norms of epidemiology research of osteoarthritis in China[J]. Chin J Pract Int Med, 2019, 39(8):663-665.
[4] ARDEN N K, PERRY T A, BANNURU R R, et al. Non-surgical management of knee osteoarthritis:Comparison of ESCEO and OARSI 2019 guidelines[J]. Nat Rev Rheumatol, 2021, 17(1):59-66.
[5] MCALINDON T E, BANNURU R R. Osteoarthritis in 2017:Latest advances in the management of knee OA[J]. Nat Rev Rheumatol, 2018, 14(2):73-74.
[6] ANTONELLIA M, DONELLI D. Hot sand baths (psammotherapy):A systematic review[J]. Complement Ther Med, 2019, 42:1-6.
[7] D’ANGELO D, COCLITE D, NAPOLETANO A, et al. The efficacy of balneotherapy, mud therapy and spa therapy in patients with osteoarthritis:An overview of reviews[J]. Int J Biometeorol, 2021, 65(7):1255-1271.
[8] JIANG L, XUE W J, WANG Y B. Inhibition of miR-31a-5p decreases inflammation by down-regulating IL-25 expression in human dermal fibroblast cells (CC-2511 cells) under hyperthermic stress via Wnt/β-catenin pathway[J]. Biomed Pharmacother, 2018, 107:24-33.
[9] 高飞, 张廷斌, 张欢, 等. 磁场响应的纳米材料与磁热效应生物医学应用[J]. 生命的化学, 2019, 39(5):903-916.
GAO F, ZHANG T B, ZHANG H, et al. Magnetic field-responsive nanomaterials and biomedical application of magnetic hyperthermia[J]. Chem Life, 2019, 39(5):903-916.
[10] CAZARES-CORTES E, CABANA S, BOITARD C, et al. Recent insights in magnetic hyperthermia:From the“hot-spot” effect for local delivery to combined magneto-photo-thermia using magneto-plasmonic hybrids[J]. Adv Drug Deliv Rev, 2019, 138:233-246.
[11] GAO F, XIE W S, MIAO Y Q, et al. Magnetic hydrogel with optimally adaptive functions for breast cancer recurrence rrevention[J]. Adv Healthc Mater, 2019, 8(14):1900203.
[12] GAO F, ZHANG T, LIU X L, et al. Nonmagnetic hypertonic saline-based implant for breast cancer postsurgical recurrence prevention by magnetic field/pH-driven thermochemotherapy[J]. ACS Appl Mater Inter, 2019, 11(11):10597-10607.
[13] WANG C Y, LIU Y, WANG Y, et al. Low-frequency plused electromagnetic field promotes functional recovery reduce inflamation and oxidative stress[J]. Mol Med Report, 2019, 19(3):1687-1693.
[14] LIU X L, YANG Y, NG C T, et al. Magnetic vortex nanorings:a new class of hyperthermia agent for highly efficient in vivo regression of tumors[J]. Adv Mater, 2015, 27(11):1939-1944.
[15] GAO F, MIAO Y Q, MA H J, et al. Boosting the photothermal performance of vacancy-rich MoSe2-x nanoflowers for photoacoustic imaging guided tumor chemo-photothermal therapy[J]. Nanoscale, 2021, 13(35):14960-14972.
[16] 康武林, 袁普卫, 李小群, 等. 口服蠲痹汤和盐酸氨基葡萄糖胶囊治疗膝骨关节炎的疗效观察及作用机制研究[J]. 中医正骨, 2016, 28(9):19-22.
KANG W L, YUAN P W, LI X Q, et al. A clinical study on the curative effect and mechanism of action of oral applications of Juanbi Tang and glucosamine hydrochloride capsules for treatment of knee osteoarthritis[J]. J Trad Chin Orthop Trauma, 2016, 28(9):19-22.
[17]" HODGKINSON T, KELLY D C, CURTIN C M, et al. Mechanosignalling in cartilage:An emerging target for the treatment of osteoarthritis[J]. Nat Rev Rheumatol, 2022, 18(2):67-84.
[18] GAO F, ZHANG T B, MIAO Y Q, et al. Mild hyperthermia synergized chemotherapy by Bi2Se3/MoSe2 nanosaucers for cancer treatment with negligible thermal resistance[J]. Nano Res, 2022, 15(9):8270-8280.
[19] LAHA S S, THORAT N D, SINGH G, et al. Rare-earth doped iron oxide nanostructures for cancer theranostics:Magnetic hyperthermia and magnetic resonance imaging[J]. Small, 2022, 18(11):e2104855.
[20] WANG S, CHENG K M, CHEN K, et al. Nanoparticle-based medicines in clinical cancer therapy[J]. Nano Today, 2022, 45, 101512.
(编辑 国 荣)

