迷迭香酸甲酯通过抑制Akt/mTOR信号通路诱导人肝癌细胞凋亡

摘要:目的 探讨迷迭香酸甲酯(methyl rosmarinate,MR)诱导人肝癌细胞(HCC)Hep-3B、SK-Hep1凋亡的作用及其机制。方法 CCK-8法检测各浓度MR(0~200 μmol/L)对Hep-3B、SK-Hep1、MIHA细胞的增殖-毒性作用;光学显微镜观察不同浓度MR处理三种细胞后的形态变化;EdU实验及流式细胞术分别检测Hep-3B、SK-Hep1细胞增殖及凋亡情况;Transwell迁移和侵袭实验检测MR对Hep-3B、SK-Hep1细胞迁移与侵袭能力的影响;Western blotting检测凋亡、上皮间质转化(epithelial-mesenchymal transition,EMT)及Akt/mTOR信号通路相关蛋白的表达情况。结果 不同浓度MR(0~200 μmol/L)处理Hep-3B、SK-Hep1细胞48 h,其细胞活性呈浓度依赖性显著降低(P<0.01),而对MIHA细胞活性无显著影响(P>0.05),Hep-3B、SK-Hep1细胞MR的IC50分别为102.5 μmol/L和99.3 μmol/L。MR(0~150 μmol/L)处理后显著抑制Hep-3B、SK-Hep1细胞增殖(P<0.05),通过光学显微镜观察到Hep-3B、SK-Hep1贴壁细胞死亡脱落和细胞外形凹陷萎缩,而MIHA细胞形态无明显改变。与对照组相比,100、150 μmol/L MR诱导Hep-3B、SK-Hep1细胞凋亡,凋亡蛋白Bax和cleaved PARP的表达显著增加(P<0.05),而抗凋亡蛋白Bcl-2的表达显著下降(P<0.05);且HCC细胞的迁移和侵袭均被抑制,E-cadherin的表达显著增加,N-cadherin和Vimentin的表达降低(Plt;0.05)。Western blotting检测结果显示,经MR处理的Hep-3B和SK-Hep1的p-Akt和p-mTOR的表达显著降低且呈剂量依赖性,这提示MR可能通过抑制Akt/mTOR信号通路发挥抗癌作用。结论 MR促进Hep-3B、SK-Hep1细胞凋亡,其作用机制可能与抑制Akt/mTOR信号通路有关。
关键词:迷迭香酸甲酯;原发性肝癌;增殖;迁移;凋亡;Akt/mTOR通路
中图分类号:R735.7 文献标志码:A
DOI:10.7652/jdyxb202305020
收稿日期:2023-02-01 修回日期:2023-05-12
基金项目:陕西省自然科学基础研究计划(No.2023-JC-QN-0915);陕西省重点研发计划(No.2020SF-061,No.2020KW-054);西安交通大学第一附属医院院基金(No.2021ZYTS-37,No.2019ZYTS-07)资助
Supported by the Natural Science Basic Research Program of Shaanxi Province(No.2023-JC-QN-0915), the Key Research and Development Program of Shaanxi, China (No.2020SF-061,No.2020KW-054), and Institutional Foundation of The First Affiliated Hospital of Xi’an Jiaotong University(No.2021ZYTS-37,No.2019ZYTS-07)
通信作者:张雷,外科学博士,副主任医师. E-mail:zhanglei0519@xjtu.edu.cn
网络出版地址:https://kns.cnki.net/kcms2/detail/61.1399.r.20230718.1655.008.htm (2023-07-19)
Methyl rosmarinate induces cell apoptosis in human hepatocellular carcinoma
cells via inhibiting the Akt/mTOR signaling pathways
XIAN Yao1, JIANG Wei2, LIU Runkun3, TU Kangsheng3,
GAO Shijie3, WANG Jun4, ZHANG Lei5
(1. Department of Nutrition, The First Affliliated Hospital of Xi’an Jiaotong University,
Xi’an 710061;2. School of Nursing, Shaoyang University, Shaoyang 422000; 3. Department of
Hepatobiliary Surgery, The First Affliliated Hospital of Xi’an Jiaotong University, Xi’an 710061;
4. Department of Emergency and Intensive Care Unit (East District), The First Affliliated
Hospital of Xi’an Jiaotong University, Xi’an 710089; 5. Department of Geriatric Surgery,
The First Affliliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
ABSTRACT: Objective To investigate the cell death-inducing effect of methyl rosmarinate (MR) on human hepatoma Hep-3B and SK-Hep1 cells and their potential mechanisms. Methods The effects of MR on the viability of Hep-3B, SK-Hep1 and MIHA cells were determined by cell counting kit-8 (CCK-8) assay. The morphological changes of three kinds of cells treated with different concentrations of MR were observed by optical microscopy. EdU assay and flow cytometry were used to detect the proliferation and apoptosis of Hep-3B and SK-Hep1 cells. Transwell assay was used to study the effects of MR on the migration and invasion of Hep-3B and SK-Hep1 cells. Western blotting was used to evaluate the protein expression levels of apoptosis, EMT and Akt/mTOR signaling pathways. Results After treated with different concentrations of MR (0~200 μmol/L) for 48 h, Hep-3B and SK-Hep1 cells activities were significantly decreased in a concentration-dependent manner (Plt;0.01), while there was no significant effect on MIHA cell activity (Pgt;0.05), and the IC50 of Hep-3B and SK-Hep1 cells were 102.5 and 99.3 μmol/L, respectively. MR treatment (0-150 μmol/L) significantly inhibited the proliferation of Hep-3B and SK-Hep1 cells (Plt;0.05), while cell detachment and shrinkage were observed by optical microscopy on the Hep-3B and SK-Hep1 cells, while the morphology of MIHA cells was not changed. Compared with the control group, MR(100, 150 μmol/L)induced apoptosis in Hep-3B and SK-Hep1 cells, the expression levels of the pro-apoptotic proteins Bax and cleaved PARP were significantly increased (Plt;0.05), while the expression level of the anti-apoptotic protein Bcl-2 was significantly decreased (Plt;0.05). MR(100, 150 μmol/L)also inhibited the migration and invasion of HCC cells, significantly increased the expression of E-cadherin and decreased the expression of N-cadherin and Vimentin compared with the control group (Plt;0.05). Finally, Western blotting results showed that the expressions of p-Akt and p-mTOR in Hep-3B and SK-Hep1 treated by MR were significantly reduced in a dose-dependent manner, suggesting that MR may play an anti-cancer role by inhibiting Akt/mTOR signaling pathway. Conclusion MR can promote apoptosis in Hep-3B and SK-Hep1 cells, which may be closely related to the inhibition of Akt/mTOR signaling pathway.
KEY WORDS: methyl rosmarinate; hepatocellular carcinoma (HCC); proliferation; migration; apoptosis; Akt/mTOR pathway
肝癌是全球范围内与癌症相关死亡的第四大病因,在新发病例中数量排名第六位,预计到2025年每年将影响100万人[1-2]。在原发性肝癌中,肝细胞癌(hepatocellular carcinoma,HCC)是最常见的形式(占90%),它通常与慢性肝病相关,其中乙型肝炎病毒(hepatitis B Virus,HBV)及丙型肝炎病毒(hepatitis C virus,HCV)感染、酒精滥用和非酒精性脂肪性肝病是主要病因[2-3]。肝癌的治疗方式主要取决于肿瘤的分期,肝切除术和肝移植是早期HCC患者的首选,5年生存率为70%~80%,射频消融可以作为局部治疗的一种选择。对于中期HCC患者,经动脉化疗栓塞(transarterial chemoembolization,TACE)已成为标准的治疗方式[2]。对于晚期HCC患者,免疫检查点抑制剂阿特珠单抗(atezolizumab,抗PDL1)和贝伐珠单抗(bevacizumab,抗VEGF)的联合疗法可改善患者的预后,已作为晚期HCC患者的一线疗法[2],晚期HCC患者在接受索拉非尼治疗后的总生存期仅为6.5~10.7个月[4-7],而大多数晚期HCC患者不能耐受手术,多种化疗效果不佳[8]。因此,探索安全、高效的药物可为HCC治疗中发挥关键作用。
迷迭香酸甲酯(methyl rosmarinate,MR)是迷迭香酸的衍生物,是从丹参、紫苏、黄荆等唇形科植物中分离得到的天然活性成分,具有抗炎、抗菌、抗氧化作用[9]。研究发现,MR具有抑制胃癌及宫颈癌细胞增殖的作用[10-11],然而MR在HCC中的抗肿瘤活性尚不明确。本研究通过体外实验探索MR对肝癌细胞的细胞毒性及治疗作用和Akt/mTOR信号通路诱导细胞凋亡相关机制。
1 材料与方法
1.1 细胞株与主要制剂
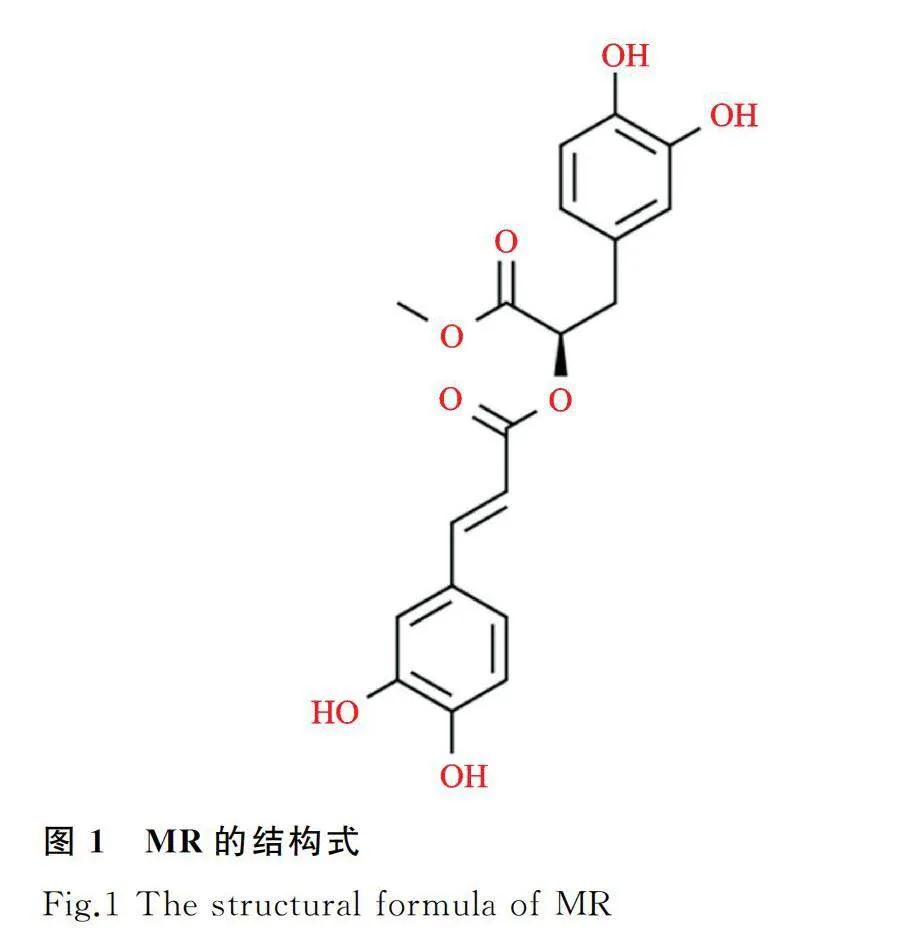
人HCC细胞系Hep-3B、SK-Hep1和人正常肝细胞系(MIHA)均购自于中科院上海细胞所细胞库,MR(分析标准品,HPLC≥98%)购自上海源叶生物科技有限公司,MR分子式C19H18O8,分子量374.34,其结构式见图1,将5 mg MR溶解于DMSO中,-20 ℃保存。
Dulbecco的改良Eagle培养基(Sigma),胰酶及胎牛血清(Gibco),CCK-8试剂盒(碧云天),E-cadherin、N-cadherin、Vimentin、β-actin抗体(Proteintech),Bax、Bcl-2抗体(Santa Cruz)。
1.2 细胞培养
将Hep-3B、SK-Hep1、MIHA细胞培养在含1%双抗、100 mL/L胎牛血清的DMEM培养基中,放置于50 mL/L CO2、37 ℃细胞培养箱中,取处于对数生长期的细胞进行后续实验。
1.3 CCK-8法测定细胞增殖
将对数期Hep-3B、SK-Hep1和MIHA细胞用胰酶消化,接种在96孔板上。接种24 h后待细胞贴壁生长良好时更换新的培养基,并加入不同浓度(0、50、100、150、200 μmol/L)MR,分别培养0、24、48、72、96 h后,每孔加入10 μL CCK-8试剂,37 ℃孵育2 h后,在450 nm波长下酶标仪检测各孔吸光度(A)值,根据回归方程求半数抑制浓度(IC50)。
1.4 细胞形态观察
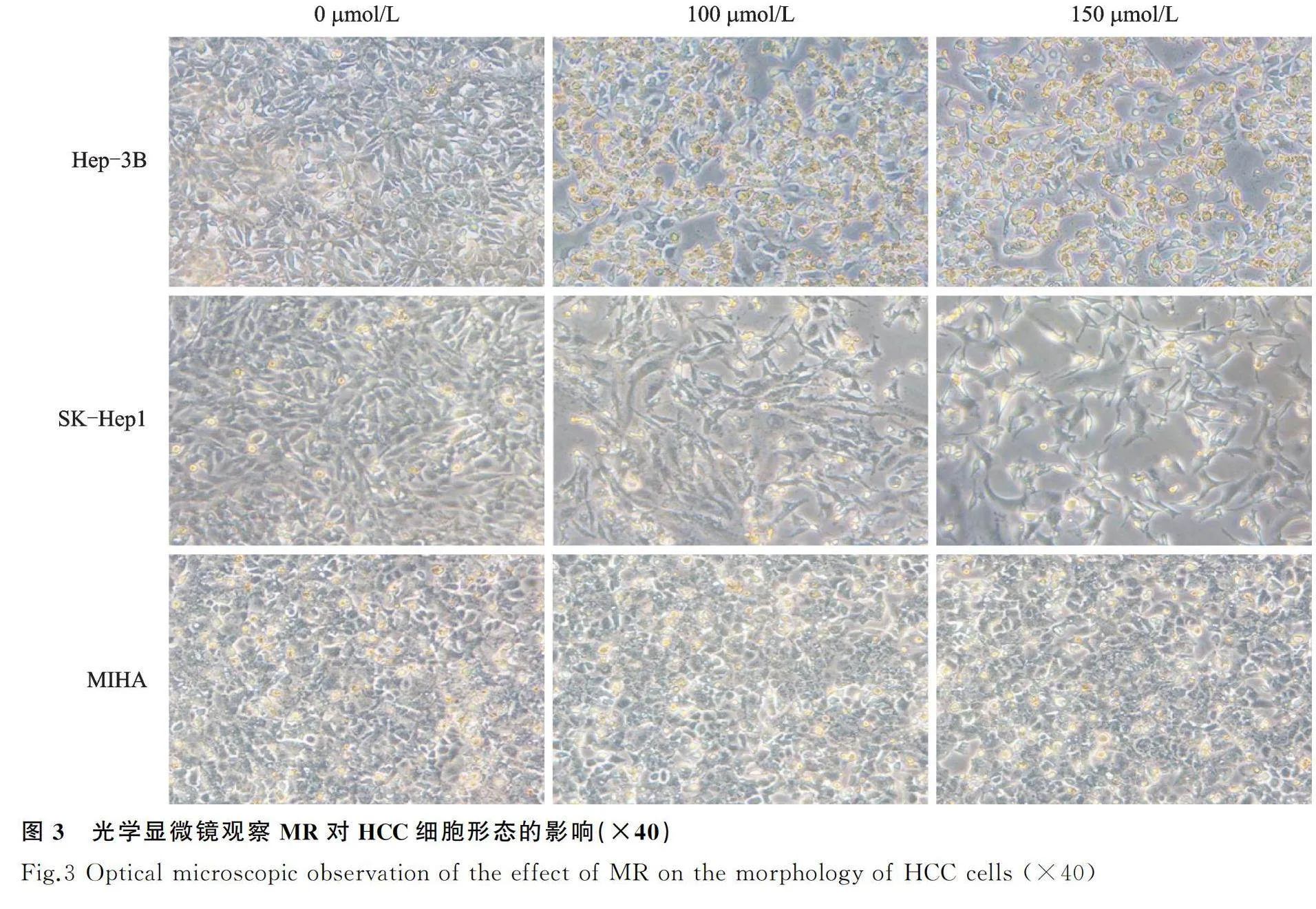
将Hep-3B、SK-Hep1和MIHA细胞用MR(0、100、150 μmol/L)处理48 h,采用Olympus光学显微镜观察并拍摄照片。
1.5 EdU细胞增殖实验
取对数生长期的Hep-3B、SK-Hep1细胞,接种于24孔板中,分别加入浓度为0、100、150 μmol/L的MR于培养箱中培养24 h,按照操作说明进行EdU标记、细胞固化、Apollo染色、DNA染色及图像获取。计算EdU阳性细胞比并对结果进行统计学分析。
1.6 流式细胞仪测定细胞凋亡
将对数生长期的Hep-3B和SK-Hep1细胞接种在六孔板上,用MR(0、100、150 μmol/L)处理24 h,收集细胞,经预冷的磷酸缓冲盐溶液(PBS)漂洗后,重悬收集细胞,并用PBS洗涤3次。加入Annexin V-FITC混匀,室温避光染色20 min,再加入碘化丙啶(PI),室温避光染色,在1 h内使用FCM流式细胞仪检查荧光强度,观察各组细胞的凋亡情况。
1.7 Transwell迁移和侵袭实验
用不同浓度MR(0、100、150 μmol/L)处理Hep-3B和SK-Hep1细胞24 h,利用Transwell小室测定细胞的迁移和侵袭能力。测定迁移能力时,在小室底部加入含100 mL/L FBS的DMEM 作为化学引诱剂,并用8 μm孔的聚碳酸酯膜将小室的上下层隔开,将MR处理后的HCC 细胞经无血清培养基混悬并接种在小室上层,然后将小室在培养箱中培养24 h,用1 g/L结晶紫染色,显微镜下拍照和计数。测定侵袭能力时,Matrigel 基质胶按1∶8稀释加入小室上室面,其余操作同上。
1.8 Western blotting 检测
用不同浓度的MR(0、100、150 μmol/L)处理Hep-3B和SK-Hep1细胞24 h后,利用RIPA裂解液抽提细胞的总蛋白并用BCA法进行蛋白定量。将待检测蛋白样品按40 μg/孔上样后行SDS-PAGE电泳,然后通过湿转法将蛋白转移至PVDF膜上,将膜用50 g/L脱脂牛奶封闭2 h后进行一抗(cleaved PARP:1∶1 000;β-Actin:1∶5 000;Bax:1∶2 000;Bcl-2:1∶200;E-cadherin:1∶1 000;N-cadherin:1∶1 000;Vimentin:1∶1 000;p-Akt:1∶1 000;p-mTOR:1∶1 000;Akt:1∶1 000;mTOR:1∶1 000)4 ℃孵育过夜后,用TBST溶液洗膜3次,每次10 min;二抗室温孵育1 h;TBST洗膜3次,每次10 min;最后,在暗室进行ECL化学发光显影。
1.9 统计学分析
利用 SPSS 22.0统计软件进行数据统计分析。符合正态分布的计量资料以均数±标准差(±s)表示。组间比较采用t检验,Plt;0.05为差异有统计学意义。
2 结 果
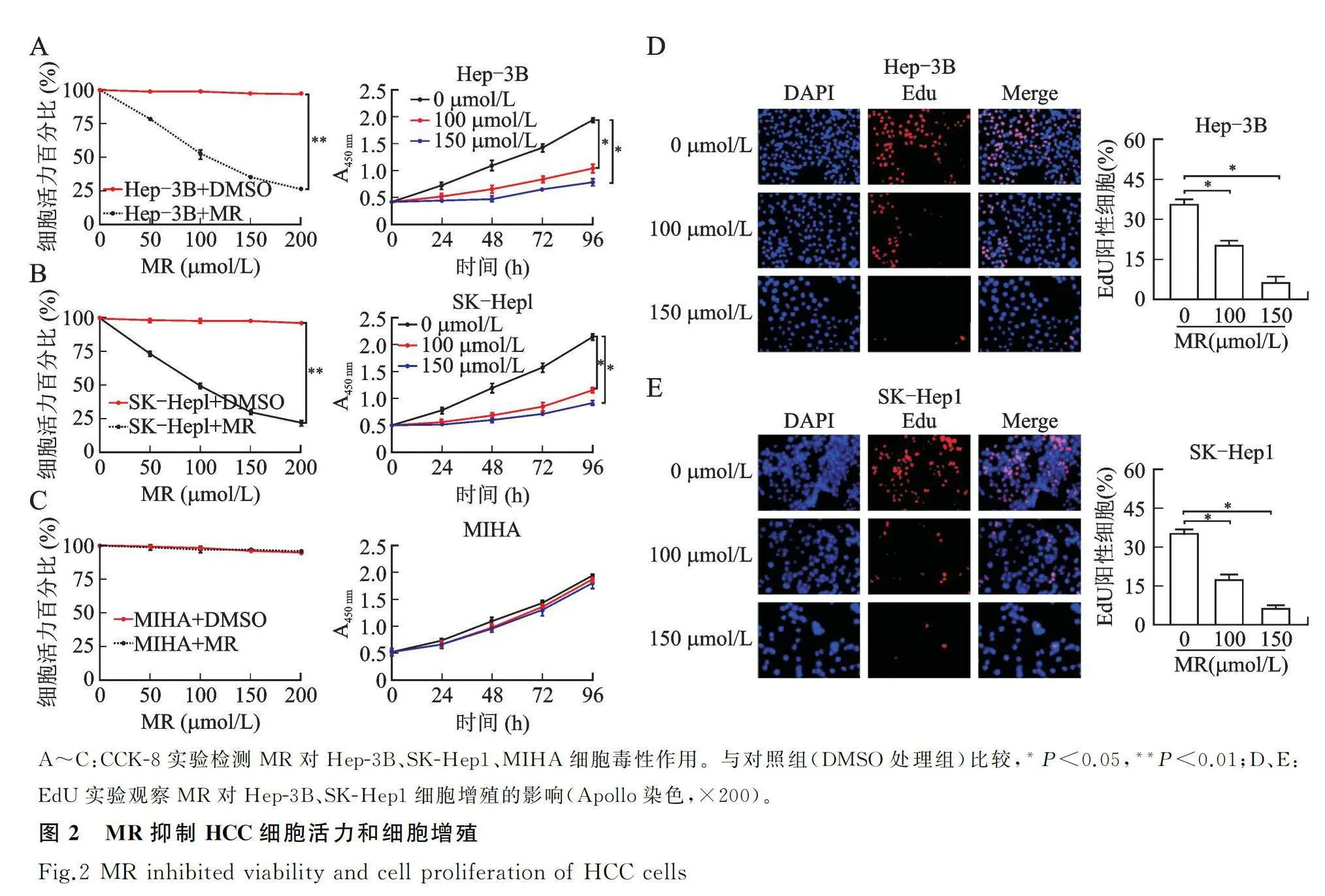
2.1 MR抑制HCC细胞活力和细胞增殖
不同浓度的MR(0、50、100、150、200 μmol/L)处理细胞48 h后发现,随着浓度的增加,Hep-3B、SK-Hep1细胞活性显著下降,具有浓度依赖性,并且Hep-3B和SK-Hep1的IC50分别为102.5、 99.3 μmol/L(图2A、图2B,P<0.01)。接着选取IC50和稍高一个梯度的浓度即100、150 μmol/L MR干预Hep-3B、SK-Hep1的结果发现,与对照组相比,随着处理时间的延长,其细胞活力均显著下降(图2A、图2B,P<0.05),因此,MR对HCC细胞的抑制具有时间依赖性。MIHA细胞在不同MR处理浓度和不同处理时间下,其细胞活力变化无统计学意义(图2C,P>0.05)。EdU实验(Apollo染色)结果显示,与对照组相比,100、150 μmol/L MR干预Hep-3B和SK-Hep1细胞时,两组细胞的EdU阳性率显著降低,提示经MR处理的HCC增殖能力呈剂量依赖的方式显著降低(图2D、图2E,P<0.05)。
2.2 MR诱导肝癌细胞的形态学变化
0、100、150 μmol/L的MR处理的HCC细胞和正常肝细胞48 h,观察到随着浓度的增加,Hep-3B和SK-Hep1细胞以剂量依赖的方式出现了贴壁细胞死亡脱落和细胞外形凹陷萎缩,细胞的分布密度显著变稀疏,而MIHA细胞在MR处理后没有明显的形态变化和细胞脱落(图3)。
2.3 MR诱导HCC细胞凋亡并改变细胞凋亡蛋白的表达
流式细胞术检测结果显示,不同浓度的MR处理Hep-3B和SK-Hep1细胞后,细胞凋亡率显著增加且呈剂量依赖性,说明MR显著促进了Hep-3B和SK-Hep1细胞凋亡(图4A、图4B,P<0.05)。
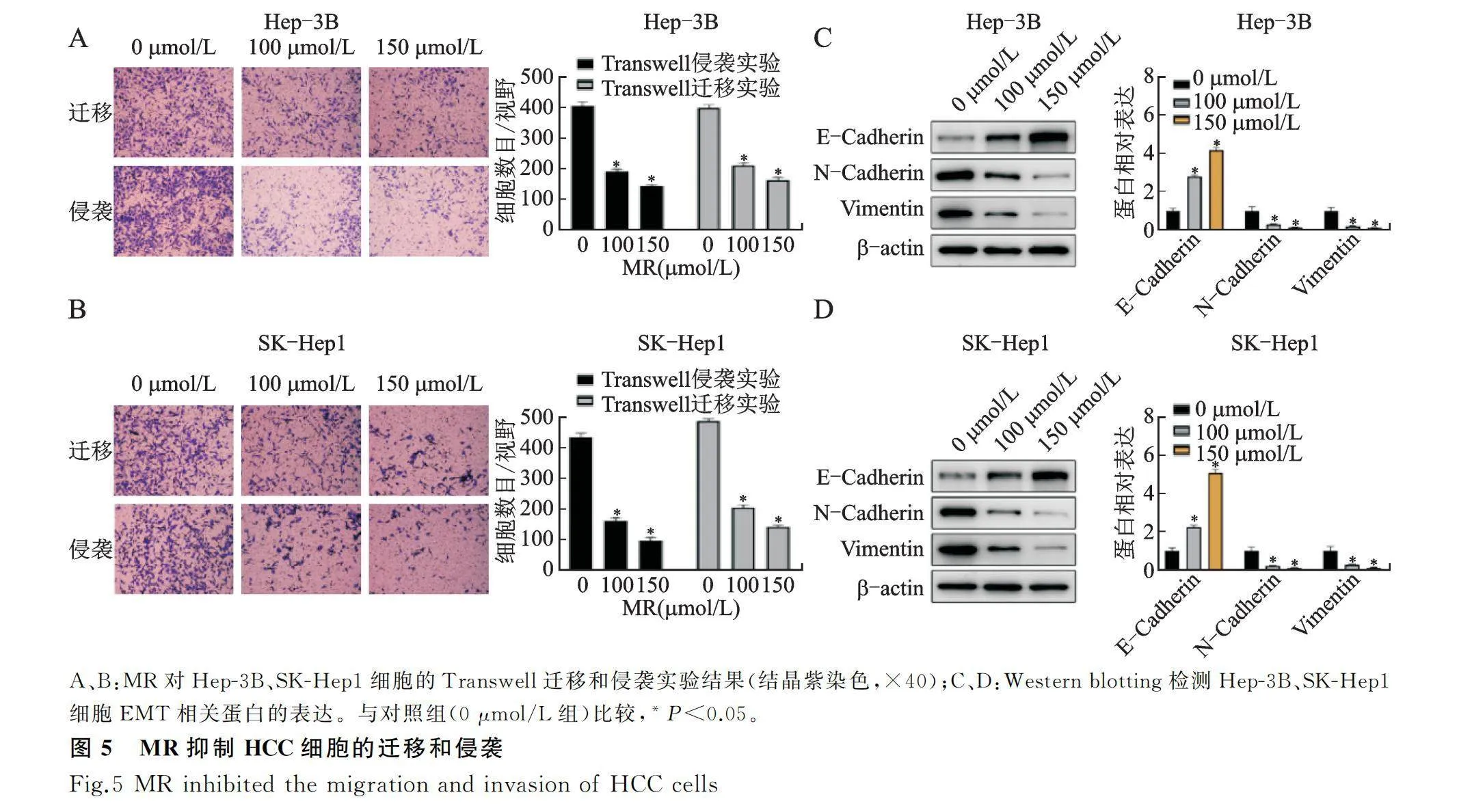
2.4 MR抑制HCC细胞的迁移和侵袭能力及EMT进程
Transwell迁移和侵袭实验结果发现,MR以剂量依赖性显著降低了Hep-3B和SK-Hep1细胞的迁移和侵袭能力(图5A、图5B,P<0.05)。
Western blotting检测HCC细胞的上皮标志物(E-cadherin)和间质标志物(N-cadherin和Vimentin)表达的结果显示,Hep-3B和SK-Hep1细胞经MR处理后,E-cadherin的表达显著增加,而N-cadherin和Vimentin的表达显著降低且呈浓度依赖性(图5C、图5D,Plt;0.05),提示MR抑制HCC细胞的EMT进程。
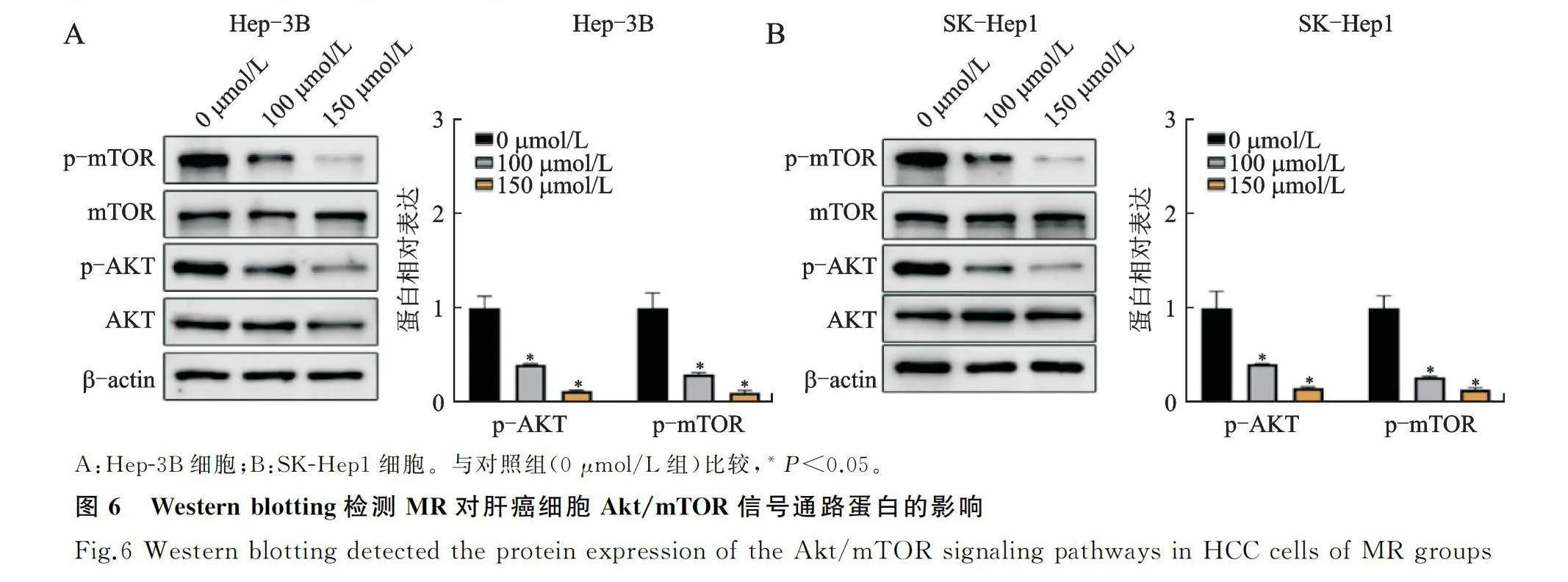
2.5 MR通过抑制Akt/mTOR信号通路诱导肝癌细胞凋亡
Western blotting检测结果显示,经MR处理的Hep-3B和SK-Hep1的p-Akt和p-mTOR的表达显著降低且呈剂量依赖性(图6A、6B,Plt;0.05)。这提示MR可能通过抑制Akt/mTOR信号通路发挥抗癌作用。
3 讨 论
传统医学不仅可以治疗一种疾病,而且将整个身体视为一个整体[12]。MR是迷迭香酸的衍生物,广泛存在于冬凌草、荆丹参、西黄草、紫苏等中草药中[9]。目前的研究发现,MR对胃癌细胞、宫颈癌细胞等多种人体实体恶性肿瘤细胞均有细胞毒性杀伤作用。庞磊等[10]发现,MR可显著抑制胃癌细胞的增殖和迁移等生物学功能,并通过上调LC3蛋白表达而诱导胃癌细胞发生凋亡。NAM等[11]发现,MR是一种新型的S6K1蛋白相关抑制剂,可诱导宫颈癌细胞自噬和凋亡,而且MR增强了顺铂对宫颈癌细胞的抑制作用,这可能与mTOR/S6K1抑制介导的自噬和凋亡有关。
本研究结果显示,MR对肝癌细胞系Hep-3B和SK-Hep1细胞具有明显的细胞毒性作用,并以时间的延长和剂量增加依赖性显著抑制了肝癌细胞的生长活力和增殖,并诱导两种HCC细胞系的形态发生改变。然而,不同浓度MR处理MIHA细胞后,其细胞活力及形态没有发生显著变化,提示MR对正常的肝细胞MIHA细胞没有显著的细胞毒性作用。
EMT是一个高度保守的细胞程序,上皮细胞在此过程中失去极化组织,进而获得迁移和侵袭能力[13]。大多数来源于实体肿瘤的肿瘤细胞侵袭相邻的细胞层,这些细胞必须经过EMT的过程才能失去细胞与细胞的黏附,获得运动性。因此,EMT已被认为是促进肿瘤细胞侵袭和恶性肿瘤进展的原发性细胞事件[14]。本研究发现,MR通过促进E-cadherin的表达上调,N-cadherin和Vimentin的表达下调而达到抑制EMT过程。AKT/mTOR通路与肿瘤的增殖、侵袭、转移和分化相关[15-16]。磷酸化AKT(p-AKT)是激活AKT的关键步骤,活化AKT磷酸化并激活mTOR,磷酸化的mTOR(p-mTOR)激活下游靶点,促进肿瘤恶性过程[17]。
细胞凋亡是受到精确调控的程序性细胞死亡的一种特殊形式,可使细胞分裂成紧密的膜封闭结构,称为凋亡小体,进而被邻近的细胞和吞噬细胞所吞噬,通常可以阻止炎症的发生及组织的损伤[18]。细胞凋亡过程中首先出现细胞收缩和染色质凝结、核碎裂等细胞形态的改变,然后半胱氨酸蛋白酶活性引起的细胞膜包裹细胞内容物进入凋亡小体,半胱氨酸蛋白酶裂解多个蛋白,导致凋亡小体被吞噬细胞识别[19]。细胞凋亡存在内外两种途径:线粒体通路(内在途径)主要通过Bcl-2家族成员触发凋亡,Bcl-2家族通过诱导线粒体外膜通透性、细胞色素c的释放及引发半胱氨酸蛋白酶级联反应,导致细胞凋亡[20];死亡受体的激活通路(外在途径)通常由死亡配体和死亡受体结合而发生,死亡配体主要为肿瘤坏死因子(tumor necrosis factor,TNF)家族,包括Fas配体、TNF受体和TNF相关的凋亡诱导配体,与死亡受体结合后招募caspase-8及Fas相关死亡结构域蛋白进而组装成死亡诱导信号复合体,从而活化caspase-3来执行细胞凋亡[21]。本研究通过流式细胞仪检测发现MR可诱导肝癌细胞凋亡,并且MR处理后Hep-3B和SK-Hep1中的促凋亡蛋白Bax和cleaved-PARP的表达均显著升高,而抗凋亡调节因子Bcl-2表达显著降低,且p-Akt和p-mTOR表达明显降低。这提示MR通过抑制Akt/mTOR信号诱导人肝癌细胞凋亡。本研究在一定程度上为肝癌的临床治疗提供了理论参考。
参考文献:
[1]VILLANUEVA A. Hepatocellular carcinoma[J]. N Engl J Med, 2019, 380(15):1450-1462.
[2]LLOVET J M, KELLEY R K, VILLANUEVA A, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2021, 7(1):6.
[3]CRAIG A J, VON FELDEN J, GARCIA-LEZANA T, et al. Tumour evolution in hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(3):139-152.
[4]ABDEL-RAHMAN O, ABDEL-WAHAB M, SHAKER M, et al. Sorafenib versus capecitabine in the management of advanced hepatocellular carcinoma[J]. Med Oncol, 2013, 30(3):655.
[5]ZHU Y J, ZHENG B, WANG H Y, et al. New knowledge of the mechanisms of sorafenib resistance in liver cancer[J]. Acta Pharmacol Sin, 2017, 38(5):614-622.
[6]LLOVET J M, RICCI S, MAZZAFERRO V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359(4):378-390.
[7]CHENG A L, KANG Y K, CHEN Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:A phase III randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1):25-34.
[8]WEI P L, HUNG C S, LU H H, et al. Areca nut extract (ANE) inhibits the progression of hepatocellular carcinoma cells via activation of ROS production and activation of autophagy[J]. Int J Med Sci, 2021, 18(15):3452-3462.
[9]丁丽敏, 刘茜茜, 苏超男, 等. 不同药材中迷迭香酸甲酯及迷迭香酸的含量测定[J]. 烟台大学学报(自然科学与工程版), 2019, 32(2):124-128.
DING L M, LIU Q Q, SU C N, et al. Quantification of methyl rosmarinate and rosmarinic acid in different traditional chinese medicine[J]. J Yantai Univ (Nat Sci Engineering Ed), 2019, 32(2):124-128.
[10]庞磊, 曹桂云, 吴凡, 等. 迷迭香酸甲酯诱导自噬抑制人胃癌细胞增殖的研究[J]. 扬州大学学报(农业与生命科学版), 2018, 39(3):26-30.
PANG L, CAO G Y, WU F, et al. Effects of methylrosmarinate on inhibiting proliferation via inducing autophagy in human gastric cancer cells[J]. J Yangzhou Univ (Agricult Life Sci Ed), 2018, 39(3):26-30.
[11]NAM K H, YI S A, NAM G, et al. Identification of a novel S6K1 inhibitor, rosmarinic acid methyl ester, for treating cisplatin-resistant cervical cancer[J]. BMC Cancer, 2019, 19(1):773.
[12]YUAN H, MA Q, YE L, et al. The traditional medicine and modern medicine from natural products[J]. Molecules, 2016, 21(5):559.
[13]DIEPENBRUCK M, CHRISTOFORI G. Epithelial-mesenchymal transition (EMT) and metastasis:Yes, no, maybe?[J]. Curr Opin Cell Biol, 2016, 43:7-13.
[14]YANG J, WEINBERG R A. Epithelial-mesenchymal transition:At the crossroads of development and tumor metastasis[J]. Dev Cell, 2008, 14(6):818-829.
[15]XIA H, OOI L L, HUI K M. MicroRNA-216a/217-induced epithelial-mesenchymal transition targets PTEN and SMAD7 to promote drug resistance and recurrence of liver cancer[J]. Hepatology, 2013, 58(2):629-641.
[16]CHEN J S, WANG Q, FU X H, et al. Involvement of PI3K/PTEN/AKT/mTOR pathway in invasion and metastasis in hepatocellular carcinoma:Association with MMP-9[J]. Hepatol Res, 2009, 39(2):177-186.
[17]SU R, NAN H, GUO H, et al. Associations of components of PTEN/AKT/mTOR pathway with cancer stem cell markers and prognostic value of these biomarkers in hepatocellular carcinoma[J]. Hepatol Res, 2016, 46(13):1380-1391.
[18]OBENG E. Apoptosis (programmed cell death) and its signals — A review[J]. Braz J Biol, 2021, 81(4):1133-1143.
[19]KESAVARDHANA S, MALIREDDI R K S, KANNEGANTI T D. Caspases in cell death, inflammation, and pyroptosis[J]. Annu Rev Immunol, 2020, 38:567-595.
[20]ZHANG L, LU Z, ZHAO X. Targeting Bcl-2 for cancer therapy[J]. Biochim Biophys Acta Rev Cancer, 2021, 1876(1):188569.
[21]EISINGER S, SARHAN D, BOURA V F, et al. Targeting a scavenger receptor on tumor-associated macrophages activates tumor cell killing by natural killer cells[J]. Proc Natl Acad Sci U S A, 2020, 117(50):32005-32016.
(编辑 国 荣)

