胃癌肿瘤突变负荷预测标志物的鉴定:基于TCGA数据和机器学习算法
摘要:目的 筛选和鉴定具有预测胃癌肿瘤突变负荷(TMB)分类的微小RNA(microRNAs),从而为胃癌患者免疫治疗提供参考依据。方法 从TCGA数据库中下载胃癌肿瘤样本的mRNA、microRNA表达谱数据和体细胞突变数据。利用R语言的“limma”包筛选高-、低-TMB组间差异表达的miRNAs。使用DIANA-miRPath v3.0数据库分析这些差异miRNAs可能参与的生物学功能。此外,采用随机森林(RF)和支持向量机递归特征消除(SVM-RFE)算法筛选出能预测TMB分类的miRNAs,然后利用曲线下面积(AUC)来评估其区分能力,并在其他癌种中进一步验证。最后,采用CIBERSORT算法评估不同TMB分组中免疫细胞浸润情况。结果 共鉴定出56个差异表达miRNAs(DE-miRNAs)。功能富集分析显示,这些DE-miRNAs主要富集在肿瘤发生发展等信号通路(如ErbB信号和MAPK信号通路)和免疫相关生物学过程(如免疫系统过程和Toll样受体信号通路)。RF和SVM-RFE算法共同鉴定出10个诊断特征的miRNAs,其中只有hsa-miR-210-3p被认为是与TMB分类最相关的预测生物标志物,因其具有较高的诊断效能,其AUC值在训练集、测试集和总集中分别为0.822、0.721和0.793,并在多个癌种中得到验证。此外,CIBERSORT计算分析提示高/低TMB组间存在免疫细胞浸润差异,并且hsa-miR-210-3p与免疫检查点相关基因和错配修复相关基因的表达呈显著正相关。结论 本研究成功鉴定出hsa-miR-210-3p为TMB分类的预测生物标志物,该生物标志物可有效预测胃癌及多种其他癌症患者中的TMB值,并可能为免疫治疗提供一定指导。
关键词:胃癌; 肿瘤突变负荷; 微小RNA; 癌症基因组图谱; 免疫治疗
中图分类号:R735
文献标志码:A
DOI:10.7652/jdyxb202305014
收稿日期:2023-06-05
修回日期:2023-07-22
基金项目:陕西省科学技术基金资助项目(S2018-YFZDSF-0102)
Supported by the Shaanxi Provincial Science and Technology Foundation (S2018-YFZDSF-0102)
通信作者:常东民,主任医师,教授. E-mail: sdmqqw@126.com
网络出版地址:https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C45S0n9fL2suRadTyEVl2pW9UrhTDCdPD65bj9enCB5IA6aZtikx7jq
SCinntgirLPelwQxo49E3EDsUdjiy-uhjamp;uniplatform=NZKPT (2023-07-26)
Identification of diagnostic signatures associated with tumor mutation burden
in gastric cancer based on TCGA and machine-learning methods
XU Longwen, NIE Yuanhua, BAI Zilong, CHANG Dongmin
(Department of Surgical Oncology, The First Affiliated Hospital of
Xi’an Jiaotong University, Xi’an 710061, China)
ABSTRACT: Objective To select and identify miRNA signatures to predict TMB level in gastric cancer based on The Cancer Genome Atlas (TCGA) database and machine learning methods. Methods MiRNA expression and somatic mutation profiles of gastric cancer (GC) were downloaded from TCGA database. R “limma” package was performed to select differentially expressed miRNAs between high-TMB and low-TMB groups. Two machine learning algorisms, random forest (RF), and Support Vector Machine-Recursive Feature Elimination were utilized to identify miRNAs with the highest discriminative ability. ROC was used to test the predictive ability of these signatures in multiple datasets. Besides, immune cells of different TMB levels were compared by the CIBERSORT method. Results A total of 56 differentially expressed miRNAs (DE-miRNAs) were filtered. Functional enrichment analysis showed that these DE miRNAs are mainly enriched in signaling pathways related to tumor occurrence and development as well as immunity-related biological processes. The RF and SVM-RFE algorithms jointly identified 10 diagnostic features of miRNAs, among which only hsa-miR-210-3p is considered the most relevant predictive biomarker for TMB classification. The AUC value of hsa-miR-210-3p in the training, testing, and total sets is 0.822, 0.721, and 0.793, respectively, and has been validated in other cancer types. Besides, CIBERSORT analysis suggests differences in immune cell infiltration between high- and low-TMB groups. Meanwhile, there is a significant positive correlation between the expression of immune checkpoint related genes and mismatch repair related genes and hsa-miR-210-3p. Conclusion This study successfully identified hsa-miR-210-3p as a predictive biomarker for TMB classification, which can effectively predict TMB values in gastric cancer and other cancer patients and may provide some guidance for immunotherapy.
KEY WORDS: gastric cancer; tumor mutational burden (TMB); microRNA; The Cancer Genome Atlas (TCGA); immunotherapy
原发性胃癌是消化系统最常见的恶性肿瘤之一。2018年全球胃癌新发病例约1 033 701人,死亡病例782 685人,约50%的病例发生在发展中国家,主要集中在中国ADDINEN.CITE.DATA[1]。2019年中国恶性肿瘤流行病学特征显示ADDINEN.CITE.DATA,我国胃癌在癌症总死亡率中排名第三,其新发病例和死亡病例数约占42.4万例和29.8万例,已成为严重危害我国居民健康的重大公共卫生问题之一[2-3]。早期胃癌因无特异性症状,大多数患者确诊时已经处于胃癌中晚期,预后不佳。尽管手术、辅助放化疗和靶向治疗药物的快速发展在一定程度上提高了胃癌患者的生存期,但由于药物耐药性等原因胃癌患者的5年生存率低于30%[4]。
近年来,免疫治疗(以PD-1/PD-L1抑制剂和CTLA-4抑制剂为代表)在胃癌的治疗中取得积极进展。2017年ATTRACTION-02 Ⅲ期临床试验,纳武单抗组的客观缓解率(ORR)为11%。在中位总生存时间和24个月的总生存时间方面,纳武单抗组较安慰剂组均有延长,并两组间差异有统计学意义。同年,纳武单抗成为全球第一个被批准用于化疗后进展的、不可切除的晚期或复发性胃癌的免疫检查点抑制剂。之后越来越多的临床试验支持免疫检查点抑制剂单药或免疫检查点抑制剂联合化疗或靶向治疗在晚期胃癌中的应用ADDINEN.CITE.DATA[5-8],但仍缺乏有效的免疫检查点抑制剂疗效预测标志物来准确筛选获益人群。
肿瘤突变负荷(tumor mutation burden, TMB),是指肿瘤组织每兆碱基中突变的总数,也可以用非同义突变表示。高肿瘤突变负荷是指肿瘤细胞在基因层面发生大量非同义突变,高突变率能产生更多肿瘤新抗原,从而更易被自身免疫系统识别,激发免疫反应ADDINEN.CITE.DATA[9-12]。因此,TMB理论上可能成为预测免疫检查点抑制剂疗效的生物标志物。然而,TMB检测主要依赖于二代测序技术,不仅需要更多的组织标本,且测序费用昂贵,在一定程度上限制了其在临床中的应用。因此,急需开发一种经济有效的方法来预测肿瘤患者TMB水平。突变基因通过转录和转录后修饰产生异常癌组分,从而刺激抗肿瘤免疫。微小RNAs(miRNAs)又被认为是转录后基因修饰的重要调节因子。理论上突变基因可能被miRNAs修饰,编码肿瘤新抗原。然而,miRNAs与TMB水平的相关性在胃癌中仍未进一步研究。故本研究旨在构建和验证预测胃癌患者TMB水平的miRNAs模型,并评估该模型的准确性。
1 材料与方法
1.1 数据来源与分组处理
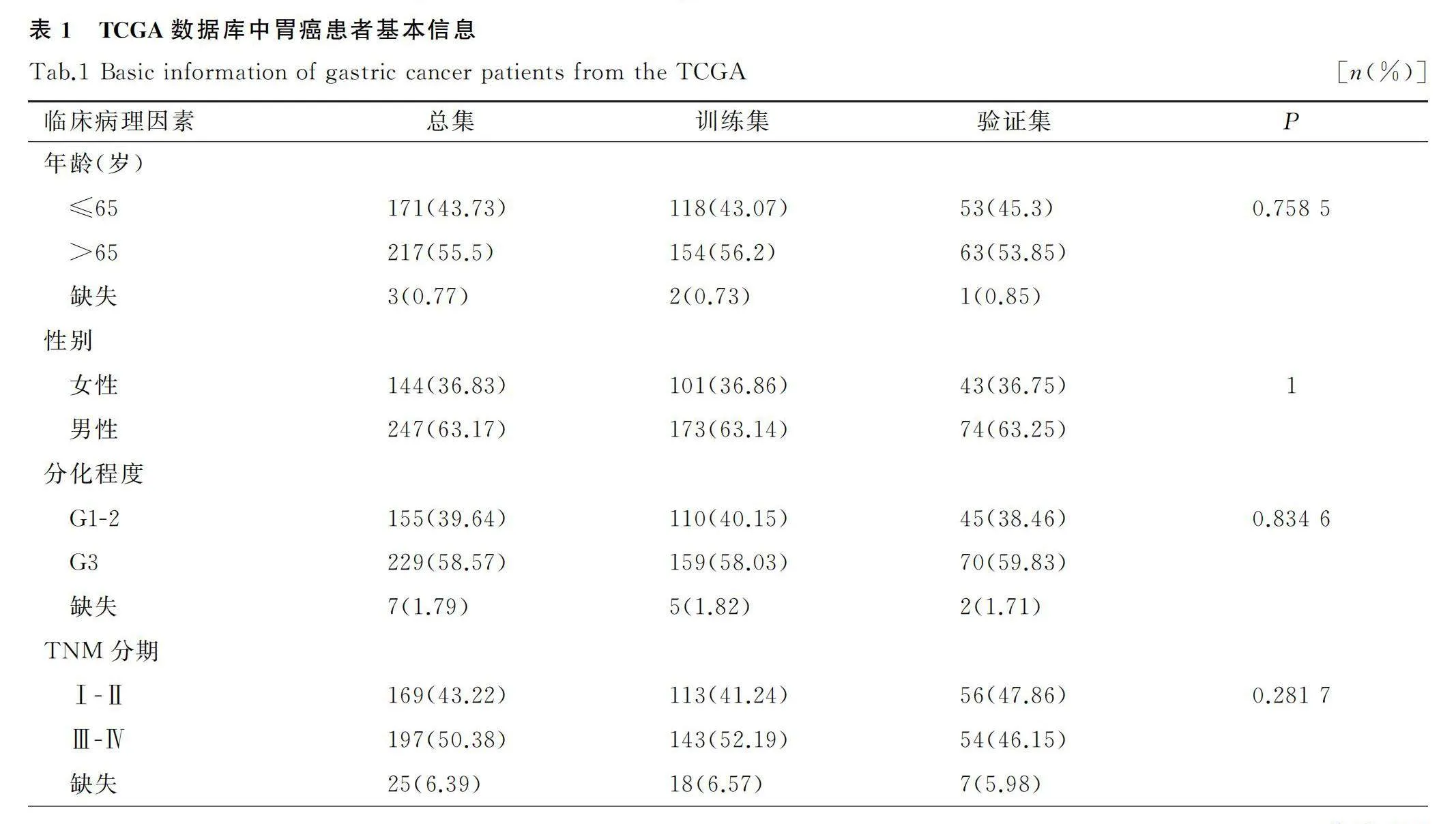
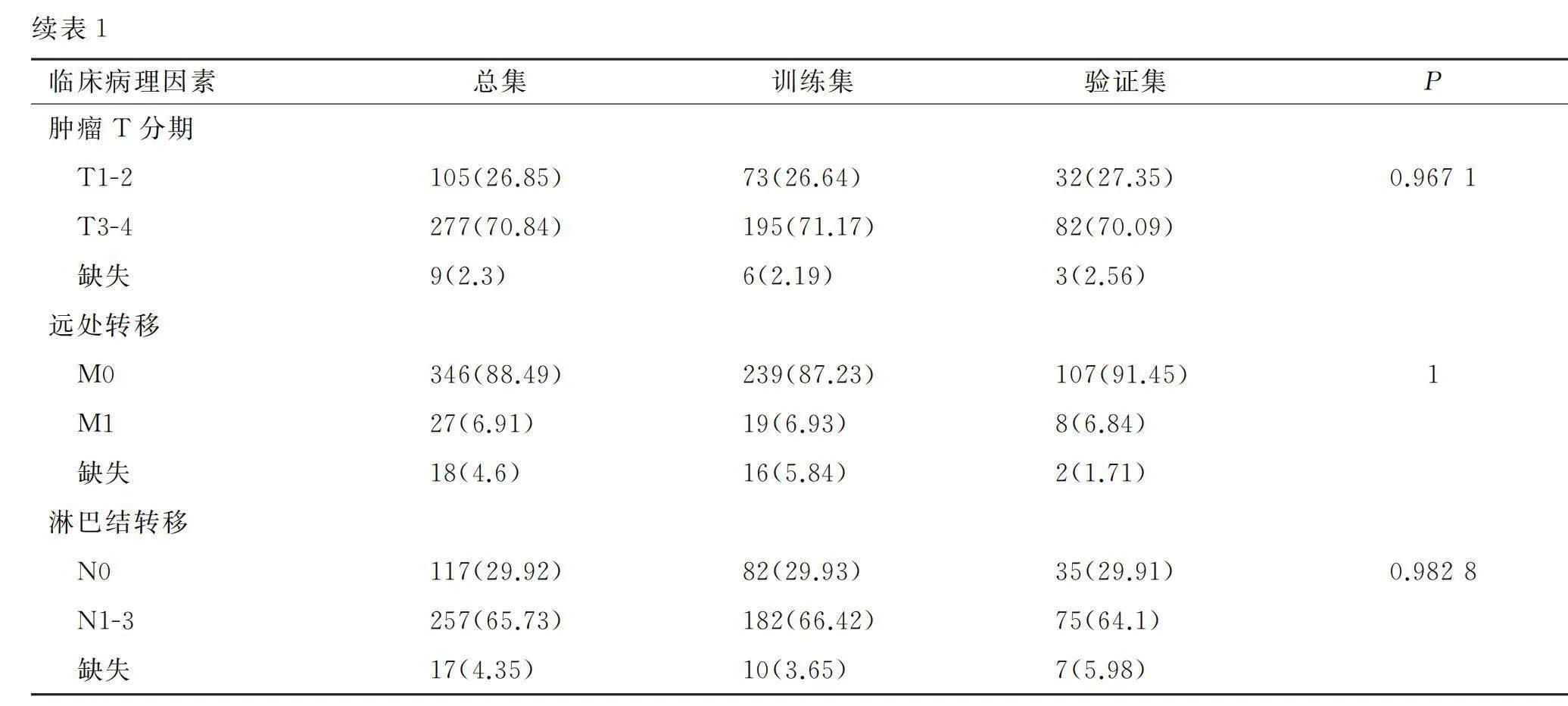
从TCGA(https://portal.gdc. cancer.gov/)中下载胃癌患者表达谱数据,miRNA数据和体细胞突变数据。对于体细胞突变数据,采用基于VarScan2 Variant Aggregation and Masking处理的突变图谱数据进行后续分析。将总共获得的391例胃癌患者同时拥有miRNA表达谱数据和体细胞突变数据纳入本次研究。并通过R caret数据包将391例患者按比例随机分入训练集(70%)和验证集(30%),并对两组样本临床因素进行组间差异比较。同时,下载了14种癌症,包括膀胱癌(BLCA)、乳腺癌(BRCA)、宫颈鳞状细胞癌和宫颈内腺癌(CESC)、结肠癌(COAD)、食管癌(ESCA)、头颈部鳞状细胞癌(HNSC)、肾透明细胞癌(KIRC)、脑低级别胶质瘤(LGG)、肝脏肝细胞癌(LIHC)、肺腺癌(LUAD)、肺鳞状细胞癌(LUSC)、前列腺腺癌(PRAD)、肉瘤(SARC)和皮肤黑色素瘤(SKCM)的miRNA表达谱数据和体细胞突变数据,用于后续验证本研究TMB相关分类模型和诊断特征miRNAs的预测性能和应用性能。
1.2 训练集中高低TMB组中差异miRNA表达
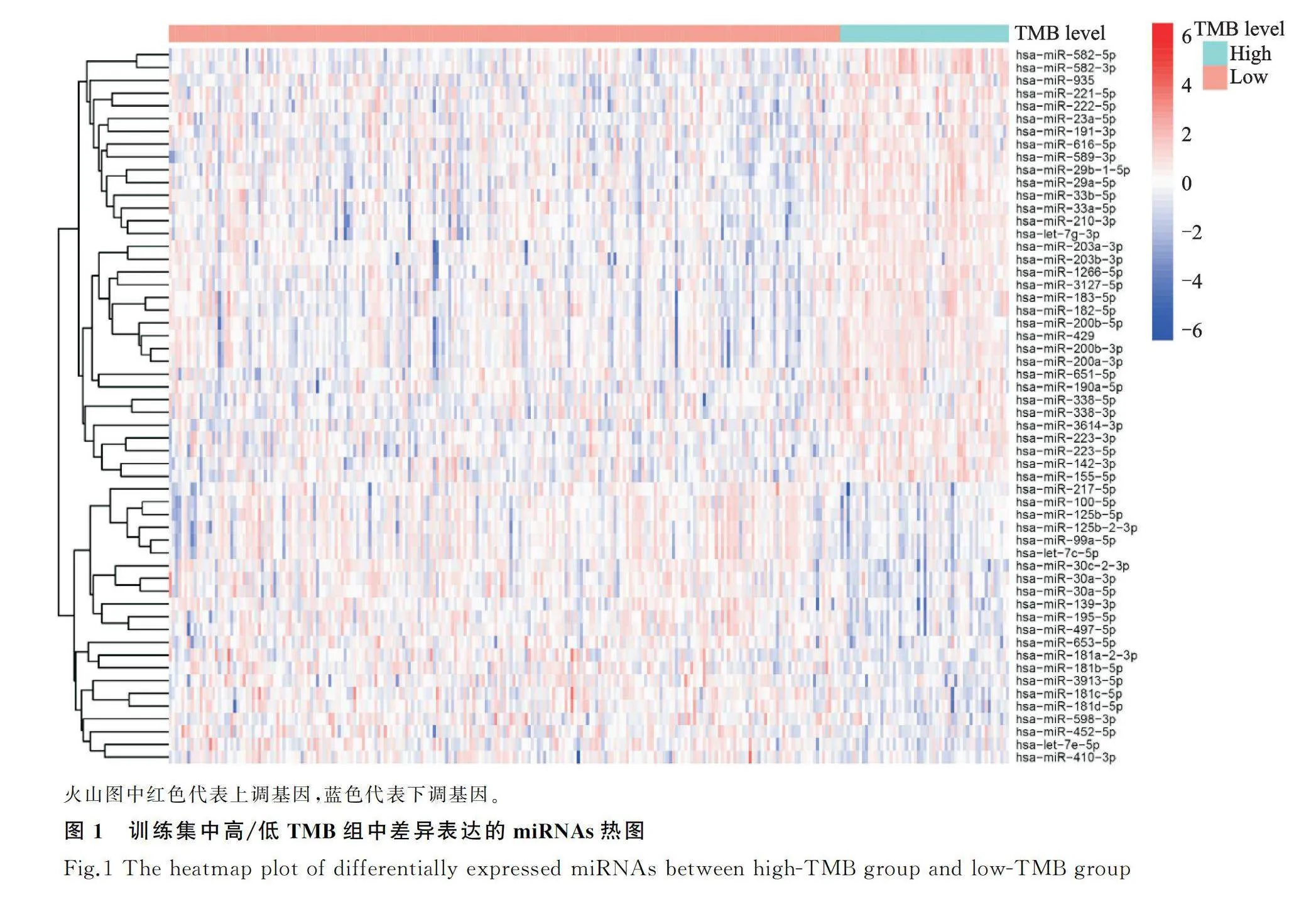
TMB(肿瘤突变负荷)是指肿瘤组织每兆碱基中突变的总数,包括基因编码错误、碱基替换、基因插入或缺失错误的总和。通过perl软件(https://www.perl.org/)计算每个样本的TMB值,并根据TMB阈值10(突变个数/百万碱基对)将样本分为高TMB组和低TMB组。以表达倍数变化值(|fold change|)≥1,校正后的P<0.05为筛选条件,利用R语言中的“limma”数据包,筛选在训练集中高低TMB两组中差异表达的miRNAs(DE-miRNAs),并通过R语言中“pheatmap”数据包,以热图的形式展示。
1.3 功能富集分析
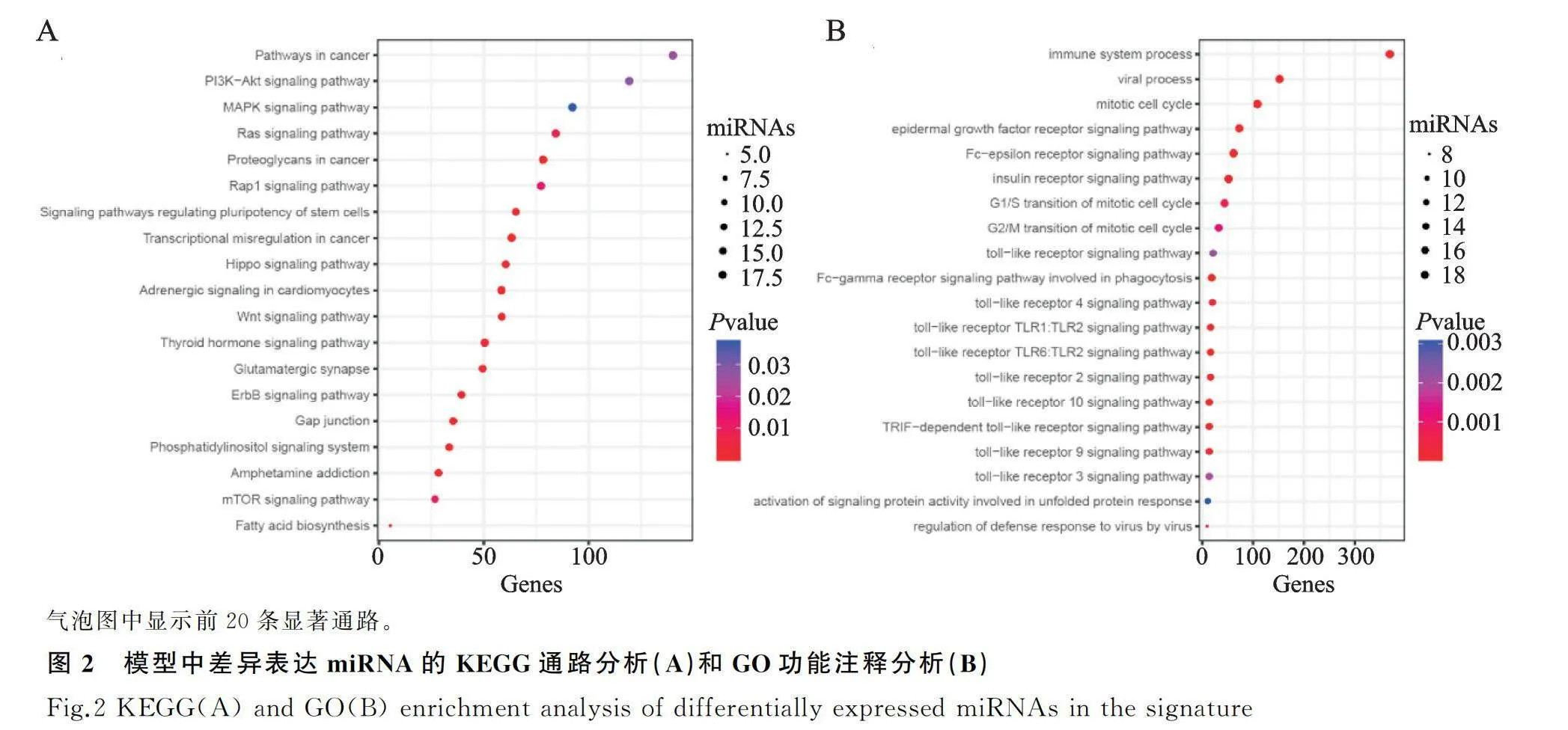
应用DIANA-mirPath V3.0软件对DE-miRNAs进行KEGG通路分析和GO功能注释,然后利用R语言中的“ggplot2”数据包对最显著的20条KEGG通路和GO的生物学过程,以可视化气泡图形式展现。
1.4 机器学习算法筛选TMB预测标签
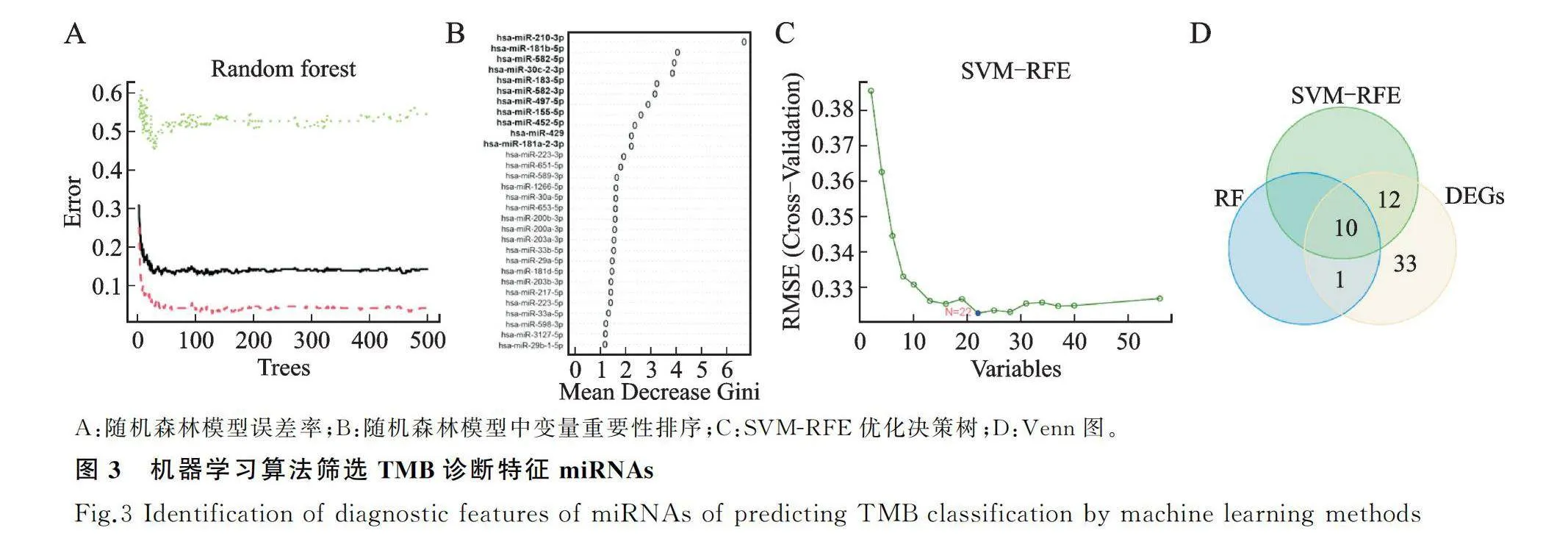
本文采用了两种机器学习算法来预测TMB分类预测。第一种方法是RF算法[13]gt;,通过R语言“randomForest”包,对DE-miRNAs构建随机森林属模型,通过重要性评分,筛选TMB分类相关的诊断特征miRNAs。第二种方法是SVM-RFE算法ADDINEN.CITE.DATA[14],通过R语言“e1071”包,识别具有最高辨别能力的特征miRNAs。最后,利用Venn图分析得到两种机器学习算法共同筛选出的TMB分类最相关的最具有诊断参考性miRNAs。
1.5 高-TMB组与低-TMB组间免疫细胞浸润程度分析
利用CIBERSORT算法,基于22种免疫细胞的参考基因集,推算胃癌表达谱数据中各样本免疫细胞的浸润程度。随后,通过R语言“vioplot”和“corrplot”包对高-TMB组和低-TMB组间免疫细胞的浸润程度差异和相关性进行分析和可视化。
1.6 hsa-miR-210-3p与TMB和相关基因表达的相关性
提取TCGA数据库中每个胃癌患者的基因表达量,TMB值和hsa-miR-210-3p表达量。之后利用Spearman相关性方法对hsa-miR-210-3p与TMB,错配修复相关基因(BRCA1、 BRCA2、 MLH1、 MSH2、 MSH6、 PSM2)和免疫检查点相关基因(PD-1、 PD-L1、 CTLA-4))进行相关性分析。
1.7 统计学分析
本研究的所有数据分析是基于R语言软件(V 4.1.2)。利用卡方检验分析训练集和验证集中的各临床病理特征。对于连续变量如年龄和TMB值,利用非参数秩和检验法进行检验。利用Spearman相关性方法检测TMB-相关预测模型和miRNAs与免疫细胞浸润程度的相关性。P<0.05为差异具有统计学意义。
2 结果
2.1 在训练集中筛选差异miRNA的表达
提取来自TCGA数据库中共391例胃癌信息,将其随机分入训练集(n=274例)和验证集(n=117例)。卡方检验结果提示,训练集和验证集中胃癌患者的基本信息和临床病理特征无统计学差异(表1)。根据TMB阈值,将训练集样本分成高TMB组和低TMB组。对上述两组进行miRNA差异分析,以校正P<0.05和表达倍数变化值(|fold change|)≥1为筛选标准,得到56个差异表达miRNAs,34个miRNAs表达上调,22个miRNAs表达下调,对差异基因进行可视化,结果见图1。
2.2 DE-miRNAs的功能分析
利用DIANA-mirPath V3.0软件对模型中56个miRNAs进行了相关KEGG通路分析和GO功能注释。KEGG结果(图2A)显示,miRNAs主要富集在肿瘤发生发展和活化肿瘤增殖等信号通路(如ErbB信号通路, Wnt信号通路和mTOR信号通路)。GO功能注释(图2B)表明,大多数miRNAs在生物学过程(BP)中,主要富集在免疫系统过程和Toll样受体信号通路等生物学过程。
2.3 TMB分类相关miRNAs的筛选与鉴定
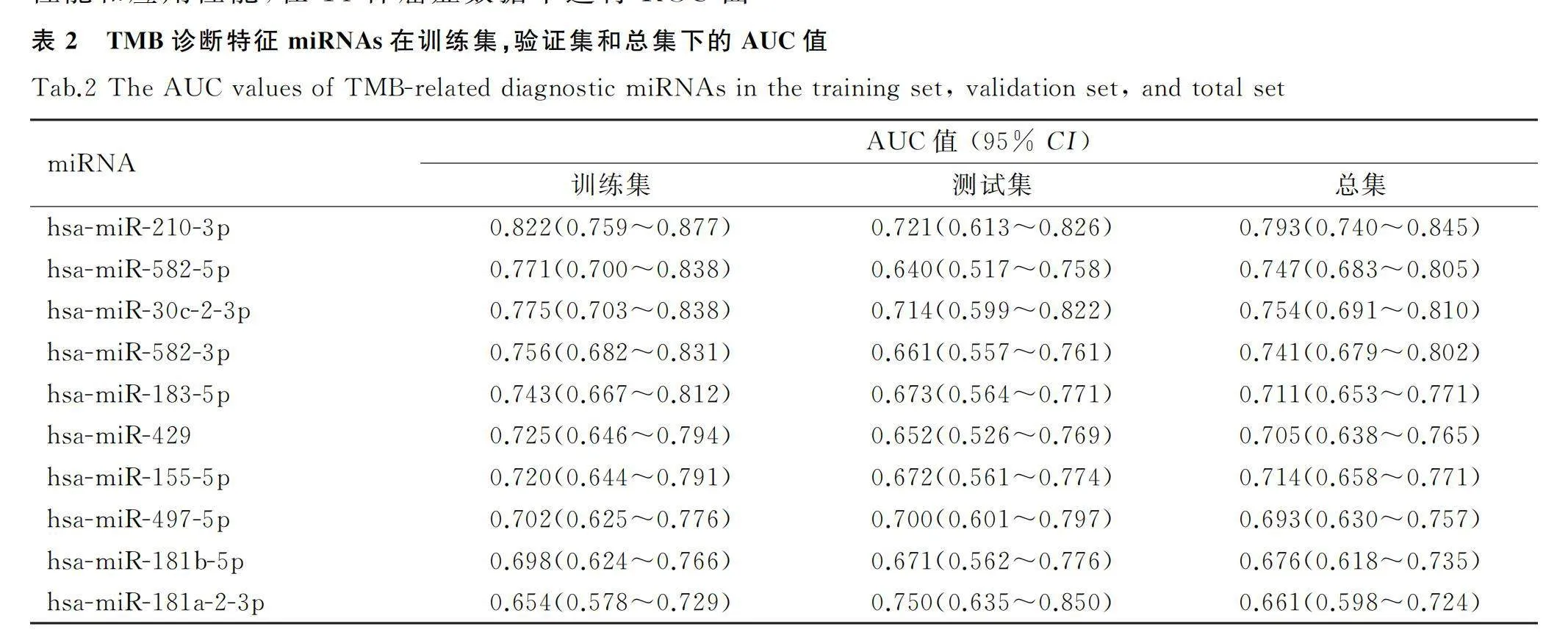
为了进一步选择对高TMB和低TMB分组具有显著特征价值的候选miRNA,首先,对这些DE-miRNAs建立随机森林(RF)分类模型后,根据RF算法给出基因重要性评分,筛选得到了11个miRNAs(图3A、图3B),随后,使用SVM-RFE算法筛选出了22个miRNAs(图3C)。最后,通过Venn图分析得到上述两种方法共同筛选出的10个具有最高辨别能力的特征miRNAs(图3D)。
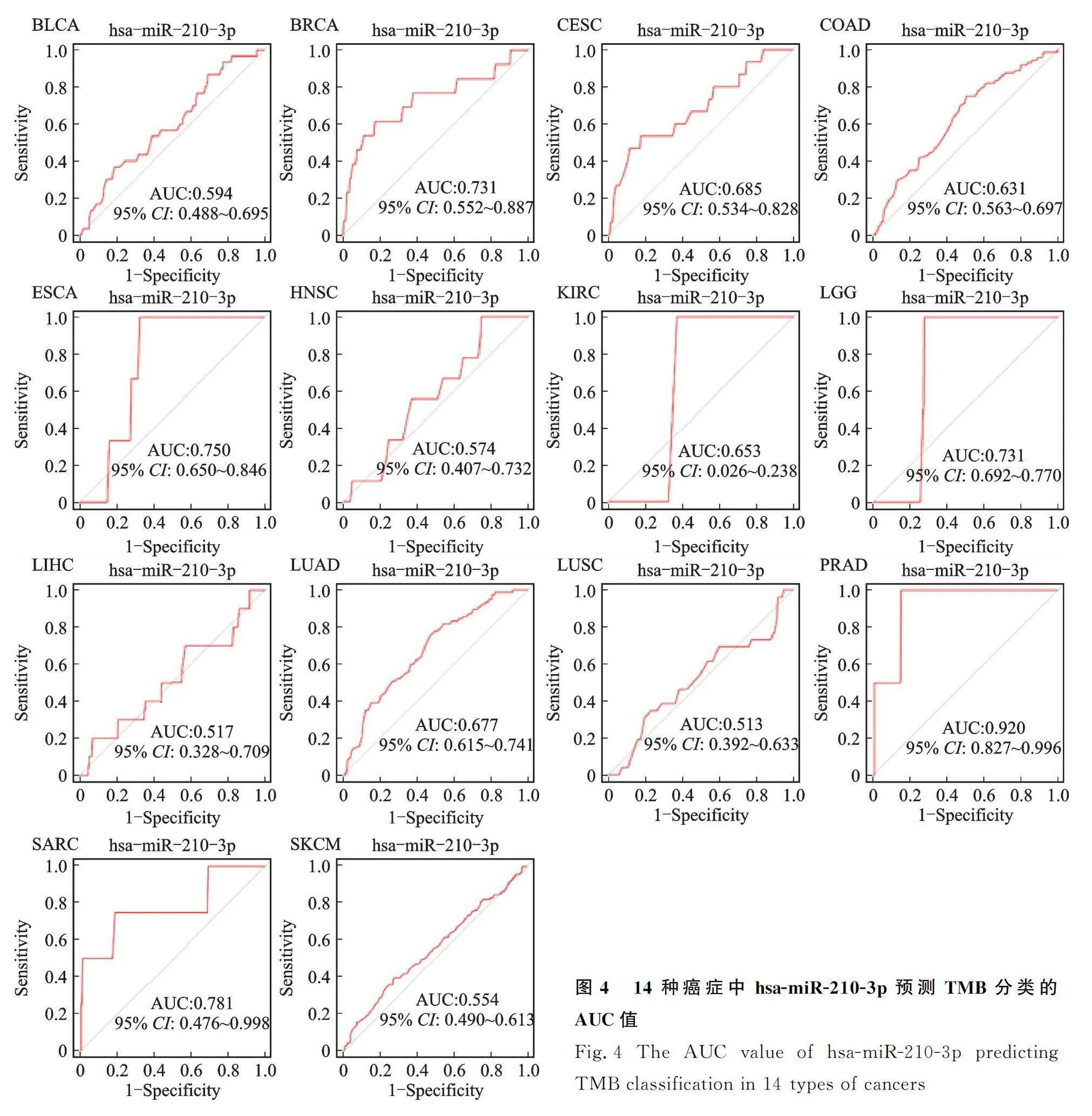
为评估这些候选诊断特征miRNAs的预测能力,利用ROC曲线来计算其AUC值(表2)。这10个miRNAs中只有hsa-miR-210-3p的AUC值在不同数据集中都大于0.7,预示着该miRNA具有较好的预测能力。同时,为进一步验证该miRNA的预测性能和应用性能,在14种癌症数据中进行ROC曲线分析(图4),可以看到hsa-miR-210-3p在乳腺癌(BRCA)、食管癌(ESCA)、低级别胶质瘤(LGG)、前列腺癌(PRAD)和恶性肉瘤(SARC)中具有不错的预测能力(AUC值>0.7),提示其可能成为一种通用的预测TMB水平的生物标志物。
2.4 免疫细胞分析
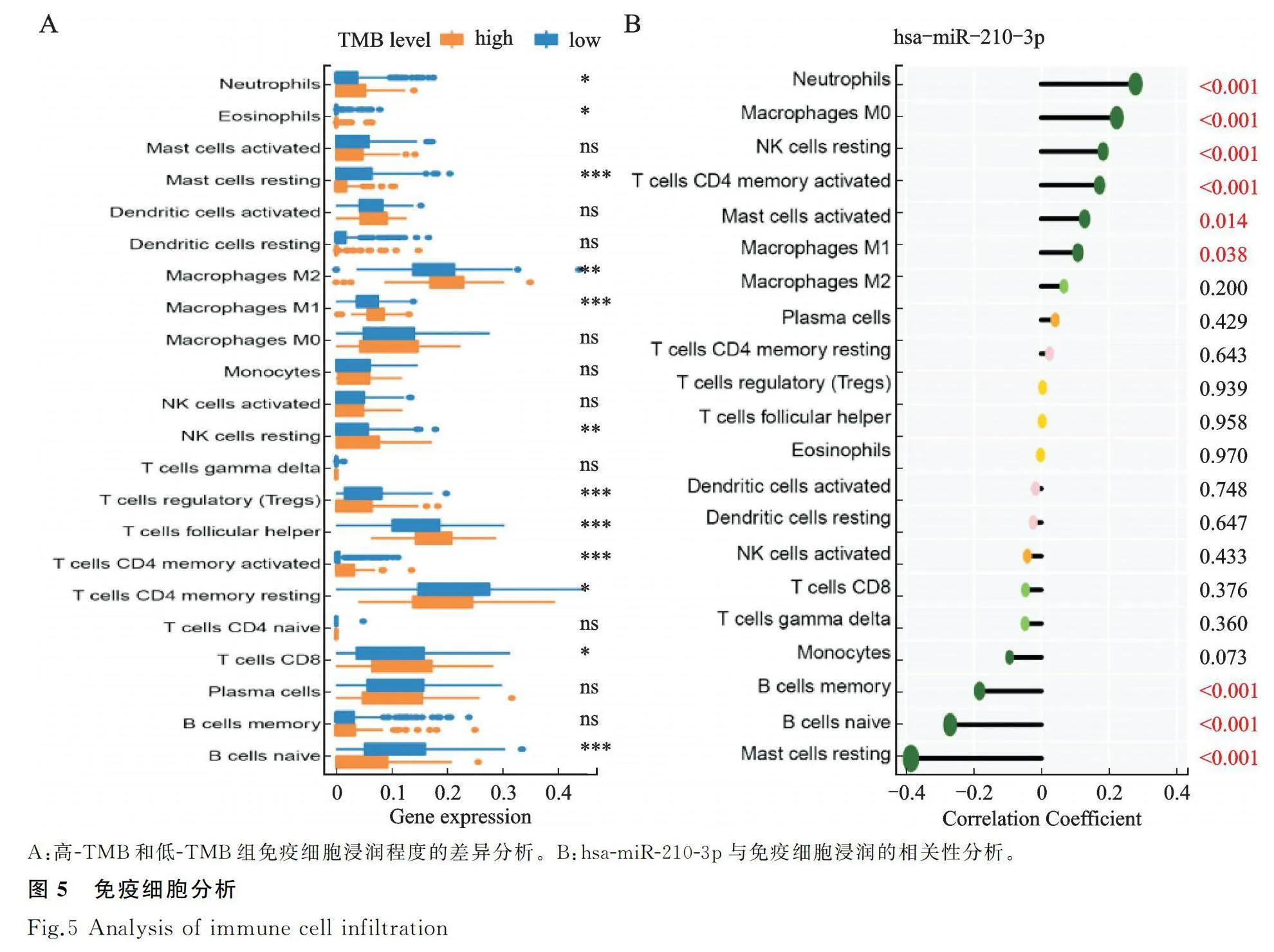
与低-TMB组相比,高-TMB组具有较高比例的T cells CD8、T cells CD4 memory activated、T cells follicular helper、NK cells resting、Macrophages M1、Macrophages M2和Neutrophils,但是具有较低比例的B cells nave、T cells CD4 memory resting、T cells regulatory (Tregs)和mast cells resting,并都具有统计学差异(P<0.05,图5A)。不同TMB分组中存在多种与免疫治疗应答相关的免疫细胞浸润程度的差异,这也部分解释了TMB为何能预测免疫治疗疗效。相关性分析显示,hsa-miR-210-3p与neutrophils、macrophages M0、NK cells resting、T cells CD4 memory activated,mast cells activated和macrophages M1浸润程度呈正相关,与mast cells resting,B cells nave,B cells memory和 monocytes浸润程度呈负相关(图5B)。这些结果提示hsa-miR-210-3p与免疫具有相关性。
2.5 hsa-miR-210-3p与TMB的关系
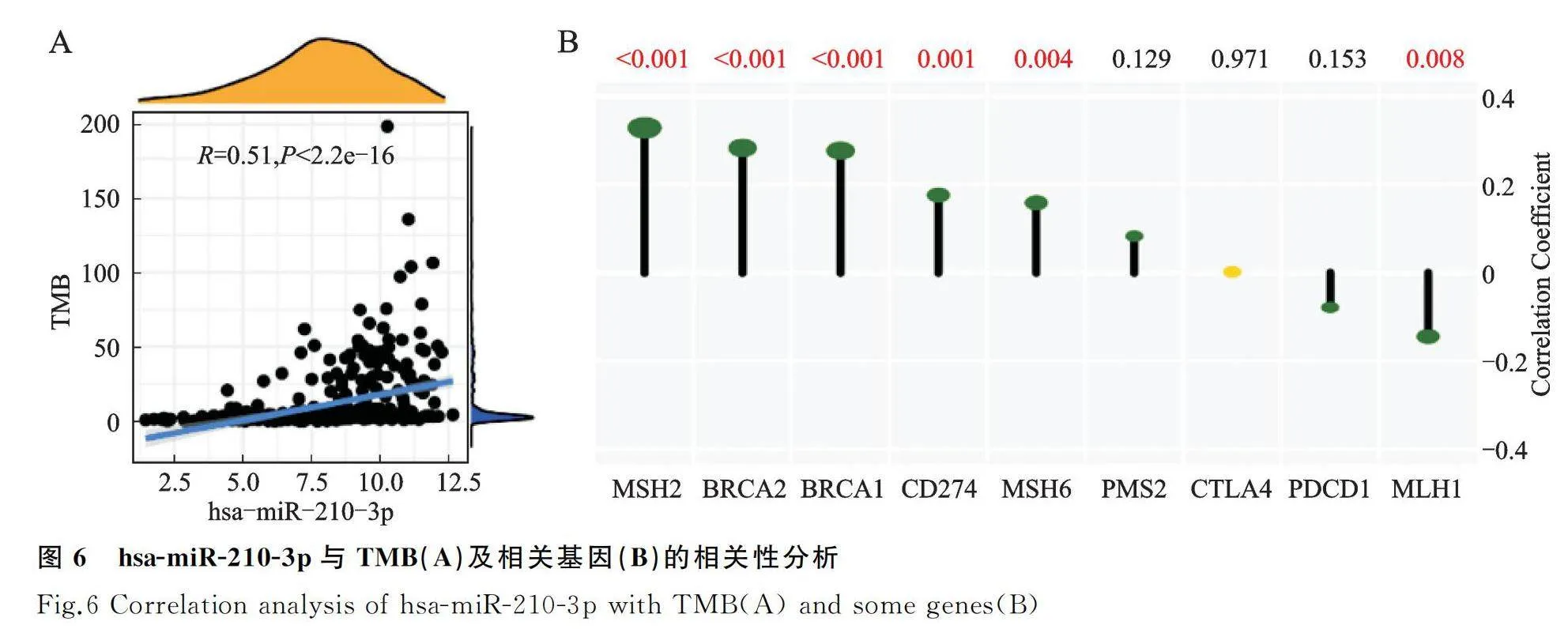
进一步研究hsa-miR-210-3p与TMB和错配修复相关基因以及免疫检查点表达的关系,结果显示(图6A、图6B),hsa-miR-210-3p与TMB水平(r=0.51, P<0.001)、 MSH2(r=0.33, P<0.001)、 BRCA2(r=0.28, P<0.001)、 BRCA1(r=0.27, P<0.001)、 CD274(r=0.18, P<0.001)、 MSH6(r=0.16, P=0.004)呈正相关,与MLH1(r=-0.14, P=0.008)呈负相关。然而,CTLA4, PDCD1和PMS2的表达水平与TMB相关二分类模型无明显相关(P>0.05)。
3 讨论
目前免疫治疗正在逐渐改变晚期胃癌的治疗策略。2020年3月纳武单抗成为国内首个PD-1单抗,被用于接收二线及以上治疗的晚期胃癌。同年ESMO年会中公布的ATTRACTION-4研究ADDINEN.CITE.DATA结果提示,不论PD-L1的表达水平,免疫检查点抑制剂联合化疗能取得约60%的ORR,但免疫检查点抑制剂联合化疗的中位OS时间为17.5个月,与单纯化疗组没有统计学差异[15]。因此,寻找能预测免疫治疗疗效的标志物是临床亟需解决的问题。近年来,TMB可能成为预测免疫检查点抑制剂疗效的生物标志物。然而由于TMB检测的金标准全外显子测序的高昂费用限制了TMB在临床中的应用,因此迫切需要寻找另一种方法来预测肿瘤患者TMB值。
本研究利用机器学习算法,基于TCGA数据库鉴定出10个TMB分类相关的诊断特征miRNAs。利用ROC曲线评估这些miRNAs的预测准确性。结果提示,hsa-210-3p是与TMB分类最相关的诊断特征miRNA,其预测准确性在多个数据集中都大于0.7。目前尚缺乏一个被广泛接受的阈值来准确定义高TMB,因为许多因素,如癌症类型、样本类型、预处理参数和检测方法,都会对高TMB阈值的确定产生影响[16]中国抗癌协会肿瘤标志专业委员会遗传性肿瘤标志物协作组中国抗癌协会肿瘤标志专业委员会遗传性肿瘤标志物协作组,中国抗癌协会肿瘤病理专业委员会分子病理协作组肿瘤突变负荷检测及临床应用中国专家共识(2020年版)中国癌症防治杂志中国癌症防治杂志。因此推测,hsa-miR-210-3p是否可以预测其他恶性肿瘤中TMB的水平。有趣的是,在14种实体恶性肿瘤中有5种类型(包括BRCA、ESCA、LGG、PRAD和SARC),hsa-miR-210-3p预测TMB水平的AUC值大于0.7,表明其具有较强的预测能力和广泛的应用潜力。
本研究对差异表达的56个miRNAs进行KEGG通路分析和GO功能注释。KEGG结果显示,多数miRNAs主要富集在肿瘤相关等信号通路(如Pathways in cancer, PI3K-Akt信号通路,Ras信号通路和Rap1信号通路);GO功能注释结果显示,这些miRNAs参与生物学过程的免疫相关生物学过程(如Toll样受体相关通路、免疫系统过程、病毒过程等)。这些miRNAs富集的肿瘤相关信号通路和免疫相关生物学过程,在胃癌的发生发展中起着重要作用。例如,在胃癌中PI3K-Akt通路的异常激活是常见的分子异常事件之一,其与肿瘤的发生、生长、侵袭和治疗抵抗密切相关ADDINEN.CITE.DATA[17]。Toll样受体是一类在免疫系统中起关键作用的受体,能够感知并识别细菌、病毒等病原体的分子模式,从而激活免疫反应[18]。除了其免疫调节功能,最近的研究表明,Toll样受体通路在胃癌的炎症反应、细胞增殖和侵袭、肿瘤免疫逃逸方面也可能发挥重要作用ADDINEN.CITE.DATA[19-21]。同时本研究观察到,不同TMB分组中存在多种免疫细胞浸润程度的差异,这些免疫细胞(如CD8+ T细胞、M1型巨噬细胞、Treg细胞等)与免疫治疗应答反应密切相关。例如,CD8+ T细胞是一类具有杀伤肿瘤细胞能力的细胞,其浸润水平在肿瘤微环境中起着重要作用。大量的临床研究表明,CD8+ T细胞在癌症患者的预后中发挥着重要的作用,其高水平的浸润与更好的预后相关ADDINEN.CITE.DATA[22]。多项研究提示,高水平的M1型巨噬细胞浸润与更好的癌症预后相关。此外,M1型巨噬细胞还可以通过调节细胞因子(如IL-12和IFN-γ)的表达和分泌来影响免疫检查点(如PD-L1)的表达,从而影响免疫治疗的效果[23]。相比之下,Treg细胞是一种抑制性免疫调节细胞,高浸润的Treg细胞通常与癌症不良预后相关。此外,研究报道Treg细胞能通过抑制CD8+ T细胞的活化和扩增,从而阻碍免疫治疗的效果ADDINEN.CITE.DATA[24]。与预期一致,本研究发现,hsa-210-3p与TMB水平呈较强正相关,同时还与PD-1呈较弱正相关,同时与错配修复相关基因(BRCA1、BRCA2、MSH2、MSH6)呈较弱正相关。这些基因在免疫调节和免疫治疗中起着重要作用,提示hsa-210-3p可能参与免疫反应。但目前研究主要发现hsa-210-3p参与肿瘤的增殖、凋亡、侵袭和转移等生物学过程ADDINEN.CITE.DATA[25-26]。至于其如何参与免疫调节罕有报道,这需要未来进一步的研究。
综上所述,本研究通过TCGA数据库和机器学习算法筛选并鉴定出hsa-miR-210-3p能准确的预测胃癌患者TMB水平,同时在多种癌症中依然有不错的预测准确性,提示其较强的临床应用价值。但因为本研究是基于在线数据库分析,hsa-miR-210-3p能否代替TMB更好地预测胃癌患者免疫治疗疗效需要临床上进一步验证。
参考文献:
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424.
[2] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[3] 郑荣寿,孙可欣,张思维. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019,41(1):19-28.
ZHENG R S, SUN K X, ZHANG S W. Analysis of the epidemic situation of malignant tumors in China in 2015[J]. Chin J Oncol, 2019, 41(1):19-28.
[4] 左婷婷,郑荣寿,曾红梅. 中国胃癌流行病学现状[J]. 中国肿瘤临床, 2017, 44(1):52-58.
ZUO T T, ZHENG R S, ZENG H M. Epidemiological status of gastric cancer in China[J]. Chin Clin Oncol, 2017, 44(1):52-58.
[5] JANJIGIAN Y Y, SHITARA K, MOEHLER M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): A randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294):27-40.
[6] SATAKE H, LEE K W, CHUNG H C, et al. Pembrolizumab or pembrolizumab plus chemotherapy versus standard of care chemotherapy in patients with advanced gastric or gastroesophageal junction adenocarcinoma: Asian subgroup analysis of KEYNOTE-062[J]. Jpn J Clin Oncol, 2023, 53(3):221-229.
[7] GU C L, ZHU H X, DENG L, et al. Bispecific antibody simultaneously targeting PD1 and HER2 inhibits tumor growth via direct tumor cell killing in combination with PD1/PDL1 blockade and HER2 inhibition[J]. Acta Pharmacol Sin, 2022, 43(3):672-680.
[8] FUCHS C S, OZGUROGLU M, BANG Y J, et al. Pembrolizumab versus paclitaxel for previously treated PD-L1-positive advanced gastric or gastroesophageal junction cancer: 2-year update of the randomized phase 3 KEYNOTE-061 trial[J]. Gastric Cancer, 2022, 25(1):197-206.
[9] YARCHOAN M, HOPKINS A, JAFFEE E M. Tumor mutational burden and response rate to PD-1 inhibition[J]. N Engl J Med, 2017, 377(25):2500-2501.
[10] MANSFIELD A S, REN H, SUTOR S, et al. Contraction of T cell richness in lung cancer brain metastases[J]. Sci Rep, 2018, 8(1):2171.
[11] GUBIN M M, ARTYOMOV M N, MARDIS E R, et al. Tumor neoantigens: Building a framework for personalized cancer immunotherapy[J]. J Clin Invest, 2015, 125(9):3413-3421.
[12] YARCHOAN M, JOHNSON B A 3RD, LUTZ E R, et al. Targeting neoantigens to augment antitumour immunity[J]. Nat Rev Cancer, 2017, 17(4):209-222.
[13] XU C, WANG J, ZHENG T, et al. Prediction of prognosis and survival of patients with gastric cancer by a weighted improved random forest model: An application of machine learning in medicine[J]. Arch Med Sci, 2022, 18(5):1208-1220.
[14] SANZ H, VALIM C, VEGAS E, et al. SVM-RFE: Selection and visualization of the most relevant features through non-linear kernels[J]. BMC Bioinformatics, 2018, 19(1):432.
[15] BOKU N, RYU M H, KATO K, et al. Safety and efficacy of nivolumab in combination with S-1/capecitabine plus oxaliplatin in patients with previously untreated, unresectable, advanced, or recurrent gastric/gastroesophageal junction cancer: Interim results of a randomized, phase II trial (ATTRACTION-4)[J]. Ann Oncol, 2019, 30(2):250-258.
[16] 中国抗癌协会肿瘤标志专业委员会遗传性肿瘤标志物协作组. 肿瘤突变负荷检测及临床应用中国专家共识(2020年版)[J]. 中国癌症防治杂志, 2020, 12(5):485-494.
Genetic Tumor Markers Collaborative Group of the Cancer Markers, Professional Committee of the China Anti-Cancer Association. Chinese Expert Consensus on Tumor Mutation Load Detection and Clinical Application (2020 Edition)[J]. Chin J Oncol Prev Treat, 2020, 12(5):485-494.
[17] BAGHERY SAGHCHY KHORASANI A, POURBAGHERI-SIGAROODI A, PIRSALEHI A, et al. The PI3K/Akt/mTOR signaling pathway in gastric cancer; from oncogenic variations to the possibilities for pharmacologic interventions[J]. Eur J Pharmacol, 2021, 898:173983.
[18] JAVAID N, CHOI S. Toll-like receptors from the perspective of cancer treatment[J]. Cancers (Basel), 2020, 12(2):297.
[19] MELIT L E, MARGINEAN C O, MARGINEAN C D, et al. The relationship between Toll-like receptors and helicobacter pylori-related gastropathies: Still a controversial topic[J]. J Immunol Res, 2019, 2019:8197048.
[20] NAGASHIMA H, YAMAOKA Y. Importance of Toll-like receptors in pro-inflammatory and anti-inflammatory responses by helicobacter pylori infection[J]. Curr Top Microbiol Immunol, 2019, 421:139-158.
[21] LIU M, HU Z, WANG C, et al. The TLR/MyD88 signalling cascade in inflammation and gastric cancer: The immune regulatory network of Helicobacter pylori[J]. J Mol Med (Berl), 2023, 101(7):767-781.
[22] TUMEH P C, HARVIEW C L, YEARLEY J H, et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance[J]. Nature, 2014, 515(7528):568-571.
[23] DENARDO D G, RUFFELL B. Macrophages as regulators of tumour immunity and immunotherapy[J]. Nat Rev Immunol, 2019, 19(6):369-382.
[24] TOGASHI Y, SHITARA K, NISHIKAWA H. Regulatory T cells in cancer immunosuppression —" implications for anticancer therapy[J]. Nat Rev Clin Oncol, 2019, 16(6):356-371.
[25] REN D, YANG Q, DAI Y, et al. Oncogenic miR-210-3p promotes prostate cancer cell EMT and bone metastasis via NF-kappaB signaling pathway[J]. Mol Cancer, 2017, 16(1):117.
[26] WANG L, HE J, HU H, et al. Lung CSC-derived exosomal miR-210-3p contributes to a pro-metastatic phenotype in lung cancer by targeting FGFRL1[J]. J Cell Mol Med, 2020, 24(11):6324-6339.
(编辑 张 敏)

