绒毛间充质干细胞对滋养细胞增殖和自噬的影响



[摘要] 目的 探讨人胎盘绒毛间充质干细胞(CV-MSC)对滋养细胞增殖和自噬的影响。
方法 在低氧条件下应用CV-MSC条件培养液处理HTR-8和JEG-3滋养细胞株。应用CCK-8试剂盒检测滋养细胞的增殖能力,采用免疫荧光法检测自噬蛋白LC-3B在滋养细胞内的表达,采用蛋白印迹法(Western blot)检测滋养细胞内自噬相关蛋白LC-3B、BECN1和P62的表达水平,采用逆转录-聚合酶链式反应(RT-PCR)检测滋养细胞内Cludin-11(CLDN11)以及雷帕霉素靶蛋白(mTOR)通路相关基因mTOR、S6K1的mRNA表达水平,采用Western blot检测滋养细胞内CLDN11、mTOR、S6K1的蛋白表达水平及磷酸化程度。
结果 与低氧组相比,低氧+CV-MSC条件培养液处理组HTR-8和JEG-3滋养细胞增殖的吸光度值显著增高(F=51.9、26.9,Plt;0.05),CLDN11、mTOR、S6K1的mRNA及蛋白表达水平显著降低(F=3.9~9.1,Plt;0.01),LC-3B、BECN1蛋白表达水平增加,P62蛋白表达水平降低。
结论 低氧条件下CV-MSC可以通过抑制CLDN11表达、失活mTOR通路、增强细胞自噬促进滋养细胞的增殖。
[关键词] 绒毛膜绒毛;间质干细胞;壳牢素类;mTOR调节相关蛋白;细胞增殖;自噬
[中图分类号] R714.24;R329.25
[文献标志码] A
[文章编号] 2096-5532(2023)01-0087-06
doi:10.11712/jms.2096-5532.2023.59.039
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20230308.1033.001.html;2023-03-09 16:50:39
EFFECT OF CHORIONIC VILLOUS MESENCHYMAL STEM CELLS ON TROPHOBLAST PROLIFERATION AND AUTOPHAGY
HOU Lei, LIU Shiguo, ZHANG Yan, GAO Guoqiang, CHU Yijing, YE Yuanhua
(Department of Obstetrics, Affiliated Hospital of Qingdao University, Qingdao 266071, China)
; [ABSTRACT] "Objective "To investigate the effect of human placental chorionic villous mesenchymal stem cells (CV-MSC) on placental trophoblast proliferation and autophagy.
Methods "Trophoblast cell lines HTR-8 and JEG-3 were treated with CV-MSC conditioned medium under hypoxic conditions. CCK-8 kit was used to measure the proliferative capacity of trophoblasts; immunofluorescence assay was used to measure the expression of the autophagy-related protein LC-3B in trophoblasts; Western blot was used to measure the expression levels of the autophagy-related proteins LC-3B, BECN1, and P62 in trophoblasts; reverse transcription-polymerase chain reaction was used to measure the mRNA expression levels of Cludin-11 (CLDN11) and the mammalian target of rapamycin (mTOR) pathway-related genes mTOR and S6K1 in trophoblasts, and Western blot was used to measure the protein expression levels and phosphorylation degrees of CLDN11, mTOR, and S6K1 in trophoblasts.
Results "Compared with the hypoxia group, the hypoxia+CV-MSC conditioned medium treatment group had a significant increase in the absorbance values of JEG-3 and HTR-8 trophoblasts (F=51.9,26.9;Plt;0.05), significant reductions in the mRNA and protein expression levels of CLDN11, mTOR, and S6K1 (F=3.9-9.1,Plt;0.01), significant increases in the protein expression of LC-3B and BECN1, and a significant reduction in the protein expression of P62.
Conclusion "CV-MSC under hypoxic conditions can promote the prolife-
ration of trophoblasts by inhibiting CLDN11 expression, inactivating the mTOR pathway, and promoting the autophagy of trophoblasts.
[KEY WORDS] "chorionic villi; mesenchymal stem cells; claudins; regulatory-associated protein of mTOR; cell proliferation; autophagy
子痫前期是常见的妊娠期疾病,严重影响母儿健康,常伴随胎盘发育异常和胎盘滋养细胞的功能异常[1]。在正常妊娠过程中,滋养细胞进入子宫蜕膜并在氧含量相对较低的子宫蜕膜内生长侵袭,为胎儿提供生长所需的氧气及营养物质,所以滋养细胞的功能对妊娠过程至关重要[2]。在子痫前期病理过程中,过度氧化应激的母胎界面微环境会导致滋养细胞的异常分化和抗血管生成蛋白分泌增加,导致滋养细胞的功能异常[3]。间充质干细胞(MSC)功能广泛,目前在抗炎、调节免疫、血管新生、诱导自噬、归巢和抗凋亡等方面皆表现出积极的作用。研究表明,胎盘MSC可以在内膜血管生成中发挥重要作用[4]。所以通过胎盘绒毛间充质干细胞(CV-MSC)改善滋养层细胞增殖和自噬的能力进而治疗妊娠相关疾病成为研究热点。本研究旨在探讨人胎盘CV-MSC对滋养细胞增殖和自噬的作用及其可能的机制,以期为子痫前期的干细胞治疗提供理论基础。
1 材料与方法
1.1 细胞培养
取足月顺产正常新生儿胎盘(孕妇及家属均签署知情同意书),剪碎后用PBS冲洗,用2.5 g/L胰蛋白酶和1 g/L的Ⅰ型胶原酶37 ℃振荡消化1 h,再用100 μm滤网过滤消化液并低速离心。将离心得到的细胞接种于培养瓶中,加干细胞培养液,置于温度37 ℃、含体积分数0.05" CO2的饱和湿度细胞培养箱中培养,得到CV-MSC[5]。取3~6代的细胞接种于培养液中,常规制备CV-MSV条件培养液(简称条培)。
JEG-3和HTR-8细胞系均购于中国ATCC中心,用含体积分数0.10胎牛血清的DMEM/F12培养液,在37 ℃、含体积分数0.05 CO2的饱和湿度细胞培养箱中培养。模拟低氧条件时,应用低氧细胞培养箱(美国BioSpherix),调整培养箱的氧气浓度为体积分数0.003。
1.2 载体转染滋养细胞
构建Cludin-11(CLDN11)过表达慢病毒载体和CLDN11小干扰RNA(siRNA)。靶点设计、载体构建及慢病毒包装均由上海吉凯基因化学技术有限公司完成。载体转染滋养细胞72 h,荧光显微镜下观察,收集细胞汇合度70%~80%、生长状态良好的细胞进行后续实验。采用逆转录-聚合酶链式反应(RT-PCR)法检测CLDN11 mRNA的表达水平以验证转染效果。
1.3 CCK-8法检测细胞增殖能力
将对数生长期的滋养细胞以每孔4×104个接种于96孔板,每孔接种细胞悬浮液100 μL。将培养板放于培养箱(37 ℃、体积分数0.05 CO2、饱和湿度)中预培养24 h。在细胞培养的48 h加入10 μL CCK-8溶液。在培养箱内孵育1 h后将培养板置酶标仪上测定各孔细胞在450 nm波长下的吸光度值(代表细胞的增殖能力),并绘制细胞的生长曲线。实验重复3次。
1.4 蛋白印迹法(Western blot)检测自噬相关蛋白含量
滋养细胞用PBS清洗后加入NP40裂解,提取细胞总蛋白,并测定其浓度。电泳上样量为 20 μg,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电转膜2 h。用封闭液摇床封闭2 h,洗涤后加入一抗,4 ℃摇床孵育过夜,洗涤后加入辣根过氧化物酶标记的二抗,室温孵育2 h,暗室中曝光、显影并扫描拍照。
1.5 RT-PCR法检测CLDN11及雷帕霉素靶蛋白(mTOR)通路相关基因表达水平
采用TRIzol法提取滋养细胞的总RNA,置于-20 ℃冰箱保存备用。应用北京宝日生物科技有限公司的逆转录试剂盒RT regent Kit进行cDNA合成,得到逆转录终产物cDNA。应用北京宝日的Takara RR420A TB Green Premix Ex Taq试剂盒进行RT-PCR反应,采用2-△△CT法计算滋养细胞中CLDN11基因以及mTOR通路相关基因mTOR、S6K1的表达水平。
1.6 免疫荧光法检测自噬相关蛋白表达
用条件培养液处理滋养细胞24 h,收集滋养细胞离心,应用40 g/L多聚甲醛固定1 h,石蜡包埋后切片。切片以PBS洗涤后,用体积分数0.10的山羊血清封闭1 h,接着用体积分数0.002的Tritonx-100浸泡2次,每次10 min。再用LC-3B和β-catenin的一抗37 ℃孵育4 h,加二抗孵育1 h,洗涤切片后进行DAPI染色。应用荧光显微镜观察拍照,进行蛋白半定量分析。
1.7 胎盘外植体培养
用胎盘外植体模拟体内胎盘的生长。取足月剖宫产胎盘,在PBS中彻底洗3次后,将绒毛组织切成小块(8 mm3),所有操作在30 min内完成。将绒毛组织小块放入6孔板内,加入含青霉素/链霉素的DMEM/F12培养液(每孔4 mL),放入细胞培养箱(37 ℃、体积分数0.05 CO2、饱和湿度)中培养2 d。胎盘外植体用条件培养液处理24 h,以PBS冲洗后放入液氮中保存。
1.8 胎盘外植体CLDN11和Ki67表达检测
胎盘外植体以石蜡包埋、切片,采用免疫组化法检测CLDN11和Ki67表达,用PBS替代一抗作为阴性对照。实验严格按照说明书进行操作。
1.9 统计学分析
采用SPSS 22.0软件进行统计学分析。计量资料经正态性检验符合正态分布,以±s表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析,以Plt;0.05为差异有统计学意义。
2 结" 果
2.1 CV-MSC对滋养细胞增殖及自噬的影响
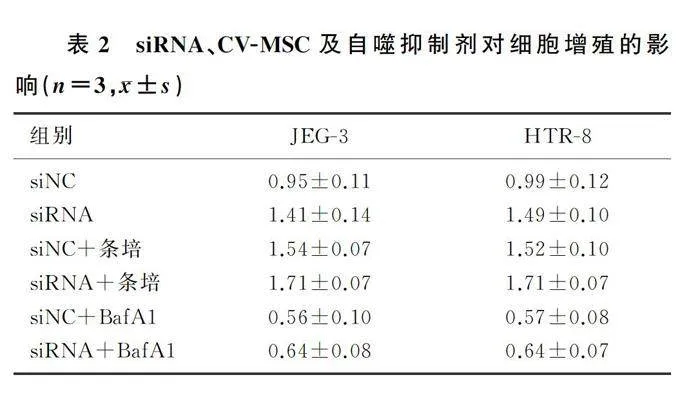
将两种滋养细胞分为对照组、低氧组及低氧+条培组,分别检测其生长48 h的吸光度值。结果显示,低氧组两种滋养细胞吸光度值较对照组明显降低,低氧+条培组滋养细胞的吸光度值较低氧组明显升高,差异均有显著性(F=51.9、26.9,Plt;0.05)。见表1。
应用低氧及条件培养液处理24 h后,Western blot检测结果显示,低氧组两种滋养细胞内自噬相关蛋白LC-3B、BECN1的表达升高,泛素结合蛋白P62(自噬标志物,与自噬趋势相反)的表达降低;低氧+条培组滋养细胞内自噬相关蛋白的表达进一步升高,P62蛋白的表达进一步降低。LC-3B的表达免疫荧光法结果与Western blot结果一致。见图1。
2.2 CV-MSC对滋养细胞内CLDN11表达以及mTOR通路活性的影响
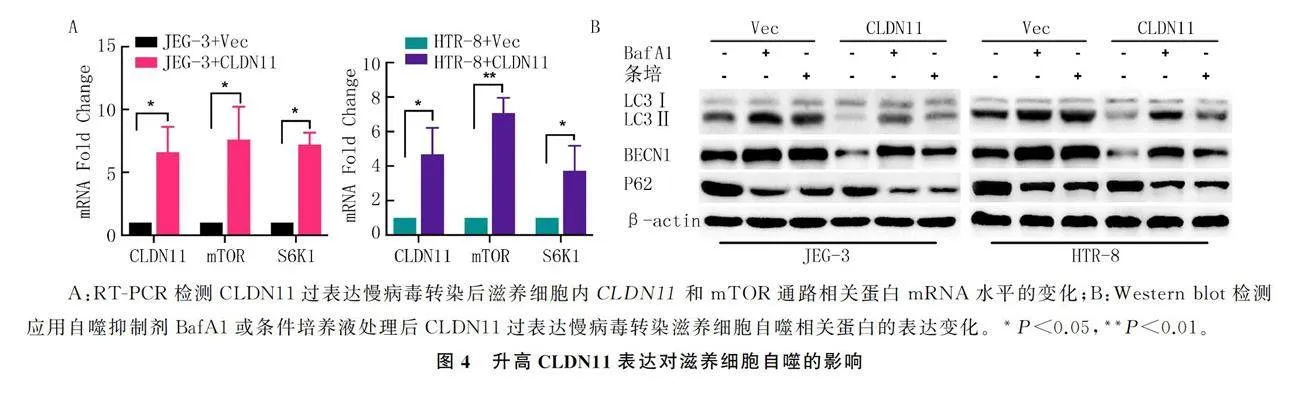
RT-PCR检测结果显示,与低氧组比较,低氧+条培组滋养细胞内CLDN11、mTOR以及S6K1的mRNA的表达水平均显著降低(F=3.9~9.1,Plt;0.01)。
Western blot检测显示,与低氧组比,低氧+条培组滋养细胞内上述蛋白的表达水平及mTOR通路相关蛋白的磷酸化水平明显降低。见图2。
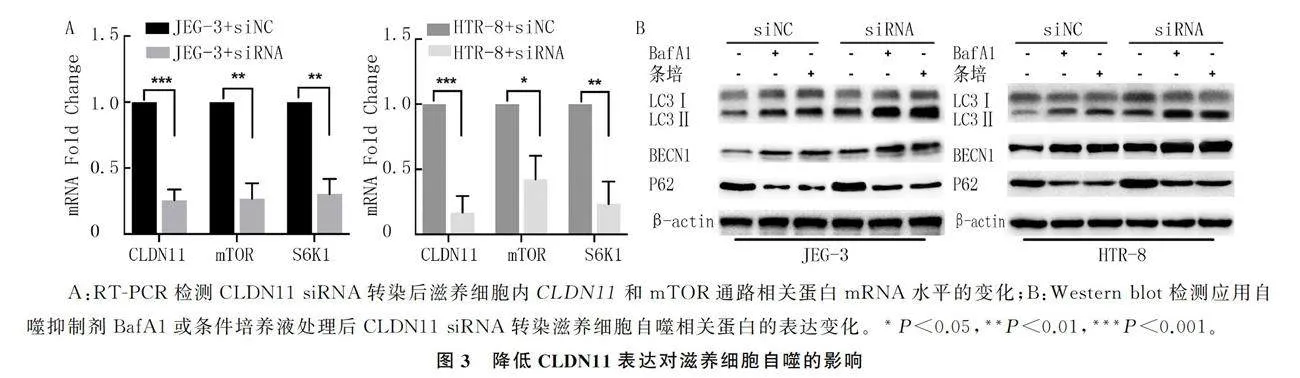
2.3 siRNA降低CLDN11表达对滋养细胞自噬及增殖的影响
RT-PCR检测结果显示,应用CLDN11 siRNA转染后,与siNC(siRNA阴性对照)组比较,siRNA组滋养细胞内CLDN11、mTOR、S6K1 mRNA的表达水平均明显降低(t=5.6~15.9,Plt;0.05)。Western blot检测结果显示,CLDN11 siRNA转染后滋养细胞自噬相关蛋白的表达水平明显上升。应用条件培养液及自噬抑制剂BafA1处理CLDN11 siRNA转染的滋养细胞24 h,二者对自噬相关蛋白的表达均具有促进作用。见图3。
细胞培养48 h后CCK-8检测显示,siRNA组与siNC组比较,siRNA+BafA1组与siNC+BafA1组比较,siRNA+条培组与siNC+条培组比较,吸光度值均明显上升,差异有显著意义(t=4.5~12.0,Plt;0.05)。见表2。
2.4 过表达慢病毒升高CLDN11表达对滋养细胞自噬及增殖的影响
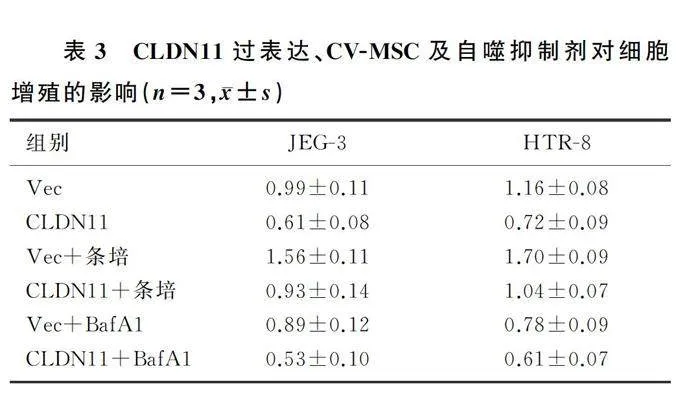
RT-PCR检测结果显示,与vec组(模型对照组)相比较,CLDN11组(过表达组)滋养细胞内CLDN11和mTOR通路相关基因的表达明显升高(t=3.3~11.2,Plt;0.05)。Western blot检测结果表明,CLDN11过表达后滋养细胞自噬水平明显下降。见图4。
CLDN11过表达慢病毒转染的滋养细胞经条件培养液或者自噬抑制剂BafA1处理24 h后,采用CCK-8法检测各组滋养细胞的增殖能力,结果显示,CLDN11组与vec组、CLDN11+条培组比较,CLND11+条培组与vec+条培组比较,吸光度值均明显下降(t=3.9~10.0,Plt;0.05);CLDN11组与CLDN11+BafA1组吸光度值比较,差异无显著性(P>0.05)。见表3。
2.5 CV-MSC对胎盘外植体自噬及增殖的影响
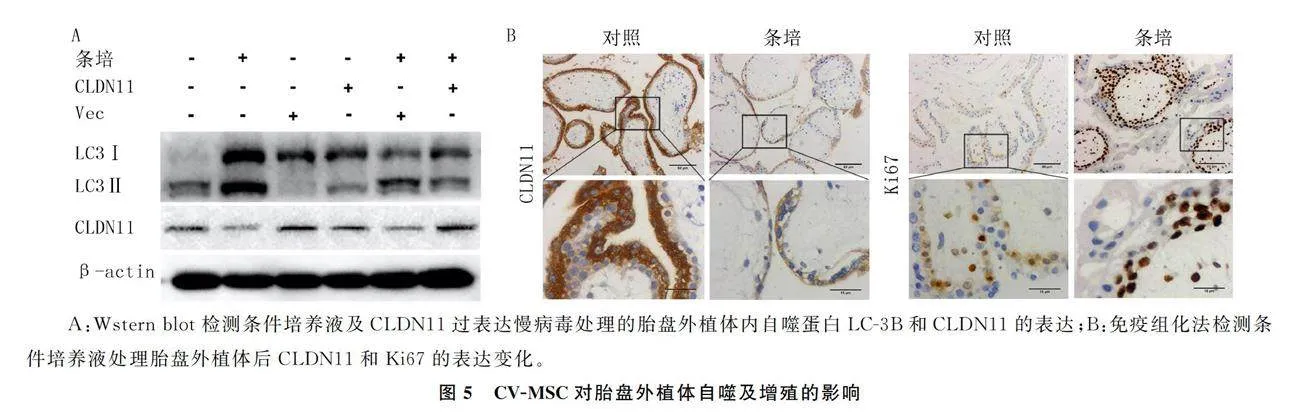
条件培养液及CLDN11过表达慢病毒处理胎盘外植体48 h,Western blot检测结果显示,条件培养液能明显增加胎盘外植体的自噬水平以及降低CLDN11的蛋白水平,而CLDN11过表达慢病毒转染升高胎盘外植体内CLDN11表达的同时抑制了这种自噬水平升高。免疫组化法检测结果表明,条件培养液能明显降低绒毛细胞内CLDN11的表达强度,而明显升高Ki67的表达强度。见图5。
3 讨" 论
胎盘的主要功能是由滋养细胞完成的,滋养细胞功能障碍是导致妊娠期高血压疾病及胎儿生长受限的根本原因[6-7]。滋养细胞功能改善和重建是胎盘异常相关疾病治疗的关键因素,但目前相关的研
究较少。MSC是间质组织中具有多向分化能力及自我更新能力的祖细胞,越来越多的研究结果表明,MSC能分泌多种细胞因子来促进血管生成,并且其免疫调节、抗炎、促血管生成和抗细胞凋亡的作用使MSC治疗成为一种重要的组织修复新疗法[8-9]。基于MSC的细胞疗法已经成为缺血性疾病最有前途的治疗策略之一,多项研究表明,MSC在缺血性心脏病、肾脏损伤和伤口愈合中的治疗作用与组织母细胞相似,表明MSC在组织损伤修复治疗中具有积极作用[10]。然而,MSC损伤修复治疗作用的基础研究较少,其具体作用机制目前仍不清楚。来源于胎儿及胎盘的MSC较成体干细胞具有更强的免疫调节作用,CV-MSC可以分泌更多的细胞因子,进而帮助调节其他细胞的基本功能[11-12]。目前已知,CV-MSC在许多器官的缺血/低氧、辐射损伤中有修复治疗作用,是一种有发展前景的细胞治疗资源。本研究评估了CV-MSC对滋养细胞增殖和自噬的调节作用,结果显示,低氧条件下CV-MSC的条件培养液能够明显促进滋养细胞的生长,提高滋养细胞的自噬水平,且伴随着CLDN11基因表达的下调,这可能是CV-MSC对低氧滋养细胞修复作用的机制。
在跨膜区中表达的Claudin蛋白家族(CLDNs)在紧密连接的基础上起着关键作用,该家族包括大约27个成员,其中大部分可以与含有PDZ的蛋白质紧密结合[13]。这些发现改变了紧密连接单纯作为细胞旁屏障的观点,紧密连接可以是参与控制细胞增殖和分化的信号级联系统复合体,与多分子复合物和细胞信号转导途径有关[14-15]。CLDNs已被证明与细胞增殖、分化和其他细胞功能的调节相关,在大多数组织中均有CLDNs表达,在许多肿瘤类型中都有CLDNs的表达改变[16]。肿瘤细胞通常表现出与正常细胞不同的CLDNs表达谱,并伴随着细胞的分化和细胞极性的降低[17]。CLDN11位于第3号染色体(3q26.2)上,编码Claudin家族中一种细胞旁紧密连接膜蛋白,是一个潜在的抑癌基因。有文献报道,皮肤癌细胞中CLDN11的表达下调,提示癌细胞中紧密连接蛋白的表达与肿瘤侵袭性相关[18]。本文结果表明,CV-MSC可以通过调控滋养细胞内CLDN11的表达促进滋养细胞增殖和自噬,这可能与CLDN11对滋养细胞间连接的调控相关,是CV-MSC细胞疗法的重要作用机制之一。
mTOR是细胞生长以及增殖的重要调节因子,mTOR及其介导的信号通路是维持细胞稳态的关键,参与免疫抑制,影响转录和蛋白合成,调节细胞的生长、凋亡和自噬[19]。自噬是细胞清除损伤、衰老、变性蛋白或细胞器和有毒物质的过程,对细胞生长及稳态维持具有重要作用,尤其在应激及营养缺乏环境中,自噬能帮助细胞生存[20]。自噬的调控十分复杂,mTOR通路作为细胞营养、应激和生长信号的传感器通路,在自噬的调节中起非常重要的作用[21]。研究发现,激活mTOR可以抑制细胞自噬,而抑制mTOR能诱导细胞发生自噬[22]。营养缺乏时,营养缺乏信号可以通过AMPK途径或通过其他间接途径作用于mTOR,并抑制其活性,导致细胞发生自噬;营养充足时,mTOR通路激活并继续活化下游因子,促进细胞蛋白质合成,进而促进细胞增殖和代谢,抑制自噬。本研究结果表明,在低氧环境下CV-MSC能明显促进滋养细胞的生长,同时伴随着滋养细胞自噬的明显激活和mTOR通路的抑制,
92
青 岛 大 学 学 报 (医 学 版)59卷
提示CV-MSC对滋养细胞的生长促进作用可能是通过激活低氧条件下的自噬实现的。
综上所述,胎盘来源的CV-MSC可以通过增强自噬促进滋养细胞的增殖,这种促进作用可能是通过调节滋养细胞内CLDN11的表达及下游mTOR通路实现的。CV-MSC作为一种非常重要的细胞治疗资源,其作用机制的研究对于细胞治疗的应用至关重要。本文结果对于滋养细胞功能障碍导致的胎盘相关疾病的病因探讨也具有重要意义,对MSC相关疗法的进一步研究给胎盘相关疾病治疗带来了新的希望。
[参考文献]
[1]SHAH S, GUPTA A. Hypertensive disorders of pregnancy[J]. Cardiology Clinics, 2019,37(3):345-354.
[2]TURCO M Y, MOFFETT A. Development of the human placenta[J]. Development (Cambridge, England), 2019,146(22):dev163428.
[3]RANA S, LEMOINE E, GRANGER J P, et al. Preeclampsia: pathophysiology, challenges, and perspectives[J]. Circulation Research, 2019,124(7):1094-1112.
[4]POLLHEIMER J, VONDRA S, BALTAYEVA J, et al. Re-
gulation of placental extravillous trophoblasts by the maternal uterine environment[J]. Frontiers in Immunology, 2018,9:2597.
[5]CHU Y J, ZHU C Z, YUE C Y, et al. Chorionic villus-derived mesenchymal stem cell-mediated autophagy promotes the proliferation and invasiveness of trophoblasts under hypoxia by activating the JAK2/STAT3 signalling pathway[J]. Cell amp;
Bioscience, 2021,11(1):182.
[6]PIERIK E, PRINS J R, VAN GOOR H, et al. Dysregulation of complement activation and placental dysfunction: a potential target to treat preeclampsia[J]? Frontiers in Immunology, 2019,10:3098.
[7]SERRA B, MENDOZA M, SCAZZOCCHIO E, et al. A new model for screening for early-onset preeclampsia[J]. American Journal of Obstetrics and Gynecology, 2020,222(6):608.e1-608.e18.
[8]MACDONALD E S, BARRETT J G. The potential of mesenchymal stem cells to treat systemic inflammation in horses[J]. Frontiers in Veterinary Science, 2019,6:507.
[9]RODRGUEZ-FUENTES D E, FERNNDEZ-GARZA L E, SAMIA-MEZA J A, et al. Mesenchymal stem cells current clinical applications: a systematic review[J]. Archives of Me-
dical Research, 2021,52(1):93-101.
[10]FU X R, LIU G, HALIM A, et al. Mesenchymal stem cell migration and tissue repair[J]. Cells, 2019,8(8):784.
[11]HEAZLEWOOD C F, SHERRELL H, RYAN J, et al. High incidence of contaminating maternal cell overgrowth in human placental mesenchymal stem/stromal cell cultures: a syste-
matic review[J]. Stem Cells Translational Medicine, 2014,3(11):1305-1311.
[12]ABUMAREE M H, AL JUMAH M A, KALIONIS B, et al. Phenotypic and functional characterization of mesenchymal stem cells from chorionic villi of human term placenta[J]. Stem Cell Reviews and Reports, 2013,9(1):16-31.
[13]KOLOSOV D, BUI P, CHASIOTIS H, et al. Claudins in te-
leost fishes[J]. Tissue Barriers, 2013,1(3):e25391.
[14]TSUKITA S, TANAKA H, TAMURA A. The claudins: from tight junctions to biological systems[J]. Trends in Biochemical Sciences, 2019,44(2):141-152.
[15]SUZUKI H, TANI K, TAMURA A, et al. Model for the architecture of claudin-based paracellular ion channels through tight junctions[J]. Journal of Molecular Biology, 2015,427(2):291-297.
[16]TAMURA A, TSUKITA S. Paracellular barrier and channel functions of TJ claudins in organizing biological systems: advances in the field of barriology revealed in knockout mice[J]. Seminars in Cell amp; Developmental Biology, 2014,36:177-185.
[17]OSANAI M, TAKASAWA A, MURATA M, et al. Claudins in cancer: bench to bedside[J]. Pflugers Archiv, 2017,469(1):55-67.
[18]NISSINEN L, SILJAMKI E, RIIHIL P, et al. Expression of claudin-11 by tumor cells in cutaneous squamous cell carcinoma is dependent on the activity of p38δ[J]. Experimental Dermatology, 2017,26(9):771-777.
[19]YOON M S. Nanotechnology-based targeting of mTOR signaling in cancer[J]. International Journal of Nanomedicine, 2020,15:5767-5781.
[20]MENIKDIWELA K R, RAMALINGAM L, RASHA F, et al. Autophagy in metabolic syndrome: breaking the wheel by targeting the renin-angiotensin system[J]. Cell Death amp; Disease, 2020,11(2):87.
[21]KIM Y C, GUAN K L. mTOR: a pharmacologic target for autophagy regulation[J]. The Journal of Clinical Investigation, 2015,125(1):25-32.
[22]XU Z R, HAN X, OU D M, et al. Targeting PI3K/AKT/mTOR-mediated autophagy for tumor therapy[J]. Applied Microbiology and Biotechnology, 2020,104(2):575-587.
(本文编辑 马伟平)

