祛风扶正散调控TLR4/NF-κB信号通路治疗周围性面瘫的作用机制



[摘要] 目的 探讨祛风扶正散调控Toll样受体4(TLR4)/核转录因子κB(NF-κB)信号通路治疗周围性面瘫的作用机制。
方法 建立RAW264.7细胞炎症模型,用不同浓度祛风扶正散受试物处理炎症模型细胞,采用Griess reagent法检测细胞一氧化氮(NO)的分泌量,酶联免疫吸附试验(ELISA)法检测细胞上清中肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、前列腺素2(PEG2)的水平,活性氧荧光探针(DCFH-DA)法检测细胞内活性氧(ROS)的水平,实时荧光定量PCR(RT-PCR)检测细胞TNF-α、IL-1β mRNA的表达,蛋白印迹法(Western blot)检测细胞p65、磷酸化p65(p-p65)、IκBα、磷酸化IκBα(p-IκBα)蛋白表达。
结果 祛风扶正散可显著降低炎症模型细胞NO、ROS、TNF-α、IL-1β、IL-6及PEG2表达水平(F=338.731~5 790.712,Plt;0.01),下调TNF-α、IL-1β mRNA表达(F=134.430、168.217,Plt;0.01),抑制p-p65和p-IκBα蛋白表达、IκBα降解及p65核易位(F=17.793~97.613,Plt;0.01)。
结论 祛风扶正散治疗周围性面瘫的作用机制可能与抑制本病相关TLR4/NF-κB信号通路的活化及其下游促炎性细胞因子、炎症递质的释放有关。
[关键词] 面神经麻痹;中药;祛风扶正散;Toll样受体4;NF-κB
[中图分类号] R745.12;R285
[文献标志码] A
[文章编号] 2096-5532(2023)01-0073-06
doi:10.11712/jms.2096-5532.2023.59.030
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.r.20230314.2037.001.html;2023-03-16 11:42:26
MECHANISM OF ACTION OF QUFENG FUZHENG POWDER IN TREATMENT OF PERIPHERAL FACIAL PARALYSIS BY RE-
GULATING THE TOLL-LIKE RECEPTOR 4/NUCLEAR FACTOR-KAPPA B SIGNALING PATHWAY
ZHOU Lihua, ZHOU Changkai, SHANG Xiuling, JING Fanbo
(College of Pharmacy, Qingdao University, Qingdao 266071, China)
; [ABSTRACT] "Objective "To investigate the mechanism of action of Qufeng Fuzheng powder in the treatment of peripheral facial paralysis by regulating the Toll-like receptor 4 (TLR4)/nuclear factor-kappa B (NF-κB) signaling pathway.
Methods
RAW264.7 cells were used to establish an inflammation model, and then the cells were treated with different concentrations of Qufeng Fuzheng powder. The Griess reagent method was used to measure the secretion of nitric oxide (NO); ELISA was used to measure the levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β), interleukin-6 (IL-6), and prostaglandin-2 (PEG2) in cell supernatant; the DCFH-DA fluorescent probe was used to measure the level of reactive oxygen species (ROS) in cells; quantitative real-time PCR was used to measure the mRNA expression levels of TNF-α and IL-1β, and Western blot was used to mea-
sure the protein expression levels of p65, phosphorylated p65 (p-p65), nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor, alpha (IκBα), and phosphorylated IκBα (p-IκBα).
Results "Qufeng Fuzheng powder significantly reduced the le-
vels of NO, ROS, TNF-α, IL-1β, IL-6, and PEG2 in cells (F=338.731-5 790.712,Plt;0.01) and downregulated the mRNA expression levels of TNF-α and IL-1β (F=134.430,168.217;Plt;0.01). Moreover, it also inhibited the protein expression of p-p65 and p-IκBα, the degradation of IκBα, and the nuclear translocation of p65 (F=17.793-97.613,Plt;0.01).
Conclusion "Qufeng Fuzheng powder exerts a therapeutic effect on peripheral facial paralysis possibly by inhibiting activation of the TLR4/NF-κB signaling pathway and the release of its downstream proinflammatory cytokines and inflammatory mediators.
[KEY WORDS] "facial paralysis; traditional Chinese drugs; Qufeng Fuzhegn powder; Toll-like receptor 4; NF-kappa B
周围性面瘫为现代医学病名,是由茎乳孔及以下部位面神经发生急性非化脓性炎症所致[1-3]。据统计,周围性面瘫在我国的发病率为34/10万,远高于欧美国家的5/10万,男女发病率相同[4]。祖国医学认为,本病是因人体正气不足,卫外功能不固,脉络空虚,外邪乘虚而入,伤及头面阳明脉络,使颜面一侧营卫不和、气血痹阻、经脉失养所致[5-6]。祛风扶正散为源自唐代经方,凭借对周围性面瘫的确切
疗效被后人沿用[7-9]。然而,本方治疗该病作用机制仍不明确,在一定程度上制约了经方现代制剂的开发创制。既往研究表明,Toll样受体4(TLR4)/核转录因子κB(NF-κB)信号通路或为本病的有效干预靶点[10-11]。本研究通过建立RAW264.7细胞炎症模型,初步探讨本方对周围性面瘫相关TLR4/NF-κB信号通路的调控机制,以期为经方制剂开发与临床精准治疗提供理论参考。
1 材料与方法
1.1 实验材料
RAW264.7小鼠巨噬细胞购自武汉普诺赛生命科技公司。脂多糖(LPS)购自Sigma公司;CCK8购自MCE公司;DMEM培养液、胎牛血清、青链霉素双抗、乙二胺四乙酸(EDTA)均购自Gibco公司;酶联免疫吸附试验(ELISA)试剂盒购自伊莱瑞特公司;一氧化氮(NO)试剂盒购自南京建成生物工程研究所;RNA提取试剂盒和反转录试剂盒均购自VAZYME公司;活性氧(ROS)检测试剂盒购自碧云天生物技术公司;二抗购自武汉博士德生物工程有限公司;兔多抗p65购自Abcam公司;兔单抗磷酸化p65(p-p65)、兔多抗磷酸化IκBα(p-IκBα)均购自Affinity公司;兔多抗IκBα购自武汉三鹰生物技术有限公司;其他试剂均为国产分析纯。
1.2 实验方法
1.2.1 祛风扶正散受试物的制备 称取制川乌中粉20 g,置于圆底烧瓶中,加入体积分数0.75的乙醇500 mL,回流提取1.5 h,滤过后得提取液。残渣按照第一次的处理方法重复操作,合并两次提取液,50 ℃减压浓缩至0.5 kg/L,加入10 g皂矾混匀后,得受试物样品,终质量浓度为0.75 kg/L(以相当于生药材质量/液体体积计)。
1.2.2 RAW264.7细胞的培养及传代 将细胞从液氮中取出,用含体积分数0.10胎牛血清的完全培养液,在37 ℃、体积分数0.05 CO2恒温培养箱中进行常规培养。当细胞密度达到80%时,按1∶4的比例传代,在37 ℃、体积分数0.05 CO2、饱和湿度条件下扩大培养。
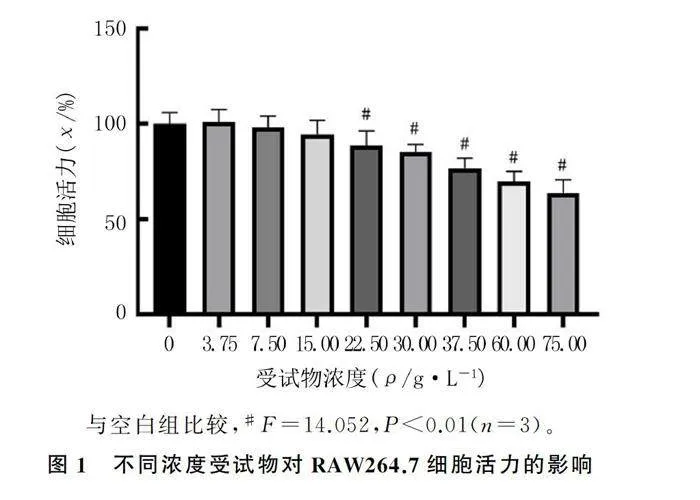
1.2.3 CCK8方法检测不同浓度的受试物对细胞增殖的影响 取处于对数生长期、生长状态良好的RAW264.7细胞,用培养液将细胞密度调整到108/L,接种于96孔板,每孔100 μL细胞悬液,于37 ℃、体积分数0.05 CO2培养箱中培养过夜。加入不同浓度(0、3.75、7.50、15.00、22.50、30.00、37.50、60.00、75.00 g/L)的受试物培养1 h后,更换新鲜DMEM培养液,并加入CCK8溶液每孔10 μL,继续培养2 h后,用酶标仪测定各孔在450 nm波长下的吸光度。
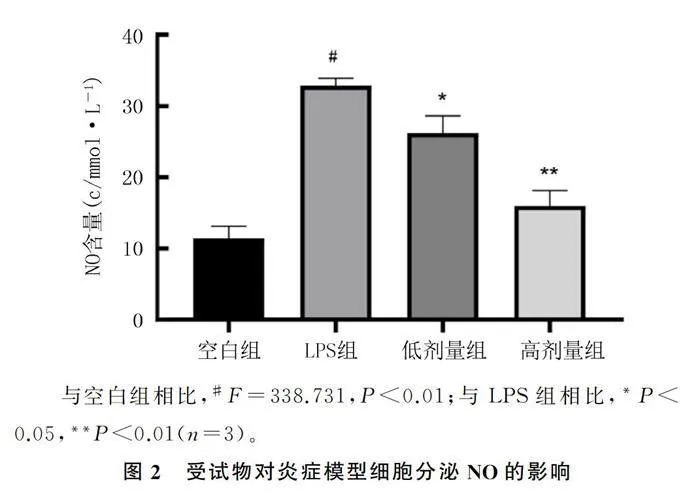
1.2.4 Griess reagent法测定NO的含量 根据CCK8实验结果,设置空白组、LPS(1 mg/L)组、药物低剂量(3.75 g/L)组和药物高剂量(15.00 g/L)组。空白组不做任何处理,LPS组只加入LPS,各药物组加入不同浓度受试物1 h后再加入LPS共同培养细胞24 h。然后,加入50 μL Griess试剂与50 μL培养液在96孔板中混合反应5 min。收集上清液并按照NO试剂盒操作说明测定细胞NO的分泌量。
1.2.5 ELISA法检测细胞上清液中炎症因子的含量 设置空白对照组(A组)、LPS(1 mg/L)组(B组)和药物低、中、高剂量(3.75、7.50、15.00 g/L)组(C、D、E组)。将处于对数生长期的RAW264.7细胞接种于96孔板,置37 ℃、体积分数0.05 CO2培养箱中培养过夜,空白对照组不做任何处理,LPS组只加入LPS,各药物组加入不同浓度受试物1 h后再加入LPS共同培养24 h。离心收集细胞上清液,按照ELISA试剂盒操作说明检测肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、前列腺素2(PEG2)含量。
1.2.6 活性氧荧光探针(DCFH-DA)法检测细胞内ROS含量 实验分组与给药同1.2.5,培养24 h后去除细胞培养液,加入1 mL稀释好的DCFH-DA,置37 ℃细胞培养箱内孵育20 min,充分洗涤后,使用奥林巴斯BX53荧光显微镜(日本奥林巴斯)检测细胞内ROS含量,检测所用激发和发射波长分别为488 nm和525 nm。
1.2.7 实时荧光定量PCR(RT-PCR)检测TNF-α、IL-1β mRNA的表达 实验分组与给药同1.2.5,处理24 h后采用Trizol法提取细胞总RNA。采用Primer5软件进行引物设计,引物序列见表1。按照反转录试剂盒操作说明进行逆转录。PCR反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火60 s,95 ℃退火15 s,40个循环。每个样品设3个复孔,TNF-α、IL-1β mRNA表达水平以相对表达量表示。
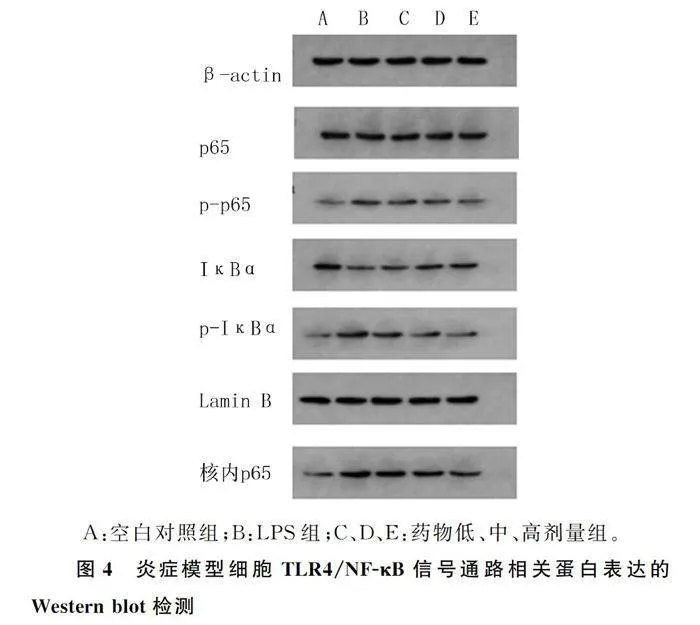
1.2.8 蛋白印迹法(Western blot)检测TLR4/NF-κB信号通路相关蛋白的表达 参照1.2.5中的方法培养和处理各组RAW264.7细胞,吸掉各孔细胞培养液,以PBS液清洗3次,采用RIPA裂解法提取各孔细胞总蛋白,用BCA试剂盒测定蛋白浓度。蛋白样品煮沸变性后,进行SDS-PAGE电泳,转膜,用含50 g/L脱脂奶粉的TBST封闭液封闭2 h后加入一抗,4 ℃孵育过夜,以TBST摇洗5次,每次5 min;加入二抗,室温孵育2 h,以TBST摇洗5次,每次5 min。用ECL显色,凝胶成像系统显像,采用BandScan软件分析胶片灰度值。
1.3 统计学处理
采用SPSS 19.0统计软件进行统计学分析,应用Graphpad prism 6.0软件绘图。所得实验数据以±s表示,组间比较采用One-way ANOVA检验,以Plt;0.05为差异有显著性。
2 结" 果
2.1 不同浓度的受试物对RAW264.7细胞增殖的影响
CCK8法检测结果显示,受试物浓度在3.75~15.00 g/L时,对RAW264.7细胞活力没有明显影响,而其他浓度组与空白组比较差异有统计学意义(F=14.052,Plt;0.01),故选择3.75、7.50、15.00 g/L作为受试物的低、中、高剂量浓度进行后续实验。见图1。
2.2 受试物对炎症模型细胞分泌NO的影响
Griess reagent检测结果显示,与空白组相比较,LPS组RAW264.7细胞NO的分泌量显著增加(F=338.731,Plt;0.01);与LPS组细胞相比较,药物低剂量组RAW264.7细胞NO的分泌量显著降低(Plt;0.05),药物高剂量组细胞NO的分泌量极显著降低(Plt;0.01)。见图2。
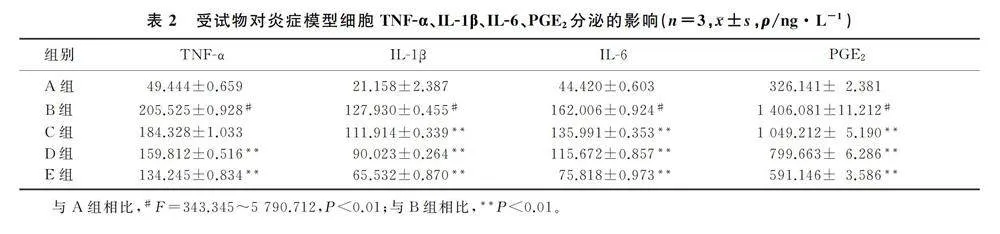
2.3 受试物对炎症模型细胞TNF-α、IL-1β、IL-6、PGE2分泌的影响
ELISA检测结果显示,与空白对照组相比较,LPS组细胞上清液中TNF-α、IL-1β、IL-6、PGE2含量显著升高(F=343.345~5 790.712,Plt;0.01);与LPS组相比,药物低、中、高剂量组细胞TNF-α、IL-1β、IL-6、PGE2的分泌呈剂量依赖性受到抑制(Plt;0.01)。见表2。
2.4 受试物对炎症模型细胞ROS分泌的影响
DCFH-DA检测结果显示,与空白对照组相比,LPS组细胞ROS分泌量显著增加;与LPS组相比,经受试物预处理后,药物低、中、高剂量组ROS的分泌量均显著降低。见图3。
2.5 受试物对炎症模型细胞TNF-α、IL-1β表达的影响
RT-PCR检测结果显示,与空白对照组相比较,LPS组细胞TNF-α、IL-1β mRNA的表达水平显著升高(F=134.430、168.217,Plt;0.01);与LPS组相比较,药物低、中、高剂量组细胞的TNF-α、IL-1β mRNA表达水平显著降低,而且受试物对TNF-α、IL-1β mRNA表达的抑制作用呈剂量依赖性(Plt;0.05)。见表3。
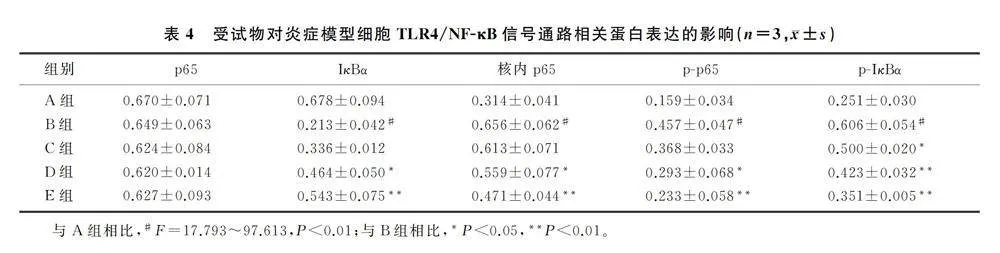
2.6 受试物对炎症模型细胞TLR4/NF-κB信号通路相关蛋白表达的影响
Western blot检测结果表明,与空白对照组相比,LPS组细胞IκBα蛋白表达水平显著降低,核内p65、p-p65和p-IκBα蛋白表达水平显著升高(F=17.793~97.613,Plt;0.01);与LPS组相比,药物低剂量组细胞p-IκBα蛋白表达水平显著降低,药物中、高剂量组细胞IκBα蛋白表达水平显著升高,核内p65、p-p65、p-IκBα蛋白表达水平显著降低(Plt;0.05)。见图4和表4。
3 讨" 论
周围性面瘫是临床常见病、多发病,可发生于任何季节,常以春秋季节多发,临床表现为一侧面部表情肌瘫痪、额纹变浅、眼裂增大、眼睑不能闭合、鼻唇沟变浅等症状[12-13]。目前该病的发病原因尚不明确,西医临床针对周围性面瘫尚无特异性治疗手段,多以皮质类固醇激素抗炎消肿和抗病毒治疗为主。中医认为,周围性面瘫属于“口僻”范畴,多因机体正气不足、脉络亏虚,外感风寒、风热、火毒之邪或内生痰湿乘虚侵袭、痹阻经脉,肌肉经筋失养、纵缓不收所致[5-6]。祛风扶正散之经方治疗周围性面瘫临床疗效确切,方中君药川乌为毛茛科植物乌头的干燥母根,具有祛风除湿、温经止痛的功效,被广泛应用于炎症疾病的治疗[14-15]。川乌有大毒,未经炮制服用可出现中毒,重者会导致死亡[16-17]。现代临床多使用制川乌,本课题组前期采用正交试验优化了制川乌功效成分的提取工艺[18]。本研究应用此提取工艺获得受试物样品。
跨膜Toll样受体(TLRs)作为信号转导蛋白,是一类模式识别受体,TLR4为其家族成员之一,可特异性识别LPS[19-21]。TLR4/NF-κB信号通路是炎症反应中主要的信号通路[22-23]。LPS刺激活化的TLR4经MyD88依赖性信号转导途径,导致NF-κB激活并入核启动炎症因子基因表达。NF-κB是一种核转录激活因子,主要由p65和p50两个亚基组成[24-25]。生理情况下,NF-κB磷酸化位点被IκB抑制蛋白结合封闭,处于无活性状态;在各种炎性损伤中,IκB被磷酸化降解,释放和活化NF-κB,使p50的核定位信号暴露,携带p65迅速转移至核内,p65可以识别特定的DNA序列,诱导多种细胞因子过量表达[26]。NF-κB通过激活、扩大炎症反应以及调控细胞因子的转录和表达,影响周围神经的再生与修复,临床研究发现其在细胞凋亡与增殖、免疫应答、炎症反应调节等过程中均发挥重要作用[27-28],近年来已发展为炎症疾病的重要治疗靶点。
周围性面瘫病人体内TLR4/NF-κB信号通路发生活化,TLR4蛋白与NF-κB p65磷酸化水平升高,下游炎症因子TNF-α和IL-1β的表达水平上升,提示TLR4/NF-κB信号通路可能在周围性面瘫的发生发展中具有重要作用[10-11]。既往研究表明,周围神经损伤后,损伤应激反应会迅速激活雪旺细胞内的NF-κB信号通路,NF-κB被激活后进一步诱导内源性巨噬细胞产生TNF-α、IL-1β、IL-6等炎症因子[29-30]。这些炎症因子的上调进一步激活NF-κB信号通路,引起炎症级联放大反应,诱导单核细胞表达趋化因子,使各种炎性细胞聚集到病变部位,导致神经纤维脱髓鞘、轴索变性、神经细胞损伤,最终促进周围神经病变的发生发展;另一方面,这些炎症因子可以刺激巨噬细胞、内皮细胞高表达一氧化氮合酶(iNOS)、环氧合酶2(COX-2),导致NO和PGE2大量合成与释放,引起周围神经功能障碍[31]。同时,周围神经损伤后,组织内ROS生成增加,高浓度的ROS可以通过影响血管平滑肌和炎症细胞的增殖及迁移、内皮细胞的凋亡、转录因子的活化、炎症细胞因子和黏附分子的过度表达,介导内皮细胞损伤,从而促进周围神经病变的发展[32]。
既往尚无祛风扶正散治疗周围性面瘫作用机制相关报道,这在一定程度上影响了相关制剂的开发创制。本研究通过建立体外细胞模型首次对其作用机制进行探讨,结果提示,LPS可诱导RAW264.7细胞TNF-α、IL-1β、IL-6、NO、PGE2和ROS等炎性因子和炎症递质分泌增加,TNF-α、IL-1β mRNA表达水平升高,不同浓度的祛风扶正散受试物预处理可显著抑制LPS诱导的RAW264.7细胞炎症因子和炎症递质的分泌,降低TNF-α、IL-1β mRNA的表达水平,且以高剂量组的效果最佳。Western blot检测结果表明,祛风扶正散受试物可有效抑制LPS诱导的RAW264.7细胞TLR4/NF-κB信号通路中p65和IκBα的磷酸化,减少IκBα的降解,降低核内p65、p-p65的表达水平。上述结果表明,祛风扶正散可调控周围性面瘫相关的TLR4/NF-κB信号通路,其治疗本病的机制可能与该通路有关。
综上所述,TLR4/NF-κB信号通路是周围性面瘫发生发展中重要的信号通路,祛风扶正散是一种良好的TLR4/NF-κB调节剂,可抑制TLR4/NF-κB信号转导通路的活化,降低LPS诱导的RAW264.7细胞TNF-α、IL-1β mRNA的表达以及TNF-α、IL-1β、IL-6、NO、PGE2、ROS的产生水平,提示其治疗周围性面瘫的机制可能与抑制TLR4/NF-κB信号通路的活化有关。本研究仅在体外细胞水平上对TLR4/NF-κB信号通路的表达变化进行了探讨,初步研究结论为将来在动物水平上开展相关机制研究提供了一定的数据支持,但关于祛风扶正散治疗周围性面瘫的分子作用机制仍需更深入的研究。
[参考文献]
[1]ALPTEKIN D . Acupuncture and Kinesio Taping for the acute management of Bell’s palsy: a case report[J]." Complementary Therapies in Medicine, 2017,35:1-5.
[2]BAUGH R F, BASURA G J, ISHII L E, et al. Clinical practice guideline: Bell’s palsy[J]." Otolaryngology Head and Neck Surgery, 2013,149(3 suppl):S1-S27.
[3]贾建平,陈生弟. 神经病学[M]." 7版. 北京:人民卫生出版社, 2013.
[4]JULIAN H, GRAEME M,任汝静. 面神经麻痹的新进展[J]." 英国医学杂志(中文版), 2005,8(2):104-109.
[5]安宝珍,刘一凡,单秋华. 浅论急性面神经炎的中医治疗[J]." 中医杂志, 2005,46(12):944-945.
[6]王松伟,吴毅. 周围性面瘫的评估及治疗概况[J]." 上海医药, 2014,35(2):14-17.
[7]朱建平. 通关散方源考[J]." 中国医药学报, 2002,17(2):114-" 115.
[8]张付森. 108例面神经麻痹祛风通络扶正散治疗体会[J]." 光明中医, 2009,24(5):857-858.
[9]石启双. 苗药祛风通络扶正散治疗面神经麻痹108例体会[J]." 中国民族医药杂志, 2007,13(2):16-17.
[10]颜建辉,黄丽娟,刘剑萍,等. Toll样受体4/核转录因子kappaB信号通路及其相关炎症因子对周围性面神经炎的影响[J]." 中国临床药理学杂志, 2017,33(14):1317-1320.
[11]姜曌,张晓杰,张文娟,等. 电针对周围性面神经炎患者TLR4/NF-κB信号通路的影响[J]." 川北医学院学报, 2020,35(5):759-762.
[12]SONG W J, YANG D, JIA T G, et al. Clinical study of Taiji needling in treatment of peripheral facial neuritis[J]." World Journal of Acupuncture-Moxibustion, 2017,27(1):17-22.
[13]全权,符少杨,李滋平. 中西医结合治疗周围性面神经炎临床观察[J]." 实用中医药杂志, 2020,36(6):763-764.
[14]叶协滔,钟凌云,杨明,等. 不同炮制方法对川乌抗痛风性关节炎及心脏毒性作用的影响[J]." 中国实验方剂学杂志, 2021,27(18):121-127.
[15]孙丹妮. 制川乌对慢性炎症性疼痛小鼠的镇痛作用及机制研究[D]." 广州:广州中医药大学, 2016.
[16]刘强强,郭海东,徐策,等. 川乌毒理作用研究进展[J]." 中国中医药信息杂志, 2012,19(8):110-112.
[17]姚琪. 乌头类药物的临床应用及毒性分析[J]." 中国医药卫生, 2005,6(9):10.
[18]周长凯,徐文,高静,等. 基于液质联用技术采用正交设计优选制川乌单酯型生物碱醇提工艺[J]." 食品与药品, 2019,21(6):435-440.
[19]EL-KASHEF D H, SERRYA M S. Sitagliptin ameliorates thioacetamide-induced acute liver injury via modulating TLR4/NF-κB signaling pathway in mice[J]." Life Sciences, 2019,228:266-273.
[20]蒋旭琴. Toll样受体2对小鼠过敏性炎症及PI3K/Akt自噬信号通路的调控研究[D]." 合肥:安徽医科大学, 2017.
[21]孙冰,韩代书. Toll样受体信号通路的负调控[J]." 生物化学与生物物理进展, 2009,36(12):1516-1522.
[22]LUO M, YAN D S, SUN Q S, et al. Ginsenoside Rg1 atte-
nuates cardiomyocyte apoptosis and inflammation via the TLR4/NF-kB/NLRP3 pathway[J]." Journal of Cellular Biochemistry, 2020,121(4):2994-3004.
[23]FONSEKA C L, KANAKKAHEWA T E, SINGHAPURA S D A L, et al. Tuberculous pachymeningitis presenting as a diffused dural thickening in a patient with chronic headache and recurrent neurological abnormalities for more than a decade: a case report and a review of the literature[J]." Case Reports in Infectious Diseases, 2018,2018:3012034.
[24]LAWRENCE T. The nuclear factor NF-kappaB pathway in inflammation[J]." Cold Spring Harbor Perspectives in Biology, 2009,1(6):a001651.
[25]HAYDEN M S, GHOSH S. NF-κB in immunobiology[J]." Cell Research, 2011,21(2):223-244.
[26]SHEN J, CHENG J Z, ZHU S G, et al. Regulating effect of baicalin on IKK/IKB/NF-κB signaling pathway and apoptosis-related proteins in rats with ulcerative colitis[J]." International Immunopharmacology, 2019,73:193-200.
[27]TIAN H, LIU Z J, PU Y W, et al. Immunomodulatory effects exerted by Poria cocos polysaccharides via TLR4/TRAF6/NF-κB signaling in vitro and in vivo[J]." Biomedecine amp; Pharmacotherapie, 2019,112:108709.
[28]YURTOULLARB, et al. Comparison of brain atrophy, cognition and optical coherence tomography
Results between multiple sclerosis patients and healthy controls[J]." Noro Psikiyatri Arsivi, 2018,55(1):3-8.
[29]SMITH D, TWEED C, FERNYHOUGH P, et al. Nuclear factor-kappaB activation in axons and Schwann cells in experimental sciatic nerve injury and its role in modulating axon regeneration: studies with etanercept[J]." Journal of Neuropathology and Experimental Neurology, 2009,68(6):691-700.
[30]TEARE K A, PEARSON R G, SHAKESHEFF K M, et al. Alpha-MSH inhibits inflammatory signalling in Schwann cells[J]." Neuroreport, 2004,15(3):493-498.
[31]LEE J S, LEE Y S, JEON B, et al. EC-SOD induces apoptosis through COX-2 and galectin-7 in the epidermis[J]." Journal of Dermatological Science, 2012,65(2):126-133.
[32]栗明,曹彬彬,苑海刚. 乌芪通络胶囊对实验性大鼠坐骨神经VEGF及ROS影响的实验研究[J]." 中医药信息, 2014,31(6):101-104.
(本文编辑 马伟平)

