右美托咪定对神经病理性疼痛小鼠痛阈影响及机制

[摘要] 目的 观察右美托咪定(DEX)对慢性神经病理性疼痛模型小鼠细胞因子信号抑制因子3(SOCS3)和白细胞介素6(IL-6)表达的影响,探讨DEX减轻神经病理性疼痛的作用机制。
方法 将6~8周龄雄性C57小鼠72只随机分为假手术(Sham)组、坐骨神经慢性压迫模型(CCI)组和DEX组,每组24只。分别于术前1 d和术后3、7、10 d测定各组小鼠的机械痛和热痛阈值,采用免疫组化方法观察中枢神经系统小胶质细胞的形态学和数量变化,采用实时荧光定量PCR(qRT-PCR)检测脊髓组织中SOCS3和IL-6 mRNA的表达。
结果 与CCI组比较,DEX组小鼠术后的热缩足反射潜伏期和机械性缩足阈值显著升高(F=19.612~839.607,Plt;0.05)。DEX组小鼠脊髓组织中的小胶质细胞活化程度较CCI组轻。与CCI组比较,术后3、7、10 d时DEX组小鼠L4~6脊髓中IL-6 mRNA的表达显著降低(F=5.265~26.022,Plt;0.05),术后7、10 d时DEX组小鼠L4~6脊髓中SOCS3 mRNA的表达显著升高(F=7.221、114.542,Plt;0.05)。
结论 DEX腹腔注射可提高CCI小鼠的热痛阈和机械痛阈,其作用机制可能与促进SOCS3表达从而负反馈抑制IL-6等炎性因子有关。
[关键词] 神经痛;右美托咪定;痛阈;细胞因子信号转导抑制因子3;白细胞介素6;小鼠
[中图分类号] R614;R971.3
[文献标志码] A
[文章编号] 2096-5532(2023)01-0033-05
doi:10.11712/jms.2096-5532.2023.59.029
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20230308.1056.013.html;2023-03-09 16:40:57
EFFECTS OF DEXMEDETOMIDINE ON PAIN THRESHOLD IN A MOUSE MODEL OF NEUROPATHIC PAIN AND ASSOCIATED MECHANISM
FAN Haisu, ZHAO Yang, WANG Yanting, WANG Pei, LI Linlin, FENG Wei
(Medical College of Qingdao University, Qingdao 266071, China)
; [ABSTRACT] "Objective "To investigate the effects of dexmedetomidine (DEX) on the expression of suppressor of cytokine signaling-3 (SOCS3) and interleukin-6 (IL-6) in a mouse model of chronic neuropathic pain, and to explore the mechanism of action of DEX in relieving neuropathic pain.
Methods "A total of 72 male C57 mice (6 to 8 weeks of age) were randomly divided into sham group, chronic constriction injury of the sciatic nerve (CCI) group, and DEX group, with 24 mice in each group. We mea-
sured the thresholds of mechanical pain and thermal pain, observed the morphological and quantitative changes of microglia in the central nervous system by immunohistochemistry, and determined the expression of SOCS3 and IL-6 mRNA by quantitative real-time PCR, for each group at 1 d before operation and 3, 7, and 10 d after operation.
Results "Compared with the CCI group, the DEX group showed significantly longer paw withdrawal latencies to thermal stimuli and significantly higher paw withdrawal thre-
sholds to mechanical stimuli (F=19.612-839.607,Plt;0.05). The level of microglial activation in the spinal cord of mice was lo-
wer in the DEX group than in the CCI group. Compared with the CCI group, the DEX group had significantly lower expression levels of IL-6 mRNA in the L4-6 spinal cord at 3, 7, and 10 d after operation (F=5.265-26.022,Plt;0.05) and significantly higher expression levels of SOCS3 mRNA in the L4-6 spinal cord at 7 and 10 d after operation (F=7.221,114.542;Plt;0.05).
Conclusion
Intraperitoneal injection of DEX can increase thermal and mechanical pain thresholds in the mouse CCI model, possibly through promoting SOCS3 expression and thereby inhibiting inflammatory factors such as IL-6 in a negative feedback mechanism.
[KEY WORDS] "neuralgia; dexmedetomidine; pain threshold; suppressor of cytokine signaling 3 protein; interleukin-6; mice
多种疾病或手术,例如脊髓损伤、神经受压、糖尿病、带状疱疹等均可导致周围神经损伤[1]。这些损伤因素通常会导致异常的慢性疼痛和痛觉过敏,即神经病理性疼痛[2]。神经性疼痛往往会影响病人的生活质量,甚至会使病人产生抑郁等心理问题,给个人带来沉重的心理及经济负担[3]。尽管近几年在病因学和疼痛管理等方面取得了长足的进步,但在临床实践中并没有针对神经病理性疼痛的完善治疗方案[3-4]。右美托咪定(DEX)是一种高效、高选择性、具有良好镇痛效果的抗癫痫、抗抑郁药物。近年有研究表明,DEX对胶质细胞的激活有间接或次级抑制作用,对慢性病理性疼痛有显著治疗作用[5-6]。
细胞因子信号抑制因子(SOCS)蛋白家族由8个成员组成(SOCS1~SOCS7和CIS)。这些蛋白控制细胞因子信号通路,可减轻严重的全身炎症反应[7]。最新研究结果表明,利多卡因可以通过上调SOCS3减轻小胶质细胞炎症和抑制神经性疼痛[8]。然而,SOCS3是否参与DEX对神经性疼痛的抑制目前尚不清楚。本研究旨在探讨DEX是否可以通过调节SOCS3的表达和活性来抑制脊髓小胶质细胞的激活,从而治疗神经病理性疼痛,并探讨SOCS3抑制神经炎症的潜在机制。
1 材料与方法
1.1 动物与分组
雄性C57小鼠,6~8周龄,体质量18~25 g,由中国济南朋悦公司提供。实验期间小鼠每笼5只分笼饲养,给予12 h昼夜循环光照,可自由饮食和饮水。将72只小鼠随机分为假手术(Sham)组、坐骨神经慢性压迫模型(CCI)组和DEX组,每组24只。本实验经青岛大学附属医院动物福利伦理委员会批准(编号ANQU-MAL20201218)。
1.2 模型制备与药物处理
小鼠于实验室适应性饲养1周后手术。CCI组和DEX组小鼠按照BENNETT等[9]的方法制备慢性神经病理性疼痛模型:以10 g/L的戊巴比妥钠(50 mg/kg)腹腔注射麻醉小鼠,通过一个小切口显露大腿中部的左侧坐骨神经,用4根4-0丝线松绑于坐骨神经上,间距为1 mm,以小鼠左腿出现抖动为宜。用4-0可吸收缝合线缝合伤口,术中用红霉素眼膏涂抹小鼠双眼。Sham组除了结扎坐骨神经外,其他步骤与CCI组均相同。手术后,DEX组小鼠每天腹腔注射DEX 50 μg/kg,CCI组和Sham组小鼠每天腹腔注射等量生理盐水,连续注射5 d。
1.3 小鼠左爪机械痛和热痛阈值测定
分别于术前1 d和术后3、7、10 d测定小鼠左爪的机械性缩足阈值(PWMT)和热缩足反射潜伏期(TWL)。PWMT测定:将小鼠固定于透明鼠筒中,让其适应3 min待其安静后,使用YSL-3E电子压痛仪(安徽正华生物仪器设备有限公司)进行测定,将小鼠左后爪固定,缓慢下压头部直至小鼠挣扎或嘶鸣,停止下压,读数。重复测试3次,测试间隔5 min以上。TWL测定:使用ZH YLS-6BS智能热板仪(安徽正华生物仪器设备有限公司),加热至52.5 ℃,将小鼠放在热板仪上,记录从放入到舔舐左后爪或抖动左后爪的时间,尽量减少其他刺激。重复测试3次,测试间隔30 min以上。
1.4 小胶质细胞Iba-1免疫组化染色
分别于术前1 d和术后3、7、10 d,每组取3只小鼠,以10 g/L戊巴比妥钠(50 mg/kg)腹腔注射麻醉,心脏灌注生理盐水50 mL后,取L4~6脊髓标本,用40 g/L多聚甲醛固定,石蜡包埋,3 μm厚切片。将切片脱蜡、水合,用生理盐水柠檬酸钠进行抗原修复。用体积分数0.03的过氧化氢溶液处理10 min灭活内源性过氧化物酶。分别以蒸馏水洗2次和PBS洗3次,加一抗anti-Iba-1抗体(Abcam,1∶250)37 ℃孵育30 min;以PBS洗4次,加山羊抗小鼠二抗(Abcam,1∶250)孵育;用PBS洗4次,DAB显色1 min。之后用苏木精进行尼氏染色。最后,切片脱水后用中性树脂密封,在显微镜(奥林巴斯)下观察。
1.5 实时荧光定量PCR(qRT-PCR)检测SOCS3和IL-6 mRNA表达
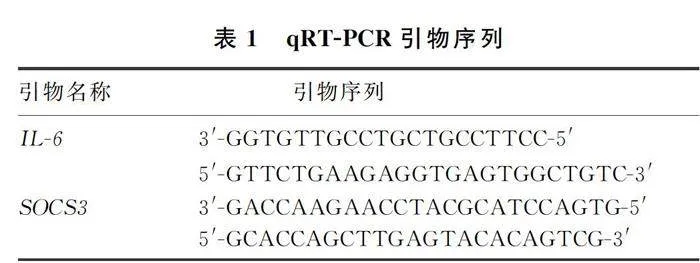
分别于术前1 d和术后3、7、10 d,每组取3只小鼠,心脏灌注生理盐水50 mL后,于冰上取L4~6脊髓标本。将标本放于800 μL Trizol中4 ℃裂解匀浆,4 ℃离心5 min,取上清液置于另一EP管中,加入200 μL氯仿,4 ℃静置后离心,取上清液并加入200 μL异丙醇,4 ℃静置后离心,用20 μL DEPC水溶解RNA沉淀并测定其浓度与纯度,储存于-80 ℃备用。使用逆转录试剂盒(湖南艾科瑞生物工程有限公司)将提取的RNA逆转录为cDNA。使用SYBR Green MASTER试剂(生工生物工程(上海)股份有限公司),在Roche LightCycler 480 Real-Time PCR系统中进行qRT-PCR反应。反应条件为:95 ℃变性5 min;95 ℃变性10 s,循环40次;60 ℃变性1 min。PCR所用的引物序列见表1。以GAPDH为内参,采用2-△△CT法进行相对定量计算并归一化[10]。
1.6 统计学方法
采用Graphpad Prism 8.0软件进行统计学分析。所得计量数据以±s表示,各组小鼠不同时间机械痛和热痛阈值的比较采用重复测量设计的方差分析,各组小鼠不同时间SOCS3和IL-6表达的比较采用析因设计的方差分析。以Plt;0.05为差异有统计学意义。
2 结" 果
本文3组小鼠体质量和周龄差异无统计学意义。术后1~10 d,所有小鼠伤口均无感染。
2.1 各组小鼠手术前后的行为学变化
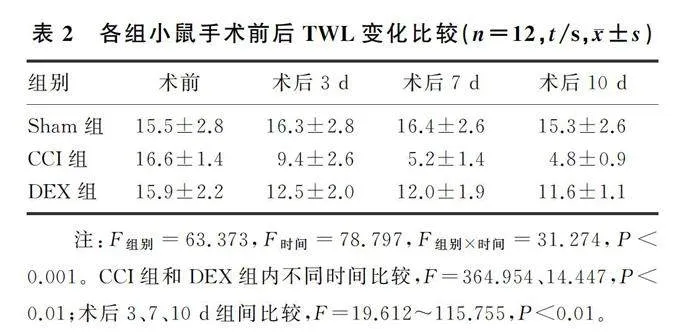
手术前,各组小鼠TWL、PWMT相比较差异均无统计学意义(P>0.05)。Sham组小鼠手术前后TWL、PWMT比较差异无统计学意义(P>0.05);CCI组和DEX组的TWL、PWMT从术后3 d开始下降,于术后7 d明显下降,维持至术后10 d(F=14.447~1 042.717,Plt;0.01)。DEX组术后TWL、PWMT的下降程度明显低于CCI组(F=19.612~839.607,Plt;0.01)。见表2、3。
2.2 各组小鼠脊髓组织小胶质细胞活化形态和数量变化
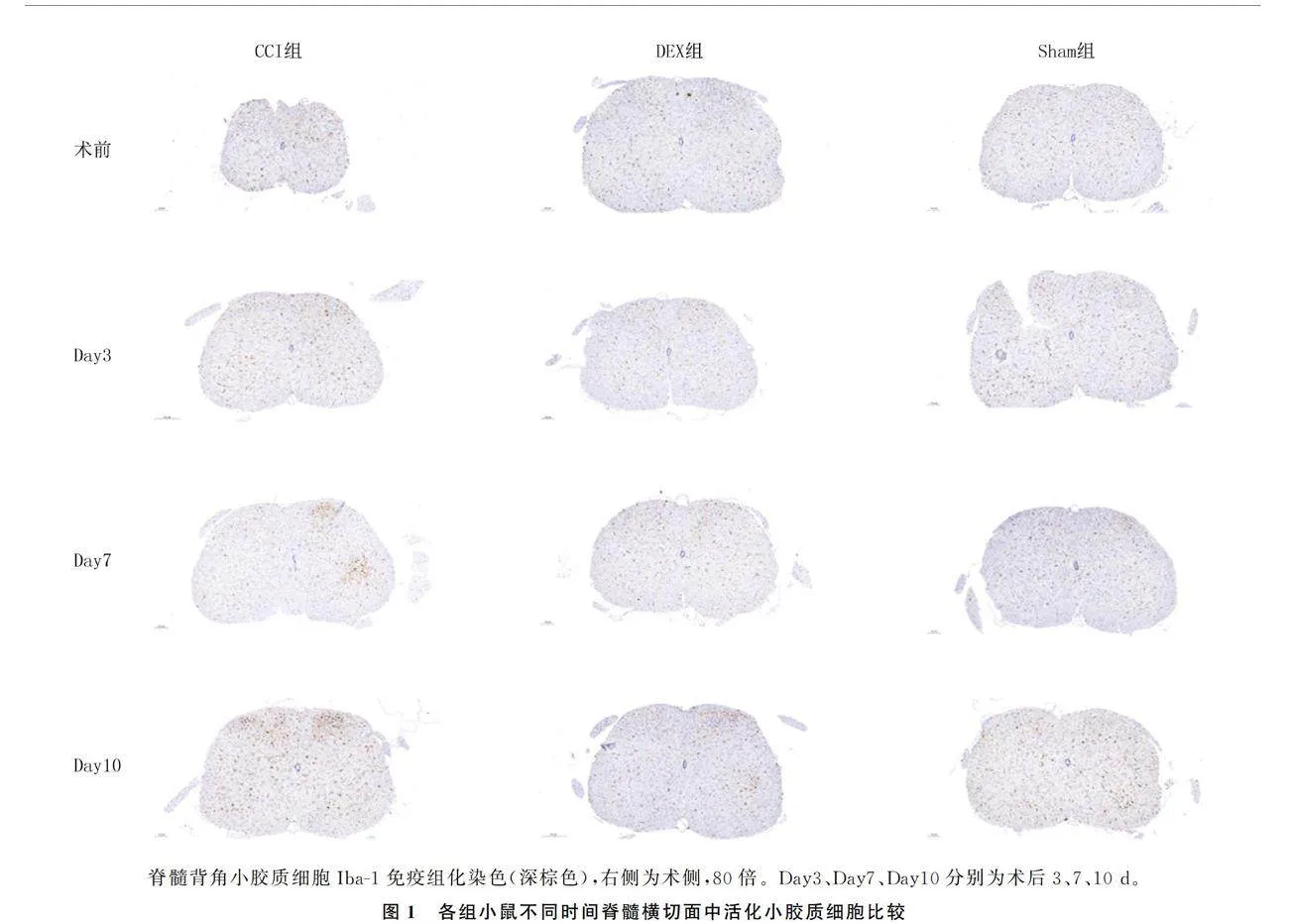
Sham组小鼠术后3、7、10 d的活化小胶质细胞与术前相比无明显变化。CCI组小鼠从术后3 d开始脊髓背角活化小胶质细胞数量随着时间的变化明显增多,活化细胞形态上表现为突触减少、胞体增大。DEX组小胶质细胞活化程度较CCI组减轻。见图1。
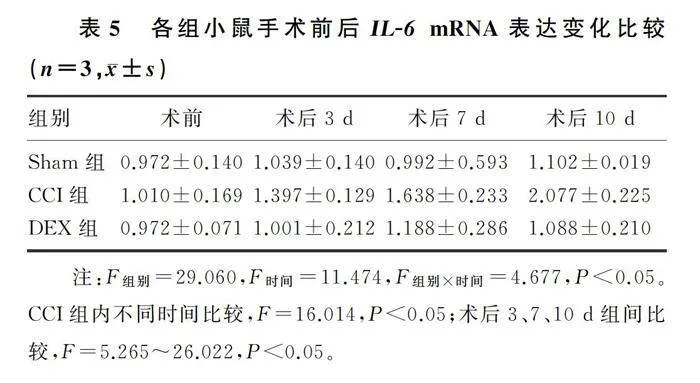
2.3 各组小鼠手术前后SOCS3、IL-6 mRNA表达的变化
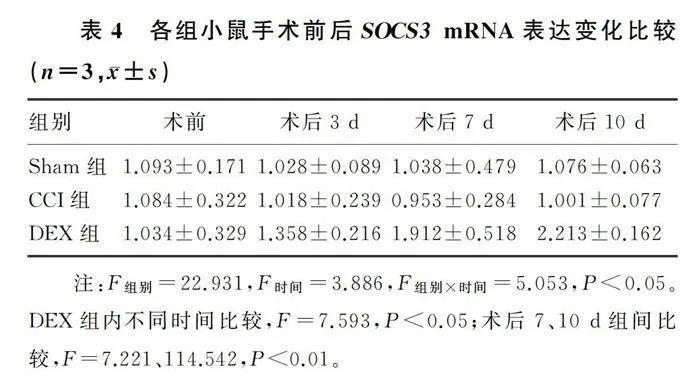
与CCI组比较,术后3、7、10 d时DEX组小鼠L4~6脊髓中IL-6 mRNA表达水平显著降低(F=5.265~26.022,Plt;0.05),术后7、10 d时DEX组小鼠L4~6脊髓中SOCS3 mRNA表达水平显著升高(F=7.221、114.542,Plt;0.05)。见表4、5。
3 讨" 论
哺乳动物的外周感觉神经纤维从背根神经节的细胞体延伸出来,在接受伤害性感受信息后,通过初级传入纤维中的动作电位传导到脊髓背角的二级神经元,然后到达痛觉皮质[3]。神经病理性疼痛是一种由于躯体感觉神经被破坏和(或)某些病理因素导致的慢性疼痛[11],对病人的生活质量、心理健康程度等造成了很大的负面影响,目前尚没有有效治疗药物。DEX是一种强效且高度选择性的α2-肾上腺素能受体激动剂,已广泛用作镇痛和抗伤害性刺激的辅助剂[12]。研究表明,DEX除了是广泛应用的围术期镇痛辅助药外,还是一种有效的镇静剂,对呼吸抑制作用小[13]。临床和实验研究表明,DEX可显著降低炎症细胞因子水平,具有隐性的抗炎和抗氧化作用[14]。动物实验研究显示,DEX外周或鞘内应用可提高机械痛和热痛的阈值[15-16]。
CCI是现今应用较为普遍且效果显著的神经病理性疼痛模型之一,该模型通过松扎坐骨神经模拟神经病理性疼痛病人的症状。
有研究表明,慢性神经病理性疼痛的发生机制是小胶质细胞的增殖和活化,并释放炎性因子导致疼痛的产生[17]。本研究采用标准的动物模型,通过腹腔连续注射DEX,探讨DEX对SOCS3和IL-6表达的影响,以及对小胶质细胞形态和活化数量的影响。
本研究结果显示,CCI组小鼠PWMT和TWL从术后3 d就开始下降,并且持续至术后10 d。而DEX组痛阈显著高于CCI组,表明DEX可明显改善CCI手术造成的术后痛阈降低。为了评估DEX对小胶质细胞形态和活化数量的影响,本研究采用Iba-1免疫组化染色来确定行为实验终止时脊髓中小胶质细胞的表现。结果显示,术后7、10 d时DEX组小鼠L4~6脊髓中小胶质细胞活化程度明显低于CCI组,小胶质细胞的活化数量和形态都有明显不同。推测慢性神经病理性疼痛中小胶质细胞的活化可能可以被DEX所抑制。
先前的研究结果表明,白细胞介素10(IL-10)可诱导小胶质细胞中SOCS3的表达[18]。SOCS3被确定为通过靶向JAKs降解来抑制IL-6家族细胞因子的信号传导蛋白[19-20]。SOCS3失调发生在许多自身免疫性疾病中,例如类风湿性关节炎、系统性红斑狼疮、1型糖尿病以及多发性硬化症等[21-22]。SOCS3基因下调可促进巨噬细胞的增殖和炎症反应[22]。最近的研究结果也表明,SOCS3的上调可减轻术后疼痛[23-24]。DOMINGUEZ等[25]的实验研究结果表明,脊髓中SOCS3过量产生的生化和行为效应直接反映了脊髓中JAK/STAT3的局部靶向阻断。有文献报道,SOCS3在脊髓损伤后发挥着神经元保护和轴突再生的作用[26]。并且,SOCS3还可以抑制IL-6介导的小胶质细胞向M1型转变[27]。DEX可通过多种通路抑制炎性因子释放,SOCS3是否是DEX抑制小胶质细胞的潜在靶点尚不明确。本研究结果显示,DEX组小鼠脊髓中SOCS3含量升高,在术后7、10 d时SOCS3表达增强,差异有统计学意义,且DEX组小鼠脊髓中IL-6的表达相对较少。推测DEX可能通过提高SOCS3的表达,抑制脊髓中小胶质细胞的炎性递质释放,从而对机体产生镇痛作用。
综上所述,DEX腹腔注射可提高CCI小鼠的热痛阈和机械痛阈,其作用机制可能与其促进SOCS3表达从而负反馈抑制IL-6等炎性因子有关。
[参考文献]
[1]FINNERUP N B, KUNER R, JENSEN T S. Neuropathic pain: from mechanisms to treatment[J]. Physiological Reviews, 2021,101(1):259-301.
[2]KWON M, HAN J, KIM U J, et al. Inhibition of mammalian target of rapamycin (mTOR) signaling in the insular cortex alleviates neuropathic pain after peripheral nerve injury[J]. Frontiers in Molecular Neuroscience, 2017,10:79.
[3]COHEN S P, MAO J R. Neuropathic pain: mechanisms and their clinical implications[J]. BMJ (Clinical Research Ed), 2014,348:f7656.
[4]FINNERUP N B, ATTAL N, HAROUTOUNIAN S, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis[J]. The Lancet Neurology, 2015,14(2):162-173.
[5]ZHAO Y, HE J S, YU N, et al. Mechanisms of dexmedetomidine in neuropathic pain[J]. Frontiers in Neuroscience, 2020,14:330.
[6]LI X N, ZHANG W. Influence of intrathecal injection with dexmedetomidine on the behavioral ability and analgesic effects on rats with neuropathic pain and expression of protein kinase C in the spinal dorsal horn[J]. Experimental and The-
rapeutic Medicine, 2018,16(5):3835-3840.
[7]YIN Y L, LIU W W, DAI Y L. SOCS3 and its role in asso-
ciated diseases[J]. Human Immunology, 2015,76(10):775-780.
[8]ZHENG Y, HOU X H, YANG S B. Lidocaine potentiates SOCS3 to attenuate inflammation in microglia and suppress neuropathic pain[J]. Cellular and Molecular Neurobiology, 2019,39(8):1081-1092.
[9]BENNETT G J, XIE Y K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]. Pain, 1988,33(1):87-107.
[10]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001,25(4):402-408.
[11]ST JOHN SMITH E. Advances in understanding nociception and neuropathic pain[J]. Journal of Neurology, 2018,265(2):231-238.
[12]GERRESHEIM G, SCHWEMMER U. Dexmedetomidine[J]. Der Anaesthesist, 2013,62(8):661-674.
[13]WANG Y L, XU X F, LIU H, et al. Effects of dexmedetomidine on patients undergoing radical gastrectomy[J]. The Journal of Surgical Research, 2015,194(1):147-153.
[14]JANG Y, YEOM M Y, KANG E S, et al. The antinociceptive effect of dexmedetomidine modulates spleen cell immunity in mice[J]. International Journal of Medical Sciences, 2014,11(3):226-233.
[15]WU J R, CHEN H, YAO Y Y, et al. Local injection to sciatic nerve of dexmedetomidine reduces pain behaviors, SGCs activation, NGF expression and sympathetic sprouting in CCI rats[J]. Brain Research Bulletin, 2017,132:118-128.
[16]XUN S N, ZHENG R Z. Retracted: Dexmedetomidine alle-
viates neuropathic pain by regulating JAK/STAT pathway in rats[J]. Journal of Cellular Biochemistry, 2020,121(3):2277-2283.
[17]GU N, PENG J Y, MURUGAN M, et al. Spinal microgliosis due to resident microglial proliferation is required for pain hypersensitivity after peripheral nerve injury[J]. Cell Reports, 2016,16(3):605-614.
[18]QIN H W, WILSON C A, ROBERTS K L, et al. IL-10 inhi-
bits lipopolysaccharide-induced CD40 gene expression through induction of suppressor of cytokine signaling-3[J]. Journal of Immunology (Baltimore, Md: 1950), 2006,177(11):7761-7771.
[19]BAKER B J, AKHTAR L N, BENVENISTE E N. SOCS1 and SOCS3 in the control of CNS immunity[J]. Trends in Immunology, 2009,30(8):392-400.
[20]LANG R, PAULEAU A L, PARGANAS E, et al. SOCS3 regulates the plasticity of gp130 signaling[J]. Nature Immunology, 2003,4(6):546-550.
[21]LIANG Y, XU W D, PENG H, et al. SOCS signaling in autoimmune diseases: molecular mechanisms and therapeutic implications[J]. European Journal of Immunology, 2014,44(5):1265-1275.
[22]OHNO-URABE S, AOKI H, NISHIHARA M, et al. Role of macrophage Socs3 in the pathogenesis of aortic dissection[J]. Journal of the American Heart Association, 2018,7(2):e007389.
[23]WEI J R, LI M, WANG D Y, et al. Overexpression of suppressor of cytokine signaling 3 in dorsal root ganglion atte-
nuates cancer-induced pain in rats[J]. Molecular Pain, 2017,13:1744806916688901.
[24]FAN Y X, QIAN C, LIU B Q, et al. Induction of suppressor of cytokine signaling 3 via HSF-1-HSP70-TLR4 axis attenuates neuroinflammation and ameliorates postoperative pain[J]. Brain, Behavior, and Immunity, 2018,68:111-122.
[25]DOMINGUEZ E, RIVAT C, POMMIER B, et al. JAK/STAT3 pathway is activated in spinal cord microglia after peripheral nerve injury and contributes to neuropathic pain development in rat[J]. Journal of Neurochemistry, 2008,107(1):50-60.
[26]LIU X F, WILLIAMS P R, HE Z G. SOCS3: a common target for neuronal protection and axon regeneration after spinal cord injury[J]. Experimental Neurology, 2015,263:364-367.
[27]IWAHARA N, HISAHARA S, KAWAMATA J, et al. Role of suppressor of cytokine signaling 3 (SOCS3) in altering activated microglia phenotype in APPswe/PS1dE9 mice[J]. Journal of Alzheimer’s Disease: JAD, 2017,55(3):1235-1247.
(本文编辑 马伟平)

