核糖体蛋白S24对人颈动脉粥样硬化的影响及机制


[摘要] 目的 研究核糖体蛋白S24(RPS24)对人颈动脉斑块血管新生的作用以及对磷酸甘油酸激酶1(PGK1)的调控。
方法 采用免疫印迹(Western blot)方法检测人体颈动脉稳定斑块组织(稳定组)和易损斑块组织(易损组)中的RPS24和PGK1蛋白表达水平。体外培养人脐静脉内皮细胞(HUVEC),将细胞分为对照组和RPS24小干扰RNA(siRNA)组(siRNA组),进行成小管实验,分别检测两组细胞形成小管的数量和总长度,采用Western blot法检测两组细胞培养上清液中RPS24和PGK1的蛋白表达量。
结果 易损组人颈动脉斑块组织中RPS24蛋白表达水平明显高于稳定组,而PGK1蛋白表达水平则明显低于稳定组,差异具有统计学意义(t=47.50、39.06,Plt;0.05)。siRNA组细胞形成小管的数量和总长度明显低于对照组(t=9.80、25.74,Plt;0.05)。siRNA组细胞培养上清液中RPS24蛋白表达量显著低于对照组,而PGK1蛋白表达量则显著高于对照组(t=36.15、28.18,Plt;0.05)。
结论 RPS24通过抑制PGK1的表达来促进颈动脉斑块的新血管生成,抑制RPS24的表达可能是治疗颈动脉易损斑块的新选择。
[关键词] 核糖体蛋白质类;斑块,动脉粥样硬化;新生血管化,病理性;磷酸甘油酸酯激酶
[中图分类号] R543.5;R364.3
[文献标志码] A
[文章编号] 2096-5532(2023)01-0006-05
doi:10.11712/jms.2096-5532.2023.59.041
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20230308.1034.003.html;2023-03-09 17:04:44
EFFECT OF RIBOSOMAL PROTEIN S24 ON HUMAN CAROTID ATHEROSCLEROSIS AND ITS MECHANISM
LI Zhuo, CHEN Baiqiang, KONG Xiangyi, QIN Zhen, LI Shifang
(Departments of Neurosurgery, The Affiliated Hospital of Qingdao University, Qingdao 266100, China)
; [ABSTRACT] "Objective "To investigate the role of ribosomal protein S24 (RPS24) in angiogenesis of human carotid plaques and its regulatory effect on phosphoglycerate kinase 1 (PGK1).
Methods "Western blot was used to measure the protein expression of RPS24 and PGK1 in stable human carotid plaque and vulnerable plaque. Human umbilical vein endothelial cells (HUVECs) were cultured in vitro and were then divided into control group and RPS24 small interfering RNA (siRNA) group; tubule formation assay was used to measure the number and total length of tubules formed in both groups, and Western blot was used to mea-
sure the protein expression levels of RPS24 and PGK1 in the culture supernatant of both groups.
Results ""Compared with the stable human carotid plaque group, the vulnerable plaque group had a significantly higher protein expression level of RPS24 and a significantly lower protein expression level of PGK1 (t=47.50,39.06;Plt;0.05). The siRNA group had significantly lower number and total length of tubules formed than the control group (t=9.80, 25.74;Plt;0.05). Compared with the control group, the siRNA group had a significantly lower protein expression level of RPS24 and a significantly higher protein expression level of PGK1 in supernatant (t=36.15,28.18;Plt;0.05).
Conclusion "RPS24 promotes neovascularization of carotid plaques by inhibiting PGK1 expression, and inhibition of RPS24 expression may be a new option for the treatment of carotid vulnerable plaques.
[KEY WORDS] "ribosomal proteins; plaque, atherosclerotic; neovascularization, pathologic; phosphoglycerate kinase
在中国,脑卒中是一个严重的公共健康问题,18%~25%的缺血性卒中可归因于颈动脉粥样硬化疾病引起的血栓栓塞,而颈动脉粥样硬化病人的脑卒中预防是基于颈动脉血管的狭窄程度[1-2]。但现在越来越多的证据表明,某些类型的颈动脉斑块,即所谓的易损斑块,与狭窄程度无关,也极有可能引起缺血性卒中和血栓并发症,与稳定斑块相比更加危险[3]。颈动脉斑块的易损性进展程度受多种因素的影响,如炎症、细胞外基质降解、血脂异常、血压异常、新生血管等[4-5]。近年来,斑块内新生血管受到越来越多的重视,病理性新生血管与动脉粥样硬化全程有关,其存在与斑块破裂的风险直接相关[6-8]。所以通过对斑块新生血管的干预来控制颈动脉斑块易损性进展对脑卒中具有重要意义。
核糖体蛋白S24(RPS24)属于S24E家族核糖体蛋白,参与了多种疾病发生、细胞增殖和凋亡、血管生成等过程[9-10]。磷酸甘油酸激酶1(PGK1)是一种糖酵解酶,除参与糖酵解反应外,还参与多种肿瘤的发生。据报道,肝癌微血管浸润相关长链非编码RNA(lncRNA)MVIH与PGK1相关,可通过抑制PGK1的分泌来激活血管生成[11-12]。而RPS24 mRNA可以与MVIH结合成为复合物,但它对颈动脉斑块易损性的作用以及具体机制目前知之甚少[13]。根据上述研究,我们推测RPS24可能通过抑制PGK1的分泌来促进血管生成。为了验证这一猜测,本研究利用国际公认的人脐静脉内皮细胞(HUVEC)的成小管实验来观察人颈动脉斑块组织内的血管生成情况[14],探讨RPS24对颈动脉斑块新生血管的作用及机制。
1 材料与方法
1.1 实验材料
RPS24抗体以及PGK1抗体购自美国Affinity Biosciences公司;实验用抗β-actin兔单克隆抗体购自美国Cell Signaling Technology公司;苯甲基磺酰氟(PMSF,0.1 mol/L)、蛋白磷酸酶抑制剂混合物(100×)、高效RIPA裂解缓冲液、BCA试剂盒、二甲基亚砜(DMSO)、优级胎牛血清购自北京索莱宝科技有限公司;HUVEC购自上海赛百慷生物技术股份有限公司;RPS24小干扰RNA(siRNA)购自上海吉玛基因公司;细胞培养试剂以及DMEM-H-Glucose、Trypsin-EDTA、glutaMax(100×)、青霉素-链霉素(100×)均购自美国Gibico公司。
1.2 实验方法
1.2.1 标本来源及分组 人颈动脉斑块组织标本来自于2020—2021年在青岛大学附属医院神经外科行颈总动脉分叉处内膜剥脱手术的12例颈动脉狭窄病人。本研究所进行的人体组织实验获得青岛大学附属医院伦理委员会批准,并征得病人书面知情同意。每例标本离体后平均分为两部分,分别用40 g/L中性甲醛和液氮保存,以备组织学观察和免疫印迹(Western blot)法检测。根据美国心脏协会制定的颈动脉易损标准[15],将两种不同方法处理的斑块组织标本分为稳定组和易损组,每组6例。
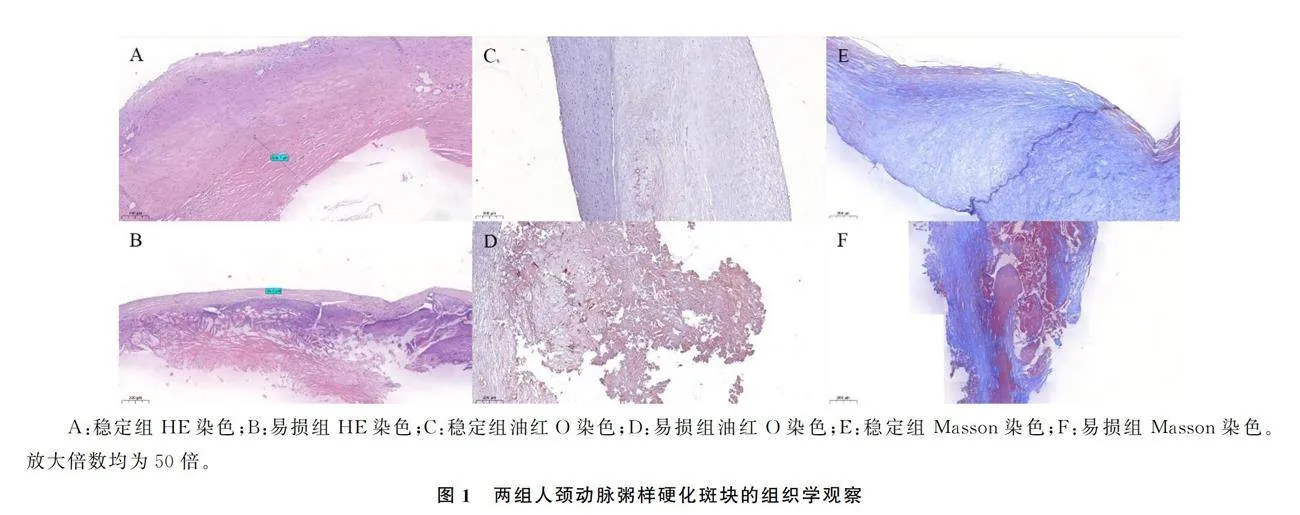
1.2.2 斑块组织学观察 两组用40 g/L中性甲醛固定的标本先进行常规石蜡包埋(脱钙、脱水)、切片(5 μm,横截面),接着进行苏木精-伊红(HE)染色,观察人颈动脉斑块组织的纤维帽厚度、脂质坏死核心、出血和钙化等;随后采用油红O染色的方法测定斑块内的脂质成分;最后进行Masson染色,检测斑块组织的纤维成分[16]。
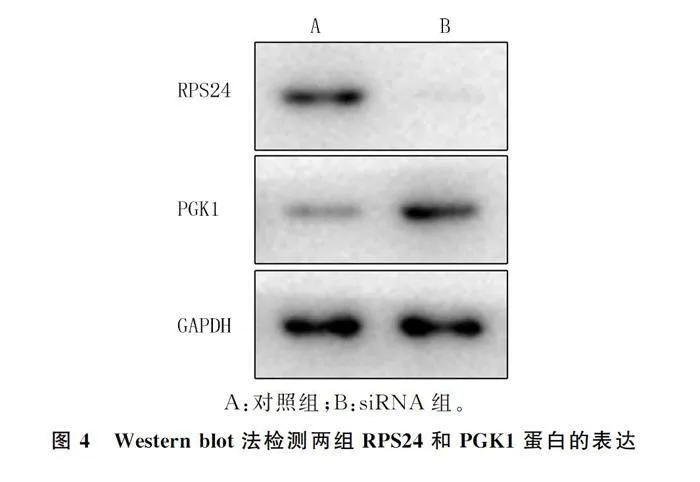
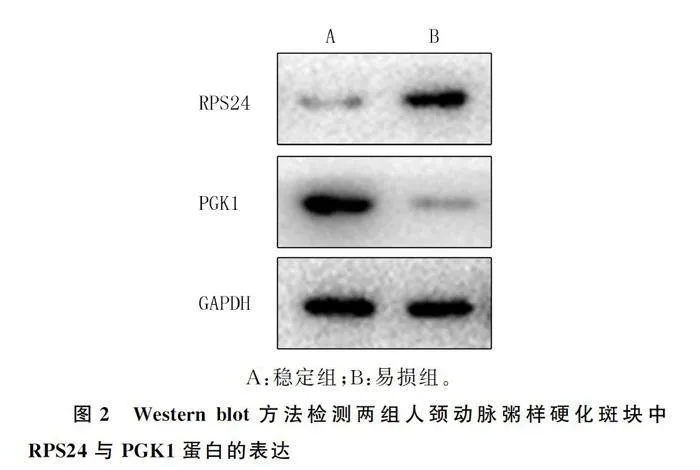
1.2.3 Western blot法检测RPS24和PGK1蛋白表达 两组保存于液氮中的斑块组织,分别在冰上添加RIPA细胞裂解缓冲液来裂解细胞,离心后提取组织总蛋白,接着用BCA试剂盒测定蛋白浓度。配制120 g/L SDS-PAGE凝胶,按每孔10 μg上样量对蛋白质进行电泳分离,将蛋白转移到PVDF膜上,用含有50 g/L脱脂牛奶的TBST溶液在室温下封闭1 h,分别加入RPS24、PGK1和GAPDH一抗,放摇床上1 h后置-4 ℃冰箱中过夜,第2天室温复温后先用TBST溶液清洗PVDF膜3次,每次10 min,然后加入酶标二抗室温孵育2 h,再次用TBST溶液清洗3次,随后采用ECL化学发光试剂盒进行显影,获取蛋白条带图。最后采用Image J软件对图像进行灰度值分析,目的蛋白的表达水平以目的蛋白与GAPDH内参蛋白条带灰度值的比值来表示。
1.2.4 细胞培养 将HUVEC置于含有体积分数0.10胎牛血清和青霉素-链霉素双抗的DMEM培养液中,在37 ℃、含体积分数0.05 CO2的细胞培养箱中培养。细胞每2 d传代1次,采用对数生长期细胞进行实验。将1 mL胰蛋白酶-EDTA消化液(2.5 g/L)加入到接近致密的单层细胞中,在室温下消化2~3 min,得到后续实验用的细胞消化液。所有实验均采用第3~6代紧密融合的单层HUVEC。
1.2.5 siRNA慢病毒转染 使用siRNA转染来敲低RPS24的表达,按照试剂盒的说明书进行操作,HUVEC被慢病毒转染12 h时换液,转染48 h时,取被转染的细胞进一步分析。
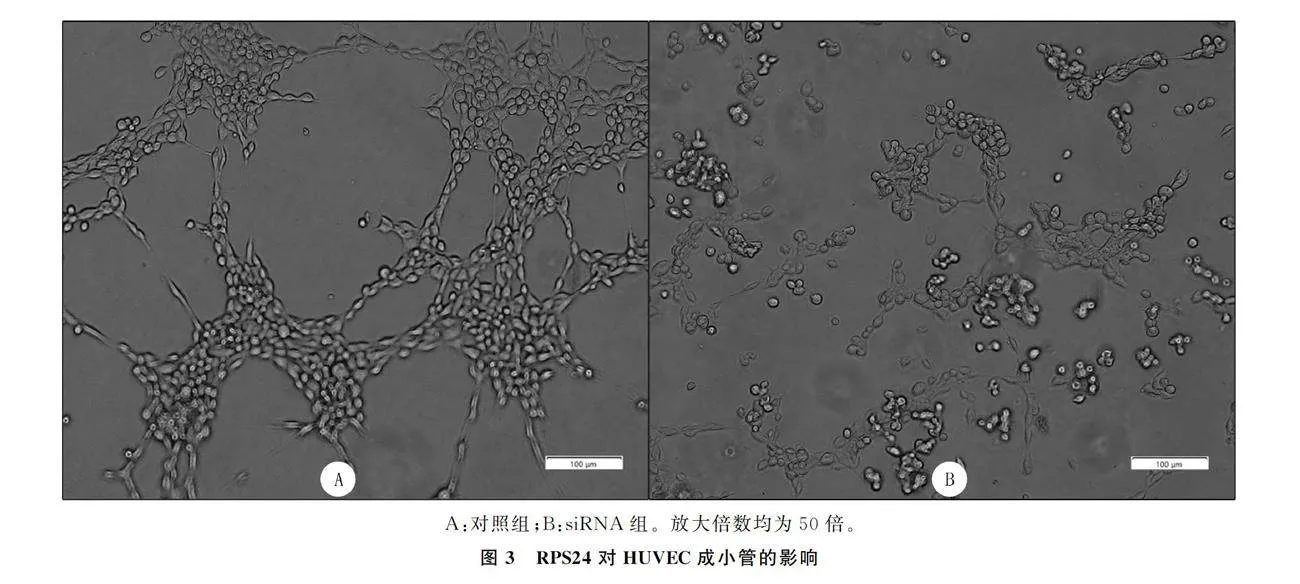
1.2.6 HUVEC成小管实验 用RPS24 siRNA转染HUVEC(siRNA组)。转染48 h待细胞消化后,通过离心获取上清液。在收集的培养上清液中培养细胞24 h(细胞密度2×108/L),接着以每孔50 μL细胞悬液的规格接种在已经在培养箱中凝固的Matrigel基质胶上,继续在 37 ℃、含体积分数为0.05 CO2的培养箱中孵育8 h,用Olympus倒置显微镜观察HUVEC的类毛细血管结构形成情况,同时拍照。使用乱序siRNA转染作为阴性对照(对照组)。最后,用Image J软件对两组细胞形成小管的数量和总长度进行量化和比较。
1.3 统计学分析
应用GraphPad Prism 8.0软件对所得数据进行统计学分析。计量数据以±s表示,两组比较采用独立样本t检验。以Plt;0.05为差异有统计学意义。
2 结" 果
2.1 两组人颈动脉斑块的组织学差异
取自颈动脉狭窄病人颈总动脉分叉处的粥样硬化斑块进行横切面切片处理后,分别进行HE染色、油红O染色和Masson染色,结果显示,两组斑块有明显差异,相较于稳定组人颈动脉斑块,易损组斑块有更薄的纤维帽,更加杂乱的脂质坏死核心和更加广泛的纤维成分。见图1。
2.2 RPS24和PGK1在两组颈动脉斑块组织中的表达差异
与稳定组人颈动脉斑块相比较,易损组斑块中RPS24蛋白的表达明显增高(t=47.50,Plt;0.05),而PGK1蛋白表达明显降低(t=39.06,Plt;0.05)。见图2、表1。
2.3 RPS24在体外对微血管生成的影响
HUVEC孵育8 h后,对照组大部分细胞都参与生成环状结构,而siRNA组几乎全部细胞都呈零星分布,并且分布杂乱,没有环状结构出现,未参与小管生成。见图3。对照组细胞生成的小管数量显著高于siRNA组(t=9.80,Plt;0.05),生成小管的总长度也显著高于siRNA组(t=25.74,Plt;0.05)。表明RPS24可以促进HUVEC小管形成。见表2。
2.4 RPS24对PGK1分泌的影响
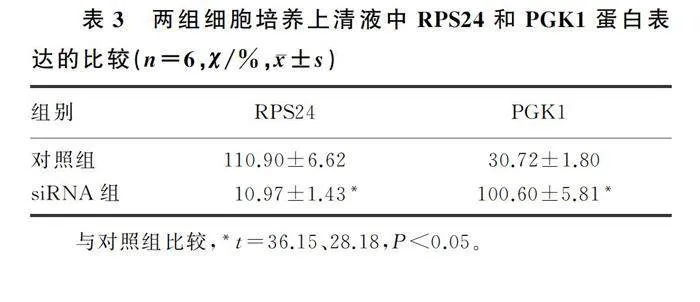
Western blot检测结果显示,siRNA组细胞培养上清液中RPS24蛋白表达量显著低于对照组,而PGK1蛋白表达量则显著高于对照组(t=36.15、28.18,Plt;0.05)。见图4、表3。
3 讨" 论
颈动脉粥样硬化是老年男性人群常见的血管疾病[17]。颈动脉斑块作为中国最高致死率疾病脑卒中的关键病因,其治疗显得尤为重要。与普通的颈动脉稳定斑块相比较,易损斑块往往有更强的炎性反应[18],更薄的纤维帽[5],更广泛、杂乱的新生血管[4],更高含量且更为活跃的基质金属蛋白酶[19],这些因素都意味着颈动脉易损斑块拥有不稳定、易碎、斑块内出血等高危特点[3]。最近的研究发现,斑块内出血是导致颈动脉斑块破裂的一大重要因素,而斑块内新血管的生成能够增大斑块内出血的风险[8]。所以本研究从新生血管入手探讨影响斑块内出血的因素。
越来越多的证据表明,核糖体蛋白在人类肿瘤的发生和进展中起重要作用[20-21]。据报道,RPS24可以在体外促进结直肠癌细胞的迁移和增殖[22]。另有研究表明,RPS24异构体可通过增强结直肠癌
中LncRNA MVIH的稳定性促进肿瘤血管生成[23]。
LncRNA MVIH位于RPS24基因内,之前有研究报道,lncRNA MVIH可以促进肝细胞癌血管生成[24]。lncRNA是非编码RNA,在多种生物过程中发挥着重要作用,包括染色质组织、转录和转录后控制[25]。而lncRNA MVIH可以与RPS24 mRNA结合形成异构体[13]。另有研究结果表明,lncRNA MVIH与PGK1相关,可以通过抑制PGK1的分泌来激活血管生成。所以,我们推测RPS24可以调控PGK1的表达和分泌。
本研究对来自于临床的人颈动脉斑块进行了Western blot检测,结果显示,相较于人颈动脉稳定斑块,人颈动脉易损斑块中RPS24的蛋白表达显著升高。由于RPS24参与多种疾病的血管生成过程,并且有研究结果表明,PGK1可以促进细胞增殖并抑制细胞凋亡,以此介导动脉粥样硬化的发展[26],所以我们猜测,RPS24在人颈动脉斑块易损性进展过程的血管新生环节中扮演了重要角色。为了探讨RPS24对血管生成的影响,本研究进行了HUVEC小管形成测定,结果表明,经过RPS24 siRNA靶向处理的培养液可以抑制HUVEC的小管形成。随后本研究又检测了在敲低RPS24情况下PGK1的表达水平,发现敲低RPS24可以解除对PGK1的抑制,从而抑制血管生成。
综上所述,本研究表明,RPS24通过抑制PGK1来促进人颈动脉斑块内的血管生成。研究RPS24对血管的影响有助于更深入了解人颈动脉斑块内血管新生的机制。通过抑制RPS24对新生血管进行调控或许会为颈动脉斑块的非手术治疗提供一种新的思路。
[参考文献]
[1]NAGHAVI M, FALK E. From vulnerable plaque to vulnerable patient[J]. Asymptomatic Atherosclerosis, 2011:13-38. doi:10.1007/978-1-60327-178-0_2.
[2]BRETT A S, LEVINE J D. The case against identifying caro-
tid stenosis in asymptomatic patients[J]. JAMA Internal Me-
dicine, 2014,174(12):2004-2008.
[3]LABADZHYAN A, CSIBA L, NARULA N, et al. Histopathologic evaluation of basilar artery atherosclerosis[J]. Journal of the Neurological Sciences, 2011,307(1-2):97-99.
[4]ICHIBORI Y, NAKATANI D, SAKATA Y, et al. Cardiac allograft vasculopathy progression associated with intraplaque neovascularization[J]. Journal of the American College of Cardiology, 2013,61(9):e149.
[5]SABA L C, ANZIDEI M, MARINCOLA B C, et al. Imaging of the carotid artery vulnerable plaque[J]. Cardiovascular and Interventional Radiology, 2014,37(3):572-585.
[6]SCHINDLER A, SCHINNER R, ALTAF N, et al. Prediction of stroke risk by detection of hemorrhage in carotid plaques: meta-analysis of individual patient data[J]. JACC Cardiovascular Imaging, 2020,13(2 Pt 1):395-406.
[7]ZHANG Y, CAO J, ZHOU J Y, et al. Plaque elasticity and intraplaque neovascularisation on carotid artery ultrasound: a comparative histological study[J]. European Journal of Vascular and Endovascular Surgery, 2021,62(3):358-366.
[8]MUJAJ B, BOS D, MUKA T, et al. Antithrombotic treatment is associated with intraplaque haemorrhage in the atherosclerotic carotid artery: a cross-sectional analysis of The Rotterdam Study[J]. European Heart Journal, 2018,39(36):3369-3376.
[9]LINDSTRM M, ZHANG Y P. Ribosomal protein S9 is a novel B23/NPM-binding protein required for normal cell prolife-
ration[J]. Journal of Biological Chemistry, 2008,283(23):15568-15576.
[10]LI C, GE M, YIN Y, et al. Silencing expression of ribosomal protein L26 and L29 by RNA interfering inhibits proliferation of human pancreatic cancer PANC-1 cells[J]. Molecular and Cellular Biochemistry: An International Journal for Chemical Biology, 2012,370(1-2):127-39.
[11]PARK M K, ZHANG L, MIN K W, et al. NEAT1 is essential for metabolic changes that promote breast cancer growth and metastasis[J]. Cell Metabolism, 2021,33(12):2380-2397.e9.
[12]LIANG J S, LIU C T, XU D Z, et al. LncRNA NEAT1 facilitates glioma progression via stabilizing PGK1[J]. Journal of Translational Medicine, 2022,20(1):80.
[13]YUAN S X, YANG F, YANG Y, et al. Long noncoding RNA associated with microvascular invasion in hepatocellular carcinoma promotes angiogenesis and serves as a predictor for hepatocellular carcinoma patients’ poor recurrence-free survival after hepatectomy[J]. Hepatology (Baltimore, Md), 2012,56(6):2231-2241.
[14]THORNTON C C, AL-RASHED F, CALAY D, et al. Me-
thotrexate-mediated activation of an AMPK-CREB-dependent pathway: a novel mechanism for vascular protection in chronic systemic inflammation[J]. Annals of the Rheumatic Diseases, 2016,75(2):439-448.
[15]STEFANADIS C, ANTONIOU C K, TSIACHRIS D, et al. Coronary atherosclerotic vulnerable plaque: current perspectives[J]. Journal of the American Heart Association, 2017,6(3):e005543.
[16]GANGULY R, KHANAL S, MATHIAS A, et al. TSP-1 (thrombospondin-1) deficiency protects ApoE-/- mice against leptin-induced atherosclerosis[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2021,41(2):e112-e127.
[17]ZHAN C Q, SHI M, YANG Y, et al. Prevalence and risk factors of carotid plaque among middle-aged and elderly adults in rural Tianjin, China[J]. Scientific Reports, 2016,6:23870.
[18]CUI Y, WAN Q. NKT cells in neurological diseases[J]. Frontiers in Cellular Neuroscience, 2019,13:245.
[19]MOLLOY K J, THOMPSON M M, JONES J L, et al. Unstable carotid plaques exhibit raised matrix metalloproteinase-8 activity[J]. Circulation, 2004,110(3):337-343.
[20]LOHRUM M A, LUDWIG R L, KUBBUTAT M H, et al. Regulation of HDM2 activity by the ribosomal protein L11[J]. Cancer Cell, 2003,3(6):577-587.
[21]MACIAS E, JIN A W, DEISENROTH C, et al. An ARF-independent c-MYC-activated tumor suppression pathway me-
diated by ribosomal protein-Mdm2 Interaction[J]. Cancer Cell, 2010,18(3):231-243.
[22]WANG Y, SUI J K, LI X, et al. RPS24 knockdown inhibits colorectal cancer cell migration and proliferation in vitro[J]. Gene, 2015,571(2):286-291.
[23]WANG Y, WU Y J, XIAO K, et al. RPS24c isoform facilitates tumor angiogenesis Via promoting the stability of MVIH in colorectal cancer[J]. Current Molecular Medicine, 2020,20(5):388-395.
[24]PONTING C P, OLIVER P L, REIK W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009,136(4):629-641.
[25]GEISLER S, COLLER J. RNA in unexpected places: long non-coding RNA functions in diverse cellular contexts[J]. Nature Reviews Molecular Cell Biology, 2013,14(11):699-712.
[26]ZHANG X, GUAN M X, JIANG Q H, et al. NEAT1 knockdown suppresses endothelial cell proliferation and induces apoptosis by regulating miR-638/AKT/mTOR signaling in atherosclerosis[J]. Oncology Reports, 2020,44(1):115-125.
(本文编辑 马伟平)

