总胆红素反弹率与总胆红素清除率在人工肝治疗重症药物性肝损伤预后评估中的作用
刘莹 朱萍 梁静 向慧玲

摘要:目的 評估总胆红素反弹率(TBRR)、总胆红素清除率(TBCR)及治疗1周后总胆红素清除率(ΔTBCR)在人工肝治疗重症药物性肝损伤短期预后评估中的作用。方法 回顾性分析2013年9月—2021年12月在天津市第三中心医院住院并行人工肝治疗的重症药物性肝损伤患者203例,收集患者的一般资料、生化指标及临床分型,根据患者出院时病情转归分为好转组和未愈组,并计算MELD评分、TBRR、TBCR及ΔTBCR。正态分布的计量资料,两组间比较采用独立样本t检验;非正态分布的计量资料两组间比较采用Mann-Whitney U检验;计数资料两组间比较采用χ2检验。绘制受试者工作特征曲线(ROC曲线)用来评估各个评价指标对患者预后的预测价值。Kaplan-Meier法用来描述不同评价指标下患者住院时间的差异。结果 好转组患者的年龄(t=-2.762)、WBC(Z=-3.184)、TBil(t=-2.809)、CBil(t=-2.739)、INR(Z=-2.357)、MELD评分(t=-3.090)、TBRR(t=-4.749)低于未愈组,而Alb(t=2.198)、PTA(t=2.018)、TBCR(t=2.166)、ΔTBCR(t=9.549)则高于未愈组(P值均<0.05)。MELD评分、TBRR、TBCR及 ΔTBCR的ROC曲线下面积分别为0.656、0.727、0.611和0.879,ΔTBCR在预测价值上优于TBRR(Z=3.169,P=0.001 5)。TBRR、ΔTBCR最佳临界值为22.5%(敏感度94.6%,特异度45.2%)、27.4%(敏感度77.7%,特异度86.5%)。而对于不同的临床病理分型,ΔTBCR均显示出良好的预测价值,特别是对混合型DILI患者进行人工肝治疗的疗效评价具有极高的敏感度(91.4%)和特异度(100.0%)。结论 TBRR、ΔTBCR对人工肝治疗重症药物性肝损伤患者短期预后评估中作用优于MELD评分,其中ΔTBCR评分的预测价值更高。
关键词:化学性与药物性肝损伤; 肝, 人工; 胆红素
基金项目:天津市医学重点学科(专科)建设项目(TJYXZDXK-034A); 天津市卫生健康科技项目重点学科专项资助(TJWJ2022XK029); 北京肝胆相照公益基金(RGGJJ-2021-014)
Value of total bilirubin rebound rate and total bilirubin clearance rate in evaluating the prognosis of severe drug-induced liver injury after artificial liver support therapy
LIU Ying, ZHU Ping, LIANG Jing, XIANG Huiling. (Department of Gastroenterology and Hepatology, Tianjin Third Central Hospital; Tianjin Key Laboratory of Extracorporeal Life Support for Critical Diseases; Artificial Cell Engineering Technology Research Center; Tianjin Institute of Hepatobiliary Disease, Tianjin 300170, China)
Corresponding author:
XIANG huiling, huilingxiang@163.com (ORCID:0000-0003-3678-4225)
Abstract:
Objective To investigate the value of total bilirubin rebound rate (TBRR), total bilirubin clearance rate (TBCR), and TBCR after 1 week of treatment (ΔTBCR) in evaluating the short-term prognosis of patients with severe drug-induced liver injury (DILI) after artificial liver support therapy. Methods A retrospective analysis was performed for 203 patients with severe DILI who received artificial liver support therapy in Tianjin Third Central Hospital from September 2013 to December 2021, and general information, biochemical parameters, and clinical classification were collected. The patients were divided into improved group and unhealed group according to the prognosis at discharge, and Model for End-Stage Liver Disease (MELD) score, TBRR, TBCR, and ΔTBCR were calculated. The independent samples t-test was used for comparison of normally distributed continuous data between groups, and the Mann-Whitney U test was used for comparison of non-normally distributed continuous data between groups; the chi-square test was used for comparison of categorical data between groups. The receiver operating characteristic (ROC) curve was plotted to investigate the value of assessment indices in predicting the prognosis of patients, and the Kaplan-Meier method was used to investigate the difference in the length of hospital stay in the context of different assessment indices. Results Compared with the unhealed group, the improved group had significantly lower age (t=-2.762, P<0.05), white blood cell count (Z=-3.184, P<0.05), total bilirubin (t=-2.809, P<0.05), conjugated bilirubin (t=-2.739, P<0.05), international normalized ratio (Z=-2.357, P<0.05), MELD score (t=-3.090, P<0.05), and TBRR (t=-4.749, P<0.05), as well as significantly higher albumin (t=2.198, P<0.05), prothrombin time activity (t=2.018, P<0.05), TBCR (t=2.166, P<0.05), and ΔTBCR (t=9.549, P<0.05). MELD score, TBRR, TBCR, and ΔTBCR had an area under the ROC curve (AUC) of 0.656, 0.727, 0.611, and 0.879, respectively, and ΔTBCR had a better predictive value than TBRR (Z=3.169, P=0.001 5). The optimal cut-off value was 22.5% for TBRR (with a sensitivity of 94.6% and a specificity of 45.2%) and 27.4% for ΔTBCR (with a sensitivity of 77.7% and a specificity of 86.5%). ΔTBCR showed a good predictive value in different clinicopathological types, with extremely high sensitivity (91.4%) and specificity (100.0%) in evaluating the treatment outcome of patients with mixed-type DILI after artificial liver support therapy. Conclusion TBRR and ΔTBCR have a higher value than MELD score in evaluating the short-term prognosis of patients with severe DILI after artificial liver support therapy, among which ΔTBCR has a higher predictive value.
Key words:
Chemical and Drug Induced Liver Injury; Liver, Artificial; Bilirubin
Research funding:
Tianjin Key Medical Discipline(Specialty)Construction Project (TJYXZDXK-034A); Tianjin Health Project (TJWJ2022XK029); Beijing iGandan Foundation (RGGJJ-2021-014)
药物性肝损伤(DILI)是指由各类处方或非处方的化学药物、生物制剂、传统中药、天然药、保健品、膳食补充剂及其代谢产物乃至辅料等所诱发的肝损伤。DILI在西方国家多由对乙酰氨基酚诱发,而在我国则以中药及膳食补充剂诱发最为常见,发病率呈逐年上升的趋势[1-2]。DILI的临床表现严重程度不一,轻症可仅有肝功能异常,重症则会快速进展至急性肝衰竭。人工肝支持系统用于肝衰竭、高胆红素血症、脓毒血症等危重症患者的救治[3-4]。但血浆的缺乏以及昂贵的治疗费用使得人工肝治疗中的选择显得尤为重要,如能在人工肝治疗的早期阶段对疾病预后作出初步评判,则对临床治疗选择及医疗资源分配有重要意义。但目前尚缺乏有效的评分系统来预测人工肝治疗重症DILI的短期预后,有研究[5-6]认为,终末期肝病模型(MELD)评分对慢加急性肝衰竭患者短期及长期的生存预后有较准确的预测价值。同时有文献[7-8]表明,总胆红素反弹率(total bilirubin rebound rate,TBRR)、总胆红素清除率(total bilirubin clearance rate,TBCR)可以有效预测人工肝治疗术后肝衰竭患者的短期预后。然而上述评分系统对重症DILI患者行人工肝治疗后的短期预后评估是否具有判断价值尚缺乏客观证据。本研究旨在观察MELD评分、TBRR、TBCR以及治疗1周后TBil清除率(ΔTBCR)对人工肝治疗重症DILI患者的短期预后的预测价值。
1 资料及方法
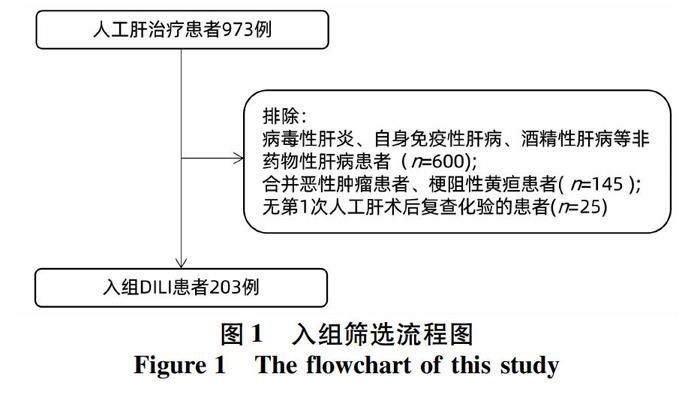
1.1 研究对象 本研究为回顾性队列研究,共纳入2013年9月—2021年12月收治于天津市第三中心医院行人工肝治疗的重症DILI患者203例。纳入标准:符合我国《药物性肝损伤诊治指南》[2]中3级重度肝损伤的诊断标准,血清ALT和/或ALP升高,TBil≥5倍正常值上限(ULN)(5 mg/dL或85.5 μmol/L),伴或不伴INR≥1.5。患者症状进一步加重,需要住院治疗,或住院时间延长;药物性肝损伤因果关系评分量表(RUCAM)评分均>6分或肝穿刺活检提示DILI。所有患者入院后均接受常规内科基础治疗,包括停用导致肝损伤的药物,给予谷胱甘肽、异甘草酸镁、双环醇、熊去氧胆酸等药物进行保肝治疗,针对并发症积极对症治疗,并在上述常规内科治疗的基础上同时给予人工肝治疗。人工肝治疗的适应证和治疗方式依据我国《肝衰竭诊治指南(2018版)》[9]及《人工肝血液净化技术临床应用专家共识(2022年版)》[4]。根据治疗前患者的一般状况和实验室检查指标选择相应的治疗模式,如胆汁淤积为主者,以血浆灌流或双重血浆分子吸附系统为主;以凝血功能障碍为主,以血浆置换(plasma exchange,PE)为主,合并肝肾综合征、腹腔感染则行PE联合血液滤过(hemofiltration,HF)。排除标准:嗜肝病毒、酒精、自身免疫性因素所致黄疸;梗阻性黄疸;溶血性黄疸;未控制的恶性肿瘤;孕妇及哺乳期妇女;以及无首次人工肝治疗后化验指标的患者。
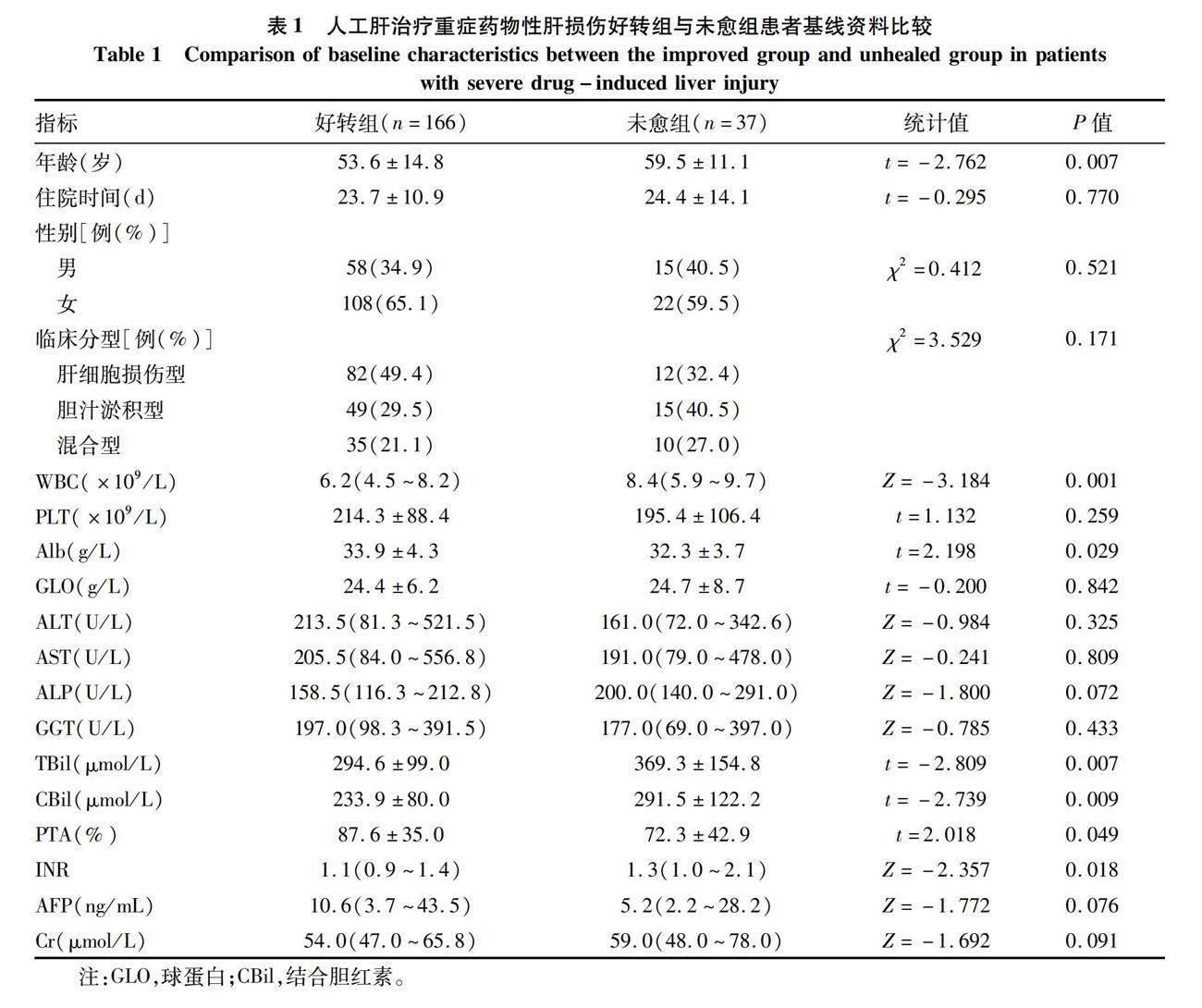
1.2 研究方法 收集患者入院时年龄、性别、住院时间、DILI临床分型、出院时病情转归等资料;收集血常规、肝功能、肾功能、凝血等指标;并计算MELD评分、TBRR、TBCR和ΔTBCR等相关评价指标。DILI临床分型以国际医学组织理事会(CIOMS)判断标准为主[10],肝细胞损伤型:ALT≥3×ULN,且R≥5;胆汁淤积型:ALP≥2×ULN,且R≤2;混合型:ALT≥3×ULN,ALP≥2×ULN,且2<R<5。R=[ALT实测值/ALT(ULN)]/[ALP实测值/ALP(ULN)]。患者出院时病情转归的评判依据《药物性肝损伤诊治指南(2015版)》[2]、《非生物型人工肝治疗肝衰竭指南(2016版)》[3],分为好转组(n=166)和未愈组(n=37)。好转组:患者出院时临床症状明显改善,肝功能指标较治疗前恢复超过1/3,DILI分级与治疗前相比下降1级或以上;未愈组:指患者肝功能无明显改善或进一步恶化而行肝移植、病情恶化自动出院放弃治疗、死亡均归入未愈组。
1.3 评分方法 根据患者入院后基线生化指标计算MELD评分。
MELD评分=3.8×ln[胆红素(mg/dL)]+11.2×ln(INR)+9.6×ln[肌酐(mg/dL)+6.4×(病因:胆汁性或酒精性0,其他1)][11]。
根据患者首次人工肝前后及治疗1周后相关指标进行分析。
TBil反弹率(TBRR)=(术后第2次TBil-术后第1次TBil)/术后第1次TBil×100%。
TBil清除率(TBCR)=(首次人工肝术前TBil-术后第1次TBil)/首次术前TBil×100%;
ΔTBil清除率(ΔTBCR)=(首次人工肝術前TBil-治疗后1周TBil)/首次术前TBil×100%。
术后第1次TBil为首次人工肝治疗结束时静脉采血结果,术后第2次TBil为首次人工肝治疗3 d后静脉采血结果。
1.4 统计学方法 采用SPSS 25.0软件进行数据统计分析。正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;非正态分布的计量资料用M(P25~P75)表示,两组间比较采用Mann-Whitney U检验;计数资料两组间比较采用χ2检验。用受试者工作特征曲线(ROC曲线)和曲线下面积(AUC)来评估各个评价指标对患者预后的价值;以约登指数最大达到最大所对应的值为最佳诊断界值(cut-off值)。AUC比较则采用正态性Z检验。AUC>0.7的模型即有临床应用价值。Kaplan-Meier方法用来描述不同评价指标下患者住院时间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 图1显示入组患者筛选路线。本研究共纳入重症DILI患者203例,其中男73例(36.0%),女130例(64.0%),平均年龄(54.7±14.4)岁,住院平均时间(23.8±11.5)d,人工肝治疗共893次,其中血浆置换(PE)478次,血浆灌流125次,双重血浆分子吸附系统266次,血液滤过(HF)24次,平均治疗(4.4±2.7)次/人。临床分型:肝细胞损伤型94例(46.3%),胆汁淤积型64例(31.5%),混合型45例(22.2%)。
2.2 好转组与未愈组基线生化指标比较 好转组患者年龄
(P=0.007)、WBC(P=0.001)、TBil(P=0.007)、CBil(P=0.009)和INR(P=0.018)低于未愈组,而Alb(P=0.029)、PTA(P=0.049)则高于未愈组(P值均<0.05)。两组患者在性别、住院时间、临床分型、PLT、GLO、ALT、AST、ALP、GGT、AFP、Cr方面的差异均无统计学意义(P值均>0.05)(表1)。
2.3 好转组与未愈组各项评价指标比较 好转组与未愈组的MELD评分、TBRR、TBCR和ΔTBCR均具有统计学差异(P值均<0.05)(表2)。2.4 各项评价指标对人工肝治疗重症DILI短期预后的评价价值 MELD评分、TBRR、TBCR和ΔTBCR的AUC分别为0.656、0.727、0.611和0.879(图2);其中,TBRR和ΔTBCR两种评价指标对人工肝治疗重症DILI的短期预后具有较好的预测价值,ΔTBCR在预测价值上优于TBRR(Z=3.169,P=0.001 5)。
MELD评分、TBRR、TBCR和ΔTBCR 4种评价指标的cut-off值分别为20.7(敏感度37.8%,特异度92.2%)、22.5%(敏感度94.6%,特异度45.2%)、32.7%(敏感度78.9%,特异度40.5%)和27.4%(敏感度77.7%,特异度86.5%)。
2.5 TBRR、ΔTBCR对不同临床分型的重症DILI患者预后的预测价值 不同临床分型下,ΔTBCR均显示出良好的预测价值,而TBRR则在肝细胞损伤型、混合型中显示出较好的预测价值。其中,在肝细胞损伤型DILI患者中,两种评价指标的差异不具有统计学差异(Z=1.032,P=0.302 3);而在胆汁淤积型(Z=2.104,P=0.035 4)、混合型(Z=2.461,P=0.013 8)中,ΔTBCR在预测价值上更优于TBRR。特别指出的是,在三种分型中,ΔTBCR对混合型DILI患者进行人工肝的疗效评价具有最高的敏感度(91.4%)和特异度(100.0%)(表3)。
2.6 不同评价指标下重症DILI患者住院时间的差异 TBRR<22.5%的患者中位住院时间为17.0 d(95%CI:14.9~19.1),低于TBRR≥22.5%的中位住院时间28.0 d(95%CI:25.6~30.4)(P<0.001);ΔTBCR ≥27.4%的患者中位住院时间19.0 d(95%CI:16.9~21.1),低于ΔTBCR<27.4%的中位住院时间35.0 d(95%CI:30.1~39.9)(P<0.001)(图3)。
3 讨论
国内外文献[12]报道DILI是否进展为重症肝损伤具有一定年龄和性别差异,以中老年、女性发病率较高。本研究共纳入重症DILI患者203例,平均年龄(54.7±14.4)岁,其中男73例,女130例,男女比例为1∶1.8,研究人群特征与既往文献报道一致。目前DILI尚无敏感且特异性强的诊断指标和特效的治疗方法,对于重症DILI的治疗,特别是胆汁淤积型或者常规内科药物治疗效果不佳的患者,有研究[13]认为人工肝治疗能提供较好的治疗效果。人工肝支持系统可通过及时清除患者体内过高的胆红素,减少毒性代谢产物、炎症介质的产生,减轻“炎症风暴”,从而达到改善内环境、促进肝细胞再生的目的,为内科治疗及肝移植赢得宝贵的时间[14-15]。本研究重症DILI患者人工肝治疗平均(4.4±2.7)次,出院时好转率81.8%,这说明人工肝治疗可以通过减轻肝细胞损伤、抑制继发性炎症及改善胆汁淤积,有效救治重症DILI患者。但人工肝高昂的治疗费用以及治疗材料尤其是血浆的紧缺使得许多有治疗指征的患者不能进行治疗或者不能完成实际需要的疗程。因此需要新的评价体系去筛选有确实治疗需要和治疗效果好的患者进行治疗,从而对有限医疗资源的合理分配和利用。
许多学者[16-17]研究发现MELD评分是预测肝衰竭预后的独立危险因素。同时有研究[8,18]发现,TBRR、TBCR可一定程度地反映行血浆置换治疗肝衰竭伴或不伴肝性脑病的治疗效果,并且对于这类患者的预后具有一定的预测价值。本研究通过对上述评价指标进行比较发现,好转组的MELD评分、TBRR低于未愈组,而TBCR及ΔTBCR高于未愈组,提示人工肝在重癥DILI的患者当中存在良好的治疗效果。MELD评分、TBRR、TBCR和ΔTBCR的AUC分别为0.656、0.727、0.611和0.879。通过比较AUC发现,TBRR、ΔTBCR对重症DILI患者预后的预测价值优于MELD评分,而ΔTBCR在预测价值上优于TBRR(Z=3.169,P=0.001 5)。此外,根据临床分型,对纳入的203例重症DILI患者进行亚组分析,结果发现ΔTBCR对DILI各分型(即肝细胞损伤型、胆汁淤积型、混合型)均显示出良好的预测价值。依据本研究结果,重症DILI患者可分别于人工肝治疗后的第3天、1周计算TBRR、ΔTBCR评分,若TBRR≥22.5%,ΔTBCR≤27.4%,即提示即使给予患者人工肝治疗可能仍无法延缓患者肝脏细胞的坏死速度,逆转患者的病情,可考虑及时进行肝移植手术,以节约医疗资源、缩短住院时间。
虽目前有多项研究提示MELD评分对重症肝病患者的生存预后有较准确的预测价值。但本研究纳入人群为重症DILI患者,多以肝细胞损伤、胆汁淤积为主要表现,少有肾脏等肝外器官损伤,MELD评分受Cr、INR等相关指标的影响,具有局限性,结果显示MELD评分对于这类患者人工肝治疗的预测价值相对偏低。与MELD评分相比,TBRR、ΔTBCR有计算简单的优点,且在人工肝治疗过程中可动态评价人工肝治疗效果,以决定是否再次行人工肝治疗,具有简单实用,可操作性强等优点。TBRR、ΔTBCR可作为一种重症DILI患者短期预后的评价指标,但对于并发症严重、合并多器官衰竭的患者,可考虑结合MELD评分系统,以增加评估的可信度。
伦理学声明:本研究于2022年7月14日经过天津市第三中心医院伦理委员会批准。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:刘莹负责课题设计,资料分析,撰写论文;朱萍负责确定研究方向以及统计分析;向慧玲、梁静负责拟定写作思路,指导撰写文章并最后定稿。
参考文献:
[1]DEVARBHAVI H, AITHAL G, TREEPRASERTSUK S, et al. Drug-induced liver injury: Asia Pacific Association of Study of Liver consensus guidelines[J]. Hepatol Int, 2021, 15(2): 258-282. DOI: 10.1007/s12072-021-10144-3.
[2]Drug-induced Liver Disease Study Group, Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the management of drug-induced liver injury[J]. J Clin Hepatol, 2015, 31(11): 1752-1769. DOI: 10.3969/j.issn.1001-5256.2015.11.002.
中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 临床肝胆病杂志, 2015, 31(11): 1752-1769. DOI: 10.3969/j.issn.1001-5256.2015.11.002.
[3]Liver Failure and Artificial Liver Group,Chinese Society of Infectious Diseases. Guideline for nonbioartificial liver support systems in treatment of liver failure:2016 update[J]. Chin J Clin Infect Dis, 2016, 9(2): 97-103. DOI: 10.3760/cma.j.issn. 1674-2397.2016.02.001.
中华医学会感染病学分会肝衰竭与人工肝学组. 非生物型人工肝治疗肝衰竭指南(2016年版)[J]. 中华临床感染病杂志, 2016, 9(2): 97-103. DOI: 10.3760/cma. j.issn.1674-2397.2016.02.001.
[4]Severe Liver Disease and Artificial Liver Group, Chinese Society of Hepatology, Chinese Medical Association. Expert consensus on clinical application of artificial liver and blood purification (2022 edition)[J]. J Clin Hepatol, 2022, 38(4): 767-775. DOI: 10.3969/j.issn.1001-5256.2022.04.007.
中华医學会肝病学分会重型肝病与人工肝学组. 人工肝血液净化技术临床应用专家共识(2022年版)[J]. 临床肝胆病杂志, 2022, 38(4): 767-775 DOI: 10.3969/j.issn.1001-5256.2022.04.007.
[5]SHAKIL AO, KRAMER D, MAZARIEGOS GV, et al. Acute liver failure: clinical features, outcome analysis, and applicability of prognostic criteria[J]. Liver Transpl, 2000, 6(2): 163-169. DOI: 10.1002/lt.500060218.
[6]SILBERHUMER GR, HETZ H, RASOUL-ROCKENSCHAUB S, et al. Is MELD score sufficient to predict not only death on waiting list, but also post-transplant survival?[J]. Transpl Int, 2006, 19(4): 275-281. DOI: 10.1111/j.1432-2277.2006.00250.x.
[7]WANG ZC, SHAO JG, GU EL. Short term prediction of rebound rate of total bilirubin in patients with chronic subacute liver failure treated with artificial liver[J]. Chin J Infect Dis, 2013, 31(11): 678-680. DOI: 10.3760/cma.j.issn.1000-6680.2013.11.009.
王忠成, 邵建国, 顾尔莉. 总胆红素反弹率对人工肝治疗慢加亚急性肝功能衰竭的短期预测 [J]. 中华传染病杂志, 2013, 31(11): 678-680. DOI: 10.3760/cma.j.issn.1000-6680.2013.11.009.
[8]XIN KF, LI M, LI SS, et al. The role of TBARR, TBRR and TBCR in evaluating the prognosis of patients with chronic acute liver failure after plasma exchange therapy[J]. Shandong Med J, 2018, 58(25): 44-46. DOI: 10.3969/j.issn.1002-266X.2018.25.012.
辛克锋, 李铭, 李莎莎, 等. TBARR、TBRR、TBCR在血浆置换治疗后慢加急性肝衰竭患者预后评估中的作用[J]. 山东医药, 2018, 58(25): 44-46. DOI: 10.3969/j.issn.1002-266X.2018.25.012.
[9]Liver Failure and Artificial Liver Group, Chinese Society of Infectious Diseases, Chinese Medical Association; Severe Liver Disease and Artificial Liver Group, Chinese Society of Hepatology, Chinese Medical Association. Guideline for diagnosis and treatment of liver failure(2018)[J]. J Clin Hepatol, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007.
中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2018年版)[J]. 临床肝胆病杂志, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007.
[10]CHALASANI NP, MADDUR H, RUSSO MW, et al. ACG clinical guideline: diagnosis and management of idiosyncratic drug-induced liver injury[J]. Am J Gastroenterol, 2021, 116(5): 878-898. DOI: 10.14309/ajg. 0000000000001259.
[11]FORMAN LM, LUCEY MR. Predicting the prognosis of chronic liver disease: an evolution from child to MELD. Mayo end-stage liver disease[J]. Hepatology, 2001, 33(2): 473-475. DOI: 10.1053/jhep.2001.22481.
[12]CHEN M, SUZUKI A, BORLAK J, et al. Drug-induced liver injury: Interactions between drug properties and host factors[J]. J Hepatol, 2015, 63(2): 503-514. DOI: 10.1016/j.jhep.2015.04.016.
[13]TIAN B, LI F, DENG BC. Clinical effect of artificial liver support system in treatment of drug-induced liver failure: A meta-analysis [J]. J Clin Hepatol, 2020, 36(4): 823-828. DOI: 10.3969/j.issn.1001-5256.2020.04.023.
田冰, 李范, 鄧宝成. 人工肝支持系统治疗药物性肝衰竭临床效果的Meta分析[J]. 临床肝胆病杂志, 2020, 36(4): 823-828. DOI: 10.3969/j.issn. 1001-5256. 2020.04.023.
[14]ZHU SH, GUO CC, LIU ZG, et al. Efficacy of abiotic artificial liver in the treatment of severe drug-induced liver injury[J]. Chin Hepatol, 2020, 25(1): 78-81. DOI: 10.14000/j.cnki.issn.1008-1704.2020.01.029.
朱绍华, 郭长存, 刘志国, 等. 非生物型人工肝治疗重症药物性肝损伤疗效观察 [J]. 肝脏, 2020, 25(1): 78-81. DOI: 10.14000/j.cnki.issn.1008-1704.2020. 01.029.
[15]WU B, DU LY, MA YJ, et al. Effects of different combinations of artificial liver support system on efficacy and inflammatory indexes of patients with hepatitis B virus-related acute-on-chronic liver failure in early and middle stages[J/CD]. Chin J Liver Dis (Electronic Version), 2021, 13(1): 32-38. DOI: 10.3969/j.issn.1674-7380.2021.01.006.
吴蓓, 杜凌遥, 马元吉, 等. 不同组合人工肝支持系统治疗乙型肝炎病毒相关早、中期慢加急性肝衰竭患者的療效及对炎症指标的影响[J/CD]. 中国肝脏病杂志(电子版), 2021, 13(1): 32-38. DOI: 10.3969/j.issn.1674-7380.2021.01.006.
[16]MORALES-ARREZ D, VENTURA-COTS M, ALTAMIRANO J, et al. The MELD score is superior to the maddrey discriminant function score to predict short-term mortality in alcohol-associated hepatitis: A global study[J]. Am J Gastroenterol, 2022, 117(2): 301-310. DOI: 10.14309/ajg.0000000000001596.
[17]KAMATH PS, WIESNER RH, MALINCHOC M, et al. A model to predict survival in patients with end-stage liver disease[J]. Hepatology, 2001, 33(2): 464-470. DOI: 10.1053/jhep.2001.22172.
[18]ZHANG YF, YU WY, CHEN DL, et al. The prognosis of acute (subacute) hepatic failure with hepatic encephalopathy treated with artificial liver[J/CD]. Prac J Organ Transplant, 2020, 8(4): 252-255. DOI: 10.3969/j.issn.2095-5332.2020.04.004.
张叶凡, 于万有, 陈冬玲, 等. 人工肝治疗急(亚急)性肝衰竭合并肝性脑病的中短期预后评估[J/CD]. 实用器官移植电子杂志, 2020, 8(4): 252-255. DOI: 10.3969/j.issn.2095-5332.2020.04.004.
收稿日期:
2022-08-10;录用日期:2022-10-29
本文编辑:林姣

