颅骨硬化性上皮样纤维肉瘤1例报告并文献复习
赵春瑞 隋建美 董世祥 叶浩 王颖 杨明 李泽浩 韩锋
【摘要】 目的 探讨硬化性上皮样纤维肉瘤(SEF) 的临床特点、影像学表现、病理诊断及治疗方法。方法 回顾分析1例颅骨SEF患者的临床资料,并复习相关文献。结果 本例男性患者,40岁,临床表现为头部持续增大包块;头颅CT检查示,左侧顶骨近椭圆形溶骨性病变。行手术切除,术中见肿瘤位于左侧顶枕部,固定于颅骨深面,边界尚清,质韧,向下生长压迫脑组织,相邻硬脑膜有增厚,手术全切病灶和受累硬脑膜。术后病理检查诊断为硬化性上皮样纤维肉瘤。术后随访15个月未见病灶复发。结论 颅骨硬化性上皮样纤维肉瘤较为罕见,易转移、复发,影像学检查误诊率高,病理检查具有重要诊断作用,手术全切病灶,未行放化疗,未见复发迹象。
【关键词】 硬化性上皮样纤维肉瘤;顶骨;颅骨;计算机断层扫描;磁共振成像
【中图分类号】 R739.4 【文献标志码】 B 【文章编号】 1672-7770(2023)02-0208-04
Abstract: Objective To explore the clinical features, imaging findings, pathological diagnosis and treatment of sclerosing epithelioid fibrosarcoma(SEF). Methods The clinical data of a patient with SEF of the skull were analyzed retrospectively, and the related literature were reviewed. Results This male patient, 40 years old, showed continuous enlargement of mass on the head. CT examination of the skull showed that the left parietal bone was a near oval osteolytic lesion. Surgical resection was performed. During the operation, it was found that the tumor was located in the left parietal occipital part, fixed in the deep surface of the skull, with clear boundary and tough quality. It grew downward and compressed the brain tissue, and the adjacent dura was thickened. The lesion and affected dura were completely removed. Postoperative pathological examination showed SEF. No recurrence was found after 15 months of follow-up. Conclusion SEF of the skull is rare, the misdiagnosis rate of imaging examination is high, pathological examination plays an important role in diagnosis, and the effect of surgical resection is good.
Key words: sclerosing epithelioid fibrosarcoma; parietal bone; skull; computed tomography; magnetic resonance imaging
基金项目:贵州省科技计划项目(黔科合LH字[2017]7213号)
作者单位:550025 贵阳,贵州医科大学临床医学院(赵春瑞,李泽浩);贵州医科大学附属医院神经外科(隋建美,杨明,韩锋);贵州省肿瘤医院外科(董世祥,葉浩,王颖)
通信作者:韩锋
硬化性上皮样纤维肉瘤(sclerosing epithelioid fibrosarcoma,SEF) 是1995年由Meis-Kindblom等首次描述,是一种组织病理学表现为低度恶性,但临床上表现为高度恶性的纤维肉瘤,最常发生于四肢、躯干、头颈部软组织,偶见于骨骼和内脏器官[1]。病理学典型特征是致密硬化基质中,上皮样细胞呈巢状和索状排列。此病发病率较低,目前文献报道仅100多例,起源于颅骨的SEF更为罕见,全世界目前报道仅有4例[1]。贵州医科大学附属肿瘤医院于2020年9月27日收治1例颅骨SEF患者并对其临床资料进行回顾性分析,通过结合相关文献复习,探讨颅骨SEF的临床特点及诊断、治疗要点,并增加颅骨起源的SEF样本量,有利于SEF的进一步研究。
1 资料与方法
1.1 一般资料 患者男,40岁,于2020年7月无意中发现左侧顶部肿块,约1.5 cm×1.5 cm大小,触及质地较硬,无疼痛等不适,未予诊治。2个月后自觉肿块较前增大,仍无触痛,且无头痛、头晕,无恶心、呕吐等不适感,为行进一步治疗,于2020年9月27日就诊于贵州医科大学附属肿瘤医院神经外科。查体示,神志清楚,言语流利,对答切题,左侧顶部可触及一个大小约5 cm×4 cm皮下隆起,质硬,活动度差,边界模糊,无压痛,无红肿。双侧瞳孔圆形等大,直径约3 mm,对光反应灵敏,视力、视野未见异常,双侧鼻唇沟对称,无变浅,伸舌居中,颈软,四肢肌力V级,肌张力正常,生理反射存在,病理反射未引出。实验室检查未见异常。既往肺结核病史。无手术史、外伤史、特殊感染史。
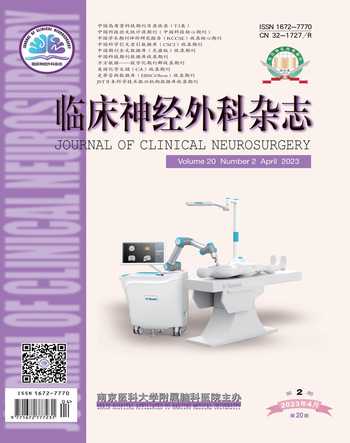
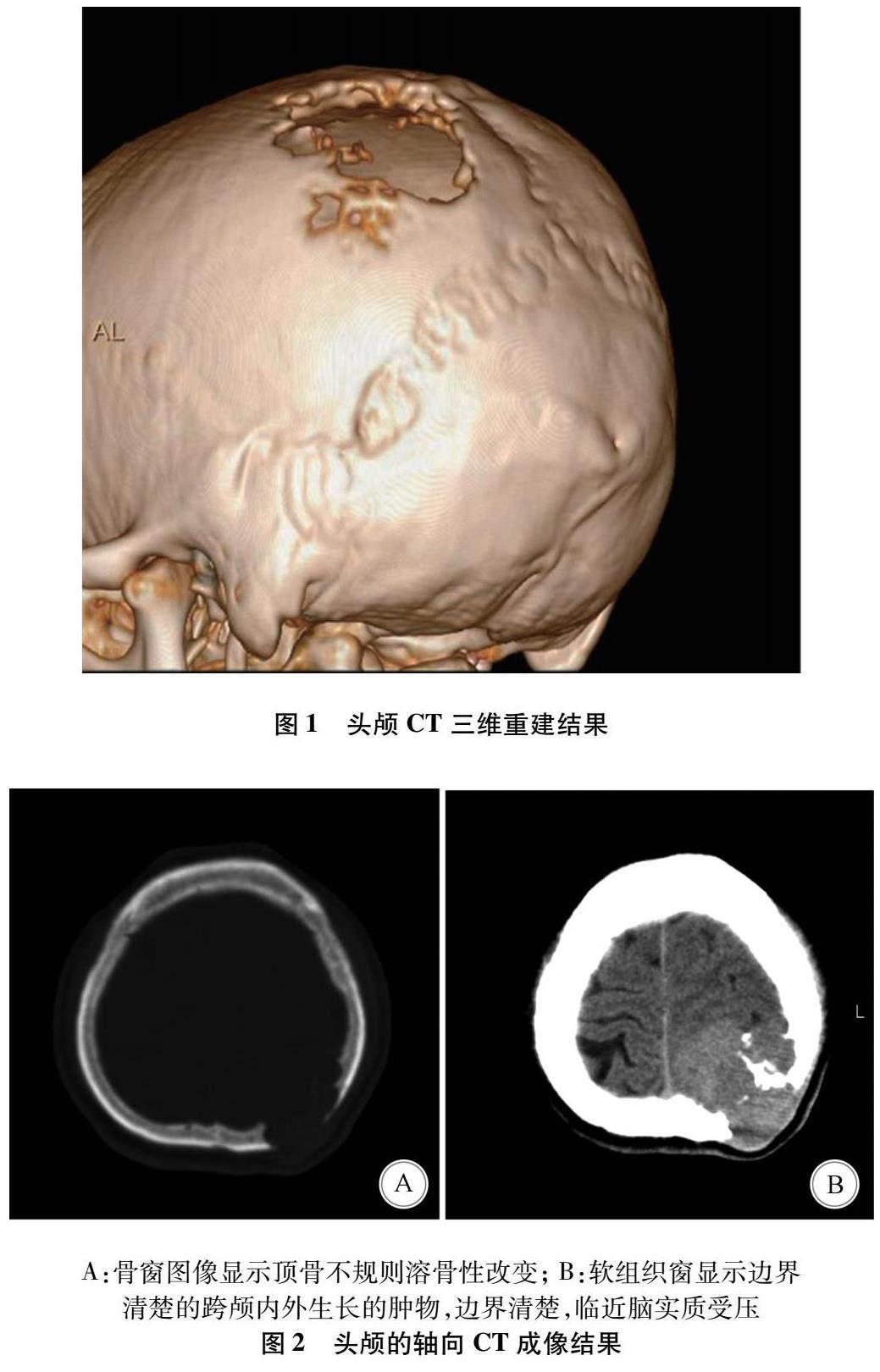
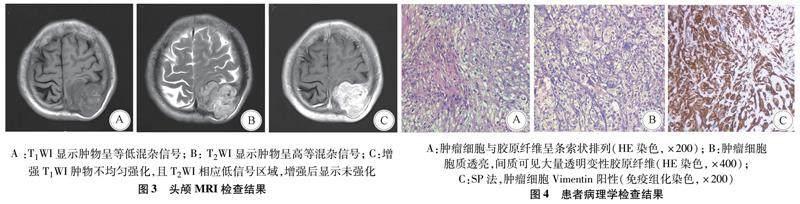
1.2 辅助检查 头颅CT三维重建显示顶骨受侵、溶骨性破坏(图1)。头颅CT可见左侧顶骨近椭圆形溶骨性病变(图2A),边缘不规则,局部软组织肿块,大小约5.1 cm×4.7 cm×5.2 cm,呈不规则分叶状,与周围组织分界清楚,向颅内外生长(图2B)。头颅MRI显示局灶性分叶状肿块,大小约5.3 cm×4.7 cm×4.8 cm,与脑实质分界清晰,T1WI上呈等低混杂信号(图3A),T2WI上呈高等混杂信号(图3B),DWI呈等至稍高信号,ADC为高低混杂信号,病灶内可见多发迂曲留空的血管影,且病灶穿透颅骨伸入帽状腱膜向体表突出。头颅MRI增强扫描肿块呈不均匀明显强化影(图3C)。依据患者病史及实验室、影像学检查,初步考虑为朗格汉斯细胞组织细胞增生症或恶性脑膜瘤。
1.3 手术方法 患者取平卧位,稍向右侧身,暴露左顶部皮肤,沿肿块周围做马蹄形切口,切开皮肤、皮下,可见皮瓣与肿块边界尚清、血供丰富,仔细游离皮瓣并翻向颞侧,见左侧顶枕部颅骨明显隆起,肿瘤由内向外生长,并侵犯破坏颅骨。电钻钻孔,探查见颅骨下硬膜完整,未见肿瘤累及,予铣刀沿计划骨窗依次铣开颅骨,可见肿瘤固定于颅骨深面,与上矢状窦比邻,肿瘤质地较韧,呈灰白色,血供丰富,边界尚清,向下生长压迫脑组织,分块全切后见相邻硬脑膜有增厚、发硬,一并切除送检。
2 结 果
肿瘤组织病理检查示,肿瘤细胞排列成巢状或索状(图4A),部分细胞有一个中央开放区域,中间有明显的胶原带隔开(图4B)。免疫组化示,细胞CK,NSE,S-100,EMA,CK7,HMB45,Melan-A,CGA,Syn,SOX-10,GFAP,SMA,Langerin,CD1a,Olig-2阴性,Vimentin,CD56,CD34阳性,CD68灶状阳性,Ki67总体可达10%,考虑为SEF(图4C)。术后患者拒绝放化疗。经15个月的随访,没有复发或转移征象。
3 讨 论
SEF是一种罕见的、侵袭性成纤维细胞肿瘤,属于纤维肉瘤的一种不易识别但独特的变体[2-4],文献描述目前仅有100余例,男女比例为1.4∶1[5]。肿瘤好发于深部肌肉,邻近筋膜或骨膜,最常见于下肢和躯干部位,其次为上肢和头颈部,偶尔也发生在骨骼和内脏器官,其中原发于颅骨的非常罕见,侵犯颅骨的肿瘤均无脑膜瘤的组织学特征,故推测其起源很可能来自异常的软组织或硬脑膜本身[2,6-7]。发病的中位年龄为44.6岁,其中56%患者年龄在50岁以下[4]。肿物生长较缓慢,三分之一的患者以发现渐进性增大包块和疼痛为首发表现[6]。从首次症状出现至确诊时间平均为33个月(1个月~13年)。确诊后,在平均36个月内,约36%患者出现局部复发,约83%患者出现远处转移,远处转移最常见的部位是肺,其次是骨骼和胸膜、胸壁[6]。SEF的病死率为25%~57%[2],就部位而言,头颈部SEF病死率为46%[6],只有约三分之一的患者可以带病存活。本例患者40岁发病,病程进展较快,肿瘤从1.5 cm增长至5 cm仅2个月时间,但无明显头痛及其他神经症状,其肿瘤速度增长较快,考虑与肿瘤位置表浅易于发现,或其侵犯颅骨有关。
SEF一般较大,平均7~10 cm,病灶通常分界清楚,大多数为灰白色,小部分呈棕色。质地坚硬,部分有弹性,但也有少数质地较软,或呈粘液性。大部分肿瘤肉眼下表现为隆起状、分叶状、螺纹状或多结节状。少数表现为囊性或伴有钙化[2,8]。
SEF在低倍镜下细胞异形性相对较低,可呈现明显的薄膜化。高倍镜下表现,在致密的纤维基质中,胞质透亮的上皮细胞呈巢状、索状排列,其生长模式呈浸润性,高度提示为癌,并且伴随硬化特征,此为该肿瘤具有的特征性光镜表现[5,9-10]。肿瘤的细胞核可呈圆形、椭圆形和梭形,核仁较小而嗜碱性,有丝分裂活性通常较低,因其细胞核呈不同角度,可出现退缩伪影,核染色质花纹细小,呈泡状。肿瘤间质内含有大量的伊红染、透明变性的胶原纤维,与骨样物质难以区分[5,8-9],偶有微小纤维瘤或低级别纤维粘液样肉瘤样区域,少数病例有软骨及骨分化。超微结构研究证实,SEF细胞核和细胞质总体上表现出成纤维细胞和肌成纤维细胞的特征。细胞质轮廓光滑,通常含有丰富的粗面内质网和波形中间丝的细胞质阵列,有少量线粒体、脂滴、溶酶体和一些中间丝及张力原纤维。
在免疫组织化学分析中,波形蛋白是唯一持续呈阳性的免疫染色标记物,但它是软组织肉瘤的通用标记物,因此对SEF没有特异性,在其他病例中也可见MUC4、EMA、CAM5.2、CD99、bcl-2陽性,而keratin、CD45、CD20、CD3、CD34、S-100 protein、SMA、desmin基本阴性[6,11]。在FISH检测(荧光原位杂交)中,大多数病例出现了EWSR1-CREB3L1基因融合[7]。故Eyden 等提出了SEF诊断标准:(1)瘤细胞由小到中等大小的圆形、卵圆形或多边形的上皮样细胞组成,肿瘤细胞胞质透亮,细胞排列成条索状、巢状、片状或腺泡状;(2)间质内可见大量的伊红染、透明变性的胶原纤维;(3)电镜下肿瘤细胞内含丰富的粗面内质网、高尔基复合体,并出现胶原分泌颗粒;(4)免疫组化vimentin阳性,其他抗体标记物均阴性[9,12]。SEF的鉴别诊断包括一系列相关的疾病,良性肿瘤包括硬纤维瘤、纤维组织细胞瘤、透明变性的平滑肌瘤、孤立性纤维性肿瘤;恶性肿瘤包括转移性癌、印戒细胞癌、单向分化的滑膜肉瘤、上皮样肉瘤、上皮样平滑肌肉瘤、恶性周围性神经鞘膜瘤、横纹肌肉瘤、透明细胞肉瘤、黏液样软骨肉瘤、恶性黑色素瘤和硬化性淋巴瘤等。
SEF因其细胞密度低、核异型性少,伴有致密硬化的透明基质,易让人认为其恶性程度较低,但随着报道病例越来越多,现在大多数学者认为SEF在临床上具有高度侵袭性[13-15],在其转移率及生存率上可以体现出来。据Ossendorf等的荟萃分析,SEF的局部复发率为40%,67%的局部复发者有远处转移,83%的患者在确诊后平均36个月出现远处转移。远处转移最常见的部位是肺,其次是骨和胸膜、胸壁,少数出现头皮、淋巴、乳房、肝脏转移,并且有多部位转移患者,且远处转移与肿瘤大小无关[6]。其统计不同年龄组死亡率在50%~60%。而在Chew等[4]的报道中,确诊后的中位总生存期为47.3个月,30%患者1年内去世,50%患者可达到3年。
到目前为止,只有4例颅骨SEF病例的相关报导,本例为第5例。本研究的病例,在其临床过程方面,病程相对较短,头部包块增长较快,从直径1.5 cm增长至5 cm仅用2个月时间。术中见肿瘤组织同样为隆起状,边界尚清,质韧,切开可见肿瘤呈灰白色,血供丰富。病理检查示,肿瘤细胞与胶原纤维呈条索状排列,胞质透亮,间质可见大量透明变性胶原纤维。SP法,肿瘤细胞Vimentin阳性,CD56,CD34阳性,CD68灶状阳性;遗憾的是,患者因个人原因拒绝进一步行基因检测。相较于其他病例,本研究的病例有完整的影像学资料;其头颅CT示跨颅内外生长的肿物,伴有明显的溶骨性骨破坏。MRI显示肿瘤内部信号不均匀,T1WI上呈等低混杂信号,T2WI上呈高等混杂信号,增强扫描呈不均匀明显强化影,其T2WI的低信号区域增强后无强化,可能为肿瘤内部的纤维组织或胶原成分,或者是肿瘤内部的坏死。这些特征可以提示肿瘤的恶性生物学行为,并为SEF的诊断提供线索或特征。
虽然影像学可以提供与SEF相关的特征性信息,但颅骨SEF的诊断仍具有挑战性,需要与其他疾病相鉴别。(1)恶性脑膜瘤:恶性脑膜瘤好发于大脑凸面和矢状窦旁,其肿瘤生长快,多向四周脑内侵入,使周围脑组织胶质增生,颅骨易受侵犯。临床表现上癫痫、头痛、偏瘫等神经系统损害症状较易出现。其CT表现为肿瘤周围水肿明显,没有钙化。MRI的T1WI和T2WI肿瘤都为高信号,而SEF在T1WI上显示为低信号,T2WI上显示为高等混杂信号,此可作为一个鉴别点。(2)朗格汉斯细胞组织细胞增多症:好发于青年人,70%患者年龄<20岁。好发于顶骨、额骨,肿瘤渐进性增大,可伴有压痛。颅骨X线示骨质溶骨性破坏。头颅CT上常呈类圆形、不规则状穿凿样骨缺损,境界清楚,边缘一般无骨质硬化和骨膜反应,破坏以板障为中心,同时累及内外板,内外板破坏不完全时,破坏区出现“纽扣征”。头颅MRI上T1WI呈等信号或低信号,在T2WI呈较高信号。增强扫描示,早期病灶强化不明显,随病程进展,病灶逐渐呈环状或分割状不均匀强化。SEF的MRI强化呈不均匀明显强化影,此有助于两者相鉴别。但两者如无典型影像学表现,往往最终依赖病理檢查才能确诊。(3)颅骨转移瘤:主要来源于肺癌、乳腺癌、宫颈癌、前列腺癌等。开始在颅骨上有一个或数个小肿块,生长迅速,肿块长大时伴有疼痛,质地较硬,基底宽。各种类型转移瘤表现与原发癌关系密切,不尽相同,如黑色素瘤局部呈青紫色,甲状腺癌转移瘤血运丰富,可见头皮血管迂曲怒张及听到血管杂音,触之波动感。成骨细胞型转移瘤,头颅X线表现为局部骨硬化,呈高密度影;破骨细胞型,头颅X线表现为颅骨破坏,界限不清,周围无硬化带。典型的颅骨转移瘤MRI示,局灶性溶骨性病灶呈长T1、长T2信号,成骨性或混合性病灶呈长T1、短或混杂T2信号,可侵及颅骨内外板以及脑膜,呈新月状或双凸形影,增强后强化明显;较小的病灶则位于板障内,呈膨胀性生长。对于原发肿瘤已确诊患者,结合影像学检查,诊断并不困难,对于未发现原发肿瘤患者,多需行病理检查才能确诊。(4)颅骨软骨肉瘤:主要位于颅底,多见于成人及老年人,病情进展缓慢。组织学上,肿瘤成分为分化程度不同的瘤软骨细胞,常含钙化及瘤骨。X线示中心型表现为轻度膨胀,多叶型溶骨性病灶,伴散在条状钙化影;外周型表现为软骨帽增厚,伴散在钙化。CT示中央型为骨髓腔内高低混合密度病灶;外周型病灶有蒂与相应骨皮质相连;强化CT可见肿瘤周边强化。MRI示T1WI呈等或低信号;T2WI低恶性者为分叶状均匀一致高信号;高度恶性者为不均匀等信号。低恶性者与SEF鉴别相对容易,而高度恶性者,往往需要病理学检查明确诊断。其他与之相鉴别的颅骨肿物包括:骨肉瘤、浆细胞瘤、软骨肉瘤、恶性纤维组织细胞瘤等[1,16-17]。
在治疗上,SEF对放化疗敏感性较差,大多数患者受益有限[4,18],经放化疗后患者生存期无明显延长,因此SEF被认为是低度恶性纤维肉瘤家族中最恶性的变异[6,19-22],其首选治疗方案以手术切除为主[6]。本研究患者的肿瘤达到R0级切除,连同增厚、硬化的硬脑膜一并切除送检,术后患者虽拒绝了放化疗,但随诊观察15个月,无复发及转移征象。据报道,同样有1例患者肿瘤R0级切除,在最初诊断后105个月没有复发及转移迹象,生存周期比肿瘤R1级及以上的切除后行放化疗的患者长[4]。因此,鉴于SEF对于放化疗的敏感性有限,早期发现,肿瘤及时地扩大切除,可能已达治疗目的,即使术后进一步行放化疗,也无证据表明可延长患者生命周期。所以SEF术后局部复发率及转移率较高,是否与术区有肿瘤局部残留有关;病灶扩大切除是否能降低复发及转移率;是否能找到有针对性的放化疗或者靶向治疗方案来阻止肿瘤的远处转移,延长患者生存期,这些问题,应通过多机构的合作,收集大量患者治疗方案及随诊结果,以寻求对SEF的进一步了解,以期确定新的治疗方案,优化目前的外科、放射和药物治疗方式。
[参 考 文 献]
[1]Xu JJ,Wang JW,Zhang MM,et al.Skull sclerosing epithelioid fibrosarcoma:a case report and review of the literature[J].Oncol Lett,2016,11(5):3417-3420.
[2]Antonescu CR,Rosenblum MK,Pereira P,et al.Sclerosing epithelioid fibrosarcoma:a study of 16 cases and confirmation of a clinicopathologically distinct tumor[J].Am J Surg Pathol,2001,25(6):699-709.
[3]Yahyaoui M,Benhammou M,Aharram S,et al.Sclerosing epithelioid fibrosarcoma:rare and serious[J].Pan Afr Med J,2020,36(6):131.
[4]Chew W,Benson C,Thway K,et al.Clinical characteristics and efficacy of chemotherapy in sclerosing epithelioid fibrosarcoma[J].Med Oncol,2018,35(11):138.
[5]Warmke LM,Meis JM.Sclerosing epithelioid fibrosarcoma:a distinct sarcoma with aggressive features[J].Am J Surg Pathol,2021,45(3):317-328.
[6]Ossendorf C,Studer GM,Bode B,et al.Sclerosing epithelioid fibrosarcoma:case presentation and a systematic review[J].Clin Orthop Relat Res,2008,466(6):1485-1491.
[7]Tsuda Y,Dickson BC,Dry SM,et al.Clinical and molecular characterization of primary sclerosing epithelioid fibrosarcoma of bone and review of the literature[J].Genes Chromosomes Cancer,2020,59(4):217-224.
[8]Peng Y,Chen T,Zhang D,et al.Primary sclerosing epithelioid fibrosarcoma of the kidney: a case report and review of the literature[J].Int J Surg Pathol,2021.DOI:10.1177/10668969211065107.
[9]Eyden BP,Manson C,Banerjee SS,et al.Sclerosing epithelioid fibrosarcoma:a study of five cases emphasizing diagnostic criteria[J].Histopathology,1998,33(4):354-360.
[10]Porteus C,Gan Q,Gong Y,et al. Sclerosing epithelioid fibrosarcoma: cytologic characterization with histologic, immunohistologic, molecular, and clinical correlation of 8 cases[J].J Am Soc Cytopathol,2020,9(6):513-519.
[11]Murshed KA,Al-Bozom I,Ammar A.Sclerosing epithelioid fibrosarcoma:in-depth review of a genetically heterogeneous tumor[J].APMIS,2021,129(8):455-460.
[12]Kosemehmetoglu K,Ardic F,Kilpatrick SE,et al.Sclerosing epithelioid fibrosarcoma of bone:morphological, immunophenotypical, and molecular findings of 9 cases[J].Virchows Arch,2021,478(4):767-777.
[13]Righi A,Pacheco M,Pipola V, et al.Primary sclerosing epithelioid fibrosarcoma of the spine:a single-institution experience[J].Histopathology,2021,78(7):976-986.
[14]Grunewald TGP,von Luettichau I,Weirich G,et al.Sclerosing epithelioid fibrosarcoma of the bone: a case report of high resistance to chemotherapy and a survey of the literature[J].Sarcoma,2010,2010(4):431627.
[15]Bai ST,Jhala N,Adsay NV,et al.Sclerosing epithelioid fibrosarcoma of the pancreas[J].Ann Diagn Pathol,2013,17(2):214-216.
[16]Mitsuya K,Nakasu Y,Horiguchi S,et al.Metastatic skull tumors:MRI features and a new conventional classification[J].J Neurooncol,2011,104(1):239-245.
[17]Gangadhar K,Santhosh D.Radiopathological evaluation of primary malignant skull tumors:a review[J].Clin Neurol Neurosurg,2012,114(7):833-839.
[18]Judson I,Verweij J,Gelderblom H,et al.Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first-line treatment of advanced or metastatic soft-tissue sarcoma:a randomised controlled phase 3 trial[J].Lancet Oncol,2014,15(4):415-423.
[19]Popli A,Mahajan R,Rustagi T,et al.Sclerosing epithelioid fibrosarcoma of the coccyx:a case report and review of literature[J].Cureus,2018,10(4):e2407.
[20]Folpe AL,Lane KL,Paull G,et al.Low-grade fibromyxoid sarcoma and hyalinizing spindle cell tumor with giant rosettes:a clinicopathologic study of 73 cases supporting their identity and assessing the impact of high-grade areas[J].Am J Surg Pathol,2000,24(10):1353-1360.
[21]Liu HT,Zhang YH,Song J,et al.Sclerosing epithelioid fibrosarcoma of the lumbar spine:a case report and review of the literature[J].Br J Neurosurg,2019.DOI: 10.1080/02688697.2019.1670332.
[22]Savvidou OD,Korkolopoulou P,Tsifountoudis I,et al.Giant sclerosing epithelioid fibrosarcoma of the thigh: a case report[J].JBJS Case Connect,2021.DOI:10.2106/JBJS.CC.20.00575.
(收稿2021-10-11 修回2021-12-29)