电离辐射对幼鼠小脑和前额叶皮质发育的影响
王洋洋 刘元朵 刘莲
摘 要:为探讨X 射线对幼鼠小脑和前额叶皮质发育的影响,照射组小鼠于出生后( postanal day,PD) 3 天进行2 Gy (2 Gy/ min) 剂量的全身X 射线照射,分别于照射后7、21 和90 天( PD 3+7、PD 3+21、PD 3+90) 采集脑样本进行不同的实验研究。苏木素-伊红( Hematoxylin-eosin, HE) 染色检测脑组织病理形态变化,免疫组织化学检测IBa1 和GFAP 蛋白表达,Western Blotting 检测IL-1β 和TNF-α 蛋白表达。结果表明,照射组小脑及前额叶皮质炎性细胞浸润,外颗粒层厚度变窄,浦肯野细胞向内颗粒层迁移,小脑部分细胞丢失。与对照组比较,照射后21天小脑IBa1 阳性细胞数增加( p<0. 05) ,照射后7 天 GFAP 阳性细胞数减少( p<0. 05) 。前额叶皮质中IBa1 阳性细胞在照射后数量持续增加( p<0. 05,p<0. 01) ,GFAP 阳性细胞数量持续减少( p<0. 01) 。照射后90 天,小鼠小脑和前额叶皮质中IL-1β 蛋白表达均增加( p<0. 05) ,而TNF-α 表达无改变。结果证实幼年小鼠2 Gy X 射线照射可引起小鼠小脑颗粒细胞层、分子层、浦肯野细胞层产生连续性病理改变,前额叶皮质出现炎性细胞聚集,前额叶皮质和小脑小胶质细胞数量增加,星形胶质细胞数量减少,炎症因子主要是IL-1β。
关键词:电离辐射;小脑;前额叶皮质;胶质细胞;神经炎症
中图分类号:R818 文献标识码:A
近年来随着电离辐射在工业及医疗领域的广泛应用,辐射暴露的风险在增大。电离辐射对机体的影响是全身性的[1-3] ,以造血系统[4] 、神经系统[5-7] 的改变最为明显。
辐射对神经系统产生影响的两个组成部分为辐射发生的时间及辐射剂量,中枢神经系统经过辐射损伤后会导致大脑环境持续改变(包括脑血管、神经胶质细胞群的结构和功能改变以及认知障碍),其中炎症起着至关重要的作用[8] 。辐射后引起的神经炎症与脑损伤和认知障碍有关[9-10] ,研究表明,电离辐射诱导神经炎症的认知能力下降涉及多种神经细胞类型的损伤,其中小胶质细胞和星形胶质细胞在神经炎症的发生和发展中發挥着关键作用,它们通过活化启动、响应炎症级联反应[11-12] ,促进进行性神经损伤。
未发育成熟的大脑比成熟的大脑辐射敏感性更高,幼年期照射可显著减少神经发生、脑血管内皮细胞发生以及产生认知障碍[13-14] 。已经有研究表明,幼年时期辐射引发成年动物认知损伤[14-15] ,而这些研究多集中于海马区域[15-17] ,目前关于电离辐射对幼年期小脑和前额叶皮质发育及胶质细胞的影响的报道较少。在本研究中,我们使用幼年期小鼠建立电离辐射损伤模型,探究X 射线对幼年期小鼠前额叶皮质及小脑胶质细胞及炎症因子的影响。
1 材料与方法
1. 1 仪器及试剂
医用电子直线加速器( Precise TreatmentSystem; Elekta, Crawley, United Kingdom ),CM1950 冷冻切片机(Leica,德 国),DM4B 显微镜(Leica, 德国), GelDoc XR 凝胶成像系统( BIO-RAD,美国), 全波长酶标仪( Thermo, 美国),BBY24 M 全自动组织破碎仪(NESTADVANCE,美国),ML - 204 电子分析天平( Mettler Toledo, 美国),涡旋混合器(金坛市医疗仪器厂,中国),电热恒温干燥箱(上海新苗医疗器械制造有限公司,中国),β-actin 抗体(博奥森,中国),兔源 GFAP 单克隆抗体(Abcam,英国),兔源 IBa1 单克隆抗体(Abcam,英国),鼠源 IL - 1β 单克隆抗体( 美国CST 公司),兔源 TNF-α 单克隆抗体(英国 Abcam公司),羊抗鼠抗体(Invitrogen,美国),羊抗兔抗体(Jackson, 美国), ABC 试剂盒、DAB 试剂盒(Vector,美国),RIPA 裂解液、PMSF(大连美仑生物技术有限公司,中国),BCA 蛋白浓度测定试剂盒(碧云天生物技术有限公司,中国),磷酸酶抑制剂(普利莱基因技术有限公司,中国)。
1. 2 方法
1. 2. 1 实验动物及分组
SPF 级8 周C57BL/ 6J 小鼠(北京市实验动物研究中心, 动物合格证号: SCXK ( 京) 2016 -0006),雌鼠25 只,雄鼠5 只,适应性喂养 1 周后,随机按雌雄比 2 ∶ 1 合笼,幼鼠出生后第一天记为产后1 天(postanal day; PD 1),将动物随机分为对照组和照射组(每组小鼠来自 4 ~ 5 只不同的孕鼠)。实验经过长江大学伦理委员会审核,均遵守实验动物饲养和使用原则。
1. 2. 2 照射条件
使用电子直线加速器( Precise TreatmentSystem; Elekta, Crawley, United Kingdom) 对产后3 天(postanal day 3,PD 3)的小鼠进行2 Gy(照射时间:1 min,剂量率:2 Gy/ min)全身X 射线照射,距离100 cm。
1. 2. 3 病理组织学
分别于照射后7、21、90 天,腹腔注射戊巴比妥麻醉后4%中性甲醛灌注,收集小鼠标本。将脑组织从正中线分开,每只小鼠的右侧半脑在4%的多聚甲醛中4 ℃ 固定过夜,乙醇二甲苯梯度脱水,再进行石蜡包埋,以5 μm 切片,将切片进行常规HE 染色,观察照射后脑组织病理学改变。
1. 2. 4 免疫组织化学染色
将小鼠大脑呈矢状面切开,左侧半脑浸泡于4%中性甲醛中固定过夜,24 h 后转入30%蔗糖溶液。待组织沉底后,以40 μm 进行冰冻切片,将切好的组织切片用画笔移入12 孔板,分别加入30%的双氧水,室温 30 min,PBST 洗涤,血清封闭室温震荡孵育2 h,加入 GFAP 抗体( 1 ∶1 000)、 IBa1 抗体(1 ∶ 1 000),4 ℃ 摇床过夜,PBST 洗涤,二抗室温孵育1 h,PBST 洗涤,加入AB 液孵育 30 min,DAB 显色,苏木素复染,脱水,透明,封片。
1. 2. 5 Western Blot 实验检测小脑和前额叶皮质中IL-1β、TNF-α 含量
处死小鼠后迅速剥离小脑和前额叶皮质,取小脑和前额叶皮质准确称重并加入 RIPA 蛋白裂解液在组织破碎仪中破碎,破碎完成后在冰上静置裂解 30 min,14 000 rpm 离心10 min 取蛋白上清。蛋白定量变性后进行常规电泳,转膜,封闭后分别加入 IL-1β (1 ∶ 500) 、TNF-α(1 ∶ 1 000)和β-actin(1 ∶ 10 000)抗体,4 ℃ 过夜,TBST 洗涤,加入相应的辣根过氧化物酶标记二抗, 室温40 min,TBST 洗涤,化学发光显色。
1. 3 图像分析和统计学方法
免疫组化图片使用Image-pro plus 6. 0 软件,小鼠小脑结构和大脑皮层结构的连续切片用于定量分析。免疫组化实验中每个标本检测 6 ~ 9 张切片,检测区域包括小脑I~ III 叶(外颗粒细胞层、浦肯野细胞层、内颗粒细胞层)、大脑皮层前额叶皮质区,高倍视野下进行阳性细胞计数,计算平均阳性细胞数。WB 蛋白条带使用 Image J 软件进行灰度分析。
所有数据使用Prism 6 软件统计分析,计量资料以均值± 单次测量标准差表示, 组间采用Students T 检验、ANOVA 检验进行分析,p <0. 05为差异具有统计学意义。
2 结果
2. 1 X 射线照射对小鼠小脑组织形态的影响
2. 1. 1 X 射线照射对小鼠小脑颗粒层细胞的影响
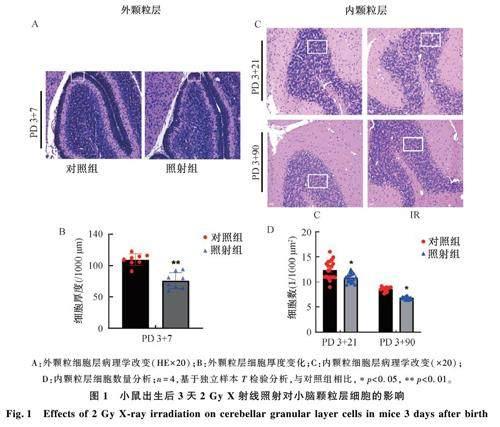
图1 为X 射线照射后使用 HE 染色小鼠小脑颗粒层细胞病理形态学的变化。由图1 可见,光镜下观察到对照组小脑颗粒层细胞饱满,形态完整,排列层次有序。与对照组相比,照射组小鼠小脑在PD 3 + 7 可见外颗粒层( external granularlayer, EGL)细胞厚度变窄(图1A、B),幼鼠发育过程中EGL 细胞于21 天后消失。在PD 3+21 和PD3+90 小脑内颗粒层(internal granular layer,IGL)与对照组相比,照射组小鼠IGL 细胞数量减少、排列松散混乱(图1C、D)。
2. 1. 2 X 射线照射对小鼠小脑浦肯野细胞的影响
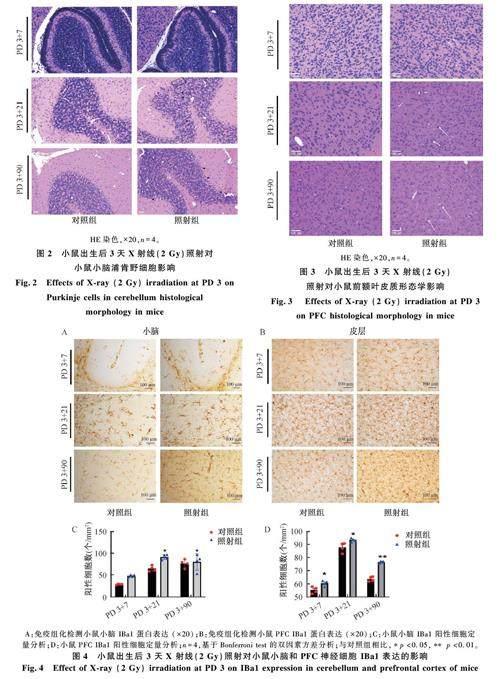
图2 为X 射线照后小鼠小脑浦肯野细胞的病理学图片。如图2 所示,光镜下观察到对照组小脑浦肯野细胞饱满,形态完整,核大而圆、透明、核仁明显清晰,边缘规整,各个时间点上生长发育过程连续。与对照组相比,照射组小鼠小脑在PD3+7、PD 3+21、PD 3+90 细胞界限不清、排列紊乱,在PD 3+21、PD 3+90 可见浦肯野细胞向IGL 迁移(见黑色箭头)、细胞丢失(见方框);且部分细胞收缩呈三角形或不规则形, 空泡化加剧, 胞质深染。
2. 2 X 射线照射对小鼠前额叶皮质形态的影响
使用HE 染色评估小鼠前额叶皮质(prefrontalcortex, PFC) 细胞病理形态学,结果如图3 所示。
由图3 可见,光镜下观察到对照组PFC 细胞饱满、形态完整,排列层次有序,各个时间点上生长发育过程连续。与对照组相比,照射组细胞排列稀疏,深嗜碱性皱缩,边缘锯齿状,形态不规则,核固缩或溶解,可见病理性改变炎性细胞浸润( 见白色箭头)。
2. 3 X 射线照射对小鼠脑组织胶质细胞的影响
2. 3. 1 X 射线照射对小鼠小胶质细胞的影响
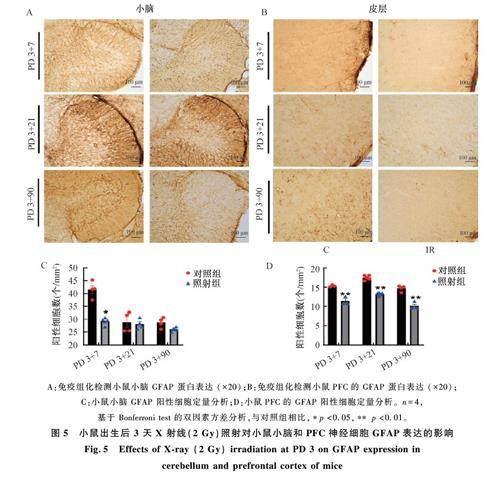
图4 为小鼠出生后 3 天X 射线(2 Gy)照射对小鼠小脑小胶质细胞表达的影响。如图4A 所示,与对照组相比,照射组小鼠小脑小胶质标志性蛋白IBa1 细胞数量在PD 3+21 增加(p <0. 05),在PD 3+90 恢复正常。如图4B 所示,与对照组相比,照射组小鼠PFC 小胶质细胞数量在照射后各时间点均增加(p<0. 05, p<0. 01)。结果说明幼鼠出生后X 射线照射早期诱导增加小脑小胶质细胞数量,而PFC 小胶质细胞在照射后持续增加至成年。
2. 3. 2 X 射线照射对小鼠星形胶质细胞的影响
图5 为小鼠出生后 3 天X 射线(2 Gy)照射对小鼠小脑星形胶质细胞表达的影响。如图5A 所示,与对照组相比,PD 3+7 照射组小鼠小脑星形胶质细胞标志蛋白 GFAP 数量减少(p<0. 05),PD3+21 和PD 3+90 數量没变化。如图5B 所示,与对照组相比,照射组小鼠PFC 的 GFAP 蛋白在照射后各时间点均降低(p<0. 01)。结果说明幼鼠出生后照射早期降低小鼠小脑星形胶质细胞数量,PFC 区星形胶质细胞数量持续降低至成年。
2. 4 X 射线照射对成年小鼠炎症相关蛋白表达的影响
图6 为 2 Gy X 射线对成年小鼠炎症相关蛋白表达的影响。如图6 所示,通过检测成年小鼠小脑和PFC 的IL-1β、TNF-α 蛋白表达,发现在小脑及PFC 中IL-1β 表达增加(p <0. 05),而TNF-α无明显改变。
3 讨论
小脑和前额叶皮质的发育是一个长期的过程。小脑发育在产前和产后早期,EGL 中干/ 祖细胞在PD 15 时达到峰值,在PD 24 消失,EGL 是幼年期小鼠神经发育的主要区域[18] ;PFC 的发育从产前持续至成年,幼年期是PFC 认知功能发展最重要的时期[19] 。因此,在发育期的小脑和皮层经历了较长时间的生长,特别容易受到不良因素的损伤。在幼鼠出生后3 天予以2 Gy X 射线全身照射后,其小脑颗粒层细胞数量降低至成年。浦肯野细胞是GABA 能神经和细胞,是小脑和皮层的主要神经元,具有延伸到分子层的精细树突状结构[18] 。本研究结果发现,幼年小鼠受照后浦肯野细胞向IGL 迁移,且部分细胞丢失,浦肯野细胞分支收缩呈深紫色的圆形或类圆形,这种改变持续至成年;在前额叶皮质中观察到细胞收缩呈深紫色的圆形或类圆形。以上结果均提示在幼年期小鼠受到照射后,小鼠小脑和皮层出现炎症反应,在其发育过程中的病理学损伤是一个不可逆的反应。
小膠质细胞和星形胶质细胞在辐射所致的脑损伤中起重要作用,其数量增加是辐射诱导神经炎症变化的特征[20-21] 。不同于成年小鼠,幼年小鼠大脑在受到损伤后 6 h 内小胶质细胞数量增加,而在 1 周后小胶质细胞数量下降至低于正常水平,其原因是辐射导致的小胶质细胞直接性死亡[22-23] 。也有研究发现,IBa1 阳性细胞在早期增多,48 h 后出现下降,而21 天增多达到高峰,随后出现下降[24] 。在本研究中。IBa1 蛋白在前额叶皮质中持续增加,在小脑中仅在照射后21 天增加,提示辐射激活小鼠小脑和前额叶皮质小胶质细胞,前额叶皮质小胶质细胞反应更为明显。有证据表明辐射早期24 ~ 48 h 星形胶质细胞GFAP会快速增高,在1 周左右出现下降,4 周左右恢复至正常水平[24] 。本研究中,在照射后7 天小鼠小脑中的GFAP 阳性细胞降低,在PD 3+21 时数量恢复正常,与上述结果一致。在大剂量照射早期皮层GFAP 的阳性表达增高[25-26] ,在电磁辐射早期PFC 中GFAP 阳性细胞表达增加而后会逐渐降低[26-27] ,本实验中小鼠前额叶皮质的GFAP 阳性细胞照射后持续降低至成年。小胶质细胞和星形胶质细胞的激活在退行性疾病中存在交互作用[12] ,而在本研究中IBa1 表达持续增加与GFAP的持续性降低,推测可能是因为辐射导致的炎症激活小胶质细胞,一方面炎症持续刺激损伤星型胶质细胞诱发其数量减少,一方面可能是因为炎症刺激引起星型胶质细胞保护性减少以缓解神经炎症损伤。其具体机制还有待我们进一步研究。
辐射产生的神经炎症会导致胶质细胞的活化并诱导炎症介质的分泌, 如IL - 1β、TNF - α 和IFN-γ 等[28-30] 。为了进一步验证神经炎症的存在,我们检测了成年小鼠小脑和前额叶皮质中IL-1β 和TNF-α 蛋白表达,结果表明照射后小脑和前额叶皮质中IL-1β 蛋白表达在成年后仍高于对照组,TNF-α 蛋白表达无明显改变。研究提示,辐射诱导的神经炎症因子以IL-1β 为主。
综上,得出以下结论,幼年小鼠X 射线照射可引起小鼠小脑颗粒细胞层、分子层、浦肯野细胞层产生连续性病理改变,前额叶皮质出现炎性细胞聚集;增加前额叶皮质和小脑小胶质细胞数量,减少其星形胶质细胞数量,炎症因子主要是IL-1β。
后期研究需要我们通过多标志蛋白观察胶质细胞的激活及极化改变,以便深层次了解两种胶质细胞在辐射所致前额叶皮质中的相互作用,为更全面了解辐射所致脑损伤机制。
参考文献:
[ 1 ] HAVRNKOV R. Biological effects of ionizing radiation [J]. Cas Lek Cesk, 2020, 159(7-8): 258-260.
[ 2 ] Pasqual E, Bosch De Basea M, LPez-Vicente M, et al. Neurodevelopmental effects of low dose ionizing radiation exposure: A systematic review of the epidemiological evidence [J]. Environ Int, 2020, 136: 105371.
[ 3 ] Tapio S, Little M P, Kaiser J C, et al. Ionizing radiation-induced circulatory and metabolic diseases [J]. Environ Int,2021, 146: 106235.
[ 4 ] Lumniczky K, Impens N, Armengol G, et al. Low dose ionizing radiation effects on the immune system [J]. Environ Int,2021, 149: 106212.
[ 5 ] Limbad C, Oron T R, Alimirah F, et al. Astrocyte senescence promotes glutamate toxicity in cortical neurons [J]. PloS ONE, 2020, 15(1): e0227887.
[ 6 ] DENG Z, HUANG H, WU X, et al. Distinct expression of various angiogenesis factors in mice brain after whole-brain irradiation by X-ray [J]. Neurochem Res, 2017, 42(2): 625-633.
[ 7 ] Gorbunov N V, Kiang J G. Brain damage and patterns of neurovascular disorder after ionizing irradiation. complications in radiotherapy and radiation combined injury [J]. Radiat Res, 2021, 196(1):1-16.
[ 8 ] Ramanan S, Kooshki M, Zhao W, et al. PPARalpha ligands inhibit radiation-induced microglial inflammatory responses by negatively regulating NF-kappaB and AP-1 pathways [J]. Free Radic Biol Med, 2008, 45(12): 1695-1704.
[ 9 ] DING Z, ZHANG H, LV X F, et al. Radiation-induced brain structural and functional abnormalities in presymptomatic phase and outcome prediction [J]. Hum Brain Mapp, 2018, 39(1): 407-427.
[10] Hladik D, Tapio S. Effects of ionizing radiation on the mammalian brain [J]. Mutat Res Rev Mutat Res, 2016, 770(PtB): 219-230.
[11] WANG Q Q, YIN G, HUANG J R, et al. Ionizing radiation-induced brain cell aging and the potential underlying molecular mechanisms [J]. Cells, 2021, 10(12):3570.
[12] Kwon H S, Koh S H. Neuroinflammation in neurodegenerative disorders: the roles of microglia and astrocytes [J]. Transl Neurodegener, 2020, 9(1): 42.
[13] Tang F R, Loke W K, Khoo B C. Postnatal irradiation-induced hippocampal neuropathology, cognitive impairment and aging [J]. Brain Dev, 2017, 39(4): 277-293.
[14] Eriksson P, Buratovic S, Fredriksson A, et al. Neonatal exposure to whole body ionizing radiation induces adult neurobehavioural defects: Critical period, dose—Response effects and strain and sex comparison [J]. Behav Brain Res,2016, 304: 11-19.
[15] Buratovic S, Stenerlow B, Fredriksson A, et al. Neonatal exposure to a moderate dose of ionizing radiation causes behavioural defects and altered levels of tau protein in mice [J]. Neurotoxicology, 2014, 45: 48-55.
[16] Gupta M, Mishra S K, Kumar B S, et al. Early detection of whole body radiation induced microstructural and neuroinflammatory changes in hippocampus: A diffusion tensor imaging and gene expression study [J]. J Neurosci Res,2017, 95(4): 1067-1078.
[17] WANG G, REN X, YAN H, et al. Neuroprotective effects of umbilical cord-derived mesenchymal stem cells on radiationinduced brain injury in mice [J]. Ann Clin Lab Sci, 2020, 50(1): 57-64.
[18] Marzban H, Del Bigio M R, Alizadeh J, et al. Cellular commitment in the developing cerebellum [ J]. Front Cell Neurosci, 2014, 8: 450.
[19] Le Merre P, Ahrlund-richter S, Carlen M. The mouse prefrontal cortex: Unity in diversity [J]. Neuron, 2021, 109(12):1925-1944.
[20] Chiang C S, Mcbride W H, Withers H R. Radiation-induced astrocytic and microglial responses in mouse brain [ J].Radiother Oncol, 1993, 29(1): 60-68.
[21] Betlazar C, Middleton R J, Banati R B, et al. The impact of high and low dose ionising radiation on the central nervous system [J]. Redox Biol, 2016, 9: 144-156.
[22] Kalm M, Lannering B, Bj?rk-Eriksson T, et al. Irradiation-induced loss of microglia in the young brain [ J]. J Neuroimmunol, 2009, 206(1-2): 70-75.
[23] Ladeby R, Wirenfeldt M, Garcia-Ovejero D, et al. Microglial cell population dynamics in the injured adult central nervous system [J]. Brain Res Rev, 2005, 48(2): 196-206.
[24] Markarian M, Krattli R P, Baddour J D, et al. Glia-selective deletion of complement c1q prevents radiation-induced cognitive deficits and neuroinflammation [J]. Cancer Res, 2021, 81(7): 1732-1744.
[25] ZHOU D, HUANG X, XIE Y, et al. Astrocytes-derived VEGF exacerbates the microvascular damage of late delayed RBI[J]. Neuroscience, 2019, 408: 14-21.
[26] Carballo-quintS M, Martínez-silva I, Cadarso-surez C, et al. A study of neurotoxic biomarkers, c-fos and GFAP after acute exposure to GSM radiation at 900 MHz in the picrotoxin model of rat brains [J]. Neurotoxicology, 2011, 32(4):478-494.
[27] Brillaud E, Piotrowski A, De Seze R. Effect of an acute 900 MHz GSM exposure on glia in the rat brain: A timedependent study [J]. Toxicology, 2007, 238(1): 23-33.
[28] Loane D J, Kumar A. Microglia in the TBI brain: The good, the bad, and the dysregulated [J]. Exp Neurol, 2016, 275(Pt 3): 316-327.
[29] Turnquist C, Harris B T, Harris C C. Radiation-induced brain injury: current concepts and therapeutic strategies targeting neuroinflammation [J]. Neurooncol Adv, 2020, 2(1): vdaa057.
[30] Boyd A, Byrne S, Middleton R J, et al. Control of neuroinflammation through radiation-induced microglial changes [J].Cells, 2021, 10(9):2381.

