早期胃癌内镜黏膜下剥离术后随访研究
蔡畅 金小亮 陆一帆 金海峰 赵晶 吕宾
2021 年国际癌症研究机构研究表明,全球新增癌症患者1 930 万例,其中胃癌发病率排名第五,死亡率排名第四[1]。在我国,胃癌的发病率和死亡率均列癌症第三位,严重影响人民健康。胃癌的预后与临床分期密切相关,进展期胃癌5 年生存率为10%~30%[2-3],早期胃癌的5 年生存率可达90%以上[4-5]。早期胃癌是指病变局限于黏膜和黏膜下层,而不论有无淋巴结转移的胃癌。内镜检查提高了早期胃癌的发现率[6],同时也是一种治疗方式,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)已成为早期胃癌的一线治疗方式[7-8]。ESD 较外科手术具有创伤小、恢复快等优势,但复发率较外科手术高,因此患者需要定期行胃内镜检查监测[9-10]。本文回顾早期胃癌行ESD 术后患者长期随访资料,分析其预后情况以及相关危险因素,现报道如下。
1 对象和方法
1.1 对象 选取2011 至2020 年在浙江中医药大学附属第一医院消化内镜中心接受ESD 治疗,并经术后病理学诊断确诊为早期胃癌的患者346 例(363 处病灶),收集患者临床资料进行分析。本研究经医院医学伦理委员会批准。
1.2 方法 通过查询医院信息系统、内镜信息系统、病理信息系统,通过电话访问等,记录患者年龄、性别等一般情况,以及以下信息。
1.2.1 ESD 术前情况 病变部位、大小、有无溃疡,幽门螺杆菌(helicobactor pylori,Hp)感染状态以及胃炎分型。萎缩分型:无萎缩或闭合型萎缩C-1、C-2、C-3,开放型萎缩O-1、O-2、O-3。病变形态分型:隆起型病变(0~I)、平坦型病变(0~Ⅱ)、凹陷型病变(0~Ⅲ)及相应亚型[11]。
1.2.2 适应证 按照相关指南[12]进行分类,绝对适应证为:(1)无论大小的无溃疡的分化型黏膜内癌;(2)直径≤3 cm 的有溃疡的分化型黏膜内癌;(3)直径≤2 cm的无溃疡未分化型黏膜内癌。扩大适应证为:直径≤3 cm 的无溃疡分化型黏膜下(Submucosal 1,SM1)癌。
1.2.3 ESD 手术情况 包括完整切除、整块切除、分片切除。
1.2.4 术后病理情况及eCura 评分 包括病理类型、大小、浸润深度、有无溃疡,以及垂直切缘、水平切缘、脉管浸润、肿瘤部位等。病理类型定义为:以高分化或中分化管状腺癌和乳头状腺癌为主的胃癌被归类为分化型癌,以低分化腺癌、印戒细胞癌或黏液腺癌为主者被归类为未分化型癌,并在上述指标基础上进行的eCura 评分[12],具体如下。eCura A:(1)分化型为主,黏膜内癌(pT1a),无溃疡(UL0),水平切除阴性(HM0),垂直切缘阴性(VM0),淋巴管浸润阴性(Ly0),静脉浸润阴性(V0),无论病灶大小;(2)长径≤2 cm,未分化型为主,pT1a,UL0,HM0,VM0,Ly0,V0;(3)长径≤3 cm,分化型为主,pT1a,UL1,HM0,VM0,Ly0,V0。eCura B:病灶为整块切除时,长径≤3 cm,分化型为主,pT1b1(SM1)(距黏膜肌层<500 μm),HM0,VM0,Ly0,V0。当病变不符合eCura A 或eCura B时,即为eCura C,内镜下切除后有肿瘤残留可能。当eCura C 病变为分化型病变且符合eCura A 或eCura B的其他分类标准,但未达到整块切除或水平切缘阳性时,即为eCura C-1,其他情况均为eCura C-2。本文将eCura 评分为A 或B 时定义为治愈性切除,eCura 评分为C-1 或C-2 时为非治愈性切除。
1.2.5 术后随访情况 腹部CT 及内镜检查情况、Hp感染和根除情况、后续治疗(追加手术、化疗、靶向药物治疗等)。
1.2.6 复发情况 包括复发时间、复发病灶部位、病理、治疗方式和预后等。复发包括同时癌及异时癌,其中同时癌指早期胃癌内镜治疗后12 个月内内镜下发现新的病灶,异时癌指早期胃癌治疗后超过12 个月后发现新的病灶[13]。
1.2.7 生存、死亡情况(死亡原因) 生存情况分为总体生存率及疾病特异死亡率,总体生存率指接受ESD的患者完成随访后尚存活的比例,疾病特异死亡率指接受ESD 的患者死于胃癌的比例。
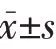
2 结果
2.1 患者基本临床特征 346 例行ESD 治疗的早期胃癌患者中,33 例(绝对适应证32 例、扩大适应证1 例)在随访过程中脱落,脱落患者由于联系方式更改、患者及家属沟通不配合等原因而失访,共完成随访314例,其中男193 例(61.5%),女121 例(38.5%),随访时长38~86 个月,中位数63 个月。随访过程中记录死亡患者6 例(1.9%),死因均为非胃癌,随访期间总体生存率为98.1%,疾病特异死亡率为0%,发生异时癌6 例(1.9%),同时癌3 例(1.0%)。本组患者无术后穿孔,17例出现术后消化道出血,其中11 例表现为黑便,6 例伴有呕血,内镜检查为创面渗血,均在内镜下止血成功。
2.2 异时癌患者与无异时癌患者临床特征比较 在随访过程中,患者ESD 术后出现异时癌共6 例,男5例,女1 例,年龄46~74 岁,平均61.5 岁;背景黏膜的胃炎分型中5 例为萎缩性胃炎O-3 型、1 例为萎缩性胃炎O-2 型,5 例分化型腺癌,1 例未分化型印戒细胞癌;异时癌发现时间区间为术后14~90 个月,中位数为44.5个月,均为术后定期胃内镜检查发现。异时癌患者与无异时癌患者性别、年龄、胃癌部位、Hp 感染情况及根除情况、脉管浸润情况、浸润深度情况、垂直切缘情况、水平切缘情况、肿瘤大小、分化程度、eCura 评分比较差异均无统计学意义(均P>0.05),异时癌患者瘢痕溃疡发生率高于无异时癌患者(P<0.05),见表1。

表1 异时癌患者与无异时癌患者临床特征比较
2.3 同时癌患者与无同时癌患者临床特征比较 同时癌患者共3 例,3 例均为术后6 个月复查发现,均为分化型腺癌,其中2 例为萎缩性胃炎O-3 型、1 例为萎缩性胃炎O-1 型,发现后均再次行ESD,术后病理检查提示均为分化型腺癌,浸润深度均为黏膜层,无脉管浸润、垂直及水平切缘均阴性,再次ESD 术后,无复发,无淋巴结及远处转移等。同时癌患者与无同时癌患者性别、年龄、胃癌部位、Hp 感染情况及根除情况、瘢痕溃疡情况、脉管浸润情况、浸润深度情况、垂直切缘情况、水平切缘情况、肿瘤大小、分化程度、eCura 评分比较差异均无统计学意义(均P>0.05),见表2。
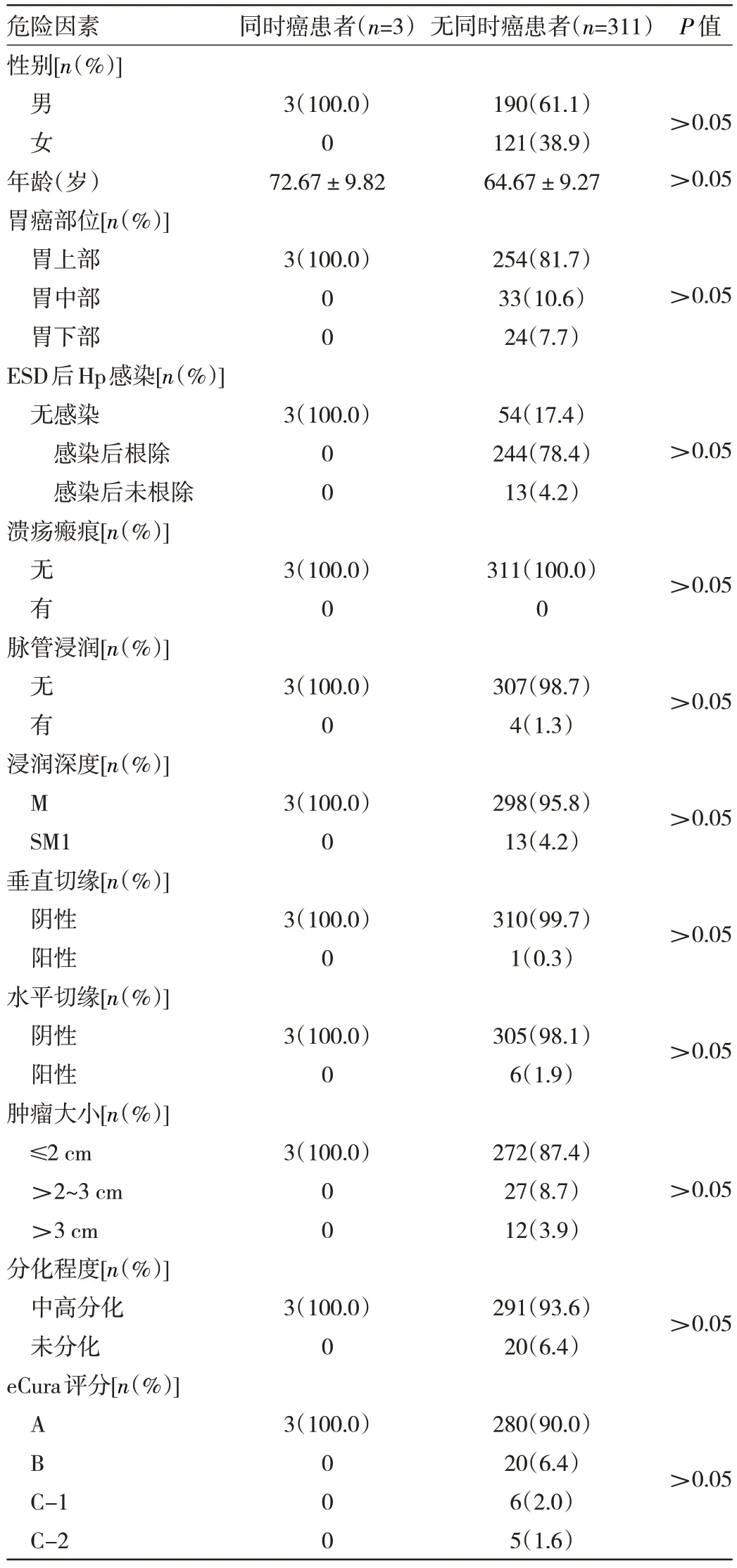
表2 同时癌患者与无同时癌患者临床特征比较
2.4 非治愈性切除患者的随访情况 共11 例非治愈性ESD 切除患者,其中1 例为垂直切缘阳性,6 例水平切缘阳性,4 例脉管浸润阳性。非治愈性切除患者中4例追加手术治疗,术中未发现淋巴结转移,术后无患者死亡,均未发现复发、淋巴结转移及远处转移,7 例接受随访观察,其中1 例垂直切缘阳性患者在随访过程中接受了外院再次ESD,术后病理学检查示垂直切缘阴性,截止到随访结束,未发现复发、转移等。1 例在随访期间死于前列腺癌,随访过程中均未出现复发、转移及因胃癌死亡的情况。
2.5 患者死亡情况 共6 例患者死亡,分别死于慢性阻塞性肺疾病导致的呼吸衰竭、慢性肾功能衰竭、肝硬化、阿尔兹海默病、肝癌和前列腺癌。
3 讨论
早期胃癌指局限于黏膜内或黏膜下层,而无论是否有淋巴结转移的胃癌。多项研究已经证实符合绝对适应证早期胃癌行ESD 治疗可获得良好预后[14-16],符合相对适应证的早期胃癌首选手术治疗。有研究提示,符合扩大适应证中肿瘤大小≤2 cm、无溃疡和活检组织学证实为未分化腺癌的早期胃癌5 年总生存率为99.3%[17];同时在相关指南中被纳入了ESD 绝对适应证,ESD 对未分化型早期胃癌的疗效和安全性得到肯定[12]。ESD 治疗早期胃癌能缩短手术时间及住院时长,降低医疗成本和提高患者术后生活质量,但因不能进行淋巴结清扫而存在术后复发风险,本研究旨在分析经ESD 治疗的早期胃癌患者长期随访的结局,对于复发者分析其相关因素。
本研究对经ESD 治疗的早期胃癌患者进行随访,中位随访时间63 个月,总体生存率98.1%,随访过程中无患者因胃癌死亡,疾病特异死亡率0%。Kosaka 等[15]研究显示,行ESD 治疗的早期胃癌患者的5 年总生存率为83.1%,疾病特异性死亡率0%。且早期胃癌患者接受ESD 治疗后出现转移性复发风险较低[14],其安全性得以验证。
胃癌的复发根据时间可分为同时癌和异时癌,既往研究提示Hp 感染及吸烟史为异时癌发生的危险因素[18],而多发型早期胃癌易因为漏诊而表现为同时癌[19-20]。内镜手术后异时癌的平均年发病率为3%~4%,常发生于内镜手术后30~37 个月[21-24]。本研究中异时癌总发病率为1.9%,发生的中位时间为58.5 个月。Ishioka 等[25]报道,中分化型胃癌的异时癌年发病率为0.9%。有纳入396 例胃癌患者的研究在5.9 年的中位随访时长中发现,根除Hp 组发生14 例(7.2%)异时癌,安慰剂组发生27 例(13.4%)异时癌,根除Hp 组较安慰剂组异时癌发生率降低[26]。本组病例中,ESD 术后Hp阳性者均实施了Hp 根除治疗,可能与较低的异时癌发生率有关。
溃疡是早期胃癌淋巴结转移的独立危险因素,这已在多项研究中被证实[27]。但溃疡与局部复发之间的关系未被阐明,既往有研究提示溃疡与黏膜下侵袭、淋巴血管浸润、神经周围浸润、淋巴结转移相关[28]。因此对于伴有溃疡的早期胃癌患者,在ESD 后复查过程中需要更加警惕复发。
本研究发现有异时癌发生患者的萎缩性胃炎均为开放型(O 型),即萎缩的范围较闭合型胃炎更广。有文献指出O 型胃炎较闭合型胃炎(C 型)有更高的进展风险和更短的无癌生存期[29],因此对于O 型萎缩性胃炎的患者,应进行更积极的胃镜检查,及时发现并处理可能发生的早期胃癌。
非治愈性切除的患者发生淋巴结转移的风险较治愈性切除的患者大大提高,ESD 术后管理也是重中之重。本研究中非治愈性切除的患者中追加手术与未追加手术的均未发生复发及死亡。有学者在中位随访时间为40 个月的ESD 对黏膜下胃癌病灶预后研究中发现,非治愈性切除患者追加手术与否,患者的总生存率与无病生存率无统计学差异[30],但也有研究表明追加手术可降低早期胃癌非治愈性ESD 后与胃癌相关的死亡风险,提高总生存率[31-33]。但究其原因,接受追加手术的患者与随访观察患者在临床病理学特征上便存在着差异,追加手术的患者往往年纪更轻,有更多的淋巴血管受累和更深的黏膜下浸润[34],更大的肿瘤[35]。由于CT 对淋巴结转移的总体诊断准确度范围为37%~70%[36],术前判断淋巴结转移仍存在一定的难度,但根据eCura 评分系统,提示eCura 评分为C-2 的患者发生LNM 风险较高,应首选手术治疗,而C-1 的患者可考虑随访,为ESD 术后管理提供更好的治疗方案。
本研究具有以下局限性:(1)为回顾性研究,存在一定的偏倚,且未纳入吸烟、胃癌家族史等背景数据;(2)研究样本量较小,且为单中心研究,日后可进行更大规模的多中心研究。
综上所述,早期胃癌接受ESD 治疗可有较好的预后,但有发生异时癌的风险,术后应加强内镜监测,尤其是萎缩范围广的患者。

