降钙素原浓度监测在评估失血性休克患者预后中的应用价值
林幼萍,张加乐,邓明汉
(东莞市滨海湾中心医院重症医学科,广东 东莞 523900)
出血所引起的失血性休克具有发病率高、致死率高和致残率高的“三高”特点。失血性休克状态与危及生命的血压下降有关,失血性休克可导致组织灌注无法维持有氧代谢的状态[1]。血管内容积的显著损失可能导致血流动力学不稳定、组织灌注减少、细胞缺氧、器官功能障碍,甚至死亡。失血性休克与严重创伤、心脏手术、肝移植手术、孕产妇大出血以及消化道大出血等疾病密切相关,是现阶段的公共卫生难题之一[2-3]。找到一种可反映失血性休克患者病情并可提示预后的生物标志物具有重要的临床价值和意义。降钙素原(procalcitonin, PCT)是一种急性期反应蛋白,可有效反映脓毒症感染的严重程度,评价抗感染疗效[4-5]。研究发现,急危重症患者血清PCT 的水平与APACHE Ⅱ评分、SOFA 评分呈正相关,可反映其疾病严重程度,对其预后具有预测价值[6]。而我们在失血性休克的研究中发现,失血性休克患者亦存在PCT 升高的情况。PCT 与失血性休克患者的预后是否存在相关性目前尚未明确。本文主要是探究PCT 浓度监测在评估失血性休克患者预后中的应用价值。
1 资料与方法
1.1 一般资料
选取2017 年1 月至2020 年1 月入住我院的失血性休克患者120 例,年龄18 ~90 岁,平均年龄(48.32±15.56)岁,其中包括男性83 例,女性37 例。纳入标准:临床症状、体征、肺动脉楔压、中心静脉压、休克指数均符合失血性休克的诊断标准。排除标准:符合失血性休克诊断标准,但未检测PCT 的病例;入院前有大量液体复苏治疗史;病历资料不完整;无法追溯28 天结局的患者。依据入院24 h 的PCT 值将患者分为A 组(PCT ≥0.5 ng/mL,n=72)和B 组(PCT <0.5 ng/mL,n=48)。根据预后将患者分为存活组(n=104)和死亡组(n=16)。本研究符合医学伦理学标准,并经我院伦理委员会批准。
1.2 方法
1.2.1 治疗方法 所有入组患者均依照失血性休克诊治指南[7]进行规范治疗,包括损伤控制、止血复苏和限制性液体复苏等。
1.2.2 观察指标 记录两组患者的入院时血红蛋白(Hb)、血细胞比容(Hct)、乳酸(Lac)水平、住ICU 时间、DIC 发生率、APACHE Ⅱ评分、7 天内感染发生率以及病死率。
1.3 统计学分析
采用GraphPad Prism 9 软件进行数据统计分析,对所检测数值进行正态分布检验,符合正态分布或近似正态分布的计量资料采用±s表示,非正态分布的计量资料以中位数( 四分位数)[M(P25,P75)] 表示,组间比较用t检验;计数资料用% 表示,组间分析采用χ² 检验。P<0.05 视为具有统计学差异。
2 结果
2.1 A 组患者与B 组患者一般资料的比较
A 组患者与B 组患者性别、年龄等一般临床资料的差异无统计学意义(P>0.05)。见表1。

表1 A 组患者与B 组患者一般资料的比较
2.2 A 组患者与B 组患者Hb、Hct、Lac 水平的比较
A组患者的Hb、Hct、Lac水平分别为(64.13±10.27)g/dL、(22.17±4.56)%、(8.21±0.38)mmol/L。B 组 患 者的Hb、Hct、Lac 水平分别为(85.01±6.13)g/dL、(28.87±3.41)%、(5.02±0.13)mmol/L。与B 组比较,A 组患者Hb、Hct 的水平较低,Lac 的水平较高,差异有统计学意义(P<0.05)。见表2。该结果提示失血性休克患者的PCT 增高与病情严重程度相关。
表2 A 组患者与B 组患者Hb、Hct、Lac 水平的比较(± s)

表2 A 组患者与B 组患者Hb、Hct、Lac 水平的比较(± s)
组别 Hb(g/dL)Hct(%)Lac(mmol/L)A 组(n=72)64.13±10.27 22.17±4.56 8.21±0.38 B 组(n=48)85.01±6.13 28.87±3.41 5.02±0.13t值 12.65 8.684 55.95P值 <0.0001 <0.0001 <0.0001
2.3 A 组患者与B 组患者住ICU 时间和APACHE Ⅱ评分的比较
A 组患者的住ICU 时间、APACHE Ⅱ评分分别为(9.25±5.37)d、(17.21±3.28)分,B 组患者的住ICU 时间、APACHE Ⅱ评分分别为(7.12±3.16)d、(14.17±2.13)分。与B 组比较,A 组患者的住ICU时间较长,APACHE Ⅱ评分较高,差异有统计学意义(P<0.05)。见表3。
表3 A 组患者与B 组患者住ICU 时间和APACHE Ⅱ评分的比较(± s)
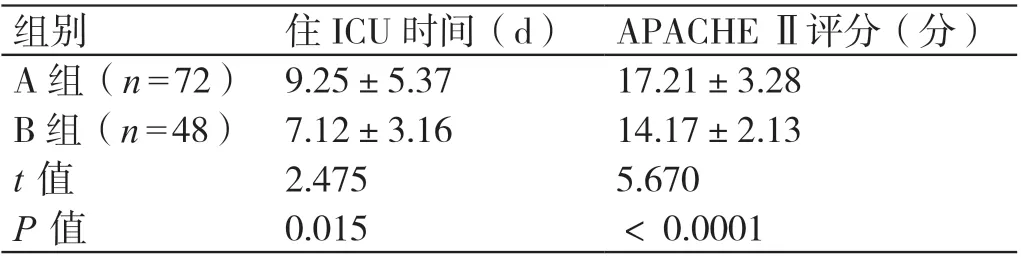
表3 A 组患者与B 组患者住ICU 时间和APACHE Ⅱ评分的比较(± s)
组别 住ICU 时间(d)APACHE Ⅱ评分(分)A 组(n=72)9.25±5.37 17.21±3.28 B 组(n=48)7.12±3.16 14.17±2.13t值 2.475 5.670P值 0.015 <0.0001
2.4 A 组患者与B 组患者预后情况的比较
A 组患者的7 天内感染发生率、病死率、DIC 发生率分别为56.95%、19.44%、6.94%,B 组患者的7天内感染发生率、病死率、DIC 发生率分别为37.50%、4.17%、4.17%。A 组患者的7 天内感染发生率及病死率均高于B 组,差异有统计学意义(P<0.05)。两组患者DIC 的发生率无统计学差异(P>0.05)。见表4。

表4 A 组患者与B 组患者预后情况的比较[例(%)]
2.5 存活组与死亡组PCT 水平的动态变化
在入院后第1 d、第2 d、第3 d,死亡组的PCT水平均高于存活组,差异有统计学意义(P<0.05)。在入院当天及入院后第5 d,两组的PCT 水平无统计学差异(P>0.05)。在入院后,两组的PCT 水平均逐渐上升,存活组在入院后第1 d 达峰,死亡组在入院后第2 d 达峰,且死亡组下降较存活组缓慢。见表5。

表5 存活组与死亡组PCT 水平的动态变化[ng/mL,M(P25,P75)]
3 讨论
研究[8-9]表明,失血性休克发生时,为保证脑心肺等重要器官的供血,全身血液会重新分配, 肠道可将约30% 的循环血量通过“自体输血”的方式输送到体循环中,因此会导致肠道灌注的不足。因为失血性休克减少了肠黏膜血液灌注,从而导致肠黏膜屏障损伤、肠屏障功能障碍、菌群异位、内毒素血症、肠道再灌注损伤等,引起大量炎症介质释放(即“炎症风暴”),进而诱发全身炎症反应综合征(SIRS),导致MODS。严重的系统性炎症反应与长时间失血性休克密切相关。患有MODS 患者的炎性细胞因子(如TNF、IL-6、PCT、CRP)水平明显高于没有发生MODS 的患者。有研究指出,炎性细胞因子可以作为评估失血性休克预后的指标[10-12]。PCT 是一种由甲状腺滤泡旁细胞产生的蛋白质,PCT 基因的表达可以由脂多糖和全身炎症介质诱导。因此,在全身细菌感染期间或炎症反应期,PCT 的血清浓度显著增加,并且其水平与炎症程度密切相关。一旦感染被清除,PCT水平会迅速降低[4-5]。研究[6,12]发现,血清PCT 水平对急危重症患者的预后有预测价值。本研究的结果显示,与B 组比较,A 组患者Hb、Hct 的水平较低,Lac 的水平、APACHE Ⅱ评分较高,差异有统计学意义(P<0.05)。提示入院后PCT 升高的患者其病情的严重程度较PCT 未升高的患者严重。与B 组比较,A 组患者的住ICU 时间较长,差异有统计学意义(P<0.05)。A 组患者的7 天内感染发生率及病死率均高于B 组,差异有统计学意义(P<0.05)。提示入院后PCT 升高的患者其出现感染、预后不良情况的风险均较PCT 未升高的患者高。这与我们团队以往的研究结果[12]相似。在对失血性休克患者早期PCT进行动态监测的过程中发现,在入院后第1 d、第2 d、第3 d,死亡组的PCT 水平均高于存活组,差异有统计学意义(P<0.05)。在入院当天及入院后第5 d,两组的PCT 水平无统计学差异(P>0.05)。在入院后,两组的PCT 水平均逐渐上升,存活组在入院后第1 d达峰,死亡组在入院后第2 d 达峰,且死亡组下降较存活组缓慢。提示对于失血性休克患者,如果早期不能监测到其PCT 的下降或下降缓慢,须警惕其是否存在感染、病情危重甚至预后不良的风险。这与Kataja A 等的研究结果相似。我们的研究结果显示:部分失血性休克患者会出现一定程度的PCT 水平升高的情况;PCT 水平可在一定程度上反映失血性休克的危重程度和预后,但不能单凭其升高程度来进行相关判断,而是要综合休克严重程度、乳酸水平、PCT 的动态变化等进行综合评估。
综上所述,PCT 水平可在一定程度上反映失血性休克患者病情的严重程度及并发症的发生风险,其可作为评估失血性休克患者预后的参考指标之一。本研究的样本量较小,且为单中心的回顾性研究,相关研究结论仍需通过进行更大规模的系统性临床研究加以证实。

