山茶油调节Keap1/Nrf2/ARE信号通路对老年痴呆大鼠氧化应激损伤的影响
谭丽萍 丁娟 韩凤珍 胥明霞
老年痴呆又称阿尔茨海默病(Alzheimer’s disease,AD),是一种神经退行性疾病,通常表现出记忆衰退混乱、认知障碍、语言障碍、执行功能障碍等行为,这种疾病起病隐匿,且病程相对缓慢不易察觉,一旦发病常令人措手不及而且会缩短患者寿命,给患者及其亲人带来极大痛苦和麻烦[1,2]。然而目前AD病因尚未明确,一些研究发现它的发生可能与氧化应激、炎症、衰老、家族遗传史、头部损伤等因素有关;另外还发现,铝、铅、镉等金属毒性与神经疾病发生有着密切关系,尤其是铝,临床研究发现,AD患者脑组织、血液中铝水平显著高于正常人[3-5]。Kelch样环氧氯丙烷相关蛋白1(Keap1)/核因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE)信号通路在机体抗氧化过程中发挥重要作用,它能够通过调控Ⅱ相酶、抗氧化酶来清除过量自由基等有害物质,减轻或抑制氧化应激发生发展,是治疗氧化应激相关疾病的一个重要靶点[6,7]。研究发现,健康合理饮食能够有效降低记忆、认知能力的减退,对AD发生具有较好预防作用。油是日常生活必不可少的一种摄入,过多食用或油质不好都会对身体产生不良影响。山茶油含有较高油酸、不饱和脂肪酸、亚油酸和丰富的维生素、亚麻酸、多酚、黄酮等物质,具有抗氧化、抗炎、抗衰老、抗癌等多种生物学功效[8]。因此,本研究通过建立AD大鼠模型,探究山茶油是否能够通过调节Keap1/Nrf2/ARE信号通路对AD大鼠氧化应激损伤发挥保护作用。
1 材料与方法
1.1 实验动物 8周SPF级雌性SD大鼠,体重(200±20)g,购于常州卡文斯实验动物有限公司,许可证号:SCXK(苏)2016-0010。大鼠1周时间适应环境,期间自由饮食饮水,保持明暗循环(12∶12)h、湿度(65±5)%和室温(22±2)℃。
1.2 主要试剂与仪器 (1)山茶油购于上海源叶生物科技有限公司(S28149);AlCl3购于西宝生物科技(上海)股份有限公司(11018);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(Interleukin-6,IL-6)、白介素-1β(Interleukin-1β,IL-1β)ELISA试剂盒及超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、丙二醛(malondialdehyde,MDA)检测试剂盒购于上海碧云天生物技术有限公司(PT516、PI328、PI303、S0088、S0058、S0131S);兔源一抗Anti-Keap1、Anti-Nrf2、Anti-HO-1、Anti-β-actin及二抗山羊抗兔IgG(8047、33649、82206、4970、7074)购于美国CST公司。(2)Morris水迷宫购于北京友诚嘉业生物科技有限公司;跳台实验装置购于上海然哲仪器设备有限公司;Alpha View凝胶成像仪购于苏州阿尔法生物实验器材有限公司。
1.3 分组、AD模型构建及给药 大鼠随机分为6组,包括空白组、AD组、山茶油低、中、高剂量组和盐酸多奈哌齐组。AD模型构建及药物处理:模型组大鼠灌胃AlCl3(110 mg/kg)+大豆油(1 ml/kg);山茶油低、中、高剂量组大鼠分别灌胃AlCl3(110 mg/kg)+山茶油(1 ml/kg)[8]、AlCl3(110 mg/kg)+山茶油(2 ml/kg)、AlCl3(110 mg/kg)+山茶油(4 ml/kg);盐酸多奈哌齐组大鼠灌胃AlCl3(110 mg/kg)+盐酸多奈哌齐(1.75 mg/kg)[1];空白组大鼠灌胃大豆油(1 ml/kg)。所有大鼠连续处理49 d,第50天处死大鼠进行样品收集。
1.4 Morris水迷宫实验及跳台实验 采用Morris水迷宫实验和跳台实验对6组大鼠空间学习记忆能力进行观察,并记录大鼠逃避潜伏时间和潜伏时间。Morris水迷宫实验、跳台实验方式及评价标准参考张彤等[1]方法进行。实验分别在大鼠灌胃7 d、14 d和21 d后进行3次,计算平均值。
1.5 样品获取 第50天,大鼠颈椎脱臼处死,取脑组织(海马组织)置于冰上,部分放入多聚甲醛固定;部分放入-80℃冷冻保存;部分使用组织溶解缓冲液均质化后经组织匀浆机制备成组织匀浆,放入-80℃保存。
1.6 HE染色 多聚甲醛中固定的海马组织制备常规石蜡切片,切片经脱蜡、水化后进行HE染色,显微镜下观察海马组织病理学变化。
1.7 大鼠脑组织TNF-α、IL-1β、IL-6水平检测 取出冻存脑组织匀浆,使用ELISA试剂盒检测促炎因子TNF-α、IL-1β、IL-6水平。检测步骤按照ELISA试剂盒说明书要求进行。
1.8 大鼠脑组织SOD、GPx、MDA水平检测 取出冻存脑组织匀浆,使用ELISA试剂盒对SOD、GPx活性和MDA水平进行检测。检测步骤根据试剂盒说明书要求进行。
1.9 大鼠脑组织Keap1、Nrf2和HO-1蛋白表达检测 取出冻存脑组织,放入液氮中研磨,之后采用RIPA试剂盒提取总蛋白,BCA试剂盒测定蛋白浓度并记录。SDS-PAGE凝胶电泳后,半干转印至聚偏氟乙烯(PVDF)膜上;5%脱脂奶粉封闭1 h;分别加入一抗Anti-Keap1、Anti-Nrf2、Anti-HO-1、Anti-β-actin(1∶500),4℃孵育过夜;加入二抗(1∶5 000),室温孵育1 h。使用化学发光法检测,Tanon软件进行图像拍摄及半定量分析。
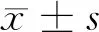
2 结果
2.1 山茶油对大鼠学习和记忆能力的影响 与空白组比较,AD组大鼠灌胃7 d、14 d、21 d后潜伏时间及逃避潜伏时间明显延长(P<0.05)。与AD组比较,山茶油低、中、高剂量组和盐酸多奈哌齐组大鼠潜伏时间及逃避潜伏时间明显缩短(P<0.05),且山茶油对大鼠潜伏及逃避潜伏时间的缩短效果存在剂量效应关系(P<0.05)。山茶油高剂量组与盐酸多奈哌齐组潜伏及逃避潜伏时间无差异(P>0.05)。见表1、2。

表1 6组大鼠跳台实验结果比较

表2 6组大鼠Morris水迷宫实验结果比较
2.2 山茶油对大鼠脑组织病理学变化影响 空白组大鼠海马组织神经细胞排列规则整齐,数量正常;AD组神经细胞出现变形、坏死现象,且细胞排列不规则,层次不清晰,细胞数量减少;山茶油低、中、高剂量组和盐酸多奈哌齐组相较于AD组,细胞变形、坏死现象减少,层次较清晰,细胞数量增多。见图1。

空白组 AD组 山茶油低剂量组
2.3 山茶油对大鼠脑组织TNF-α、IL-1β、IL-6水平的影响 与空白组比较,AD组大鼠脑组织中TNF-α、IL-1β、IL-6水平明显升高(P<0.05)。与AD组比较,山茶油低、中、高剂量组和盐酸多奈哌齐组TNF-α、IL-1β、IL-6水平明显降低(P<0.05)。山茶油对TNF-α、IL-1β、IL-6降低效果存在剂量效应关系(P<0.05)山茶油高剂量组TNF-α、IL-1β、IL-6水平与盐酸多奈哌齐组比较差异无统计学意义(P>0.05)。见表3。

表3 6组大鼠脑组织TNF-α、IL-1β、IL-6水平比较
2.4 山茶油对大鼠脑组织SOD、GPx、MDA水平的影响 与空白组比较,AD组大鼠脑组织中SOD、GPx活性明显降低(P<0.05),MDA水平明显升高(P<0.05)。与AD组比较,山茶油低、中、高剂量组和盐酸多奈哌齐组SOD、GPx活性明显提高(P<0.05),MDA水平明显降低(P<0.05)。山茶油对SOD、GPx、MDA作用效果存在剂量效应关系(P<0.05),高剂量山茶油作用效果最好。山茶油高剂量组SOD、GPx活性及MDA水平与盐酸多奈哌齐组比较差异无统计学意义(P>0.05)。见表4。

表4 6组大鼠脑组织SOD、GPx、MDA水平
2.5 山茶油对大鼠脑组织Keap1、Nrf2和HO-1蛋白表达的影响 与空白组比较,AD组大鼠脑组织中Nrf2、HO-1蛋白表达明显降低,Keap1蛋白表达明显升高(P<0.05)。与AD组比较,山茶油低、中、高剂量组和盐酸多奈哌齐组Nrf2、HO-1蛋白表达明显升高,Keap1蛋白表达明显降低(P<0.05)。山茶油对Keap1、Nrf2、HO-1蛋白表达作用效果存在剂量效应关系(P<0.05),高剂量山茶油作用效果最好。山茶油高剂量组Keap1、Nrf2、HO-1蛋白表达水平与盐酸多奈哌齐组比较无明显差异(P>0.05)。见表5,图2。

表5 6组大鼠脑组织Keap1、Nrf2、HO-1蛋白表达水平

图2 6组大鼠脑组织Keap1、Nrf2、HO-1蛋白表达;A 空白组;B AD组;C 山茶油低剂量组;D 山茶油中剂量组;E 山茶油高剂量组;F 盐酸多奈哌齐组
3 讨论
AD导致患者出现学习能力下降、记忆衰退、行为改变、焦虑抑郁等情况,是威胁老年人生命健康的巨大隐患。日常干预或减缓AD的发生与发展,对AD治疗及预后有重要作用[9]。山茶油因营养丰富,被证明具有抗氧化、抗炎、降低胆固醇、调节肠道微生物等多种功效,并且对增强学习、记忆和认知能力也有良好帮助[10,11]。Morris水迷宫和跳台实验能够反映出大鼠学习、记忆、空间定位等情况,帮助判断大鼠痴呆和智力程度。本研究结果,AD组大鼠潜伏时间及逃避潜伏时间明显延长,而与AD组比较,山茶油低、中、高剂量组和盐酸多奈哌齐组潜伏时间及逃避潜伏时间明显缩短。提示山茶油能够提高大鼠学习和记忆能力,减轻大鼠痴呆程度。
炎性反应是造成AD的因素之一[12],并且炎性反应与氧化应激二者之间相辅相成、相互促进、相互影响[13]。因此抑制炎性反应对减轻AD的发生和氧化应激损伤具有重要意义。TNF-α、IL-6、IL-1β是较典型的促炎因子,能够造成细胞损伤,诱导炎症信号通路活化,促进更多炎性介质如活性氧、活性氮产生,加剧氧化应激和炎性反应发生发展[14,15]。本研究结果显示,AD组大鼠脑组织中TNF-α、IL-6、IL-1β水平明显升高,而与AD组相比,山茶油低、中、高剂量组和盐酸多奈哌齐组TNF-α、IL-6、IL-1β水平明显降低。提示山茶油能够减少大鼠脑组织促炎因子水平,从而抑制大鼠脑组织炎性反应,减轻大鼠AD。
SOD和GPx是两种重要的抗氧化酶,在维持氧化还原反应中具有重要作用[16]。MDA是自由基与细胞大分子反应的有毒产物,可作为氧化应激标志物[17]。本研究结果显示,AD组大鼠脑组织中SOD、GPx活性明显降低,MDA水平明显升高,而与AD组比较,山茶油低、中、高剂量组和盐酸多奈哌齐组SOD、GPx活性明显提高,MDA水平明显降低。提示山茶油具有提高抗氧化酶活性,降低氧化应激反应的能力。
Nrf2是CNC调节蛋白家族成员,在机体各个组织器官广泛分布,作为调控细胞氧化还原的调节因子,在正常情况下与其抑制剂Keap1相结合处于失活状态;当细胞受到活性氧等自由基刺激出现氧化还原失衡时,Nrf2会与Keap1解离,解离后Nrf2处于活化状态转移至细胞核中,先结合Maf蛋白,形成异质二聚体,再结合ARE,发挥调控Ⅱ相酶、抗氧化酶的作用,从而抑制氧化应激反应减轻氧化应激损伤[18-20]。本研究结果提示山茶油能够通过提高Nrf2、HO-1蛋白表达,增强细胞和组织抗氧化能力,降低氧化应激反应和损伤。
综上所述,山茶油能够调节Keap1/Nrf2/ARE信号通路对老年痴呆大鼠氧化应激损伤发挥保护作用,其具体作用机制可能是提高Nrf2、HO-1蛋白表达,加强抗氧化酶活性,减轻氧化应激反应,减少氧化还原损伤,同时抑制促炎因子水平,抑制AD发生发展。

