参葛方对脂肪变性肝细胞氧化应激和线粒体功能的影响
郑彦希,余 卓,方 淼,高亚婷,高月求
上海中医药大学附属曙光医院肝病科(上海 201203)
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)已成为目前发达国家和地区最常见的慢性肝病,是进展为肝硬化、肝癌的重要因素之一[1]。我国成年人非酒精性脂肪性肝病的患病率已超过25%,并仍呈现不断上升的趋势[2]。同时它也和心血管疾病、2型糖尿病、代谢综合征等疾病的发生发展密切相关,正严重威胁着人们的健康。目前对于NASH的治疗仍以加强运动、控制饮食为主,临床尚缺乏理想的药物,因此研发有效治疗NASH的药物是当下临床迫切需求的。
参葛方是上海中医药大学附属曙光医院肝病科治疗脂肪肝的临床验方,全方由丹参、葛根、炒白术、姜黄、女贞子、垂盆草组成,具健脾益肾、化湿祛痰、活血消脂之效。既往研究[3-4]表明,参葛方可显著降低NASH小鼠模型中三酰甘油(TG)含量,减轻炎症损伤和肝脂肪变性,具有抑制氧化应激的作用。
肝细胞氧化应激损伤能够增加脂质过氧化水平、改变线粒体形态、损害线粒体生物合成和线粒体功能[5],是NASH发生的重要环节[6]。本研究通过建立棕榈酸(PA)诱导的肝脂肪变性模型,探讨参葛方对肝细胞氧化应激、线粒体功能的影响。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性C57BL/6J小鼠36只,4周龄,体质量(14±2)g,购于浙江维通利华实验动物有限公司。实验动物生产许可证号:SCXK(浙)2019-0001。动物饲养于上海中医药大学实验动物中心SPF级屏障系统中,温度(24±2)℃,湿度55%。小鼠自由摄取饲料和饮用水,12 h的光照与黑暗循环。实验动物使用许可证号:SYXK(沪)2017-0014。
SPF级雌性SD大鼠5只,6周龄,体质量(170±5)g,购于浙江维通利华实验动物有限公司。实验动物生产许可证号:SCXK(浙)2019-0001。动物饲养于上海中医药大学实验动物中心SPF级屏障系统中,温度(24±2)℃,湿度55%。大鼠自由摄取饲料和饮用水,12 h的光照与黑暗循环。实验动物使用许可证号:SYXK(沪)2017-0014。
实验过程中所有操作均符合上海中医药大学实验动物伦理委员会规定(伦理批准号:PZSHUTCM210320005)。
1.1.2 细胞 人肝癌细胞HepG2细胞,由中国科学院上海细胞库提供。
1.1.3 药物与试剂 参葛方药物组成:丹参15 g,葛根15 g,炒白术15 g,片姜黄15 g,女贞子15 g,垂盆草30 g。本实验的药物来自上海中医药大学附属曙光医院中药房。取药材置于自动煎药机,加入纯水,浸泡30 min,100 ℃下过滤得提取液;于旋转蒸发仪中于65 ℃、真空度为8 kPa、转速为60 r/min的条件下,提取浓缩液;置于冷冻干燥器中于-0.01 kPa、-56 ℃的条件下真空冷冻干燥。干燥后过筛,得批号为20210304-1的干燥样品。
TG试剂盒,美国Abcam公司(批号:ab65336);肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)酶联免疫吸附试验(ELISA)试剂盒,美国Abcam公司(批号:ab183218、ab178031);活性氧(ROS)、丙二醛(MDA)检测试剂盒,碧云天生物技术有限公司(批号:S0033S、S0131S);Western blot抗体,美国Abcam公司[沉默信息调节蛋白3(SIRT3):批号为ab217319,1/1 000;磷酸化腺苷酸活化蛋白激酶(p-AMPK):批号为ab92701,1/10 000;腺苷酸活化蛋白激酶(AMPK):批号为ab32047,1/5 000;过氧化物酶体增殖活化受体γ共激活因子-1α(PGC-1α):批号为ab106814,1/1 000;谷胱甘肽过氧化物酶(GSHPX):批号为ab108427,1/10 000];腺苷三磷酸(ATP)含量检测试剂盒,北京索莱宝科技有限公司(批号:BC0305-100T/96S);SIRT3抑制剂(3-TYP)、AMPK抑制剂(Compound C),美国AbMole公司(批号:M8978、M2238)。
1.1.4 仪器 恒温水浴锅,常州朗越仪器制造有限公司(型号:HH-W-420);分光光度计,青岛聚创环保集团有限公司(型号:721);离心机,上海卢湘仪离心机仪器有限公司(型号:TGL-16M);荧光酶标仪,赛默飞世尔科技(中国)有限公司(型号:Varioskan LUX);垂直电泳仪、转印电泳仪,上海天能科技有限公司(型号:VE-180、VE-586);凝胶/蛋白成像一体机,上海天能科技有限公司(型号:Tanon-4600SF);倒置显微镜,日本Olympus株式会社(型号:IX70);透射电镜,日本日立中国有限公司(型号:HT7800);高效液相色谱仪,日本岛津制作所(型号:LC15C)。
1.2 动物实验
1.2.1 分组 将36只雄性C57BL/6J小鼠分为正常组、模型组、参葛方治疗组,正常组、模型组13只,参葛方治疗组10只。
1.2.2 造模与干预 正常组予以普通饲料,模型组、参葛方治疗组通过蛋氨酸和胆碱缺乏(MCD)饮食诱导脂肪肝模型[7],连续16周。
于第12周结束取正常组、模型组小鼠各3只,通过大体观察、肝细胞脂肪变性染色进行模型鉴定。于第13周起参葛方治疗组行中药灌胃至结束,灌胃量为每10 g小鼠体质量0.1 mL,每天1次,参葛方剂量为15.75 g·kg-1·d-1。同时正常组、模型组予等量蒸馏水灌胃。
小鼠末次给药24 h后摘眼球取血,并取肝组织备用。
1.3 体外实验
1.3.1 药物血清的制备 采用SD大鼠,将煎煮好的参葛方冻干粉按成人等效剂量7倍进行灌胃,连续3 d,每天2次,在末次灌胃1 h后,麻醉。按公式[8]计算大鼠的正常给药剂量:大鼠的正常给药剂量(g/kg)=成人用药量(g)/成人标准体质量(kg)×7。
参葛方药物血清及正常大鼠(未用参葛方干预)血清均从腹主动脉取血制备,2 500 r/min离心10 min,无菌分离血清后,经56 ℃、30 min灭活,0.22 μm微孔滤膜过滤除菌。-80 ℃低温保存备用[9]。
1.3.2 细胞培养 将HepG2细胞培养于含10%胎牛血清的高糖型DMEM培养基,置于5%CO2、100%湿度的37 ℃恒温培养箱,传代培养至70%~90%融合状态。
1.3.3 细胞分组 实验分为7组,即对照组(Control)、模型组(PA)、参葛方组(PA+SGF)、SIRT3抑制组(PA+3-TYP)、AMPK 抑制组(PA+Compound C)、参葛方+SIRT3抑制组(PA+3-TYP+SGF)、参葛方+AMPK抑制组(PA+Compound C+SGF)。每组均设3个样本。
1.3.4 造模与干预 用0.2 mmol/L棕榈酸处理HepG2细胞24 h建立肝细胞脂肪变性模型[10]。分别加入正常大鼠(未用参葛方干预)血清、参葛方药物血清、50 μmol/L 3-TYP、10 μmol/L Compound C处理24 h。其中Control、PA、PA+3-TYP、PA+Compound C加入正常大鼠(未用参葛方干预)血清;PA+SGF、PA+3-TYP+SGF、PA+Compound C+SGF加入参葛方药物血清。
1.4 检测指标与方法
1.4.1 小鼠肝组织病理染色 于小鼠肝组织最大叶切割组织块3块(0.5 cm×0.5 cm×0.5 cm大小),其中2块放入包埋框,4%甲醛溶液固定,脱水、包埋成石蜡组织块,5 μm切片;其余肝组织分装,-80 ℃保存。肝组织二甲苯、多级乙醇脱蜡至水,进行HE、油红O和血红素加氧酶-1(HO-1)免疫组化染色。显微镜下200倍、400倍观察。
1.4.2 HepG2细胞中TG含量 取对数生长期HepG2细胞,以1.5×105/孔接种于6孔板。收集各组细胞于EP管中,1 000 r/min,离心10 min,弃上清,留细胞沉淀。加入1 mL磷酸盐缓冲液(PBS)清洗2次。每组加入RIPA细胞裂解液,裂解20 min。按“1.3.4”项下方法干预后,根据酶法测试盒说明书测定细胞内TG含量。
1.4.3 HepG2细胞中TNF-α、IL-6水平 对数生长期HepG2细胞,以105/mL密度接种于6孔板,按“1.3.4”项下方法干预后,根据ELISA试剂盒操作说明书要求测定上清液TNF-α、IL-6水平。
1.4.4 HepG2细胞中ROS、MDA、ATP含量 取对数生长期HepG2细胞,以105个/mL密度接种于96孔板上,按“1.3.4”项下方法干预后,使用活性氧荧光探针(DCFH-DA)检测细胞ROS含量,硫代巴比妥酸法(TBA)检测MDA含量,微量法检测ATP含量。参照试剂盒说明书进行检测。
1.4.5 HepG2细胞中 SIRT3、p-AMPK/AMPK、PGC-1α蛋白表达 采用Western blot法分别检测SIRT3、p-AMPK/AMPK、PGC-1α蛋白含量。取HepG2细胞加入RIPA细胞裂解液,冰上裂解20 min后,离心收集上清,提取细胞蛋白。采用蛋白质定量试剂盒(BCA)法测定细胞总蛋白浓度。各孔取10 μL的蛋白上样,于10%聚丙烯酰胺凝胶电泳进行蛋白分离(80 V电压,60 min)。将分离后的蛋白电转移(100 V电压,120 min)至聚偏二氟乙烯膜(PVDF膜)。加入封闭液于摇床上室温封闭0.5 h。用TBST洗膜3次,每次8 min,分别加入SIRT3、p-AMPK、AMPK、PGC-1α抗体,4 ℃反应过夜。次日先以TBST洗膜3次,每次10 min。后加入二抗,室温反应1 h。再用TBST洗膜3次,每次10 min。按增强型化学发光试剂(ECL)试剂盒说明进行显影。采用ImageJ图像分析管理系统对蛋白条带灰度值进行分析。
1.4.6 HepG2细胞中线粒体结构观察 取HepG2细胞,按照细胞线粒体分离试剂盒说明书相关步骤,将细胞沉淀并重新置于线粒体提取缓冲液中,在匀浆处理后,离心取上清,再次离心后,弃上清液,其沉淀物即为线粒体。采用铀铅双染色法染色,电镜下观察线粒体结构。
1.5 统计学方法 研究数据应用SPSS 21.0统计软件和GraphPad Prism 6.0软件进行统计分析和作图。实验数据以±s表示。若资料符合正态分布且方差齐时,多组间比较采用单因素方差分析(One Way ANOVA);若资料不符合正态分布或方差不齐时,多组间比较采用Kruskal-Wallis H检验。以P<0.05为差异有统计学意义。
2 结果
2.1 对小鼠肝组织炎性反应、胶原沉积及过氧化的影响 HE染色法观察肝脏组织炎性反应。模型组肝小叶结构欠清晰,肝索结构紊乱,肝小叶内分布以小泡性为主的脂肪变性且融合成片,可见少量肝细胞气球样变,肝小叶内可见少量炎症细胞浸润。与模型组比较,参葛方治疗组小鼠炎性反应程度减轻,炎症细胞浸润减少。见图1。
油红O染色法观察肝脏组织内脂滴沉积情况。肝组织染色显示,模型组小鼠肝脏脂肪变性明显,肝细胞肿大变圆,内含大的脂肪滴,部分细胞可见细胞核挤向胞膜,呈以大泡性为主的脂肪变性。与模型组比较,参葛方治疗组小鼠脂肪变性程度明显减轻,脂滴数量减少。见图1。
HO-1免疫组化法观察肝脏组织内脂质过氧化水平。HO-1是诱导型血红素加氧酶,具有抗氧化应激作用,其在组织中的表达水平与脂质过氧化水平具有显著相关性[11]。肝组织染色显示,相较于模型组,参葛方治疗组的肝组织内HO-1表达明显升高。见图1。

图1 各组小鼠肝组织病理情况(炎性反应、胶原沉积及过氧化)
2.2 对HepG2细胞中SIRT3、p-AMPK/AMPK、PGC-1α蛋白表达的影响 与Control比较,PA的SIRT3蛋白表达显著降低(P<0.05)。与PA比较,PA+SGF的SIRT3表达上调,差异有统计学意义(P<0.05)。与PA+SGF比较,PA+3-TYP+SGF明显抑制SIRT3的表达,差异有统计学意义(P<0.05)。与PA+Compound C比较,PA+Compound C+SGF上调SIRT3的表达,差异有统计学意义(P<0.05)。见图2、图3。
与Control比较,PA的p-AMPK/AMPK表达降低,差异有统计学意义(P<0.05)。与PA比较,参葛方处理后PA+SGF的p-AMPK/AMPK表达上调,差异有统计学意义(P<0.05)。与PA+SGF比较,PA+3-TYP+SGF能够抑制p-AMPK/AMPK的表达,差异有统计学意义(P<0.05)。与PA+Compound C比较,PA+Compound C+SGF可上调p-AMPK/AMPK的表达,差异有统计学意义(P<0.05)。见图2、图3。
与Control比较,PA的PGC-1α表达降低,差异有统计学意义(P<0.05)。与PA比较,参葛方处理后PA+SGF的PGC-1α表达上调,差异有统计学意义(P<0.05)。与PA+SGF比较,PA+3-TYP+SGF能够抑制PGC-1α的表达,差异有统计学意义(P<0.05)。与PA+Compound C比较,PA+Compound C+SGF可上调PGC-1α的表达,差异有统计学意义(P<0.05)。见图2、图3。

图2 各组HepG2细胞SIRT3、p-AMPK/AMPK、PGC-1α蛋白条带
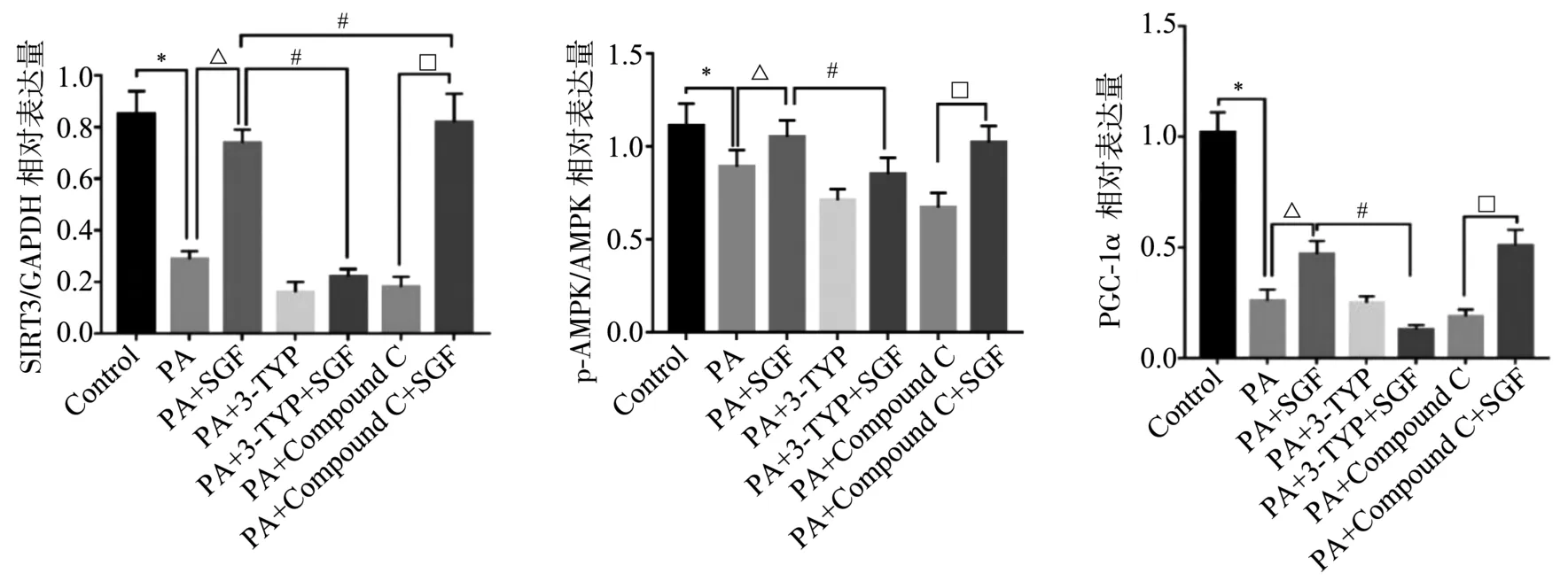
图3 各组HepG2细胞SIRT3、p-AMPK/AMPK、PGC-1α蛋白表达情况比较
结果提示,参葛方能促进SIRT3、p-AMPK/AMPK、PGC-1α的表达。
2.3 对HepG2细胞中TG、TNF-α、IL-6含量的影响 与Control比较,PA的TG、TNF-α、IL-6含量明显升高,差异有统计学意义(P<0.05)。与PA比较,参葛方处理后PA+SGF的TG、TNF-α、IL-6含量降低,差异有统计学意义(P<0.05)。与PA+SGF比较,PA+3-TYP+SGF对PA诱导的TG、TNF-α、IL-6含量增加的抑制作用明显减弱,差异有统计学意义(P<0.05)。与PA+Compound C比较,PA+Compound C+SGF对PA诱导的TG、IL-6含量增加的抑制作用减弱,差异有统计学意义(P<0.05),但TNF-α含量差异无统计学意义(P>0.05)。
结果提示,参葛方可降低TG,降低TNF-α、IL-6含量,从而减少炎症反应,均与SIRT3、AMPK有关。见图4。
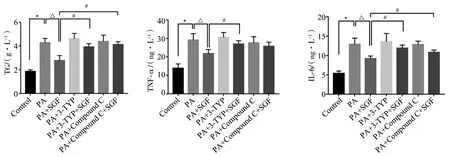
图4 各组HepG2细胞TG、TNF-α、IL-6含量比较
2.4 对HepG2细胞中ROS、MDA含量的影响 与Control比较,PA的ROS、MDA含量明显升高,差异有统计学意义(P<0.05)。与PA比较,PA+SGF的ROS、MDA含量降低,差异有统计学意义(P<0.05)。与PA+SGF比较,PA+3-TYP+SGF、PA+Compound C+SGF对棕榈酸诱导的ROS、MDA含量增加的抑制作用明显减弱,差异有统计学意义(P<0.05)。结果提示,参葛方可抑制氧化应激,且与SIRT3、AMPK有关。见图5。
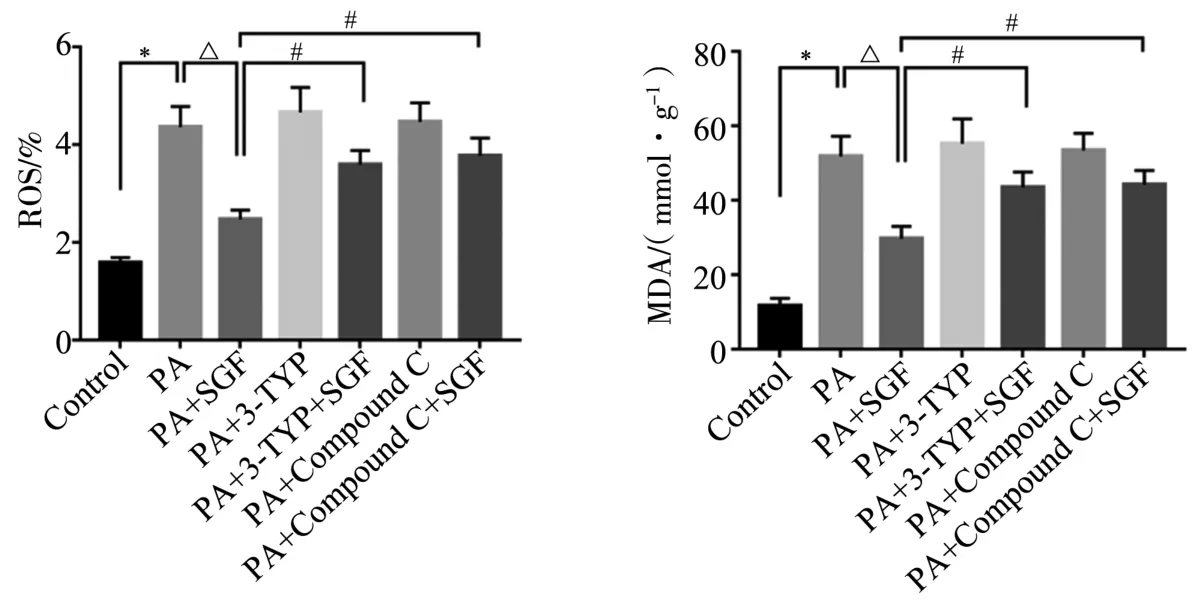
图5 各组HepG2细胞ROS、MDA含量比较
2.5 对HepG2细胞中ATP含量的影响 与Control比较,PA细胞ATP生成量明显减少,差异有统计学意义(P<0.05)。与PA比较,PA+SGF细胞ATP生成量显著增加,差异有统计学意义(P<0.05)。与PA+SGF比较,PA+3-TYP+SGF、PA+Compound C+SGF的细胞ATP生成量明显被抑制,差异有统计学意义(P<0.05)。与PA+Compound C比较,PA+Compound C+SGF抑制细胞ATP生成,差异有统计学意义(P<0.05)。结果提示,参葛方可改善线粒体功能,且与SIRT3、AMPK有关。见图6。
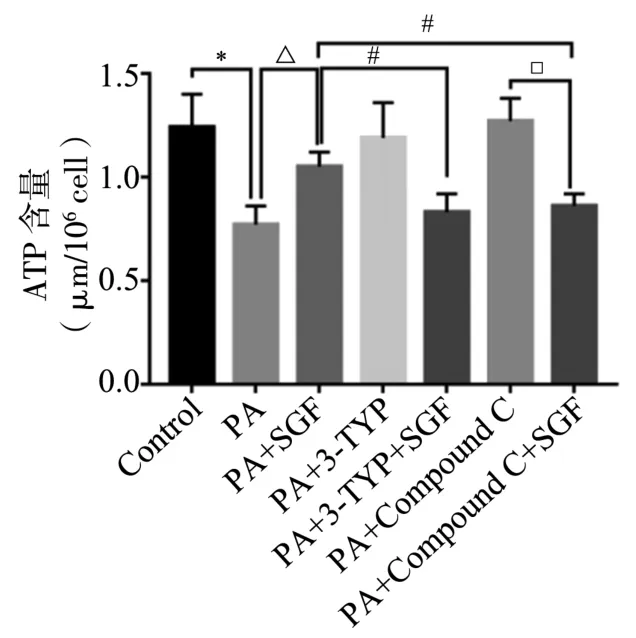
图6 各组HepG2细胞ATP含量比较
2.6 对HepG2细胞中线粒体结构的影响 与Control比较,PA的细胞出现线粒体肿胀、嵴断裂。与PA比较,PA+SGF细胞线粒体水肿减轻、无明显嵴断裂或者消失。与PA+SGF比较,PA+3-TYP+SGF、PA+Compound C+SGF细胞线粒体水肿程度升高,伴不同程度嵴断裂。结果提示,参葛方可稳定线粒体结构,且与SIRT3、AMPK有关。见图7。
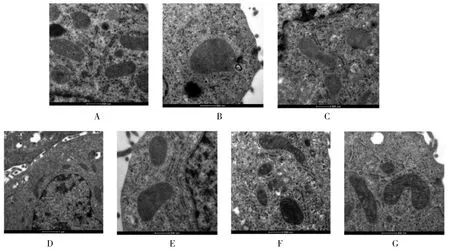
图7 参葛方对PA诱导的HepG2细胞线粒体结构的影响(铀铅双染色,×13 000)
3 讨论
中医学认为脂肪肝的发生多因先天脾胃虚弱或后天过食肥甘厚味,饮食不节,情志失调,导致肝失疏泄、脾失健运、气虚血瘀、痰瘀互结所致。痰脂结于肝脏则为肝癖,病久则累及肾脾,本虚标实,虚实相杂,治宜活血化瘀、清热利湿、补益肝肾、益气健脾。上海中医药大学附属曙光医院肝病科治疗NASH的有效验方参葛方,正是针对此病机特点所配伍的。方中丹参和姜黄活血行气化瘀,炒白术健脾化湿,葛根升清阳、促进气血津液的运行,垂盆草可以解毒利湿,另加女贞子滋补肝肾,使气血滋化有源。本方在临床上长期应用,可有效降低NASH患者的体质量,且能显著降低丙氨酸转氨酶(ALT)水平,调节血脂及提高肝脾计算机断层扫描(CT)比值[12];相关的基础研究[3-4]也肯定了参葛方能减轻NASH模型小鼠体质量及肝质量,减少肝脏脂质沉积,显著降低血清ALT、天冬氨酸转氨酶(AST)、TNF-α水平,减轻小鼠肝脏氧化应激反应。由此认为,参葛方治疗脂肪肝具有良好的发展前景,但其机制尚未明确。
对NASH临床文献进行用药规律研究,发现高频使用的药物主要为丹参、山楂、泽泻、决明子、柴胡、白术,提示这6味药可能是组成治疗NASH的核心处方[13]。在对参葛方的单体研究中发现,丹参中潜在有效成分,如丹参酮Ⅱ、丹酚酸b和丹参素,可通过调节细胞内分子靶点过氧化物酶体增殖激活受体α(PPARα)、细胞色素P450家族成员1A2(CYP1A2)、基质金属蛋白酶-2(MMP-2)等发挥抗氧化、调节脂质代谢的作用[14]。葛根素可通过激活AMPK信号通路,增加PPARα介导的氧化分解,从而改善HepG2细胞中的脂质沉积[15]。姜黄素可通过降低核因子-κB发挥抗炎作用、减少氧化应激,调节线粒体凋亡途径、保护线粒体功能[16-17]。白术多糖可显著降低肝组织CD36含量、升高apo B100含量,增加肝脏TG运转,减少脂质沉积[18]。这些研究辅证了参葛方治疗NASH的有效性。
关于NASH的发病机制研究众多,其中以“二次打击”学说作为其经典发病机制,最为广泛接受。首次打击已被证实与胰岛素抵抗有关,主要表现为肝内游离脂肪酸过度聚集;第二次打击则是在此基础上由ROS诱导的肝细胞氧化应激损伤。而ROS增加的主要原因是肝实质细胞的线粒体功能障碍,同时过量的ROS也会损伤线粒体,成为恶性循环。
SIRT3是一种线粒体NAD+依赖的去乙酰化酶,在肌肉、肝脏、心脏和褐色脂肪组织等代谢活动活跃的组织中高表达。当细胞处于应激状态时,剪切成短链的SIRT3进入线粒体,调解脂质代谢、增加活性氧清除酶活性、促进线粒体自噬、稳定线粒体功能,通过促进下游线粒体内主要的抗氧化酶SOD2基因的转录,增强机体的抗氧化水平,减轻NASH损伤[19-21]。AMPK作为细胞能量水平的传感器,可增强脂肪分解代谢而产生ATP,促进肝内脂肪酸的合成与氧化,减少脂质在肝脏中的沉积,起到调控线粒体生物发生的作用[22-24]。PGC-1α是AMPK下游效应分子,也是线粒体生物合成的最重要的调节因子,能够增加能量代谢和线粒体的生物合成[22,25]。
SIRT3可减少线粒体内ROS生成,通过改善氧化应激、影响线粒体呼吸链,以控制线粒体ATP的生成,且线粒体蛋白表现出高度的去乙酰化,引起AMPK磷酸化。被活化的AMPK可以调节PGC-1α表达,促进线粒体的生物合成,提高线粒体的呼吸功能,改善氧化应激,稳定线粒体功能。此三者与细胞氧化应激密切相关[26-28]。
本研究结果表明,参葛方可降低TG蓄积,增加PGC-1α表达,有效减轻肝细胞脂肪变性;降低ROS、MDA生成,抑制氧化应激损伤;提高ATP生成量,稳定线粒体结构,改善线粒体功能。参葛方可以增加SIRT3蛋白表达及AMPK磷酸化水平;应用3-TYP和Compound C后,以上作用均减弱。上述提示参葛方治疗NASH的作用机制可能与上调SIRT3、AMPK表达有关,为参葛方改善线粒体功能、抑制氧化应激治疗脂肪肝提供了理论依据。

