高效液相色谱—串联质谱法测定食品塑料包装材料中双酚A和壬基酚
唐吉旺 袁列江 肖 泳 王淑霞 潘 照 邓 航
(湖南省产商品质量检验研究院,湖南 长沙 410007)
双酚A(Bisphenol A,BPA)和壬基酚(Nonylphenol,NP)是一类典型的酚类环境雌激素,具有雌激素效应和慢性毒效应[1-2],常见于食品包装材料、容器内壁涂料及阻燃剂、抗氧化剂、黏合剂等精细化工产品中[3]。双酚A和壬基酚可以由食品接触材料迁移进入食品中,成为一种内分泌干扰物质对人体癌细胞生长及生殖能力产生严重影响[4],因此被列入欧盟优先控制污染物质名录。GB 9685—2016中规定:食品接触塑料材料及制品、食品接触用涂料和涂层、食品接触材料及制品用黏合剂中双酚和壬基酚的特定迁移限量(SML)分别为0.6 mg/kg和不得检出(方法规定检出限为0.01 mg/kg),其中双酚A不得用于生产婴幼儿专用接触材料及制品。
常见的壬基酚和双酚A的检测方法有酶联免疫吸附测定(ELISA)[5]、荧光检测法[6]、胶体金免疫层析法(ICA)[7]、液相色谱法(LC)[8-10]、气相色谱—质谱法(GC/MS)[11-12]及高效液相色谱—串联质谱法(HPLC-MS/MS)[13-15]等。高效液相色谱—串联质谱法因具有高通量、高灵敏度及高效率的特点被广泛应用于有机物的检测。研究拟通过优化样品前处理方法及固相萃取净化条件,开发基于固相萃取的高效液相色谱—串联质谱法测定食品接触包装材料中的双酚A和壬基酚的检测方法,以期为食品接触材料中双酚A和壬基酚的监测提供技术支持。
1 材料与方法
1.1 试剂与仪器
正己烷、甲醇、丙酮、乙酸乙酯、四氢呋喃及二氯甲烷:色谱纯,上海安谱科学仪器有限公司;
4-n-壬基酚标准品(纯度99.7%)、双酚A标准品(纯度99.7%)及双酚A-D4标准品:德国Dr.Ehrenstorfer公司;
壬基酚-13C6:A chemTek公司;
高效液相色谱—串联质谱仪:QTRAP 5500型,美国SCIEX公司;
超声仪:YQ-1007A型,上海易净超声波仪器有限公司;
离心机:Allegra 64R型,美国贝克曼公司;
试管振荡器:STD VORTEX Mixer型,美国Talboys公司;
超纯水仪:Milli-Q型,美国Millipore公司;
硅胶固相萃取柱:Agela型(1 g, 6 mL),天津博纳艾杰尔科技有限公司。
1.2 标准溶液的配制
分别称取适量的双酚A、4-n-壬基酚、双酚A-D4及壬基酚-13C6标准品,用甲醇溶解配制成质量浓度均为1.0 mg/mL 的标准储备液,于-18 ℃冰箱密封保存。移取适量各标准储备液,用甲醇配制成质量浓度均为10.0 mg/L 的混合标准中间液和混合内标中间溶液。移取不同体积的混合标准中间液,用甲醇配制成质量浓度分别为1,2,5,10,20,50,100,200 μg/L的系列混合标准工作液,内标的质量浓度均为50 μg/L。
1.3 样品处理
1.3.1 样品提取 将样品剪碎成细小片状,称取0.2 g(精确至0.001 g)样品于10 mL具盖玻璃试管中,加入10 mL二氯甲烷,涡旋振荡1 min,超声提取60 min。提取液转移至另一10 mL具盖玻璃试管中,在35 ℃以下氮吹浓缩至约1.0 mL,用正己烷定容,盖上塞子,涡旋振荡混匀。
1.3.2 样品净化 将以上提取溶液全部转移至经6 mL甲醇和6 mL正己烷活化过的硅胶固相萃取柱中。待样品溶液流完后用5 mL正己烷淋洗,弃去淋洗液并将柱子抽干。用5 mL正己烷+乙酸乙酯(V正己烷∶V乙酸乙酯=7∶3)溶液洗脱,收集全部流出液,准确加入50 μL混合内标使用液,涡旋振荡混匀后在35 ℃下氮吹浓缩至近干,准确加入1.0 mL甲醇,涡旋振荡1 min,以充分溶解残渣,试液经0.22 μm有机滤膜过滤后供高效液相色谱—串联质谱测定。
1.4 仪器条件
1.4.1 色谱条件 Venusil MP C18(2)色谱柱(100 mm×2.1 mm,2.6 μm),柱温30 ℃;流动相A为0.1%氨水溶液,流动相B为甲醇,流速0.3 mL/min;进样量10 μL;梯度洗脱程序见表1。
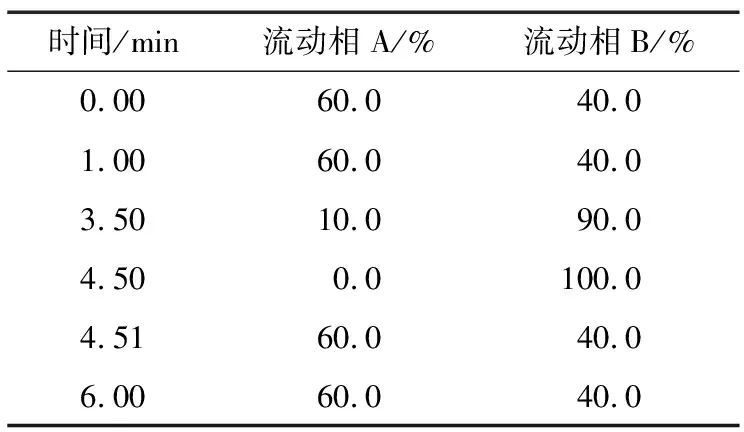
表1 流动相梯度洗脱程序
1.4.2 质谱条件 电喷雾离子源(ESI);离子源温度500 ℃;负离子扫描;喷雾电压4 500 V;气帘气压力0.24 MPa;喷雾气(Gas1)流速55 μL/min;辅助加热气(Gas2)55 μL/min;多反应监测(MRM)模式。
2 结果与讨论
2.1 质谱条件的优化
酚类环境雌激素具有酚羟基化学电离的性质,容易失去H+,因此,采用负离子模式扫描,以针泵连续流动进样,进行一级质谱扫描,得到各个化合物对应的母离子[M-H]-,然后分别对其进行子离子全扫描,找出两个响应强度较高的子离子并与其母离子组成两对离子对,优化碰撞能量(CV)及去簇电压(DP),得到的双酚A、4-n-壬基酚及内标双酚A-D4和壬基酚-13C6最优质谱参数见表2。
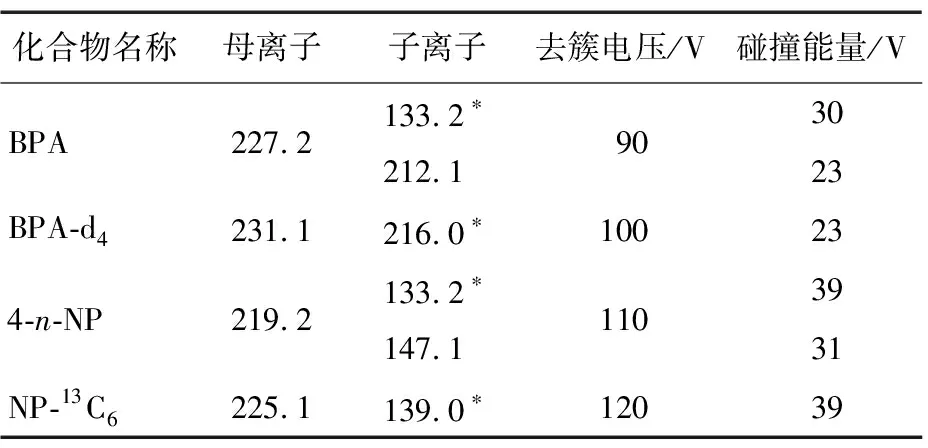
表2 双酚A、4-n-壬基酚及其内标的多反应质谱参数†
2.2 色谱条件的优化
2.2.1 色谱柱的选择 选用Venusi®AS-T C18、Hypersil GOLD、Phenomenex Knietex®F5、Venusil MP C18(2)4款柱子进行测试,试验结果表明双酚A、4-n-壬基酚及其内标在Venusil MP C18(2)柱上具有较好的峰形、响应及分离度,因此选择Venusil MP C18(2)作为分析柱。
2.2.2 流动相的优化 对比了甲醇—水、乙腈—水、甲醇—0.1%氨水、乙腈—0.1%氨水、甲醇—5 mmol乙酸铵含0.1%乙酸、乙腈—5mmol乙酸铵含0.1%乙酸6种不同流动相体系下的目标物的色谱图强度、峰形及分离效果,试验结果表明,双酚A、4-n-壬基酚及其内标在甲醇—水流动相体系中的响应值要高于其在相应的乙腈—水中的(约为2~3倍);当流动相为甲醇—0.1%氨水时,双酚A、4-n-壬基酚及其内标的响应值比其在甲醇—水中的大2~3倍;而当流动相为甲醇—5 mmol乙酸铵含0.1%乙酸时,双酚A、4-n-壬基酚及其内标的响应值相比其在甲醇—水中的有所下降。经分析,这是由于双酚A、4-n-壬基酚及其内标中的羟基能够电离出氢离子而呈现出一定的弱酸性,流动相体系加入一定量的氨水(呈弱碱性)能够促进待测目标化合物电离,提高其离子化效率;加入一定量的乙酸铵含0.1%乙酸反而抑制了待测目标化合物电离,导致其离子化效率降低。因此,最终确定甲醇—0.1%氨水为流动相。
2.3 提取方式及提取溶剂的选择
以二氯甲烷为提取溶剂,分别采取超声提取、振荡提取、快速溶剂萃取及索氏提取等不同提取方式对同时含有双酚A和4-n-壬基酚的阳性样品进行提取,结果见图1。由图1可知,超声提取效果与快速溶剂萃取及索氏提取效果相当且均优于振荡提取。采用快速溶剂萃取时,由于受快速溶剂提取仪塑料管道的影响,空白对照本底中含有少量的壬基酚,易干扰样品的测定;索氏提取耗时长,有机溶剂消耗量大,不环保,且不利于批量处理,前处理效率较低;超声提取操作简单易于批量处理,且提取效果较好。因此,选择采用超声提取方式对样品进行提取。
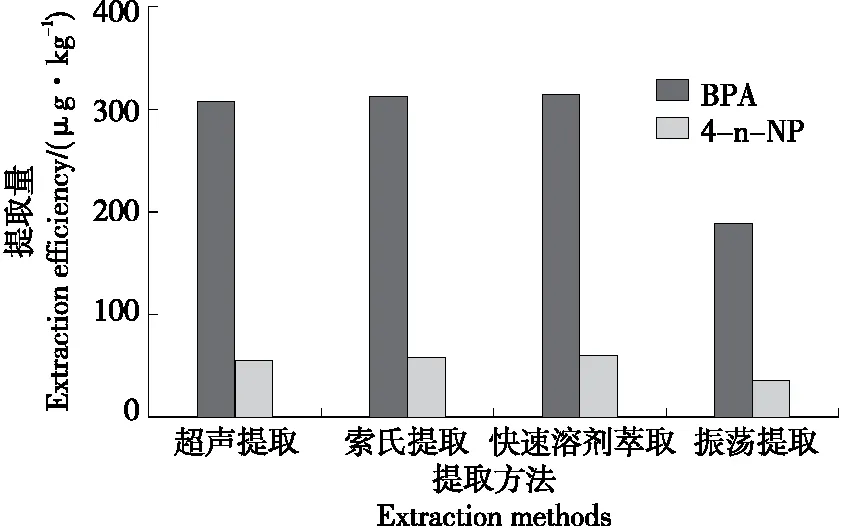
图1 提取方式对双酚A和4-n-壬基酚提取量的影响
分别用甲醇、无水乙醇、丙酮、乙酸乙酯、二氯甲烷、环己烷及正己烷7种溶剂对同时含有双酚A和4-n-壬基酚的阳性样品进行超声提取。用高效液相色谱—串联质谱测定不同提取溶剂中双酚A和4-n-壬基酚的含量,检测结果如图2所示。由图2可知,以二氯甲烷作为提取溶剂时,所测定样品中双酚A的含量最高,4-n-壬基酚的含量与以甲醇及乙酸乙酯为提取溶剂时的相当。因此,选择二氯甲烷作为提取溶剂。
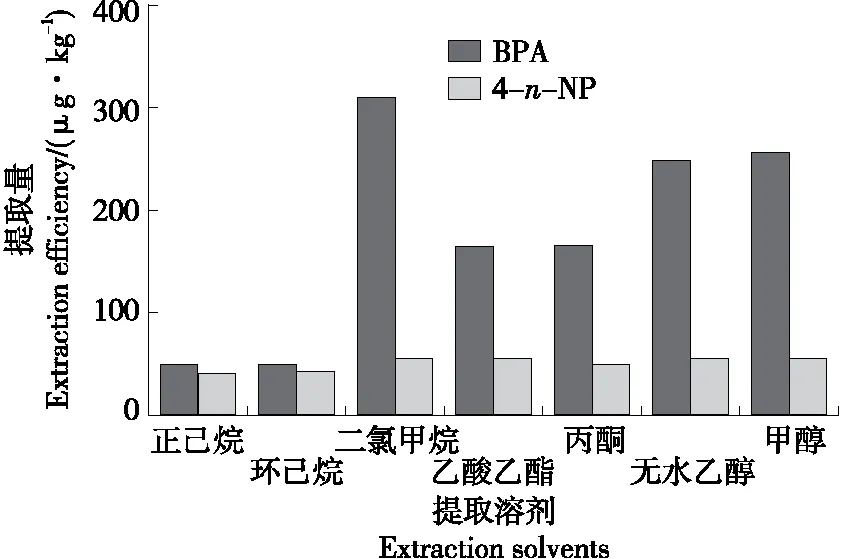
图2 提取溶剂对双酚A和4-n-壬基酚提取量的影响
2.4 净化条件的优化
2.4.1 固相萃取柱的选择 考虑到待测目标物双酚A和4-n-壬基酚化合物中含有极性较大的官能团,因此选择具有极性固定相的萃取柱。考察了硅胶柱、氨基柱、氟罗里硅土柱及中性氧化铝4种极性固相萃取柱的回收率。活化溶剂均为丙酮和正己烷,上样溶液均为100 μg/L双酚A和4-n-壬基酚的混合标准溶液[以正己烷+二氯甲烷(V正己烷∶V二氯甲烷=9∶1)为溶剂],淋洗溶剂均为正己烷,洗脱溶剂均为正己烷+丙酮(V正己烷∶V丙酮=7∶3),上柱体积均为5 mL。试验结果(如图3所示)表明,双酚A和4-n-壬基酚在硅胶柱上的回收率高于其在氨基柱、氟罗里硅土柱和中性氧化铝上的,因此选择硅胶固相萃取柱进行净化处理。
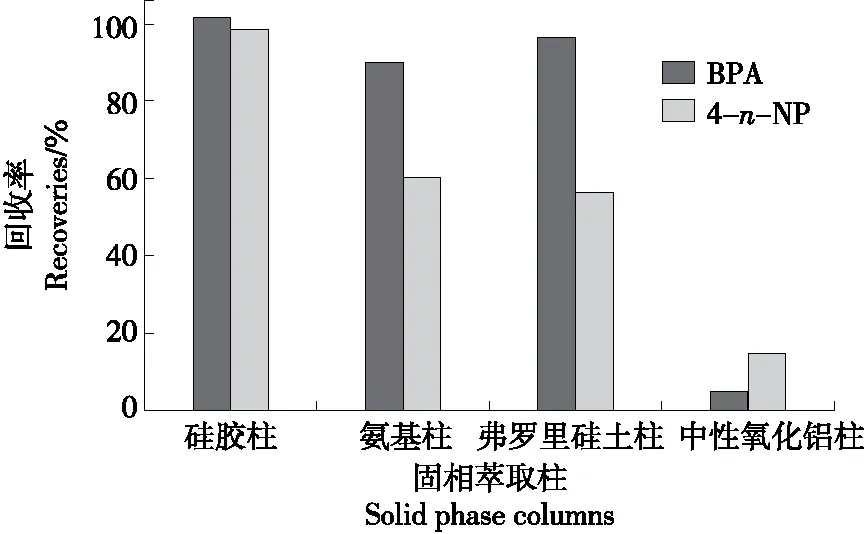
图3 固相萃取柱对双酚A和4-n-壬基酚回收率的影响
2.4.2 活化溶剂的选择 硅胶多孔性的硅氧烷交链骨架表面含有很多硅醇基基团,这些基团能够通过氢键与水分子连接导致其吸附性能降低。因此,活化的第一个目的是为了除去硅胶柱的水分,充分释放硅胶表面的硅醇基,提高其吸附性能。试验对比了丙酮和甲醇两种极性较强溶剂的活化效果。由于丙酮溶解色素的能力较强,采用丙酮活化时,不利于样品中色素在硅胶柱上的保留;而采用甲醇活化时既能达到活化的目的又有利于样品中色素在硅胶柱上的保留。因此,选用甲醇作为第一活化溶剂。经6 mL甲醇活化后,再用6 mL正己烷进行活化,其目的是建立一个非极性的基质环境以增强吸附剂和目标化合物之间的极性作用力。
2.4.3 样品溶剂及淋洗溶剂的选择 由于硅胶填料具有一定的极性,非极性的样品溶剂中不含有与其形成氢键的官能团,可以避免与填料产生对目标化合物的竞争性吸附。因此,选用极性相对较小的正己烷作为样品溶剂。以极性较大的二氯甲烷作为样品提取溶剂,使用前需将其浓缩至近1 mL,再用正己烷定容至10 mL,相当于样品溶剂为正己烷+二氯甲烷(V正己烷∶V二氯甲烷=9∶1)溶液。试验过程中没有将样品提取溶剂二氯甲烷全部挥发干,主要是基于以下两方面考虑:① 全部挥发干会导致目标物的损失且增加浓缩时间;② 保留1 mL二氯甲烷更有利于后续样品加标处理,因为标准物质溶剂为甲醇,容易与二氯甲烷混溶,但不能溶于纯正己烷。
为了确保目标物全部保留在固相萃取柱中,且尽可能除去其他干扰物,淋洗溶剂的极性不能太大,试验证明以正己烷作为淋洗溶剂能够确保目标物不被洗脱,同时还能除去一些干扰物质。因此,选择正己烷作为淋洗溶剂。
2.4.4 洗脱溶剂的选择 考察了四氢呋喃、二氯甲烷+四氢呋喃(V二氯甲烷∶V四氢呋喃=8∶2)、正己烷+四氢呋喃(V正己烷∶V四氢呋喃=9∶1)、二氯甲烷、二氯甲烷+乙酸乙酯(V二氯甲烷∶V乙酸乙酯=9∶1)、正己烷+甲醇(V正己烷∶V甲醇=9∶1)、正己烷+丙酮(V正己烷∶V丙酮=9∶1)、乙酸乙酯、正己烷+乙酸乙酯(V正己烷∶V乙酸乙酯=7∶3)、正己烷+乙酸乙酯(V正己烷∶V乙酸乙酯=6∶4)及正己烷+乙酸乙酯(V正己烷∶V乙酸乙酯=5∶5)11种溶剂的洗脱效果。洗脱效果主要是从两方面进行考察,① 洗脱目标物的回收率;② 洗脱后样品中的色素是否能够尽可能保留在硅胶固相萃取柱中而与目标物进行分离。试验结果表明,除正己烷+乙酸乙酯(V正己烷∶V乙酸乙酯=7∶3)外,其余洗脱剂均能够将样品中的色素洗脱下来,达不到理想的洗脱效果。以正己烷+乙酸乙酯(V正己烷∶V乙酸乙酯=7∶3)作为洗脱溶剂时,样品中的色素基本上能够保留在硅胶中,且双酚A和4-n-壬基酚的洗脱回收率均在90%以上。
2.5 方法学验证
2.5.1 方法的线性范围、检出限及定量限 采用内标法进行定量,以各待测目标物和其内标物的峰面积比值y和质量浓度比值x绘制标准曲线,考察双酚A和4-n-壬基酚的线性关系。由表3可知,双酚A和4-n-壬基酚在1~200 μg/L 范围内线性良好,相关性系数(R)>0.999。在净化后的空白基质样品溶液中添加双酚A和4-n-壬基酚标准溶液并对其进行测定,分别以定量离子的3倍信噪比(S/N=3)和10倍信噪比(S/N=10)确定该方法的检测限(LOD)为0.5 μg/kg和定量限(LOQ)为1.0 μg/kg。

表3 双酚A和4-n-壬基酚的线性方程、线性范围、相关系数、检出限及定量限
2.5.2 方法的准确度和精密度 双酚A和4-n-壬基酚的加标水平均为1.0,10.0,200.0 μg/kg,每个水平重复测定6次,对方法的准确度和精密度进行考察,结果见表4。结果表明,双酚A和4-n-壬基酚平均回收率在89.2%~101.2%,相对标准偏差(RSD)为3.1%~6.2%。
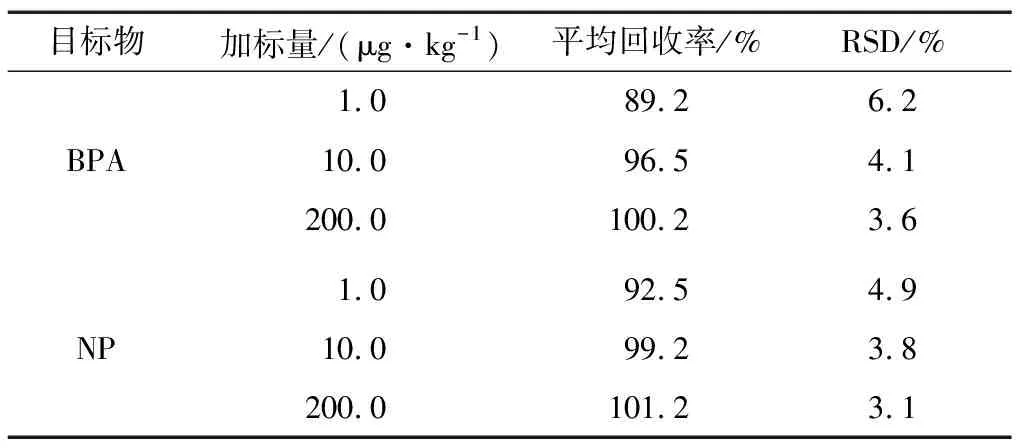
表4 食品包装材料中双酚A和4-n-壬基酚的平均添加回收率及相对标准偏差
2.6 实际样品的测定
运用建立的方法对市售30个食品塑料包装材料中的双酚A和4-n-壬基酚含量进行测定,样品包括蛋糕袋、牛奶袋、三明治饼干袋及麻辣熟食袋等常见的食品塑料包装材料。结果表明,5个样品检出双酚A,含量在5.25~190.25 μg/kg;10个样品检出4-n-壬基酚,含量在6.81~987.13 μg/kg。
3 结论
研究建立了一种基于固相萃取的高效液相色谱—串联质谱法的食品包装材料中双酚A和壬基酚含量检测方法。对样品提取和净化方式进行了优化,解决了样品提取效率低、净化效果差的问题。该方法准确、高效,可应用于食品塑料包装材料中双酚A和壬基酚的检测。

