基于“药辅合一”理念的当归精油纳米乳递药系统的构建、表征及评价
邱 菁,徐纯艺,周玮玲,赵淋仙,李燕燕,胡慧玲
基于“药辅合一”理念的当归精油纳米乳递药系统的构建、表征及评价
邱 菁,徐纯艺,周玮玲,赵淋仙,李燕燕,胡慧玲*
成都中医药大学药学院 西南特色中药资源国家重点实验室,四川 成都 611137
构建当归精油纳米乳(essential oil-loaded nanoemulsion,AEO-NE)递药系统并对其进行表征及稳定性、毛囊靶向、毛发生长促进作用评价。分别应用伪三元相图法和星点设计-响应面法(central composite experiment design-response surface method,CCD-RSM)对纳米乳处方进行筛选和优化。对纳米乳乳剂类型、粒径、ζ电位、多分散指数(polydispersity index,PDI)、微观形态、黏度、pH值进行表征。以粒径、PDI、外观变化及-藁本内酯含量为指标,评价最优处方纳米乳离心稳定性、放置稳定性以及稀释稳定性。通过在体给药荧光标记的AEO-NE于小鼠背部皮肤研究制剂毛囊靶向能力。应用C57BL/6小鼠研究AEO-NE体内促进毛发生长的作用。AEO-NE最优处方为AEO-辛基酚聚氧乙烯醚10(OP-10)-无水乙醇-水(2.25∶0.75∶1∶96);按最优处方所制AEO-NE外观澄清、透明、微泛蓝光,乳剂类型为O/W型,平均粒径为(15.95±0.33)nm,PDI为0.11±0.02,ζ电位为(−0.14±0.10)mV,pH值为5.89±0.16,黏度为(1.57±0.08)mPa·s,透射电镜结果表明AEO-NE乳滴呈球形,外观圆整,大小在20 nm内。AEO-NE离心稳定性、稀释稳定性良好,在4 ℃条件下密封避光放置稳定性良好,粒径及-藁本内酯含量无显著变化。AEO-NE局部皮肤给药24 h内均表现出毛囊靶向性,具有促进毛发生长的作用。基于“药辅合一”理念,成功构建了以AEO为唯一油相的AEO-NE,其宏观及微观形态、相关理化性质符合纳米乳制剂要求,稳定性良好,在靶向促进毛发生长方面具有一定潜力。
当归精油;纳米乳;伪三元相图;星点设计-响应面法;表征;稳定性评价;毛囊靶向;促进毛发生长
当归为伞形科植物当归(Oliv.) Diels的干燥根,具有补血活血、调经止痛、润肠通便的功效,兼具极高的药用价值和食用价值[1]。当归精油(essential oil,AEO)是当归中主要活性部位之一,含量约为1%。研究表明AEO具有多种药理作用,包括抗氧化、抗炎、抑菌等[2-5]。除此之外,当归作为“血中圣药”,对因气血不足和失于调达造成的斑秃、脂溢性脱发等具有良好的治疗效果。临床研究发现,以95%乙醇配制的含生药质量浓度为0.25 g/mL的AEO溶液临床治疗脱发有效率达76.2%[6]。
无翅型MMTV整合位点家族成员(wingless-type MMTV integration site family,Wnt)、骨形态发生蛋白(bone morphogenetic protein,BMP)、外胚叶发育不全蛋白基因(ectodysplasin-A,Eda)、Notch和Shh(Sonic hedgehog)通路与毛囊的分化及其形态产生密切相关,而核转录因子-κB(nuclear factor-κB,NF-κB)的水平对于以上信号通路的调控至关重要[7]。Wu等[8]研究发现,AEO的主要成分-藁本内酯具有抑制NF-κB信号通路的作用。对接斑秃主要原因——免疫炎性浸润,AEO具有显著的抗炎作用,能够显著下调肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、IL-1β等促炎因子水平[9-10]。综上,AEO在改善脱发、促进毛发生长方面具有一定潜力。然而,AEO亲脂性强,其主要成分具有遇光、热不稳定,水溶性差的缺点,限制了其在临床上的应用。
与普通乳液不同,纳米乳(nanoemulsion,NE)乳滴平均直径通常小于100 nm,因而其外观一般呈透明或半透明状[11-12]。NE具有增加难溶性药物溶解度[13]、提高稳定性[14]及生物利用度[15]的作用,是挥发油类药物的优良载体。此外,NE具有较强的皮肤递送能力[16],且其黏度小,皮肤顺应性良好[17]。AEO作为改善脱发症状的潜力药效物质,不但自身具有良好的皮肤渗透性,还对多种生物活性成分具有一定的促渗透作用[18],具备“药辅合一”的应用特色。
基于提高AEO稳定性、增强患者顺应性并充分体现“药辅合一”的原则,本研究拟将AEO作为油相制成经皮给药的纳米乳制剂,对其理化性质进行表征,并评价制剂稳定性及其毛发生长促进作用,以为斑秃、脂溢性脱发等皮肤疾病相关制剂的研发提供理论和实验依据。
1 材料与仪器
1.1 药品与试剂
辛基酚聚氧乙烯醚10(OP-10)、氢化蓖麻油聚氧乙烯醚(C0-40)、聚氧乙烯氢化蓖麻油(RH 40)、1,3-丁二醇、Labrasol、聚乙二醇-400(PEG-400),山东优索化工科技有限公司;聚山梨酯-80(Tween-80,T80)、无水乙醇、甘油,成都市科隆化学品有限公司;苏丹III染色液、1%亚甲基蓝染色液,北京索莱宝科技有限公司;无水硫酸钠,重庆茂业化学试剂有限公司;对照品-藁本内酯,批号MUST-22022602,10 mg/mL,2 mL/支,成都曼斯特生物科技有限公司;尼罗红,上海麦克林生化科技有限公司;达霏欣(2%米诺地尔),陕西振东安欣生物制药有限公司,批号20220503。
1.2 仪器与设备
85-2A型数显恒温测速磁力搅拌器,常州越新仪器制造有限公司;QUINTIX35-1CN型十万分之一电子分析天平,赛多利斯科学仪器有限公司;pHs-3C型pH计,上海仪电科学仪器股份有限公司;LitesizerTM500型纳米粒度电位仪,上海安东帕商贸有限公司;JEM 2100F型透射电子显微镜(TEM),日本捷欧路科贸有限公司;DM6B型显微镜、SOPI-SW0033型冷冻切片机,德国徕卡仪器有限公司;Agilent 1260型高效液相色谱仪,含DAD检测器,美国Agilent公司。
1.3 实验动物
6周龄健康雄性SPF级C57BL/6小鼠,体质量(20±2)g,由成都达硕实验动物有限公司提供,实验动物许可证号为SYXK(川)2020-030。所有小鼠实验期间全程饲养于(25±1)℃和50%~60%湿度下,每12小时进行光照/黑暗交替,并允许自由获取水和食物,实验开始前适应性喂养1周。所有动物实验遵循成都中医药大学实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 AEO的制备
取当归药材粉末适量,精密称定,参照《中国药典》2020年版挥发油测定法甲法采用水蒸气蒸馏法提取AEO,收集并用无水硫酸钠处理后,于4 ℃避光储存备用。采用GC-MS分析AEO的化学成分,其中以-藁本内酯含量最高,占比约80%。
2.2 当归精油纳米乳(AEO-NE)的制备
精密称取处方量的OP-10和无水乙醇,磁力搅拌混匀后加入AEO,磁力搅拌使其充分混匀,再逐滴加入去离子水,于室温、800 r/min条件下磁力搅拌30 min,即得AEO-NE。
2.3 Z-藁本内酯HPLC含量测定
2.3.1 色谱条件 色谱柱为Desc: Uranus C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(55∶45);检测波长320 nm;柱温35 ℃;体积流量1.0 mL/min;进样体积10 μL。
2.3.2-藁本内酯对照品溶液的配制 精密量取-藁本内酯对照品溶液(10 mg/mL)100 μL置于10 mL棕色量瓶中,加适量甲醇超声溶解并定容至刻度,配制成质量浓度为100 μg/mL的-藁本内酯对照品储备液。
2.3.3 AEO-NE供试品溶液的制备 精密吸取200 μL AEO-NE于10 mL棕色量瓶中,先加5 mL甲醇超声5 min破乳后,静置,再用甲醇定容,经0.22 μm微孔滤膜滤过,取续滤液作为AEO-NE供试品溶液。
2.3.4 阴性对照溶液的制备 取空白纳米乳(blank NE,B-NE)溶液,按照“2.3.3”项下方法制备,即得阴性对照溶液。
2.3.5 专属性考察 分别将-藁本内酯对照品溶液、AEO-NE供试品溶液、阴性对照溶液进样高效液相色谱仪,记录各色谱图,结果见图1,-藁本内酯在供试品溶液和对照品溶液中的出峰位置一致,结果表明AEO-NE中其他成分对-藁本内酯含量测定无影响。
2.3.6 线性关系考察 精密配制质量浓度分别为1.00、2.00、5.00、10.00、20.00、50.00、100.00 μg/mL的-藁本内酯对照品溶液,按“2.3.1”项下色谱条件,进样10 μL,以-藁本内酯对照品质量浓度为横坐标(),峰面积为纵坐标(),得回归方程为=9.704 7+2.158 2,2=0.999 6,结果表明-藁本内酯在1.00~100.00 μg/mL线性关系良好。

图1 B-NE (A)、Z-藁本内酯对照品(B) 和AEO-NE样品(C)的HPLC图
2.3.7 精密度考察 取同一AEO-NE供试品溶液,用0.22 μm微孔滤膜滤过后,按“2.3.1”项下色谱条件,进样10 μL,重复进样6次,记录色谱峰面积并计算其RSD值,结果表明RSD值为0.12%,仪器精密度良好。
2.3.8 重复性试验 取同一批AEO-NE 6份,按“2.3.3”项下方法制备供试品溶液,按“2.3.1”项下色谱条件,进样10 μL,记录峰面积并计算-藁本内酯质量浓度的RSD值,结果表明其RSD为1.95%,方法重复性良好。
2.3.9 稳定性试验 取新鲜制备的AEO-NE,按“2.3.3”项下方法制备供试品溶液,按“2.3.1”项下色谱条件,分别在制备后的0、1、2、4、8、12、24 h进样10 μL,记录峰面积,并计算峰面积RSD值。结果表明,RSD值为0.69%,AEO-NE供试品溶液在24 h内稳定性良好。
2.3.10 加样回收率试验 分别精密吸取5、10、20 μg/mL的-藁本内酯对照品溶液1 mL于一定体积B-NE样品中,每个浓度平行3份,涡旋混匀后经0.22 μm微孔滤膜滤过,取续滤液按“2.3.1”项下色谱条件进样10 μL,记录峰面积并计算平均加样回收率。结果表明加样回收率分别为(98.66±0.33)%、(96.79±0.24)%、(104.78±0.28)%,RSD值为0.33%、0.25%、0.27%,该方法准确性良好。
2.4 纳米乳递药系统构建
2.4.1 处方筛选 经预实验研究发现,以AEO为纳米乳递药系统的唯一油相,可以制得澄清、透明、微泛蓝光纳米乳。因此,基于精简处方、提高载药量和“药辅合一”理念,以目标药物AEO作为纳米乳递药系统的油相。基于水包油型(O/W)纳米乳的制备目的,根据亲水亲油平衡值(hydrophilic and lipophilic balance value,HLB)初步确定待筛选乳化剂为T80(HLB值∶15)、OP-10(HLB值∶13.6)、RH-40(HLB值∶14~16)、CO-40(HLB值∶14~16),待筛选助乳化剂为常用的甘油、PEG-400、Labrasol、1,3-丁二醇、无水乙醇。
采用水滴定法结合伪三元相图法,确定纳米乳递药系统中乳化剂和助乳化剂的种类以及乳化剂与助乳化剂的质量比(m)。伪三元相图的绘制:将乳化剂与助乳化剂按质量比为3∶1、2∶1、1∶1、1∶2混匀,再将混合表面活性剂(Smix)与AEO以9∶1、8∶2、7∶3、6∶4的质量比混合均匀,在800 r/min、(25±1)℃条件下逐滴加入去离子水,记录临界加水量,应用Origin 2019绘制伪三元相图并观察成乳区域面积。以伪三元相图纳米乳区域面积大小为指标,同时结合混合乳化剂的乳化能力(与油相在一定质量比条件下形成纳米乳的能力)确定纳米乳的处方组成。结果表明,以T80为乳化剂无法形成纳米乳,如图2~4所示,确定乳化剂为OP-10,助乳化剂为无水乙醇,m为2∶1。
2.4.2 星点设计实验 基于前期实验结果,以m(1)、油相与油相及混合表面活性剂得质量比[油/(油+Smix),2]为影响因素,以粒径(1)、PDI(2)、挥发油含量(3)的总评归一值(overall desirability,OD)为评价指标,应用Design Expert8.0.6软件采用2因素5水平的星点设计响应面法进行实验设计。因素、水平、实验安排及结果见表1。

图2 乳化剂筛选的伪三元相图

图3 助乳化剂筛选的伪三元相图

图4 Km筛选的伪三元相图
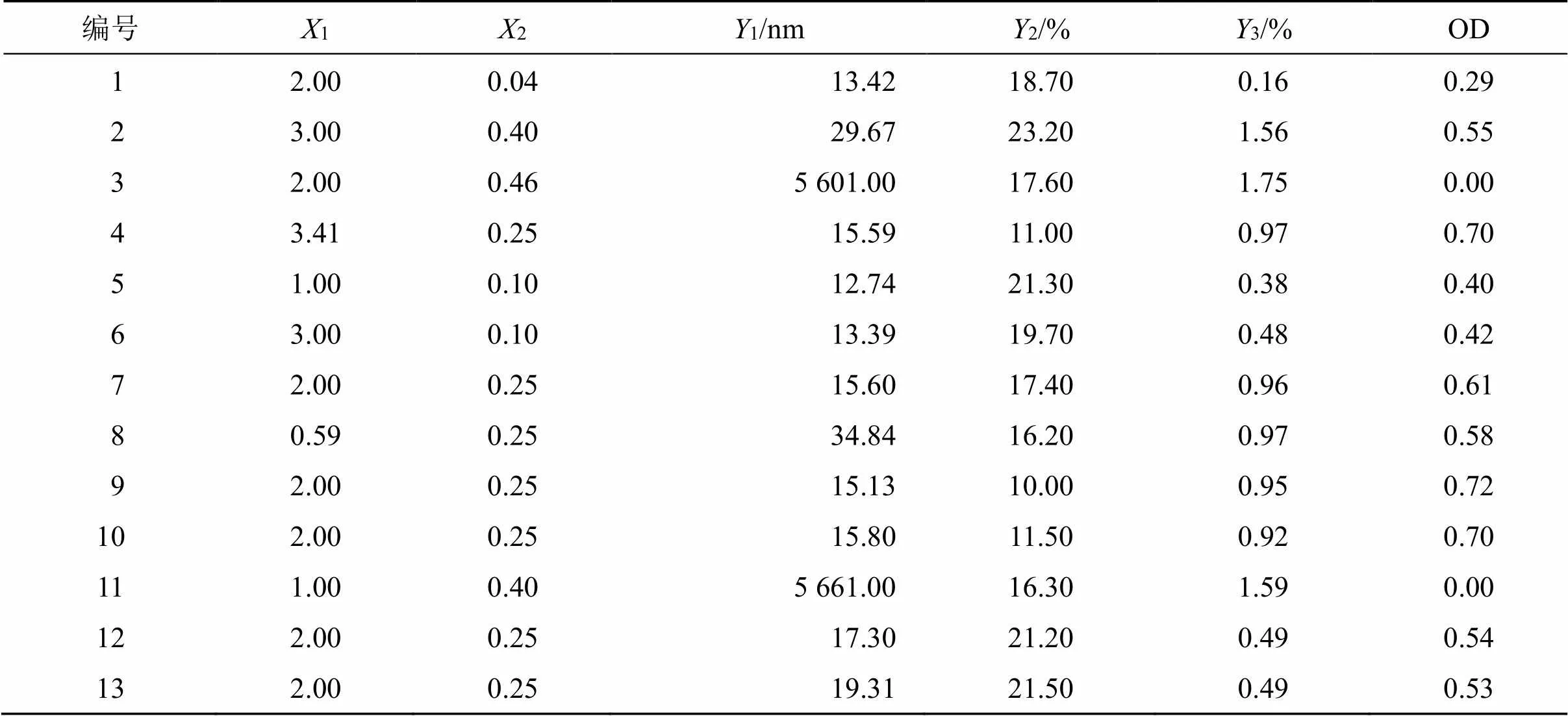
表1 CCD-RSM因素、水平及结果
OD=(12…d)1/n
对于取值越小越好的因素:d=(max-y)/(max-min)
对于取值越大越好的因素:d=(y-min)/(max-min)
2.4.3 模型拟合 通过Design-Expert 8.0.6软件对OD值进行二次非线性拟合,=26.63,=0.000 5<0.05,方程具有统计学意义,失拟项=1.27,=0.397>0.05,并拟合得回归方程OD=0.319 43-0.127 631+3.226 152+0.885 3412-11.114 1322。方差分析结果表明,回归模型=0.000 2<0.001,2为0.916 6,失拟项水平不显著(= 0.397>0.05),说明模型拟合良好,预测性好。根据所拟合的方程,应用Design-Expert 8.0.6软件绘制三维效应面图,见图5。
2.4.4 最优处方预测 根据平均粒径和PDI越小越好,OD值越大越好的标准并结合效应面图,预测出最优处方m=3∶1,挥发油与混合表面活性剂的质量比为0.26,OD值为0.715。最优处方为1% AEO、2.25% OP-10、0.75%无水乙醇、96%水。

图5 X1及X2对OD值影响的三维效应面图(A)及二维等高线图(B)
2.4.5 验证实验 按照最佳处方,按“2.2”项下方法平行制备3批AEO-NE,测定粒径、PDI并计算AEO含量,结果见表2。照优化处方制备的AEO-NE粒径较小且分布均一性良好,偏差较小,表明该方程预测性良好,重复性良好。

表2 最优处方验证实验结果(, n = 3)
2.5 纳米乳表征
2.5.1 乳剂类型鉴别 采用染色法和稀释法对AEO-NE乳剂类型进行鉴别。取等量AEO-NE装于2个磨口玻璃瓶中,分别加入等量水溶性染料亚甲基蓝和油溶性染料苏丹红III,观察比较二者在AEO-NE中的扩散速度。结果表明,水溶性染料亚甲基蓝在AEO-NE中的扩散速度快于油溶性染料苏丹红III。取适量AEO-NE,向其中加入一定量水,结果表明AEO-NE能被水稀释而不发生外观性状的变化。综上,AEO-NE为O/W型纳米乳。
2.5.2 粒径、ζ电位及多分散系数 按优化后处方制备AEO-NE 3批,于25 ℃条件下采用纳米粒度仪测定粒径、ζ电位及多分散系数。结果如图6所示,AEO-NE平均粒径大小为(15.95±0.33)nm,PDI为0.11±0.02,ζ电位为(−0.14±0.10)mV。
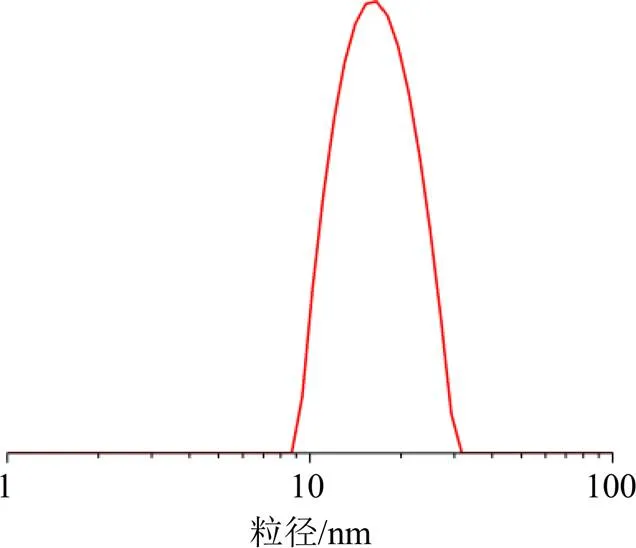
图6 AEO-NE的粒径分布
2.5.3 宏观和微观形态 最优处方AEO-NE外观澄清、透明、微泛蓝光,符合纳米乳的制剂特征(图7-c、d)。采用TEM对AEO-NE的微观形态进行表征,取少量AEO-NE滴于铜网的支持膜上,自然晾干,再用2%磷钨酸负染10 min,用滤纸吸去多余的染液,经自然晾干后,将铜网置于TEM下观察制剂微观形态并拍照。结果如图7-a、b所示,AEO-NE乳滴之间无黏连,呈球形,外观圆整,粒径在20 nm内。
2.5.4 pH值及黏度 人体正常皮肤表面pH值为5左右,呈弱酸性,皮肤给药制剂直接作用于皮肤,影响皮肤表面pH,因此,相关制剂pH应尽可能接近皮肤本身pH值[19-20]。按最优处方平行制备3批AEO-NE,应用pH计于室温条件下测定其pH值,平行3次。测量结果表明,最优处方AEO-NE pH为5.89±0.16(=3),符合皮肤给药制剂弱酸性的要求。皮肤外用制剂的感官特性对于患者尤为重要,易于涂抹、使用后无黏腻感可显著提高患者的顺应性。此外,较小的黏度有利于制剂渗透皮肤[21]。

图7 AEO-NE的TEM微观形态(100 nm, a; 50 nm, b)和宏观形态(c, d)
按最优处方平行制备3批AEO-NE,应用旋转黏度计于室温条件下测定其黏度,平行3次。结果表明,最优处方制备的AEO-NE的黏度为(1.57±0.08)mPa·s(=3),属于低黏度流体,适于皮肤局部给药。
2.5.5 载药量及包封率 照最优处方制备3批AEO-NE,并按“2.3.3”项下方法制备供试品溶液,经0.22 μm微孔滤膜滤过后取续滤液加入样品瓶,按“2.3.1”项下色谱条件进样,记录-藁本内酯峰面积,计算样品中-藁本内酯的含量。结果表明,AEO-NE载药量以-藁本内酯计为(0.69±0.01)%。
采用超滤离心法,取一定量AEO-NE于10 000超滤离心管中,以10 000 r/min离心(离心半径为9.2 cm)20 min,取滤液以适量甲醇溶解混匀,经HPLC检测-藁本内酯含量,并按公式计算包封率。结果表明,AEO-NE的包封率为(99.28±0.44)%。
包封率=(total-free)/total
total为制剂中-藁本内酯含量,free为滤液中-藁本内酯含量
2.6 稳定性评价
2.6.1 离心稳定性 取适量AEO-NE分别于6000、8000、10 000 r/min(离心半径为6.2 cm)条件下离心20 min,观察并测定离心前后外观性状、粒径及PDI的变化。结果如表3所示,AEO-NE在6000、8000、10 000 r/min离心后粒径未发生显著变化,PDI仍保持在30%以内,且外观仍呈澄清、透明、微泛蓝光状,未产生分层、沉淀等不稳定现象,表明离心稳定性良好。

表3 不同离心转速条件下AEO-NE离心前后粒径和PDI变化(, n = 3)
2.6.2 稀释稳定性 用蒸馏水将AEO-NE分别稀释50、100、200、1000倍,观察AEO-NE稀释前后外观性状。结果表明,按照以上倍数稀释后,AEO-NE仍呈澄清透明状,未产生分层、破乳、沉淀等不稳定现象,表明稀释稳定性良好。
2.6.3 放置稳定性 将AEO-NE装于棕色密封螺口瓶中,分别在4、25、60 ℃条件下放置3个月,观察外观性状并测定粒径及-藁本内酯含量变化情况。AEO-NE在60 ℃条件下不稳定,发生分层、破乳等不稳定现象,而在4、25 ℃条件下可维持澄清透明。
如表4所示,AEO-NE在4 ℃条件下放置稳定性良好,粒径无显著变化,在25 ℃条件下粒径显著增加(<0.001);2种温度条件下,PDI均保持在30%以内;4 ℃、避光条件下,AEO-NE中主要成分-藁本内酯含量仅下降约2.5%,而在25 ℃、避光条件下,制剂中主要成分-藁本内酯含量下降达75%。综上,AEO-NE在4 ℃、避光条件下放置稳定性良好。

表4 不同温度下AEO-NE放置3个月粒径、PDI及Z-藁本内酯含量变化(, n = 3)
与同温度0 d比较:***<0.001;与同时间4 ℃比较:###<0.001
***< 0.0010 d at the same temperature;###< 0.0014 ℃ at the same time
2.7 毛囊靶向研究
以尼罗红为荧光探针制备荧光标记的AEO-NE和AEO,精密吸取100 μL涂抹于C57BL/6小鼠背部脱毛区皮肤(2 cm×2 cm),分别于给药12、24 h后将小鼠处死,取给药区皮肤,经冷冻切片(纵切,10 μm)后置于荧光显微镜(552 nm,×20)下观察。如图8-c、d所示,AEO给药12 h,药物主要停留在皮肤表皮层,给药24 h后可观察到药物进入皮肤真皮层,但分布无规则。如图8-a、b所示,AEO-NE给药12、24 h后,皮肤全层均有红色荧光,说明AEO-NE能成功穿透皮肤各层;其中以真皮层毛囊部位的荧光最强,说明AEO-NE具有一定的毛囊靶向能力。
2.8 AEO-NE的体内促进毛发生长药效学研究
2.8.1 造模 用宠物剃毛器剃除小鼠脊柱两侧背部的毛发(面积约为4 cm2=2 cm×2 cm)使其变短后,取适量脱毛膏涂抹于剃毛部位,3~4 min后除去残余毛发并用温水清洗干净,选取脱毛区皮肤为粉红色或肤色且无破损的小鼠进行后续实验。
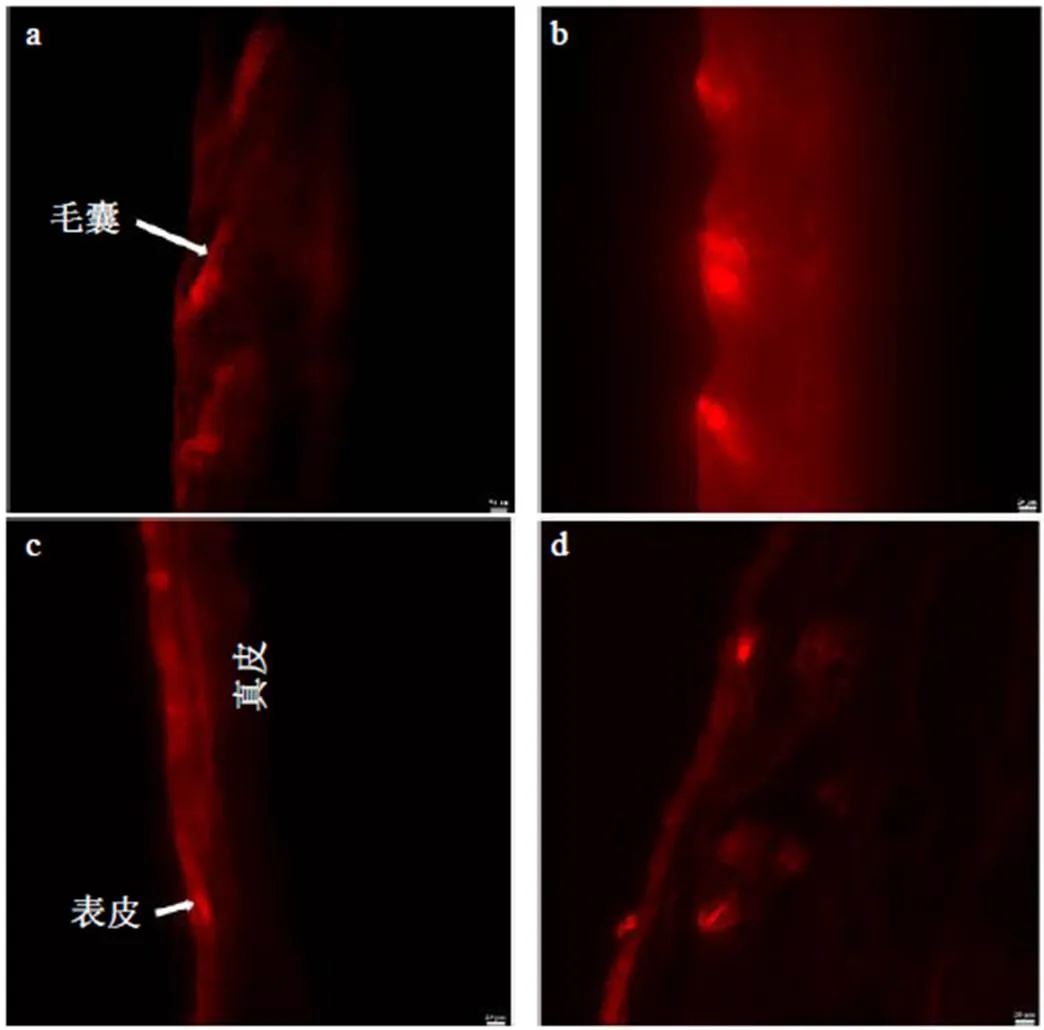
a、b-AEO-NE给药12、24 h c、d-AEO给药12、24 h
2.8.2 动物分组及给药 24只C57BL/6小鼠随机分为对照组(B-NE)、AEO-NE组、阳性对照组(2%米诺地尔)及AEO组,每组6只。在造模24 h后,用微量移液器吸取药液后,用吸头均匀涂抹在小鼠脱毛区皮肤上,待背部涂药区完全挥干后,再放入笼中。每次给药前使用生理盐水将背部给药区清洗干净后擦干,随即给药,每天涂抹100 μL,每天1次,连续21 d。
2.8.3 体内促进毛发生长作用评价 于给药第21天测定小鼠新生毛发长度,在脱毛区中间部位随机拔取新生毛发5根,在放大镜下用游标卡尺下观察测量,将毛发两端的最远距离记为毛发长度,取平均值。末次给药24 h后,将小鼠备皮,处死,取背部定点皮肤(面积约2 cm×2 cm),10%福尔马林固定,石蜡包埋切片,常规HE染色。在光学显微镜下观察切片,对比分析各组的毛囊生长情况,并将病理切片置于光学显微镜(×200倍)对毛囊进行计数分析。
结果如表5所示,与对照组相比,AEO-NE及阳性药(2%米诺地尔)组小鼠毛发长度、毛囊密度均显著增加(<0.05、0.01),AEO组虽无显著性差异,但仍有增加趋势。AEO-NE组小鼠毛囊密度最大(<0.01),且显著高于AEO组(<0.01),说明纳米乳递药系统有利于AEO的局部皮肤递送。如图9所示,各组小鼠给药区域皮肤各层分界清晰,均未见明显炎性细胞浸润,AEO-NE组小鼠可见大量毛囊增多。综上,AEO-NE可以显著增加新生毛发长度、增大毛囊密度,具有促进C57BL/6小鼠毛发生长的作用,且无明显皮肤刺激性。

表5 C57BL/6小鼠新生毛发长度、毛囊密度测量结果(, n = 6)
与对照组比较:*<0.05**<0.01;与AEO-NE组比较:##<0.01
*< 0.05**< 0.01control group;##< 0.01AEO-NE group

图9 C57BL/6小鼠皮肤组织病理学
3 讨论
脱发疾病发生率高,影响着全世界上亿人,仅斑秃就困扰着数百万人[22-23]。脱发属于皮肤科常见病和多发病,以脂溢性脱发和斑秃最为常见[24],虽不会危及生命健康,但均明显影响患者外在形象,从而可能会产生较为严重的心理后果,包括高度焦虑和抑郁等[25]。治疗脱发的药物以合成药物为主,包括钾离子通道类药物(米诺地尔及其衍生物)、抗雄激素药物(非那雄安和螺内酯)、抗炎的糖皮质激素类药物等[26-27]。上述药物安全性、长期有效性、不良反应等问题的存在,限制了其临床应用。基于安全性较高的特点,天然药物及其有效成分在脱发疾病的治疗领域受到广泛关注。研究表明,酸枣仁精油、薰衣草精油、薄荷精油、侧柏精油等挥发油均有一定的促进毛发生长的作用[28-31],提示天然植物来源的挥发油在治疗脱发疾病方面具有一定潜力。
皮肤是人体最大的器官,经皮给药途径为药物的吸收提供了更大的表面积,有利于临床疗效的发挥[32]。且与口服、注射剂等相比,经皮肤递药具有增强患者顺应性的优势。皮肤角质层的障碍是药物进入皮肤的关键难题,其解决方法一般分为物理方法(微针、微射流、激光、电导等)和化学方法(渗透促进剂、生物肽等)2种[33-34]。“药辅合一”是中药制剂过程中辅料使用的一大重要原则,也是中药制剂区别于化药制剂的显著特征,但在新型递药系统中较少得到体现。AEO既是改善脱发症状的潜力药效物质,又具有促渗透作用,可作为一种具有促渗透作用的亲脂性油状液体,在纳米乳递药系统中既能充当油相又能作为促渗透剂,充分体现了“药辅合一”的原则。此外,基于前期预实验结果及精简处方、提高目标药物含量的考虑,本研究以AEO为纳米乳递药系统唯一油相,制备皮肤给药发挥局部作用的AEO-NE,以提高原料药物AEO的稳定性,精准递药于毛囊,发挥促进毛发生长作用。本实验首先通过单因素实验确定磁力搅拌速度为800 r/min,搅拌时间为30 min,应用伪三元相图法筛选纳米乳处方中乳化剂、助乳化剂的种类以及m。乳化剂筛选过程中发现,以AEO为油相,常用乳化剂T80与各助乳化剂在一定质量比条件下均不能形成纳米乳,可能与湿度有关。RH-40伪三元相图面积稍大于OP-10,但实验发现以RH-40为乳化剂、混合表面活性剂与油相质量比为6∶4时,不能形成纳米乳;以OP-10为乳化剂、混合表面活性剂与油相质量比为6∶4时,能形成纳米乳,因此综合考虑初步确定乳化剂为OP-10。
药物的尺寸会影响其皮肤递送的效率,一般尺寸越小越容易进入皮肤的较深层[35]。制剂表征结果表明,AEO-NE粒径较小,利于AEO进入皮肤深层发挥药理作用。药效学研究证实,AEO-NE较AEO增加毛发长度、毛囊密度的作用强,表明NE有利于AEO的皮肤递送,发挥毛发生长促进作用。荧光成像结果表明,皮肤给药AEO-NE在24 h内表现出一定的毛囊靶向性,有利于药效的精准发挥和毒性的降低。综上,纳米乳在毛囊相关疾病的制剂开发方面具有一定前景。本研究成功构建了适于皮肤给药的AEO-NE,揭示了其在靶向治疗毛囊相关疾病的潜力,但皮肤刺激性、皮肤渗透及滞留等性能的体内外评价有待进一步开展。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 139.
[2] Li X C, Wu X T, Huang L. Correlation between antioxidant activities and phenolic contents of(Danggui) [J]., 2009, 14(12): 5349-5361.
[3] Li S Y, Yu Y, Li S P. Identification of antioxidants in essential oil ofusing HPLC coupled with DAD-MS and ABTS-based assay [J]., 2007, 55(9): 3358-3362.
[4] Chao W W, Hong Y H, Chen M L,. Inhibitory effects ofethyl acetate extract and major compounds on NF-kappaB trans-activation activity and LPS-induced inflammation [J]., 2010, 129(2): 244-249.
[5] Gong W X, Zhou Y Z, Gong W L,. Coniferyl ferulate exerts antidepressant effect via inhibiting the activation of NMDAR-CaMKII-MAPKs and mitochondrial apoptotic pathways [J]., 2020, 251: 112533.
[6] 李铭. 当归精油的生发作用临床观察 [J]. 中医药研究, 1995(1): 28.
[7] Gregoriou S, Papafragkaki D, Kontochristopoulos G,. Cytokines and other mediators in alopecia areata [J]., 2010, 2010: 928030.
[8] Wu Z W, Uchi H, Morino-Koga S,.-ligustilide ameliorated ultraviolet B-induced oxidative stress and inflammatory cytokine production in human keratinocytes through upregulation of Nrf2/HO-1 and suppression of NF-κB pathway [J]., 2015, 24(9): 703-708.
[9] Li J, Hua Y L, Ji P,. Effects of volatile oils ofon an acute inflammation rat model [J]., 2016, 54(9): 1881-1890.
[10] Fu R H, Hran H J, Chu C L,. Lipopolysaccharide-stimulated activation of murine DC2.4 cells is attenuated by-butylidenephthalide through suppression of the NF-κB pathway [J]., 2011, 33(5): 903-910.
[11] McClements D J. Emulsion design to improve the delivery of functional lipophilic components [J]., 2010, 1: 241-269.
[12] McClements D J. Edible nanoemulsions: Fabrication, properties, and functional performance [J]., 2011, 7(6): 2297-2316.
[13] Shakeel F, Faisal M S. Nanoemulsion: A promising tool for solubility and dissolution enhancement of celecoxib [J]., 2010, 15(1): 53-56.
[14] Lima T S, Silva M F S, Nunes X P,. Cineole-containing nanoemulsion: Development, stability, and antibacterial activity [J]., 2021, 239: 105113.
[15] Zeng F Y, Wang D D, Tian Y,. Nanoemulsion for improving the oral bioavailability of hesperetin: Formulation optimization and absorption mechanism [J]., 2021, 110(6): 2555-2561.
[16] Abd E, Benson H A E, Roberts M S,. Minoxidil skin delivery from nanoemulsion formulations containing eucalyptol or oleic acid: Enhanced diffusivity and follicular targeting [J]., 2018, 10(1): 19.
[17] Grampurohit N, Ravikumar P, Mallya R. Microemulsions for topical use-A review [J]., 2011, 45(1): 100-107.
[18] 赵婷婷, 张彤, 项乐源, 等. 当归、丁香挥发油的促透皮吸收作用 [J]. 中成药, 2016, 38(9): 1923-1929.
[19] Blaak J, Staib P. The relation of pH and skin cleansing [J]., 2018, 54: 132-142.
[20] Lambers H, Piessens S, Bloem A,. Natural skin surface pH is on average below 5, which is beneficial for its resident flora [J]., 2006, 28(5): 359-370.
[21] Ahmad K, Win T, Jaffri J M,. Palm olein emulsion: A novel vehicle for topical drug delivery of betamethasone 17-valerate [J]., 2018, 19(1): 371-383.
[22] Adil A, Godwin M. The effectiveness of treatments for androgenetic alopecia: A systematic review and meta-analysis [J]., 2017, 77(1): 136-141.
[23] 马欢. “头顶”市场规模扩张防脱产品路向何方? [J]. 中国化妆品, 2020(11): 28-31.
[24] Škulj A Z, Poljšak N, Glavač N K,. Herbal preparations for the treatment of hair loss [J]., 2020, 312(6): 395-406.
[25] Hunt N, McHale S. The psychological impact of alopecia [J]., 2005, 331(7522): 951-953.
[26] Blumeyer A, Tosti A, Messenger A,. Evidence-based (S3) guideline for the treatment of androgenetic alopecia in women and in men [J]., 2011, 9(Suppl 6): S1-S57.
[27] Meidan V M, Touitou E. Treatments for androgenetic alopecia and alopecia areata [J]., 2001, 61(1): 53-69.
[28] Yoon J I, Al-Reza S M, Kang S C. Hair growth promoting effect ofessential oil [J]., 2010, 48(5): 1350-1354.
[29] Oh J Y, Park M A, Kim Y C. Peppermint oil promotes hair growth without toxic signs [J]., 2014, 30(4): 297-304.
[30] Lee B H, Lee J S, Kim Y C. Hair growth-promoting effects of lavender oil in C57BL/6 mice [J]., 2016, 32(2): 103-108.
[31] Zhang Y, Chen S S, Qu F Z,.andevaluation of hair growth potential of, and GC-MS analysis of the active constituents of volatile oil [J]., 2019, 238: 111835.
[32] Desai P, Patlolla R R, Singh M. Interaction of nanoparticles and cell-penetrating peptides with skin for transdermal drug delivery [J]., 2010, 27(7): 247-259.
[33] Hwa C, Bauer E A, Cohen D E. Skin biology [J]., 2011, 24(5): 464-470.
[34] Münch S, Wohlrab J, Neubert R H H. Dermal and transdermal delivery of pharmaceutically relevant macromolecules [J]., 2017, 119: 235-242.
[35] Verma D D, Verma S, Blume G,. Particle size of liposomes influences dermal delivery of substances into skin [J]., 2003, 258(1/2): 141-151.
Construction, characterization and evaluation ofessential oil-loaded nanoemulsion drug delivery system based on concept of “combination of drugs and adjuvants”
QIU Jing, XU Chun-yi, ZHOU Wei-ling, ZHAO Lin-xian, LI Yan-yan, HU Hui-ling
State Key Laboratory of Southwestern Traditional Chinese Medicine Resources, College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
To prepare, characterizeessential oil (AEO)-loaded nanoemulsion (AEO-NE) and evaluate on its hair follicle targeted capacity, hair growth promoting effect and stability.The pseudo-ternary phase diagram method and central composite design-response surface method (CCD-RSM) were used to screen and optimize the prescription of AEO-NE, respectively. The type, average droplet size, ζ potential, polydispersion index (PDI), microscopic morphology, viscosity and pH of AEO-NE were characterized. The centrifugation stability, placement stability and dilution stability of the optimized AEO-NE were evaluated with particle size, PDI, appearance change and content of-ligustilide as indicators. The hair follicle targeted ability of AEO-NE was investigated by administrating fluorescin-labeled AEO-NE to the back skin of mice. The promoting effect of AEO-NE on hair growth was studied in C57BL/6 mice.The optimized formula of AEO-NE consisted 2.25% octylphenol polyoxyethylene ether 10 (OP-10), 0.75% absolute ethanol, 1% AEO and 96% water; The appearance of the optimized AEO-NE was clear, transparent and slightly blue. The emulsion type is O/W type, the average particle size was (15.95 ± 0.33) nm, the PDI was 0.11 ± 0.02, the ζ potential was (−0.14 ± 0.10) mV, the pH value was 5.89 ± 0.16, and the viscosity was (1.57 ± 0.08) mPa·s. The result of transmission electron microscope showed that AEO-NE was spherical and round, and its size was within 20 nm. AEO-NE had good stability in centrifugation and dilution, and was stable at 4 ℃ avoiding light with no significant changes in droplet size and-ligustilide content. AEO-NE showed hair follicle targeted property within 24 h with local skin administration, and had the effect of promoting hair growth.Based on the concept of “combination of drugs and adjuvants”, the AEO-NE with AEO as the only oil phase was successfully constructed. Its macro- and micro-morphology, related physical and chemical properties met the requirements of nanoemulsion preparation. With good stability, AEO-NE had certain potential in hair follicle-targeted promoting hair growth.
essential oil; nanoemulsion; selection of composition; CCD-RSM; characterization; stability evaluation; hair follicle targeted; hair growth promoting effect
R283.6
A
0253 - 2670(2023)06 - 1783 - 10
10.7501/j.issn.0253-2670.2023.06.010
2022-10-19
四川省科技厅项目(2019ZYZF0171)
邱 菁(1998—),女,硕士研究生,研究方向为中药制剂新剂型、新技术。E-mail: 1814105634@qq.com
胡慧玲,女,教授,硕士生导师,研究方向为中药制剂新剂型、新技术。E-mail: huhuiling@cdutcm.edu.cn
[责任编辑 郑礼胜]