红花CDPK基因家族的鉴定及表达分析
胡祥祥,许 姣,2,宋梦瑶,2,朱畇昊,2
(1.河南中医药大学药学院,河南郑州 450046; 2.呼吸疾病诊疗与新药研发河南省协同创新中心,河南郑州 450046)
Ca2+作为第二信使,负责协调植物对内外界各种刺激的感知,在植物体内多种信号途径传导过程中起重要作用。钙信号感应器识别Ca2+浓度变化,将信号传递至下游级联系统,激活植物逆境响应机制。钙依赖蛋白激酶(CDPK)是CDPK-SnRK超家族的主要成员[1],广泛存在于植物和一些原生生物中,具有典型的丝氨酸和苏氨酸激酶结构域及EF-hand结构域,在植物生长和发育、激素信号传导中发挥重要作用[2]。研究表明,CDPK在植物中主要以器官分布为主,且参与植物生长发育的大部分过程,如细胞骨架建成、气孔运动、以及生物与非生物胁迫响应等[3-5]。此外,CDPK还参与植物细胞内其他的信号通路,如脱落酸(ABA)信号通路、茉莉酸信号通路、水杨酸合成途径等等[6]。目前,已有研究对许多植物的全基因组水平进行CDPK及相关基因家族鉴定。
红花(CarthamustinctoriusL.)是菊科红花属植物,一种重要的草本植物,以花入药,有活血化瘀之功效。红花种子含油率为20%~40%,平均亚油酸含量高于75%,素有“亚油酸之王”的美誉,同时还含有丰富的维生素和人体必需的氨基酸[7]。红花喜欢温暖、干燥的气候,较一般植物有着较强的抗寒能力。但是红花对栽培条件要求较高,抗旱怕涝,这也是目前影响红花产业发展的一个重要因素。然而,对于CDPK基因家族是否介导红花生长发育的调控目前尚无研究报道。
本研究通过对红花全基因组数据库的搜索,筛选出CDPK基因家族成员,通过构建系统进化树、染色体定位、基因组比较等生物信息学方法,分析CDPK基因的进化关系,以期为探究红花CDPK基因家族功能奠定一定的基础。
1 材料与方法
1.1 红花CDPK基因家族的鉴定
分别从红花基因组数据库(http://safflower.scuec.edu.cn)和拟南芥(Arabidopsisthaliana)数据库TAIR (https://www.ara‐bidopsis.org/)下载红花的30个CDPK基因蛋白序列以及拟南芥21个CDPK基因的蛋白序列,进行本地BLASTp比对,得到最佳比对结果,通过Pfam 和CDD在线工具对得到的序列进行结构域确认,选择同时含有CDPK蛋白典型结构域的蛋白序列,利用在线工具Expasy ProtParam对CtCDPK蛋白的分子量、等电点(pI)等进行分析。利用GPS-Lipid 网站预测N-豆蔻酰化和十六烷酰化的位点。利用CELLO V2.5网站预测红花CDPK蛋白的亚细胞定位信息。
1.2 红花CDPK基因家族染色体定位
利用 Perl 程序从红花基因组注释信息中获取得到CtCDPK基因的染色体位置信息,之后利用MapChart软件构建红花染色体定位图。
1.3 系统进化树的构建与分析
利用从拟南芥数据库TAIR下载21个AtCDPK蛋白序列,运用MEGA 7.0软件,将下载的21个ATCDPK蛋白与鉴定得到的30个CtCDPK蛋白进行序列比对,通过邻接法构建系统进化树[8]。
1.4 基因结构和保守基序、保守结构域分析
根据红花基因组注释信息GFF文件中CDPK基因的外显子和内含子位置信息,利用GSDS 网站(http://gsds.gao-lab.org/)绘制红花CDPK基因结构图。利用MEME在线网站(http://meme-suite.org/tools/meme)对红花CDPK蛋白序列保守基序进行分析。
1.5 顺式作用元件预测
利用TBTools提取红花CtCDPK基因家族成员密码子上游1 500 bp,然后提交到PlantCARE数据库预测顺式作用元件,然后利用GSDS网站绘图。
1.6 蛋白互作网络分析
将红花CDPK蛋白序列导入STRING数据库(https://string-db.org/),建立蛋白互作网络(protein-protein interaction networks,PPI),将结果保存为TSV文件,然后通过Cytoscape软件将PPI网络可视化。
1.7 红花CDPK基因家族表达模式分析
从NCBI数据库分别下载红花3个部位:叶、花瓣、种子(PRJNA76135)上传于2011年10月29日的高通量测序原始数据;5个时期:小芽期、中芽期、初花期、盛花期、烂花期(PRJNA774916)上传于2021年10月27日的高通量测序原始数据,利用NCBI SRA Toolkit将测序数据sra文件转换为fasta文件,利用转录组定量工具Kallisto计算TPM,将其作为基因表达量,利用Tbtools将结果可视化。
2 结果与分析
2.1 红花CDPK基因家族的理化性质分析
根据鉴定筛选结果在红花中共获得30个CDPK基因家族成员,并依次命名为CtCDPK1~CtCDPK30(表1)。随后通过对红花CDPK蛋白基因家族进行分子量及等电点的理化性质分析,分析结果表明,其中最长的CtCDPK16编码855个氨基酸,分子量为93 251.66;最短的CtCDPK12编码418个氨基酸,分子量为47 781.96。30个CDPK蛋白家族等电点介于5.09~9.26之间,大部分蛋白等电点小于7。亚细胞定位结果表明,大部分成员定位在叶绿体和细胞质中,小部分定位在线粒体等其他地方。与此同时,大部分基因家族成员N端并没有发现豆蔻酰化保守序列位点,但是均有十六烷酰化的保守序列位点。
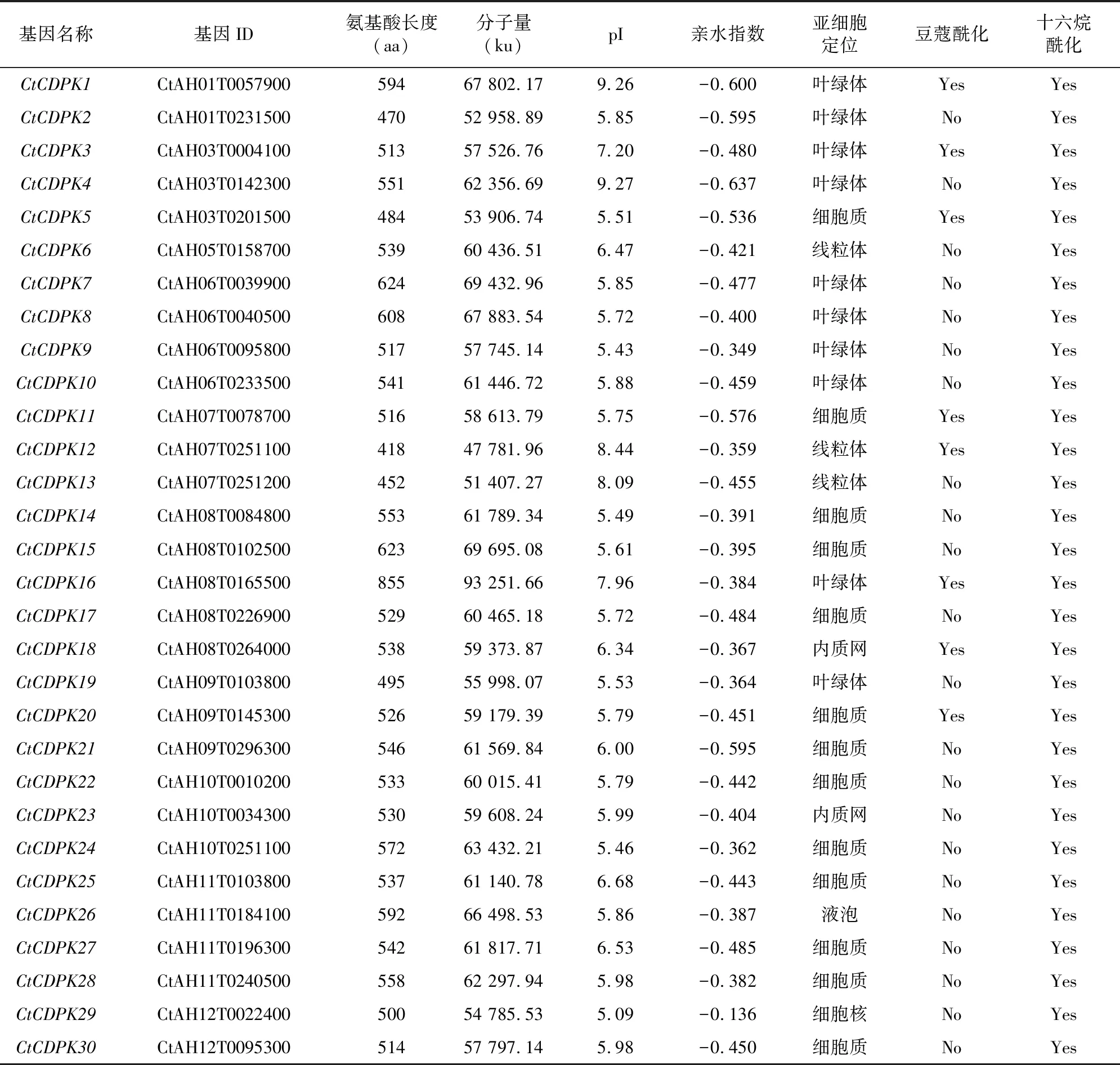
表1 红花CtCDPK基因家族蛋白理化性质
2.2 染色体定位分析
由红花CDPK基因在染色体上的位置分布(图1)可知,CtCDPK基因在各条染色体上分布不均匀,除2号、4号染色体上没有分布外,其余10条染色体上均有分布,在8号染色体上分布数量最多,有5条;在5号染色体上只分布1条。

2.3 系统进化分析
通过MEGA构建红花与拟南芥CDPK基因家族进化树。参照拟南芥CDPK分组情况,可将所有的CDPK基因分成6类(Ⅰ~Ⅵ)。第Ⅰ组家族成员最多,并且红花CtCDPK家族成员主要集中在此家族,有8个拟南芥CDPKs和19个红花CDPKs;第Ⅲ组的数量最少,包含1个红花CDPKs(图2)。

2.4 红花CDPK基因家族结构特征
根据全基因组注释信息中基因的内含子、外显子信息,绘制红花CtCDPK基因家族成员基因结构图,结果(图3-C)显示,CtCDPK基因内含子数量在5~13个之间,外显子数量在6~13个之间,含有内含子数最少的是CtCDPK12,含有5个内含子,内含子数量最多的是CtCDPK16,含有14个内含子,并且CtCDPK16所含外显子数量也是最多的,为13个,同一亚家族的外显子数量较为稳定。在同一个基因家族中,含有共同motif的成员有可能功能相似,使用MEME在线软件来识别它们的保守基序,结果(图3-B)显示,motif2、motif1、motif5、motif4、motif12、motif7、motif9存在于每个家族成员,这些motif构成了CDPK基因典型的结构域,motif3存在于除CtCDPK29外的每个家族成员;motif6存在于除CtCDPK4、CtCDPK18、CtCDPK1外的所有成员;同时,只有CtCDPK6、CtCDPK2和CtCDPK29不含motif8,且CtCDPK29也不含motif10,除此之外,CtCDPK12和CtCDPK13既不含motif10也不含motif11。同一亚家族的成员,结构相似。

2.5 顺式作用元件分析
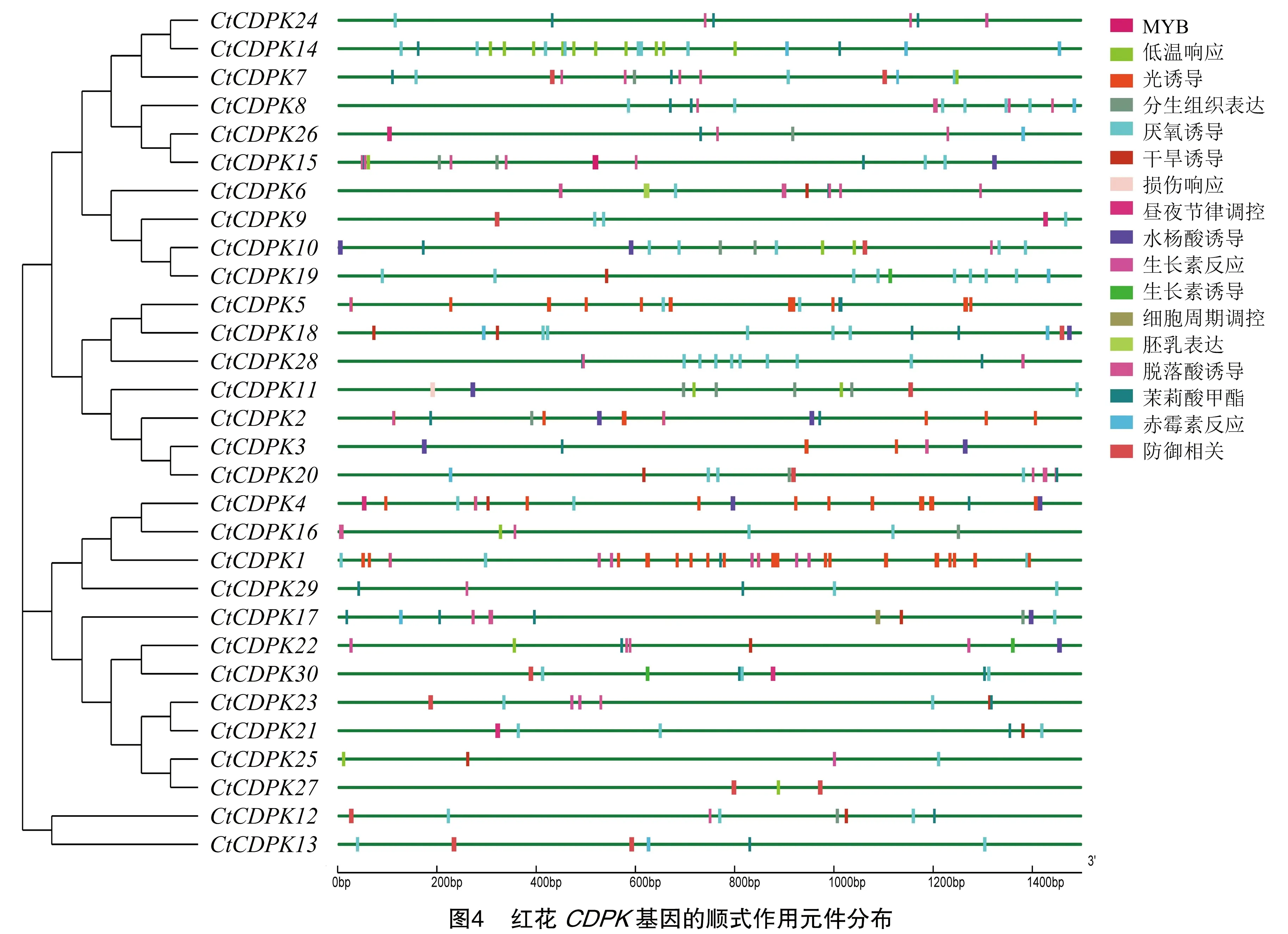
根据PlantCARE数据库预测顺式作用元件,GSDS网站的绘图结果表明,在多数CtCDPK基因中出现频率最高的顺式作用元件是光响应元件,有25种,包括G-Box、G-box、Box 4、GT1-motif、TCT-motif、GA-motif、I-box等,由此推测CtCDPK在红花响应光调控过程中发挥重要作用。此外还有胁迫响应元件、激素应答响应元件、生长发育响应元件,其中胁迫响应元件主要有厌氧诱导(ARE)、防御与应激(TC-rich repeats)、干旱诱导(MBS)、低温响应(LTR)、损伤响应(WUN-motif)等5种,表明含有这些响应元件的基因可能会在受到胁迫的情况下提高植物的抗逆性,其中LTR主要存在于CtCDPK14中;WUN-motif只存在于CtCDPK11中;激素应答响应元件及生长发育响应元件出现频率比较低,只能在少数CtCDPK基因中预测到。
2.6 红花CDPK基因家族蛋白互作网络
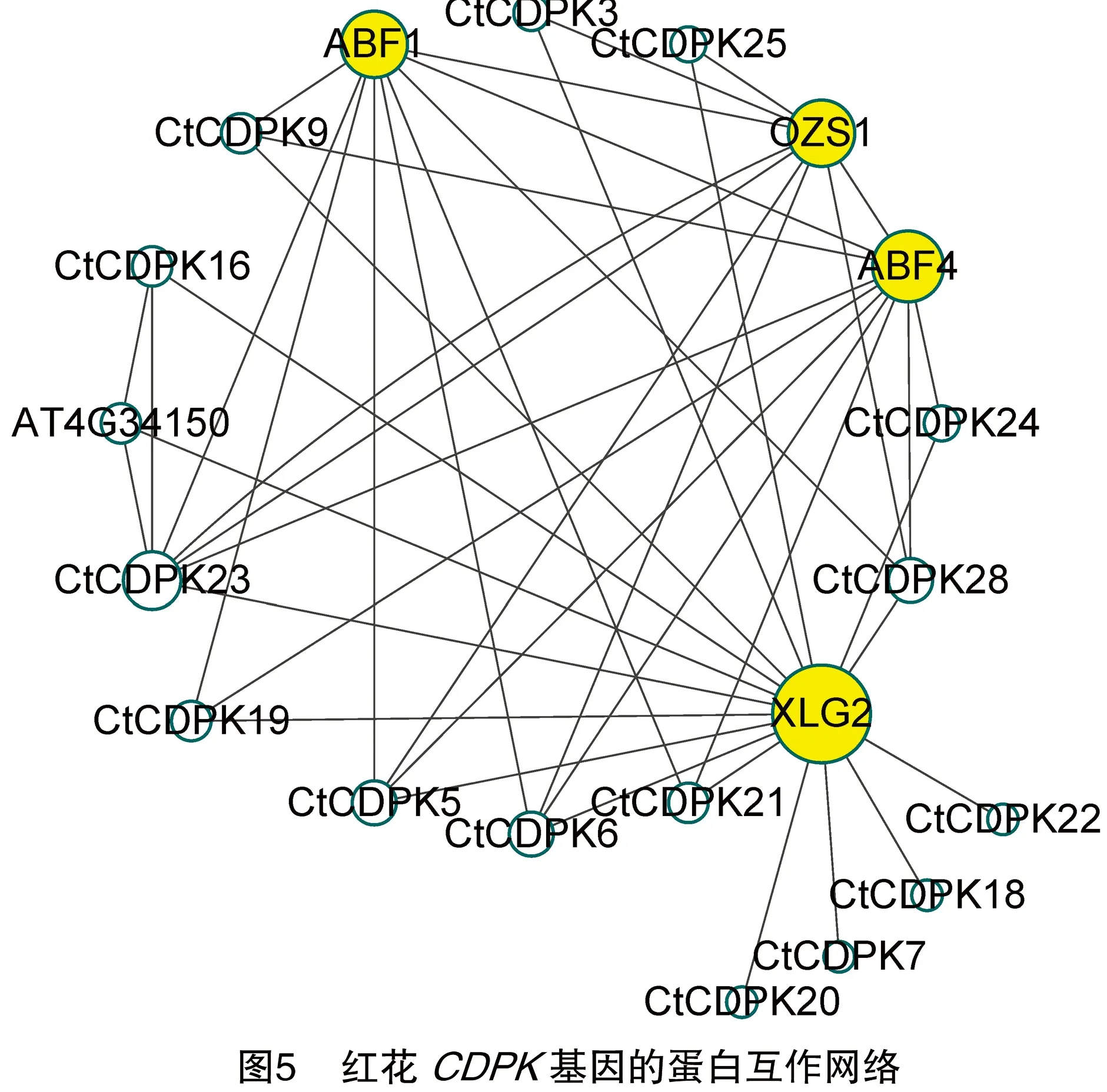
如图5所示,红花CDPK蛋白之间以及与其他如ABF1、OZS1、XLG2、ABF4等蛋白间存在较强的关联,其中尤其是与XLG2蛋白关联最强。根据互作网络节点大小可以直观地看出核心蛋白除上述关联性较强的蛋白之外还有AT4G34150、CtCDPK28、CtCDPK21、CtCDPK23等。XLG2蛋白属于G-alpha超家族,作为对触发水杨酸 (SA) 途径的病原体抗性的正调节剂。ABF1鉴定为与脱落酸反应元件结合的蛋白质,可能介导ABA反应的转录调控,属于bZIP家族,能够与rd29B基因启动子的ABA反应元件特异性结合。拟南芥CDPK基因家族中的AT5G66210.1作为协调茎伸长和血管发育的发育控制调节剂,与之对应的CtCDPK1、CtCDPK4、CtCDPK16均有此作用。此外,CtCDPK19、CtCDPK23均与ABF4互作,作为钙介导的脱落酸信号通路的调节剂。
2.7 红花CDPK基因家族表达模式分析
根据Tbtools的结果(图6),对CtCDPK基因在3个不同组织部位中(种子、叶、花瓣)的表达模式进行分析,发现只有CtCDPK12未在任一组织中检测到,大部分CtCDPK基因都可以在3种不同的组织中被检测到。其他该家族基因的表达模式也不相同,一些CtCDPK基因在3个不同组织中都有着较高的表达量,如CtCDPK2、CtCDPK4、CtCDPK23、CtCDPK24,说明这些CtCDPK基因在红花的生长发育过程中有着不可替代的作用,还有一些CtCDPK基因只在1种组织中表达,具有表达特异性,如CtCDPK18、CtCDPK27只在红花花瓣中表达;此外,CtCDPK1、CtCDPK5和CtCDPK29只在叶和花瓣中表达,在种子中不表达,表明这3个基因家族成员调控红花的叶和花瓣的发育,在红花叶和花瓣的发育过程中有一定的调控作用,但还需要进一步研究其功能机制。
根据NCBI不同发育阶段下的转录组数据对CtCDPK基因的表达量作图(图6-B),发现CtCDPK12在初花期及腐烂花期均不表达,在其他的生长发育阶段表达量比较低,而与此相反的是CtCDPK21、CtCDPK22、CtCDPK23、CtCDPK24这几个基因家族的成员在红花生长的任意阶段,无论是小芽期、中芽期、初花期、盛花期、腐烂花期的表达量都普遍高于其他家族成员,说明这几个成员对于调控红花的整个生长发育阶段有着比较重要的作用,CtCDPK25在腐烂花期-1阶段的表达量明显高于其他发育阶段,说明它在该阶段有特异性表达。

3 讨论与结论
红花作为一种常用的中药材,主要含红花黄色素、红花甙、红花多糖等,可用于治疗闭经痛经、跌打损伤、心脑血管等疾病[9],具有广阔的发展前景。CDPK基因家族的身影在植物界中随处可见,二倍体棉花基因组中鉴定出41个CDPK基因[10],辣椒30个[11],山核桃25个[12],杨树30个[13],葡萄19个[14]。本研究从红花基因组中鉴定出30个CtCDPK基因家族成员,进一步和拟南芥CDPK基因家族构建系统发育树,共获得了6个亚家族,6个亚家族的成员大部分定位于叶绿体,说明这些CtCDPK基因家族成员主要在叶绿体中和细胞质中发挥作用。对CtCDPK蛋白结构域进行分析,发现所有的CtCDPK蛋白均含有典型结构域Ser/Thr蛋白激酶区,该结构域也是CDPK蛋白的主要功能结构域[15-16]。
自然界中有许多基因或蛋白参与植物生长发育的调控,目前已有研究证明,热激蛋白HSP101在非胁迫条件下会促进拟南芥开花,这种促进过程取决于与开花相关基因FLC及SVP基因的表达[17]。有关研究表明,牡丹PI基因能够调控植物花器官的形成,牡丹中PsPI基因在生殖器官中的表达相对于营养器官来说是高表达的,花瓣中表达量最高[18]。基因的表达模式可能与其功能特征相关,而CDPK基因在不同植物组织中、不同发育期表达量差异显著,其中CtCDPK12在红花的任意组织部位表达量为零,CtCDPK18和CtCDPK27具有表达选择性,只在花瓣中有一定的表达量,在其他组织部位不表达,在有些植物中也存在这种情况,如玉米中的1个CDPK基因只在花粉中表达[19]。
相关研究表明,CDPK基因家族的成员主要参与植株生长和发育的调控,对矮牵牛在花粉期表达的2种CDPK基因PiCDPK1和PiCDPK2的研究发现,若二者均过量表达,则前者影响花粉管的生长极性;后者则抑制了花粉管的伸长能力[20]。进一步研究表明,在许多植物体内发现CDPK基因与抗氧化酶有密切的联系[21],酶在植物体内广泛分布,参与植物的多种代谢途径,研究结果表明,玉米体内CDPK的过量表达,能够明显提高超氧化物歧化酶和过氧化物酶的活性[22],从而加快植物的代谢过程。此外,CDPK基因还能调节种子的萌发过程,在蓖麻(RicinuscommunisL.)种子早期发育过程中,RcCDPK2的表达量先上升后下降[23]。同时CDPK还参与对植物细胞骨架的调节以及对离子和水分跨膜转运的调节等[24]。
CDPK基因编码的蛋白质作为Ca2+感受器,贯穿植物的整个生命周期,参与植物体内的各种生命活动。本研究基于红花基因组数据,共鉴定出30个CtCDPK基因,并通过生物信息学分析,明确30个CtCDPK基因家族成员的基本信息,包括进化关系、结构域及酰化位点、互作关系等,本研究结果为后续深入探究CtCDPK基因的功能提供了思路。

