R-spondins与乳腺癌的相关性研究进展*
蒋树云,马德寿,马志军
(1.青海大学研究生院,青海 西宁 810016; 2.青海大学附属医院 肿瘤外科,青海 西宁 810001)
乳腺癌是女性最常见的恶性肿瘤,其发病率位居我国女性恶性肿瘤首位[1]。探究乳腺癌发病的分子机制,寻找有效的治疗靶点和预后标志物一直是该领域的研究热点。R-spondins也称为特异性顶部盘状底板反应蛋白(RSPO),是近期发现的一种分泌蛋白质家族,存在于所有脊椎动物中,在机体的发育、血管形成等方面扮演重要角色[2],近期研究表明,该蛋白家族在包括乳腺癌等多种恶性肿瘤的发生发展中发挥重要作用[3-5]。因此,本文深入研究RSPO在乳腺癌中发挥的功能及相关发病机制,为乳腺癌的精准治疗、预后评估等提供新的方向。
1 RSPO的结构和功能
RSPO是由凝血酶刺激的血小板中分离出的一种新型分泌蛋白质家族,由4种蛋白成员(RSPO1、RSPO2、RSPO3、RSPO4)组成,相互之间有40%~60%的氨基酸相似性,共有4个主要的功能区:N端为一段富含疏水氨基酸的分泌信号肽,其次为两段富含半胱氨酸的Furin样蛋白质结构域,紧跟一段血栓反应蛋白1型重复结构域(thrombo spondin1 repeats, TSR1),C端为一段可变长度的富含碱性氨基酸的结构域(basic amino acidrich, BR)。其中Furin样1结构域和Furin样2结构域分别与锌环指蛋白3/E3泛素连接酶-环指蛋白43(zinc and ring finger 3/ring finger protein 43, ZNRF3/RNF43)和富含亮氨酸的G蛋白偶联受体(leucine-rich repeat G protein-coupled receptors4-6,LGR4-6)相结合,RSPO-LGR(LGR4-6)构成了一个配体-受体系统,与ZNRF3/RNF43结合形成稳定三元复合物进入到细胞内,避免卷曲跨膜受体(Frizzled, FZD)的降解从而激活Wnt通路[6-8]。Furin样结构域是RSPO激活Wnt/β-catenin信号通路充分且必要的条件,并决定着RSPO的活性强度[8-9]。
前期研究[10]表明,激素受体阳性的乳腺管腔细胞分泌的RSPO1在核因子κB受体协同作用下,通过活化Wnt通路而促进小鼠乳腺的发育;而在雌激素受体阴性的管腔细胞分泌的双调蛋白可通过诱导RSPO1的表达,形成雌激素-双调蛋白-RSPO1的调节轴,为乳腺的发育提供了特殊的调控模式[11]。此外,卵巢激素可通过调节RSPO1和Wnt4的协同作用促进乳腺上皮干细胞(mammary stem cell, MaSC)的自我更新和再生能力,这为体外培养扩增MaSC并保持其特性提供了一种可能[12]。在性腺分化阶段,RSPO1的缺失会导致部分性反转表型从而出现性反转现象,因此RSPO1的存在对调控性别差异是十分必要的[7]。而RSPO3通过调控Wnt通路、促进血管母细胞的分化等途径调节造血细胞与血管内皮细胞分化之间的平衡,在血管生成和胚胎发育方面发挥重要功能[7,13]。此外,正常乳腺间质和小鼠乳腺的基底干细胞富集区均发现了RSPO3的表达,提示其可能参与正常乳腺的发育,抑制乳腺腔室的分化[14]。RSPO2和RSPO4在正常乳腺中的研究尚未见报道,有报道[7]称RSPO2可通过Wnt通路促进胚胎肌肉、呼吸道及毛囊的发育,而RSPO4被认为在指甲形态的发育中扮演重要角色。
2 RSPO受体LGR4-6的结构及功能
作为RSPO高亲和力的细胞膜受体,LGR4-6属于LGR家族中的B型受体,由长达17个富含亮氨酸基序列的结构域,以及氮端的富含亮氨酸基序列和碳端的富含亮氨酸基序列构成[15]。LGR4-6因在促进胚胎发育、维持成人组织稳态中发挥重要功能而受到关注[16]。近期研究[17]表明,LGR4-6也参与乳腺的生长发育,LGR4缺失的小鼠表现为乳腺发育迟缓、乳腺导管分支减少及MaSC增殖能力降低的特点。利用3D成像等技术观察到LGR5在管腔细胞和基底细胞中可促进乳腺腺泡的形成,其在乳腺移植后的机体内能有效地重建乳房[18-19]。而在妊娠状态下,LGR6与其配体结合后通过增强腺泡细胞的增殖能力从而促进乳腺腺泡发育[20]。总之,上述研究表明,LGR4-6通过与其配体RSPO结合后在乳腺发育的不同阶段发挥特殊的动态调控功能。
3 RSPO在乳腺癌中的表达
目前研究提示,RSPO在乳腺癌组织中的表达特征不尽一致。有研究[21]结果表明,RSPO1在孕激素受体阳性的乳腺癌组织中表达显著升高,进一步分析提示其水平与患者无病生存期显著相关,可作为浸润性导管癌独立的预后因子。COUSSY等[4]在446例乳腺癌包括三阴性乳腺癌(triplenegative breast cancer, TNBC)和化生性乳腺癌(metaplastic breast cancer, MBC)中检测RSPO的结果表明,与癌周组织比较,RSPO2和RSPO4在癌组织中的表达明显升高,尤其在TNBC和MBC中表达更加显著,而RSPO1和RSPO3的表达却无明显差别;此外,其相关受体LGR4-6也呈高表达状态,且主要以LGR4为主;CONBOY等[22]研究也提示,RSPO2在乳腺癌中呈高表达,进一步分析表明,其在基底细胞样型和HER-2过表达型中表达更为显著;而TOCCI等[14]研究结果却表明,RSPO3及其相关受体LGR4-6、Runt相关转录因子在基底细胞样亚型的乳腺癌中呈显著高表达,且3者的水平呈明显的正相关;此外,笔者也运用癌症基因组图谱(the cancer genome atlas, TCGA)数据库检索了RSPO在乳腺癌组织中的表达特征,与癌旁组织相比,RSPO2和RSPO4在乳腺癌中呈高表达,而RSPO1和RSPO3却呈低表达(见图1)。进一步分析RSPO在乳腺癌各分子亚型中的表达特征显示:RSPO2和RSPO4在基底细胞样型中的表达显著升高,而RSPO1和RSPO3在各分子亚型中的水平较癌旁组织明显降低,尤其在基底细胞样型中更为显著,推测其在乳腺癌中可能作为一种潜在的抑癌基因(见图2)。然而该数据库部分结果与上述研究结果不尽一致,如RSPO1虽在孕激素受体阳性的乳腺癌中升高,但TCGA数据库却显示其在乳腺癌中呈低表达,分析其原因可能与以下几点相关:①鉴于肿瘤的时间、空间异质性,使所取组织可能由于分子水平层面的不同,导致检测结果的差异性;②RSPO与相关受体结合后的检测不能反映其真实的表达水平[23];③研究中使用的检测方法、仪器设备、试剂等差异也可能导致RSPO检测结果不一致。
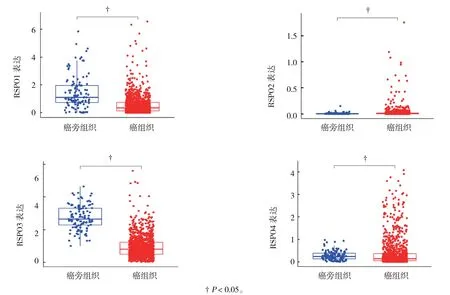
图1 TCGA数据库中RSPO在乳腺癌中的表达特征 (±s)

图2 TCGA数据库中RSPO在各乳腺癌分子亚型中的表达 (±s)
4 RSPO在乳腺癌中的功能
RSPO作为一种新型分泌蛋白质家族,其成员不仅在维持乳腺的生长发育中发挥重要的生理功能,而且其表达失调时还与乳腺癌的发展演进相关。KLAUZINSKA等[24]在小鼠乳腺肿瘤病毒(mouse mammary tumor virus, MMTV)诱导的小鼠乳腺肿瘤中发现RSPO2可作为一个MMTV新的共同整合位点,在HC11细胞中RSPO2过表达或与Wnt1共表达都会产生纺锤形的恶性细胞漩涡继而在小鼠体内形成肿瘤,当RSPO2和Wnt1共表达时则显著增强细胞的侵袭能力,并表现出强烈的上皮-间充质转化(epithelial-mesenchymal transition, EMT)样特征并易转移到肺和脾脏。此外,在乳腺癌细胞中RSPO2-LGR4通过调控Dickkopf-1相关蛋白的分泌而建立乳腺癌骨转移前的微环境,继而促进乳腺癌骨转移的进程[25];而COUSSY等[4]报道进一步表明,RSPO2的表达量与乳腺癌患者的无转移生存期呈负相关,提示其也许可作为一种潜在的预后指标;THEODOROU等[26]研究显示,RSPO3在P53缺失的乳腺上皮细胞中表达升高且有明显的致癌作用;TOCCI等[14]在小鼠模型中发现RSPO3可诱导肿瘤干细胞(cancer stem cell, CSC)和EMT相关基因如波形蛋白和纤维链接蛋白的表达,并促进乳腺癌细胞的侵袭和迁移;TER等[27]研究也表明,高表达RSPO3的乳腺癌组织分化程度更低、侵袭能力更强。上述部分研究提示RSPO3在乳腺癌组织中呈高表达并发挥促癌作用,这与上述生物信息学提示的其可能作为潜在抑癌基因的结论相反,因此推测RSPO在肿瘤中发挥的功能可能具有组织和细胞特异性,如miR-155在肺癌中被认为是促癌基因[28],而在胃癌中却发挥抑癌功能[29];COUSSY等[4]研究进一步表明,RSPO4与乳腺癌的病理组织分级、雌激素受体状态和TNBC亚型密切相关,过表达RSPO4可通过增强乳腺癌细胞中β-catenin、轴抑制蛋白2的表达而激活Wnt通路,继而促进肿瘤的发展演进。针对上述具有促癌特征的RSPO,通过研发相应的靶向药物抑制其表达,可为乳腺癌的精准治疗提供参考。
5 RSPO在乳腺癌中的调控机制
5.1 RSPO与Wnt通路
Wnt/β-catenin通路的过度活化是肿瘤发生发展的经典机制之一,Wnt配体通过结合FZD和低密度脂蛋白相关蛋白5或6(lipoprotein-related protein5/6, LRP5/6)而诱导胞质、多蛋白破坏复合物释放出β-catenin蛋白来激活Wnt通路[30]。前期研究表明,β-catenin蛋白在乳腺癌细胞中的累积导致Wnt信号频繁被激活可能是乳腺癌发生的机制之一[31]。但最近的研究结果却表明乳腺癌中Wnt通路的异常激活不一定依赖β-catenin蛋白的累积[30],分析可能存在激活Wnt通路的其他途径。
TOCCI等[30]研究表明,RSPO结合受体LGR4-6并诱导结合ZNRF3/RNF43的自泛素化和膜清除,促使细胞膜表面的FZD累积,继而激活经典的Wnt信号通路(图3-①),而在一些LGR(LGR4-6)低表达或不表达的细胞中,RSPO可通过TSR结构域或BR结构域与细胞膜外的硫酸肝素蛋白聚糖(heparan sulfate proteoglycans, HSPG)的相互作用(图3-②),为ZNRF3/RNF43提供一条不依赖于LGR的通路,分析HSPG很可能是RSPO的共受体,在促进LGR低表达或不表达的乳腺癌进展中发挥重要功能[6,32]。其次,在清除了ZNRF3/RNF43的情况下,RSPO-LGR复合体还可通过招募GTP酶激活蛋白1(IQGAP1)(图3-③),在清除了ZNRF3/RNF43的机制中增强Wnt通路活性[30,32],从而使RSPO激活Wnt通路的作用形式更加丰富。综上,在不依赖β-catenin蛋白累积的情况下,RSPO通过结合不同的受体或受体组合激活Wnt通路,继而发挥促癌功能。然而RSPO在特定的环境下是如何选择不同受体或受体组合激活Wnt通路的具体机制目前尚不明确,有必要开展进一步的研究。

图3 RSPO激活Wnt通路的新途径 (图片由Medpeer网站绘制)
5.2 RSPO受体LGR与乳腺癌
如前所述,LGR4-6参与调控不同阶段乳腺的生长发育。而在乳腺癌中,YUE等[33]发现LGR4在癌组织中表达上调,其通过调节性别决定基因相关转录因子的表达维持乳腺癌CSC的功能,从而促进癌细胞的增殖和更新;而在细胞的侵袭和转移机制中,局部黏着斑激酶(focal adhesion kinase,FAK)与肿瘤细胞的黏附、扩散密切相关,LGR4则通过FAK-类固醇受体辅助活化因子途径协调肌动蛋白动力学调控机制从而促进癌细胞的侵袭、迁移;乳腺癌中高表达的LGR5主要通过蛋白激酶A激活β-catenin的活性,继而促进肿瘤细胞的增殖、迁移并增加顺铂的耐药性[34]。上述研究表明在乳腺癌组织中,异常表达的LGR可通过RSPO-LGR系统发挥促癌功能,还可通过单独调控下游相关基因的表达参与肿瘤的进展。如靶向抑制LGR的水平,也许在临床上可发挥双重抑制肿瘤的效果。
5.3 RSPO及其受体LGR介导EMT特征
EMT是上皮来源的恶性肿瘤细胞获得迁移和侵袭能力的关键步骤。有研究报道在高表达RSPO2的乳腺癌组织中检测到间充质蛋白标志物,如波形蛋白、纤维连接蛋白、N-钙黏蛋白等,而未发现上皮标志物E-钙黏蛋白、细胞骨架角蛋白的表达,表现出与EMT一致的基因表达谱,使得肿瘤更易向周围组织侵袭转移[24]。体外实验也表明,与rRSPO3共培养的乳腺细胞中,间充质标志物纤维连接蛋白和波形蛋白的表达显著增加,而E-钙黏蛋白减少,提示其可能通过诱导细胞发生EMT而发挥促癌作用[14]。此外,在MDA-MB-231细胞中,抑制LGR4的表达后EMT间充质蛋白标志物水平明显减少,进一步分析表明其通过诱导Wnt/β-catenin通路介导EMT发生[34]。鉴于EMT被认为是导致肿瘤转移的关键病理过程,因此积极探索靶向调控诱导EMT发生的关键分子对乳腺癌的治疗具有重大的意义。
6 结语与展望
乳腺癌的放化疗由于严重的毒副反应在临床实践中存在诸多限制。目前,个体化的精准靶向治疗已成为新型的肿瘤治疗模式。作为一种新型的分泌蛋白质家族,在生理状态下RSPO不仅参与血管形成、促进胚胎、乳腺等器官的发育;而在乳腺癌组织中,其表达出现显著的失调,异常表达的RSPO与乳腺癌的分子亚型、预后等显著相关;RSPO还与其受体LGR4-6在促进乳腺癌细胞生长、转移、EMT发生、诱导CSCs的活性方面发挥重要的功能;此外,作为一种新型的Wnt通路激活因子,其可在不依赖β-catenin蛋白累积的条件下活化Wnt通路而发挥促癌功能。因此,针对RSPO及其受体在乳腺癌中的表达特征及发挥功能的机制,研制特定的靶向药物或许能为乳腺癌的预后评估及精准个体化治疗提供新的策略。然而,目前关于RSPO在乳腺癌中研究结论还缺乏深入的临床验证,因此后续开展更多深层次的临床研究是十分必要的。

