异价阳离子替代实现的金属卤化物CsCdCl3的明亮宽带绿色发光
宋 妍,王 录,陈明星,魏荣敏,李新慧,贾 贞,夏明军
(1.中北大学化学工程与技术学院,太原 038507;2.德州学院化学化工学院,德州 253023;3.北京大学分析测试中心,北京 100871;4.中国科学院理化技术研究所,人工晶体研究发展中心,中国科学院功能晶体与激光技术重点实验室,北京 100190)
0 引 言
在过去的几十年里,金属卤化物因其有趣的光电特性和在发光二极管、光电探测器和防伪等领域的应用前景而受到广泛关注[1-8]。其中,全无机金属卤化物因其载流子迁移率大、发光效率高和稳定性好而备受关注。以前对全无机金属卤化物的研究主要集中在CsPbX3(X=F、Cl、Br)[9],近年来,人们开始关注全无机镉(Cd)基金属卤化物,如Rb2CdCl2I2、Cs7Cd3Br13、Cs2Cd2BrCl5和Rb4CdCl6等,以期获得更多具有优异光物理性能的材料[10-14]。
根据以往的报道,在金属卤化物中掺杂具有光活性的金属阳离子,以获得新的发光性能是提高光致发光量子效率(photoluminescence quantum yield, PLQY)有价值的策略[3,15-16]。含有ns2孤对电子的主族金属阳离子,包括Sn2+、Ge2+、Bi3+和Sb3+,由于ns2电子与卤素的p轨道的反结合特性,产生非常浅的缺陷,提高了结构缺陷容忍度,进一步提升了金属卤化物的光电性能,是很有前途的光活性掺杂剂。然而,Sn2+和Ge2+为不稳定氧化态,Bi3+发光效率较低。Sb3+具有发射光谱宽、PLQY高、抗氧化能力强等优点,是最有应用前景的绿色光活性离子。例如,将Sb3+掺入到Cs2ZrCl6基质中,实现了Sb3+的黄光发射[17];零维金属卤化物A2InCl5(H2O)(A=Rb, Cs)的PLQY很低(<2%),引入Sb3+后,其PLQY提高到95.5%[18-19]。
本工作将Sb3+引入到CsCdCl3中,Sb3+占据Cd2+晶格位置,形成SbCl6八面体,掺杂5%的Sb3+获得了PLQY为95.5%的宽带绿光。有报道发现RbCdCl3∶Sb3+是一种黄光材料[14],尽管RbCdCl3和CsCdCl3化学式相似,但它们的晶体结构截然不同。与RbCdCl3的一维链状结构不同,CsCdCl3结晶为六方相,结构中的CdCl6相互连接形成三维网状结构。虽然SbCl6八面体被认为在这两种化合物中均起着敏化剂和激活剂的作用,但对Sb3+在晶体中的晶格占位和相应的基质位点环境的了解可能有助于解释为什么这两种化合物的发光有着巨大的差异。此外,简便的高温固相合成法为CsCdCl3∶Sb3+的应用铺平了道路。
1 实 验
1.1 试剂与仪器
试剂:CsCl(纯度99.9%,Macklin)、CdCl2(纯度99.9%,Macklin)、RbCl(纯度99.9%,Macklin)和SbCl3(纯度99.9%,Macklin)。所用原料均未经进一步处理直接使用。
仪器:用Bruker D8 Advance X射线衍射仪,以Cu靶 (λ=0.154 06 nm)为辐射源,在室温下对样品进行粉末X射线衍射(XRD)测试;用ZEISS Merlin Compact场发射扫描电子显微镜(SEM)记录物质的形貌和元素成分;用STA449F3热重分析仪器测试物质的热稳定性(TGA);用配备积分球的岛津UV-2700光谱仪测量物质的紫外-可见吸收光谱;用配备积分球的爱丁堡FLS980荧光光谱仪,以BaSO4为参比,记录了室温及变温发光、时间分辨发光衰减曲线和PLQY。
1.2 物质的合成
采用高温固相反应法制备了未掺杂和Sb3+掺杂的CsCdCl3多晶样品。按化学计量比称量适量CsCl、CdCl2和SbCl3,研磨混合均匀,转移到石英管中。将石英管在真空环境中密封,并置于烘箱中。将烘箱升温至180 ℃并保温10~24 h,中间取出1~2次研磨,然后自然冷却至室温。制备好的样品密封在玻璃瓶中,防止它们吸收水分。将CsCl替换为RbCl,用上述相同方法合成了未掺杂和Sb3+掺杂的RbCdCl3。
2 结果与讨论
2.1 物相分析
1964年,Siegel等报道了CsCdCl3的六方相单晶结构(空间群P63/mmc)[20]。CsCdCl3结构中,两个Cs、两个Cd和六个Cl占据八个独立的结晶位点。两种Cd离子均与六个Cl离子配位,形成CdCl6八面体,其中Cd1表现为D3d对称性,Cd2占据C3v对称位点(见图1(a))。两个Cd2Cl6通过共面连接,形成Cd2Cl9基团,该基团通过共角方式与六个Cd1Cl6连接(见图1(b))。Cd1Cl6和Cd2Cl9沿b轴按线性方式排列并沿c轴交替出现,构建了三维网状结构,CsCl12填充于孔道中(见图1(c))。
图1(d)表明,已合成的CsCdCl3∶x%Sb3+(x≤10)的粉末X射线衍射(XRD)与标准物质的粉末XRD(ICSD#16575)很匹配,表明其纯度很高[14,21]。同时,随着Sb3+浓度增加,CsCdCl3结构中[013]晶面的XRD峰逐渐移向高的角度。根据Vegard定律,这一现象说明了物质单胞体积在减少(见图1(e))。众所周知,较小的离子代替较大的离子会减少相应晶体的单胞体积,这与Sb3+(CN=6,IR=0.076 nm)比Cd2+(CN=6,IR=0.095 nm)离子半径小相符[20]。合成原料中加入15%的SbCl3,样品的粉末XRD出现了SbCl3峰(见图1(f)),证实CsCdCl3中Sb3+饱和浓度约10%。
选择粒径约10 μm的CsCdCl3∶5%Sb3+分析其形貌和元素分布。图1(g)显示,在CsCdCl3∶5%Sb3+中,Cs、Cd、Cl和Sb的原子百分比为19.53%、16.08%、60.98%、3.41%,这与原料投料比例非常接近。图1(h)中,棱角分明的颗粒形貌显示了CsCdCl3∶5%Sb3+良好的结晶性。图1(i)~(l)显示Cs、Cd、Cl和Sb元素均匀地分布在CsCdCl3∶5%Sb3+中,证明Sb3+已成功地融入CsCdCl3基质中。
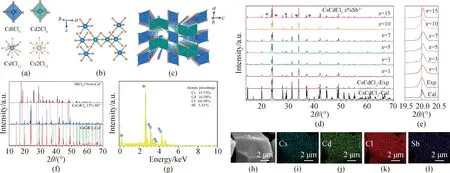
图1 CsCdCl3晶体结构及CsCdCl3∶Sb3+物相分析。(a)~(c)CsCdCl3晶体结构;(d)~(e)未掺杂和Sb3+掺杂CsCdCl3粉末XRD;(f)模拟的CsCdCl3和SbCl3及实验的CsCdCl3∶15%Sb3+粉末XRD图谱; CsCdCl3∶5%Sb3+的EDS元素分析图谱(g),SEM照片(h)和EDS扫描图谱(i)~(l)
2.2 热稳定分析
氮气保护下将CsCdCl3从室温加热到800 ℃,得到CsCdCl3的热重分析曲线如图2(a)所示。从图中可以看出,将CsCdCl3从室温加热到560 ℃,没有出现失重现象,表现出好的热稳定性。
2.3 光学性质
紫外可见吸收光谱中,未掺杂和Sb3+掺杂的CsCdCl3在200~270 nm范围内均表现源自CdCl6八面体的固有吸收(见图2(b))。与CsCdCl3相比,CsCdCl3∶Sb3+的吸收带延伸到430 nm,强度明显增加,这源于Sb3+的能带吸收[18,22]。通过Tauc曲线拟合了物质的带隙,CsCdCl3为4.76 eV,CsCdCl∶5%Sb3+为2.20 eV,表明Sb3+使CsCdCl3的带隙明显变窄(见图2(c))。
从图2(d)可以看出,CsCdCl3室温时表现极弱的荧光激发(PLE)和发射(PL),这与已报道的镉基金属卤化物性能一致,如RbCdCl3[18]、Rb4CdCl6[23]、Cs2CdCl4[24]等。Sb3+的引入,使CsCdCl3的PL强度明显增加,这与其吸收光谱变化相吻合。CsCdCl3∶Sb3+的PLE位于260~380 nm,有一个高能激发带峰值为300 nm,一个低能激发带其峰值分裂为341和352 nm。从图2(e)可以看出,Sb3+浓度对CsCdCl3∶Sb3+发光有较大影响,最佳掺杂浓度为5%,最高PLQY约95.5%。用341 nm的光激发,CsCdCl3∶Sb3+表现从420 nm到650 nm的宽带发光,最大发射波长530 nm,斯托克斯位移(Stokes shift)189 nm,半峰全宽(full width at half maximum, FWHM)128 nm,色坐标位于绿光区域(0.321, 0.478)(见图2(f))。
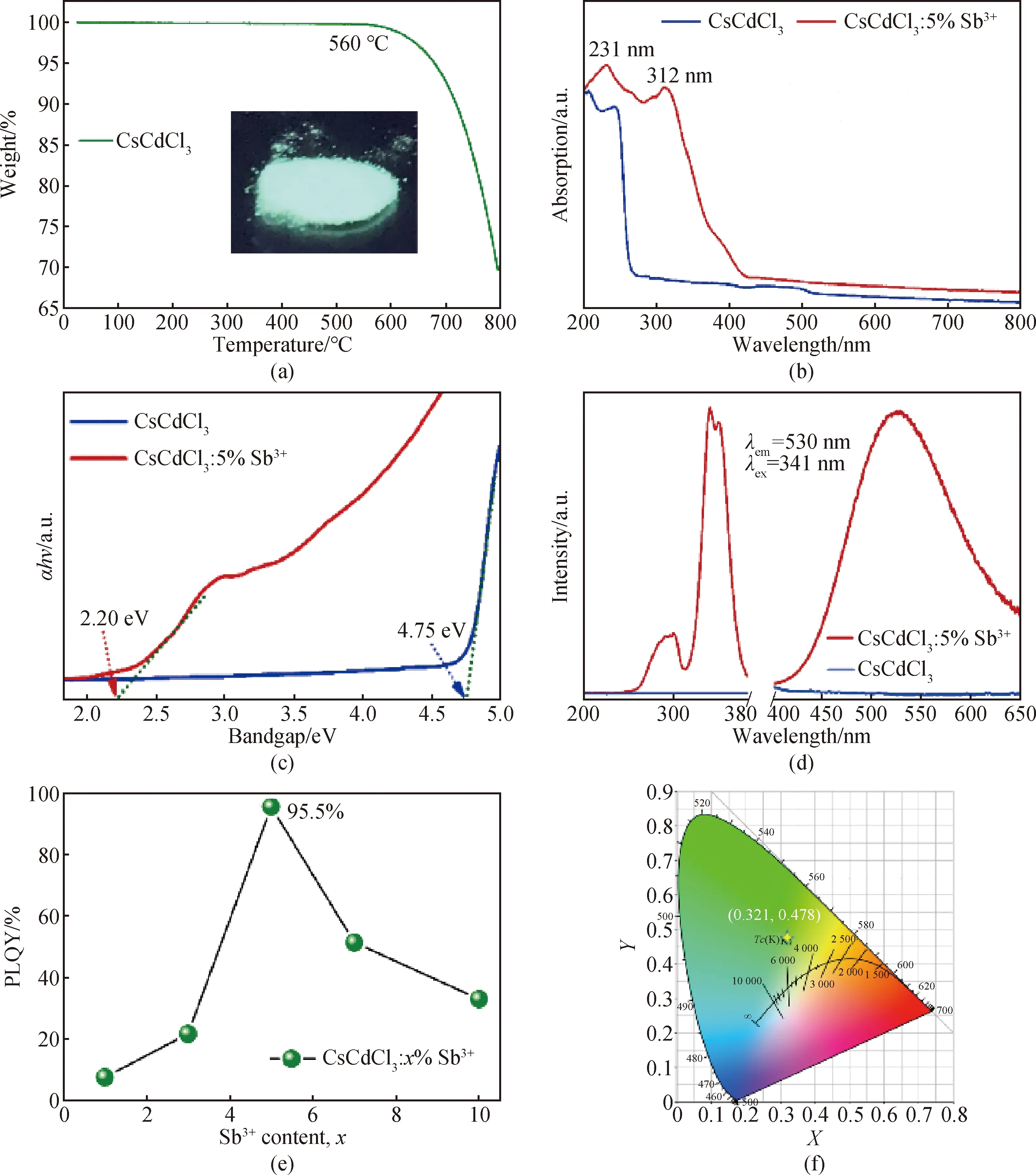
图2 CsCdCl3热稳定性及CsCdCl3∶Sb3+光学性质。(a)CsCdCl3热重曲线(插图为CsCdCl3∶5%Sb3+紫外光下照射的图片);(b)紫外-可见光吸收光谱;(c)Tauc图;(d)荧光激发和发射光谱;(e)发光量子产率与Sb3+浓度关系图; (f)CsCdCl3∶5%Sb3+光谱的色坐标
2.4 发光机理
CsCdCl3∶5%Sb3+在530 nm处的发光寿命可以用双指数函数拟合,得到一个短寿命0.514 3 μs,占总数34.1%,一个长寿命1.000 6 μs,占总数65.9%,平均寿命0.953 7 μs(见图3(a))。根据以前报道,短寿命和长寿命应该分别与3P1→1S0和3P0→1S0电子跃迁有关[22]。为进一步揭示CsCdCl3∶Sb3+发光机理,测试了CsCdCl3∶5%Sb3+从320 K到88 K的变温发光光谱,如图3(b)所示。从图中可以看出,CsCdCl3∶5%Sb3+处于530 nm的最大发射峰几乎不受环境温度影响,然而,发光强度对环境温度具有强烈依赖性[23]。
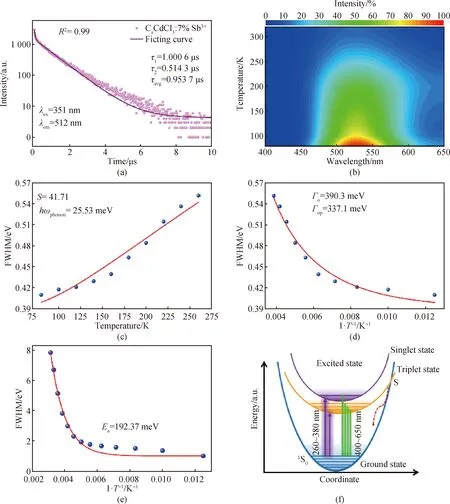
图3 CsCdCl3∶5%Sb3+的发光机制。(a)时间分辨PL光谱;(b)变温PL谱的三维等高线;(c)PL峰随温度变化的拟合曲线;(d) PL峰随温度变化的Toyozawa equation拟合曲线;(e)发光光谱面积与温度的拟合曲线;(f)电子跃迁示意图
据此,CsCdCl3∶Sb3+发光具有带宽(FWHM 为128 nm),斯托克斯位移大(189 nm),发光寿命较长(微秒级)以及强烈的温度依赖,这些都是自捕获激子(self-trapped excitions, STEs)发光的重要特征[4,13-14,24-27]。众所周知,STEs与软晶格和电子-声子耦合密切相关。不同温度下,电子-声子相互作用可以从不同FWHM值(β1/2)计算出来[3]:
(1)
Γ(T)=Γ0+Γop/(ehωphonon/kBT-1)
(2)
式中:S代表Huang-Rhys因子;h代表普朗克常数;ωphonon代表声子频率;kB代表玻尔兹曼常数;T代表温度;Γ0代表绝对温度0 K时的FWHM;Γop代表电子-光学声子耦合能。通过FWHM与温度的拟合(见公式(1)),计算得到CsCdCl3∶5%Sb3+的S值为41.74,与Sb3+掺杂的全无机金属卤化物相当(见图3(c))[13]。此外,显示电子-声子相互作用的Γop可以通过Toyozawa方程(见公式(2))得到。CsCdCl3∶5%Sb3+的Γop值为337.1 meV(见图3(d))。这么高的数值表明CsCdCl3∶5%Sb3+电子-声子相互作用很强,进一步证实了Jahn-Teller效应导致的晶格畸变。上述结果表明,掺入Sb3+后,CsCdCl3∶5%Sb3+拥有更软的晶格和更强的电子-声子耦合,从而导致更容易形成STEs和强STEs发射。
据报道,激子结合能IT可从Arrhenius公式(公式(3))中活化能Ea来粗略估计[28]:
(3)
式中:I0和Ea分别代表0 K时发射光谱的积分面积和活化能。拟合的Ea为192.37 meV(见图3(e))。如此大的活化能表明CsCdCl3∶Sb3+中激子结合能很高,电子-声子耦合强,使STEs实现高度局域,这有利于STEs强烈发光。
低维金属卤化物中声子相关STEs重组发光机制如图3(f)所示。每条抛物线最小值代表基态或激发态最低能态,每条抛物线能级差异由金属卤化物结构变化引起,吸收和发射跃迁发生在不同电子能级状态之间,从而产生发射概率的过渡,导致宽带发射[28]。激发态和基态的多个能级之间的差异导致了发光中大的斯托克斯位移。基态和激发态抛物线的交叉点S提供了载流子从激发态到基态的直接跃迁,而这个过程是热能导致的非辐射重组,对发光没有任何贡献,这为STEs随温度升高的发光猝灭提供了合理解释。
这也可以解释Sb3+掺杂的CsCdCl3和RbCdCl3发光的巨大差异。CsCdCl3∶Sb3+发射明亮绿光,而RbCdCl3∶Sb3+显示黄光(见图4(a)、(b)),CsCdCl3∶Sb3+发射光比RbCdCl3∶Sb3+蓝移,斯托克斯位移比RbCdCl3∶Sb3+小(见表1)。从化学式看,RbCdCl3和CsCdCl3似乎均属于ACdCl3(A=碱金属)家族,然而,它们的晶体结构明显不同(见表2)。RbCdCl3以正交晶系结晶,空间群Pnma,Cd离子和Rb离子均占据一个晶体位点,Cd与六个Cl配位形成CdCl6。沿b方向,相邻CdCl6八面体共边互相连接,形成双链结构,沿a方向,这些相邻的双链被RbCl9分开,构成了一维构型(见图4(c)~(f))。从结构分析,CsCdCl3对称性大于RbCdCl3,表明其晶体结构的扭曲程度比RbCdCl3小,导致CsCdCl3∶Sb3+与RbCdCl3∶Sb3+相比具有较小的斯托克斯位移和相应的发射峰蓝移。
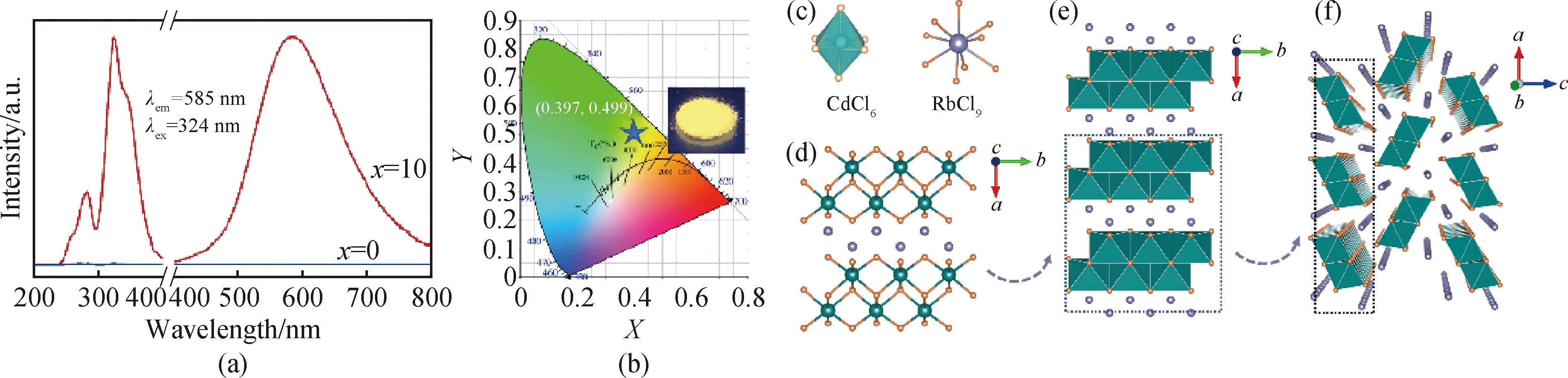
图4 RbCdCl3晶体结构及RbCdCl3∶Sb3+发光性能。(a)RbCdCl3∶xSb3+荧光激发和发射光谱;(b)RbCdCl3∶10%Sb3+的CIE坐标图(插图为RbCdCl3∶10%Sb3+紫外光下照射的图片); (c)~(f) RbCdCl3的结构

表1 掺杂Sb3+的RbCdCl3和CsCdCl3的发光特性
表2 RbCdCl3和CsCdCl3结构比较
3 结 论
在CsCdCl3中掺杂Sb3+产生明亮的绿光,最高PLQY约95.5%。适量的Sb3+分散在CsCdCl3中,相邻的SbCl6分离形成孤立的八面体,从而在室温下诱导了高效的STEs发射。CsCdCl3和RbCdCl3化合物的结构和发光差异表明,结构的对称性在发光中起着重要作用。此外,CsCdCl3在高温下表现出良好的化学稳定性,加上方便的高温固相合成方法,有利于其进一步的应用。

