比较羊水细胞原位培养法和胰酶消化法在产前诊断染色体检查中的应用价值*
候舒文,陈 薇,严雅兰,刘 慧,袁 静
安徽医科大学第一附属医院产前诊断中心,安徽合肥 230022
由染色体数目或者结构异常引起的一类遗传性疾病被称为染色体病,其可以导致新生儿出生缺陷[1]。自从1966年有研究者首次培养羊水细胞成功并用于产前诊断后,该技术已成为一种减少新生儿出生缺陷的重要手段[2-3]。1984年TABOR等[4]首次报道了羊水细胞载玻片-原位培养法(以下简称原位法),该方法是将羊水细胞直接接种到载破片上进行培养。而目前各实验室普遍应用的方法是羊水细胞胰酶消化法,即将羊水细胞接种到培养瓶上进行培养。本实验室原先以胰酶消化法培养羊水细胞,从2020年开始同时采取胰酶消化法和原位法进行平行培养羊水细胞并进一步进行染色体核型分析。为探讨两种羊水细胞培养方法在产前诊断中的临床意义及比较两种不同的方法对羊水细胞培养、收获、制片及染色体核型分析的效果,现对两种方法的羊水细胞培养成功率、培养时间、分裂相、染色体核型结果等进行比较分析,现报道如下。
1 资料与方法
1.1一般资料 选取2020年7—12月在安徽医科大学第一附属医院进行产前诊断的1 105例孕妇羊水标本作为研究对象,年龄17~47岁,孕周18~24周。本研究经安徽医科大学第一附属医院伦理委员会批准,并与所有受检者签订知情同意书。1 105例孕妇羊水产前诊断指征包括高龄(324例)、唐氏筛查高风险(258例)、B超异常(159例)、不良妊娠史(168例)、夫妇之一染色体异常(38例)、无创产前基因检测高风险(60例)、其他(98例)。
1.2仪器与试剂
1.2.1仪器 超净工作台SW-CJ-1F(苏州净化)、二氧化碳培养箱HERAcell240i(美国Thermo)、倒置显微镜TS2 Fi3(日本Nikon)、大容量低速离心机KDC-1044L(安徽中科中佳)、电热恒温水槽DK-B600型(上海三发)、电热恒温鼓风干燥箱(上海跃进)、电热恒温培养箱DNP-9082BS-Ⅲ(上海新苗)、冰箱BCD-192WE(青岛Hisense)、医用低温保存箱DW-25W518(青岛Haier)、染色体分散仪CDS-5(美国THERMOTRON)、GSL-120 全自动染色体核型扫描分析系统(美国Leica)。
1.2.2试剂 羊水细胞培养基(广州达晖)、细胞原位培养盒(杭州杰毅麦特)、细胞培养瓶(美国FALCON)、秋水仙素(杭州宝荣)、氯化钾(上海泸试国药)、枸橼酸钠(上海泸试国药)、乙二胺四乙酸(上海生工)、胰酶(美国Sigma)、甲醇(无锡展云)、冰乙酸(无锡展云)、胰酶分带液(杭州宝荣)、Giemsa染液(杭州宝荣)、其他试剂均为国产分析纯。
1.3方法
1.3.1标本抽取 在无菌条件下抽取孕18~24周羊水20 mL,分别注入两个15 mL无菌离心管内备用。
1.3.2接种 两管羊水转速以2 000 r/min离心7 min,弃上清,一管羊水加入培养基4 mL,吹打混匀后,接种至培养瓶中;另一管羊水加入2 mL相同羊水培养基,轻吹混匀,吸取悬液分别接种至2个原位培养盒,移至37 ℃、5% CO2培养箱进行培养。原位培养20~48 h后,向培养盒中加入3 mL新鲜羊水培养基,继续培养。
1.3.3换液 (1)胰酶消化法:培养9~11 d后于显微镜下观察细胞生长情况。当细胞贴壁生长并且有多个较好的梭形细胞克隆形成时,将原培养液移入另一培养瓶中继续培养以备用,向原培养瓶中加入4 mL新鲜培养基继续培养24 h。(2)原位法:培养6~8 d后于显微镜下观察细胞生长情况。克隆较多,且多为中大克隆时即可换上3 mL新鲜培养基继续培养24 h。
1.3.4收获 (1)胰酶消化法:用注射器(7号针头)向培养瓶内加入浓度为20 μg/mL的秋水仙素2滴,于37 ℃恒温培养箱中处理2.5 h后,采用胰酶消化法(0.25%消化胰酶)收集羊水细胞,再加入37 ℃预热的低渗液(0.075 mol/L KCl)6 mL,吹打混匀后低渗5 min,然后依次进行预固定、固定处理制得细胞悬液后,进行滴片、烤片、G显带制备染色体。(2)原位法:向培养盒内加入100 μg/mL秋水仙素50 μL,于二氧化碳培养箱内继续培养30 min,吸去培养液,再加入37 ℃预热后的低渗液(0.4% KCl,0.4%枸橼酸钠=1∶1)低渗30 min,依次进行预固定、第一次固定、第二次固定、第三次固定处理后,将培养盒内的玻片平放在染色体分散仪中进行分散,然后再烤片、G显带制备染色体。
1.3.5阅片分析 G显带后,采用德国徕卡(Leica)GSL-120 全自动染色体核型扫描分析系统进行扫描、捕获核型。根据中华人民共和国卫生行业标准(WS 322.2-2010)分析染色体核型,计数分析的细胞应来自两个独立的细胞培养系统,染色体显带分辨率至少应达到320条带水平,原瓶消化法计数至少20个细胞,分析5个细胞,染色体核型分析2个细胞;原位培养法计数至少15个克隆,分析5个细胞,染色体核型分析2个细胞。如遇到异常核型,应该增加计数分析染色体核型数量。
1.3.6染色体核型质量等级评分 根据文献[5]标准,染色体核型质量采取等级进行评分。染色体核型在1 000倍放大下,分为分散(一个视野下不包含全部染色体核型)、优质(一个视野下包含全部染色体核型且染色体核型交叉少于或等于5条)、差(染色体核型交叉大于5条)3个等级。
1.4统计学处理 采用SPSS21.0软件进行统计分析。采用Kolmogorov-Smirnov检验对计量资料进行正态分布检验。非正态分布以M(25,P75)表示。组间比较采取Mann-WhitneyU检验(非正态分布计量变量)。计数资料用率(%)表示,组间比较采取配对设计χ2检验。P<0.05 表示差异有统计学意义。
2 结 果
2.1原位法与胰酶消化法羊水细胞培养成功率比较 1 105例羊水标本均采用原位法、胰酶消化法两种培养方法进行双线培养及制片,其中2例羊水样本两种方法均培养失败,这2例样本有陈旧性出血,离心后有少许褐色沉淀;1例样本性状为茶色、颜色浑浊,原位法培养失败,胰酶消化法培养成功;2例样本胰酶消化法培养失败,原位法培养成功,其中1例羊水性状呈酱油色,1例呈褐色。胰酶消化法培养成功率为99.64%(1 101/1 105),原位法培养成功率为99.73%(1 102/1 105),这两种方法的培养成功率比较,差异无统计学意义(χ2=0.33,P>0.05)。
2.2原位法与胰酶消化法羊水细胞培养条件及分裂相比较 原位法羊水需求量为5 mL,培养基用量为7 mL;胰酶消化法羊水需求量为10 mL,培养基用量为8 mL。与胰酶消化法相比,原位法羊水细胞培养时间短,分裂相及优质分裂相数目多,差异均有统计学意义(Z=-31.83,P<0.001;Z=-2.937,P=0.003;Z=-2.943,P=0.003)。见表1。原位法每张玻片获得的染色体核型数目多于胰酶消化法,且其核型完整度、染色体分散度、显带清晰度都要优于胰酶消化法。见图1、2。
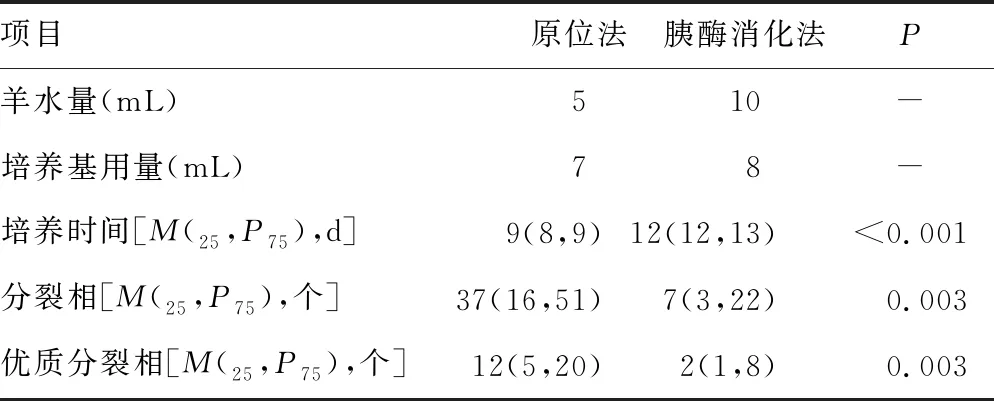
表1 原位法与胰酶消化法羊水细胞培养条件及分裂相数目比较

注:A为原位法的显微镜下染色体核型(×10);B为胰酶消化法的显微镜下染色体核型(×10)。

注:A为原位法的1 000倍放大下染色体核型;B为胰酶消化法的1 000倍放大下染色体核型。
2.3原位法与胰酶消化法羊水染色体核型结果比对与分析
2.3.1羊水染色体核型结果比对分析 实行胰酶消化法、原位法两种方法双线培养均成功的羊水标本为1 100例,其中两种方法均检出972例正常核型(88.36%)、128例异常核型(11.64%),染色体核型结果符合率为100%。128例异常核型包括3例13三体(0.27%)、3例18三体(0.27%)、16例21三体(1.45%)、3例47,XXX(0.27%)、3例47,XXY(0.27%)、1例49,XXXXY(0.09%)、1例69,XYY(0.09%)、12例易位(1.09%)、23例倒位(2.09%)、3例缺失(0.27%)、1例重复(0.09%)、52例染色体多态性改变(4.73%)、7例染色体数目异常真嵌合(0.64%)。见表2。

表2 1 100例羊水染色体核型结果符合率比对分析(n)
2.3.2染色体核型嵌合 在双线培养的原位法发现了8例染色体异常嵌合,其中7例嵌合的异常核型均出现在原位法两线培养玻片上的数个克隆内,并且在单线培养的胰酶消化法中也发现这7例染色体异常嵌合,则判断此为真嵌合,7例核型异常真嵌合结果见表3;还有1例仅在原位法1线培养的8号克隆内发生1号染色体部分片段易位,其他克隆内的核型均未出现易位,判断此为假嵌合现象。

表3 7例羊水染色体核型嵌合结果
3 讨 论
新生儿出生缺陷的重要原因是染色体病,而确诊染色体病的主要方法是羊水细胞培养及染色体核型分析技术。目前随着分子生物学技术的发展,不断涌现许多新的遗传诊断技术,而染色体核型分析仍是诊断染色体异常的金标准,因为其对易位、倒位、嵌合等染色体异常的检出具有无可替代的重要作用。羊水多来源于外、中、内三个胚层的脱落细胞,活细胞少,培养难度高[6]。本实验室原先采用的是传统的羊水细胞培养瓶-胰酶消化培养法,该法操作步骤繁琐、细胞丢失多、核型清晰度不佳,且由于采用胰酶消化将细胞克隆混合而无法区分细胞来源[7],之后本实验室为提高染色体核型质量及产前诊断的准确率而引入羊水细胞载玻片-原位培养法。
本研究同时采取胰酶消化法和原位法培养羊水细胞,配对设计χ2检验分析两种方法的培养成功率,差异无统计学意义(P>0.05),与郝娜等[7]报道结果一致。原位法使用的载玻片是具有天然正电荷的玻璃材质,羊水细胞更容易在其表面贴壁生长[8],缩短了培养时间,且其接种面积较胰酶消化法小,培养基用量更少,与胰酶消化法相比,原位法既缩短了产前诊断报告发放时间又节省了羊水培养基用量。本研究对进行产前诊断的孕妇抽取20 mL羊水进行染色体核型分析,10 mL羊水接种于培养瓶中,另10 mL羊水平均分成两份5 mL分别接种于两个原位培养盒中。在原位法的羊水接种量仅为5 mL的情况下,其核型分裂相仍多于胰酶消化法。本研究采取GSL-120 全自动染色体核型扫描分析系统进行扫描、捕获核型,根据染色体核型交叉条数及在1 000倍放大的视野下是否包含全部染色体来评判染色体分散质量[5],结果显示原位法培养的羊水中优质分裂相也多于胰酶消化法。可能由于原位法直接将羊水接种于载玻片上,样本无需进行多次转移、胰酶消化及多次离心吹打、滴片等步骤,相较于胰酶消化法简化了实验操作步骤,减少了细胞损失及实验操作错误的发生,实现了羊水细胞标准流程化操作,从而可以获得更多、更满意的染色体核型以供分析。
本研究对原位法与胰酶消化法同时培养成功的1 100例羊水染色体核型结果进行比对与分析,结果显示两种方法培养的羊水染色体核型结果符合率为100%,均检出972例正常核型、128例异常核型,其中包括7例染色体数目异常真嵌合。嵌合体是指同一个体内同时存在两种或两种以上的细胞系[9],在阅片过程中能够准确鉴别真假嵌合体,对临床预后的选择具有至关重要的作用。国外学者主张根据嵌合体性质将嵌合体分为3种水平[10]:水平Ⅰ是指单个异常核型仅出现在单个培养体系中,一般判断为假嵌合;水平Ⅱ是指两个或两个以上相同异常核型仅出现在单个培养体系中;水平Ⅲ是指两个或两个以上相同异常核型出现在两个或两个以上的培养体系中,一般为真嵌合的可能性高。对于水平Ⅱ嵌合体胰酶消化法很难鉴别,因为胰酶消化法采用胰酶消化将细胞克隆混合而无法有效辨别真假嵌合;原位法则保留了羊水细胞克隆性,可以有效区分真假嵌合。在原位法的羊水染色体核型分析过程中若发现两个或两个以上的相同异常核型仅出现在单个克隆内时,则认为此是假嵌合[11]。在实验过程中造成假嵌合的原因可能为羊水细胞在体外培养的环境与体内不同而发生的异常突变、母体细胞在羊膜腔穿刺时混入导致其与羊水细胞同时增殖、胰酶消化法制片过程中由于胰酶消化、刮取细胞等操作导致的染色体断裂、易位等[12-15]。与胰酶消化法相比,原位法保留了羊水细胞克隆性,可以鉴别羊水细胞来源,分辨染色体真假嵌合,降低了假性嵌合风险,有利于产前诊断的嵌合体异常诊断[16]。
综上所述,原位法具有培养时间短、培养基用量少、羊水需求量少、操作步骤简单、优质分裂相多,以及可以有效诊断真假嵌合等优点,实现了羊水细胞标准流程化操作,提高了染色体核型质量,缩短了产前诊断报告发放时间。但原位法耗材成本高且制片的可重复性低;胰酶消化法则由于可以重复滴片其制片的可重复性相对较高,且耗材相对经济。结合原位法和胰酶消化法的优缺点,羊水细胞培养可以采用原位法为主、胰酶消化法为辅的培养模式,提高产前诊断的效率、准确率与成功率。

