直肠癌保肛术后低位前切除综合征研究进展*
乔新华,王砚丽,张凤联
010059呼和浩特,内蒙古医科大学 护理学院(乔新华);010017 呼和浩特,内蒙古自治区人民医院 护理部(乔新华、王砚丽),胃肠外科(张凤联)
结直肠癌已成为全球第3大最常见的癌症,其发病率和死亡率在世界范围内高居第 3位和第 2位[1]。随着国人癌症疾病谱的变化,“富人癌症”之一的结直肠癌的发病率在我国也逐年增高,负担沉重。据统计,我国结直肠癌发病率和死亡率已跃居第2位和第5位,其中直肠癌较结肠癌更为多见,约70% ~ 80%的病例以中低位直肠癌为主[2]。目前,直肠低位前切除术和全直肠系膜切除术等保肛手术已逐渐取代经腹会阴联合切除术(Miles)成为低位直肠癌根治的首选术式,可避免患者终生携带造口[3]。但大约 70% ~ 90% 的患者在保肛术后都会经历不同程度的肛门直肠功能障碍,如排便次数增加、排便不尽、排便困难甚至大便失禁等,临床上称之为低位前切除综合征(low anterior resection syndrome,LARS),有些患者的LARS症状甚至会长期存在,严重影响患者的身心健康和生活质量[4]。因此,本文拟从直肠癌患者保肛术后LARS的影响因素、评估工具及干预措施方面进行探讨,以期为降低LARS的发生和减轻其症状,提高患者生活质量提供参考。
1 LARS的影响因素
患者个体不同,影响LARS发生的因素也有所不同,只有明确其形成因素,才能更好预防LARS,降低其发生风险。本文将从术前、术中、术后不同阶段对影响LARS高发的多重因素进行分析。
1.1 术前因素
高龄、原发肿瘤的影响以及新辅助放化疗等多种因素在患者进行根治术前就可能造成其肛门直肠功能障碍[5]。据相关研究[6]指出,以上因素与患者术后LARS的高发显著相关,会增加患LARS的几率。而新辅助放化疗近年来已被广泛应用于中低位直肠癌,尤其术前同步放疗目前已成为II ~ III期直肠癌患者的标准治疗方法,不但能缩小肿瘤体积,阻断肿瘤侵袭,还能降低局部复发率,提高保肛率[7]。但是术前新辅助放疗引起的辐射损伤会使盆腔组织纤维化,在一定程度上损害了患者术后肛门直肠功能,成为LARS发生的高危因素之一[8]。而新辅助化疗对肛门直肠功能的影响并不显著,Qin等[9]研究发现,接受新辅助放化疗的患者比只接受新辅助化疗的患者发生严重LARS的风险高出5倍多。因此,对于有LARS高危因素的患者,新辅助化疗可作为一种潜在的治疗选择[10]。术前重视对发生LARS风险因素的评估,帮助患者认识到术后可能面临的肛门直肠功能障碍,有利于其在保肛手术与术后排便功能之间做出最佳选择。
1.2 术中因素
在手术操作过程中,许多因素会对LARS的发生产生影响。肿瘤位置作为发生LARS的高危因素,距离肛门越近,患者术后发生异常排便症状的风险也越高[11]。Croese等[12]研究指出残余直肠< 4 cm的患者比≥4 cm的患者术后发生严重LARS的风险高出36%,分析原因主要可能与肿瘤位置低,手术切除部分或全部直肠造成肛门静息压下降,残余直肠储便能力下降以及损伤盆腔神经引起肛管感觉功能减退等有关[3]。而且由于肿瘤位置低下,患者吻合口往往要低至肛管直肠环水平,这也大大增加了术后LARS发生的几率[13]。郭帆等[14]指出吻合口距肛缘<5 cm组比≥5 cm组发生LARS的概率高42.9%,分析原因可能因为在手术过程中,患者吻合口位置过低,手术可操作空间减小,容易损伤肛门内括约肌及直肠周围神经,再加上低位吻合手术难度大,术后张力增大并发吻合口漏等都可能造成LARS的高发生率[3]。另外,为降低吻合口处肠管的压力,减少吻合口漏的发生,部分患者会进行预防性造瘘,以暂时性流转粪便,减少粪便对吻合口的刺激,但有研究发现,预防性造瘘可能会增加术后发生LARS的风险[7]。一项Meta分析显示,和未造瘘的患者相比,行预防性造瘘的患者在瘘口回纳后肠道功能障碍更严重,发生LARS的危险也高出其4.11倍[15],主要原因可能与人为肛门失用导致废用性肠炎的高发引起胆汁吸收不良、小肠细菌过度生长等有关[16]。
1.3 术后因素
吻合口漏作为直肠癌术后常见且严重的并发症之一,也是影响患者术后排便功能,发生LARS的重要因素之一[3]。据报道,患者术后发生吻合口漏会导致LARS的发生风险增加5.5倍[17]。还有研究[14]显示,在105例行低位前切除手术(low anterior resection,LAR)的直肠癌患者中有10例术后发生吻合口漏,但1年后,这些患者肛门直肠功能仍未完全恢复,依然伴有不同程度的LARS。这可能是因为吻合口漏导致盆腔感染引起神经病变以及周围组织愈合后瘢痕化,降低了肠管的顺应性甚至造成不同程度的肠管狭窄,从而导致LARS的高发生率,并且无法随时间延长而逐步恢复[18]。因此,要充分重视术前肠道准备、减少术中操作技术误差、保证术后引流通畅,多方面协同作用尽可能预防吻合口漏的发生以减少LARS。
2 LARS的评估工具
对于直肠癌保肛术后LARS患者,评估其肛门直肠功能至关重要。表1中列出了LARS患者常用肛门直肠功能评估量表[19-21]。

表1 LARS患者常用肛门直肠功能评估量表介绍Table 1.Commonly Used Anorectal Function Assessment Scales for LARS Patients
2.1 LARS评分
LARS评分是国际上唯一一个专门用于评估LAR术后患者排便障碍的工具,能评估患者症状的严重程度及其生活质量的高低[22]。它涵盖排气失禁、稀便失禁、排便频率、排便聚集、大便急迫感5个条目,适合于对早期LARS患者的初筛,能指导治疗,易于临床应用[19]。其中,评分范围 0~42分,分数越高表示LARS症状越严重。研究发现,当LARS患者得分≥30分时,定义为重度LARS,会严重影响其社会功能并对生活质量造成重大影响[3]。但由于LARS评分是一种主观评价,评分结果可能也会受到患者性格和情绪的影响[23],因此在临床中应与其他客观指标配合使用以提高评估的可信度。
2.2 纪念斯隆-凯特琳癌症中心肠道功能(Memorial Sloan Kettering Cancer Center Bowel Function Instrument,MSKCC BFI)问卷
MSKCC BFI能直接地反映肛门括约肌的功能状态[20]。它包含便频便急、饮食因素、排便感觉3个维度共18个条目,评分范围18 ~ 90分,分数越高表明肠道功能水平越好[24]。有学者认为,该问卷评估全面且深入,但其问题数量多且评分复杂,不如LARS评分直观且实用,可能会限制该问卷在临床上的应用[24]。鉴于MSKCC BFI能对LARS患者进行详细的症状评估,且患者易于理解并接受,故为患者制定针对性的干预措施可用其提供参考。
2.3 徐忠法五项十分制评分法
该量表通过患者回答便意、控便能力、感觉功能、排便次数、排便时间这5个问题来评估肛门功能,评估结果分为优、良、一般、差4个等级,评分范围0 ~ 10分,分数越高表示肛门功能越好[25]。相比于其他评估量表,该量表不仅包括便意、排便感觉等主观指标,而且还包括排便次数及时间等相对客观指标,评估结果更全面、可靠。
2.4 大便失禁问卷
Wexner评分是临床上使用最广泛的大便失禁问卷,主要从排气、稀便、硬便失禁及使用衬垫、生活习惯改变这5方面的发生频率进行评价来判断患者的失禁程度,评分范围0 ~ 20分,分数越高表示患者越容易发生大便失禁[26]。此外,还有Vaizey 评分、Pescatori评分、AMS评分等都可以根据肛门失禁程度判断其功能情况,但其临床应用远不及Wexner评分[21]。以上评分主要针对大便失禁这一主要症状进行评估,没有反映LARS的总体风险或对生活质量的影响,评估内容较为单一,因此与其他评估量表或客观指标联合使用可能效果更好,而且在评估前应充分了解患者真正重要的症状,为其选择合适的评估工具。
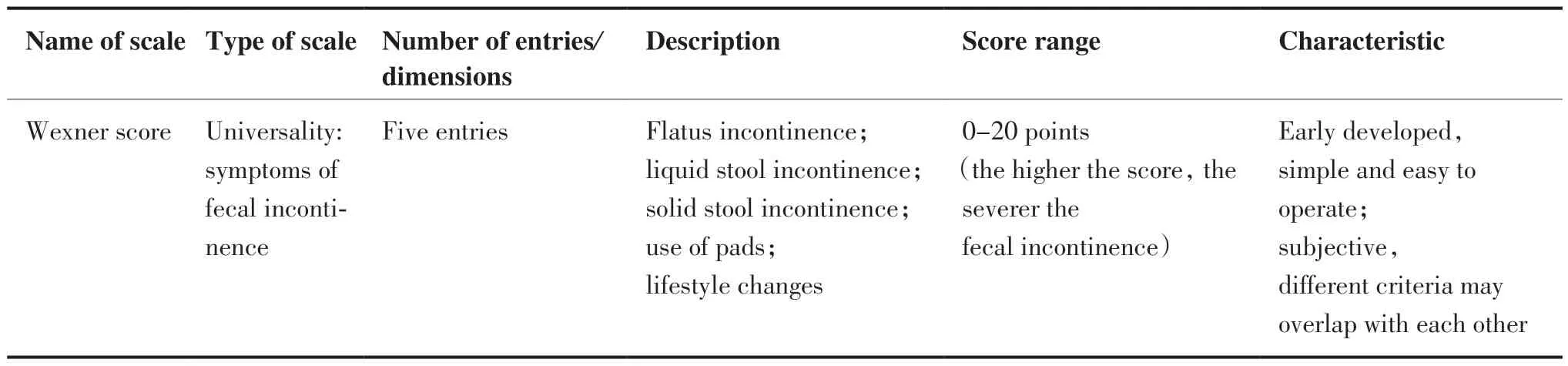
(Continued from previous page)
综合以上量表,其操作简单直接,更注重患者的亲身感受,不会加重患者经济负担,接受度较高,但主观性强,评估结果相对片面。应根据患者实际情况,配合肛门直肠测压、直肠超声、MRI等安全、无创、简便、客观的方法精准全面反映患者肛门直肠功能[21]。
3 LARS的干预措施
目前,针对LARS的治疗还没有统一标准,主要使用现有的治疗大便失禁、急迫和排空障碍的方法进行对症治疗以改善肛门直肠功能、减少异常排便的发生。下面就目前常用的干预方法进行介绍。
3.1 盆底康复治疗(pelvic floor rehabilitation,PFR)
盆底康复治疗包括盆底肌肉训练(pelvic floor muscle training,PFMT)、生物反馈训练(biofeedback training,BFT)、直肠球囊训练(rectal balloon training,RBT),是目前改善肛门直肠功能、治疗大便失禁最重要的方法之一,治疗率可达50% ~ 80%[27]。
PFMT主要是进行盆底肌肉和肛门括约肌的自主收缩和舒张,能增强盆底肌及肛周肌肉的力量,且方法简单、痛苦小,患者更容易接受[24]。有研究显示,在患者住院期间及出院后半年内实施PFMT,是对LARS的有效干预[28]。Asnong等[29]也发现,在根治术后或造口回纳后1个月通过PFMT治疗,在第4个月时,试验组LARS改善的患者比对照组多18.76%,6个月时比对照组多26.5%,二者差异均有统计学意义;但在第12个月时不再如此,干预组LARS改善的人数只比对照组多5.1%,二者差异无统计学意义,同样证明了PFMT是直肠癌保肛术后LARS的早期治疗选择。但由于PFMT是患者自主训练,治疗效果很大程度上取决于患者居家锻炼的动机、意愿和自律性[30],故提高患者的自我管理能力对PFMT至关重要,可将移动医疗用于指导直肠癌保肛术后患者LARS的管理中,以改善患者自我管理能力,提高其锻炼依从性。
BFT作为一种具有持久效果的非侵入性、非药物性选择,通过肛管直肠测压或肌电图等设备将患者盆底肌肉舒缩运动可视化,为患者提供直接反馈,能让他们更标准、更有效地进行锻炼[27]。RBT训练是通过模拟排便的紧迫感以训练直肠敏感性、提升储便能力的一种方法[27]。目前多项研究表明,采用多模式方法将干预技术相结合锻炼效果更好,更有利于缓解LARS症状[31]。吴晓丹等[32]对109例直肠癌保肛患者进行16个月的干预,结果发现BFT联合PFMT组LARS发生率为22.86%,明显低于PFMT组的47.22%。季怡虹等[33]研究发现,患者经RBT联合PFMT干预后,LARS评分降低且30 mL水量球囊比15 mL水量球囊更有利于患者术后排便功能恢复,分析原因可能是因为30 mL水量球囊与术后患者单次粪便体积相似,能够模拟正常粪便体积。虽然多种技术的联合使用效果更好,但这需要患者定期去门诊进行盆底康复,受到医生出诊时间及经济原因等多种因素限制,因此临床实际工作中应综合考虑患者实际情况,制定个性化干预方案。
3.2 骶神经刺激(sacral nerve stimulation,SNS)和经皮胫神经刺激(percutaneous tibial nerve stimulation,PTNS)
SNS采用皮下埋置发生器经低电流刺激骶神经,起到调节神经支配的作用,已广泛用于急迫性尿失禁、慢性排尿功能障碍等泌尿系统疾病并取得良好效果,后逐渐用于大便失禁、慢性便秘等消化系统疾病,具有创伤小,可调控等优势[34]。目前多项研究证实,对保守治疗LARS无效的患者可采用SNS治疗,能有效改善LARS[35]。Rubio-Perez等[36]对25例LARS患者进行SNS,治疗后LARS评分从37.82分降到29分,Wexner评分从16.24分降到11.13分,大便失禁程度明显改善,不足的是患者需要频繁地改变程序设置,这与Croese等[37]研究结果基本一致。此外,SNS治疗费用高而且植入脉冲发生器后还可能发生排异反应、感染、电极脱落等副作用[37]。考虑到与植入脉冲发生器相关的潜在感染风险,目前已经研究出了一种侵入性更小、更简单、更便宜的PTNS替代方案[38]。Cuicchi 等[39]研究发现,LARS患者经PTNS治疗后LARS评分从35.8分降到28.2分,大便失禁严重程度指数从36.8分降到17.2分,均有显著差异,而且生活质量也明显改善,证明了PTNS是治疗LARS的有效方法,同样使 LARS 患者受益,但对于其长期疗效,有必要扩大患者样本量进行长期随访以确认治疗的有效性。
3.3 肛门灌洗(tansanal lavage,TAI)
TAI是治疗LARS患者简单、经济又有效的方法,尤其是对于便频、便急、便失禁等与结肠动力障碍相关的症状具有良好疗效[40]。据研究[41]显示,TAI已成功地用于治疗重度LARS患者,能减少其排便次数至每天1 ~ 2次,每晚0次,有效改善肠道功能,提升生活质量。虽然TAI在技术上易于学习,可以通过加强患者自我管理能力来控制LARS,但TAI治疗后还可能出现不同程度的腹痛、寒战、恶心等副作用,甚至存在穿孔的风险[42]。因此对于优势与风险并存的TAI治疗,我们应根据患者症状的严重程度进行全面评估,选择最佳治疗方法。
3.4 中医治疗
有研究[43]显示,中药内服、中药坐浴、艾灸、针刺等中医疗法可有效改善LARS患者的异常排便症状,加快肠道功能恢复,对治疗LARS有一定优势。李可欣[44]将揿针埋于八髎穴对19例LARS患者进行揿针治疗,结果发现治疗后患者LARS评分从33.95分降到26.63分,排气失禁、排便次数及排便急迫感均较治疗前有所下降,在一定程度上能改善患者异常排便情况,提升生活质量。但因治疗时间短,此方法无法维持远期效果,因此延长治疗时间,开展多中心、大样本、进行长期高质量研究对今后LARS的治疗非常重要[44]。而且中医干预疗法具有我国传统特色,方法多种多样,未来可以在专科护士的配合下逐步探索中医药及中西医结合等多种干预手段用于LARS的治疗。
3.5 饮食干预
目前,大多数直肠癌保肛患者会通过加强自我管理来控制术后LARS的发生,其中,饮食管理对缓解肠道功能障碍发挥着不可或缺的作用,通过改变饮食行为、调整膳食能直接影响肠道动力、改变肠道菌群结构,影响肠道症状[45]。一项研究显示,超过96%的患者能通过饮食控制肠道症状,尤其是高纤维和低脂肪饮食[46]。Liu等[47]研究也发现,在直肠癌患者保肛术后前6个月内,油(植物油或动物油)摄入量每减少1个单位,LARS改善的概率能增加6.3%。而Sun等[48]的结论不一致,认为蔬菜和水果等高纤维食物有害于直肠癌患者术后的肠道功能,会加重大便失禁的发生,分析原因可能与摄入的纤维类型有关,如西红柿、苹果等可溶性膳食纤维能改善粪便的保水能力及粘稠度,减少大便失禁,相比之下,来自水果皮、大白菜、玉米等食物的不溶性纤维可能会加剧腹泻和腹胀,因此对排便的影响存在差异[49]。故在术前就应加强对患者饮食习惯的早期评估,术后及时进行饮食计划教育健康指导,对可能加重LARS的食物减少摄入以缓解肠道症状。
3.6 药物干预
肠道药物干预是一种旨在控制症状的保守治疗措施[46]。目前,止泻药、类固醇、抗生素等已被应用于LARS的治疗中,尤其对于轻度LARS患者,大部分可接受药物对症治疗[3]。Rokkas等[50]研究指出,对餐后腹泻的LARS患者可使用5-HT3受体拮抗剂来缓解症状,能减慢结肠运输,减少排便次数,缓解大便急迫感以及大便失禁程度。此外,对LARS相关型腹泻还可使用洛哌丁胺、山莨菪碱等止泻药来抑制肠道蠕动,对胃肠胀气症状可采用利福昔明或新霉素等抗生素对症治疗[3]。但大多数药物治疗仅针对单一症状进行控制,同时应该加强患者自我管理教育,使其能保持健康饮食和良好的生活习惯,协同配合逐步改善LARS症状。
综上所述,以上干预措施主要针对LARS发生后的治疗,很少用于研究对LARS的预防作用。Martellucci等[24]建议在每个出院患者中使用PFMT,可以改善术后肛门括约肌功能的恢复,尤其对于造口术后患者不仅能防止造口期的功能失用,还能增强造口回纳后的功能反应[51]。因此术后6个月作为LARS患者恢复肛门直肠功能的“黄金期”,在此期间应尽早开始所有可能的康复干预,以达到最佳的长期功能效果。
4 小 结
总而言之,对于直肠癌保肛患者要充分认识到影响LARS发生的危险因素,并重视对LARS患者的肛门直肠功能评估,这对治疗方法的选择、治疗效果的评价具有关键作用。另外,对于肛门直肠功能评估目前尚无统一且客观的量化指标,主要以主观性量表评估更为常见。后续研究可将这些量表与肛门直肠测压、直肠超声等客观指标相结合,精准评估LARS患者的肛门直肠功能,为后续治疗提供有效的反馈。此外,针对LARS的治疗,目前缺乏特异性方法,相关干预研究还处于探索阶段,虽然PFR、SNS、TAI、中医等方法已被证明治疗LARS是有效的,但后续还需要成立多学科团队,开展多中心、大样本、多模式研究评估其长期疗效,以便更好地改善直肠癌患者术后肠道功能。同时,还要重视对LARS的预防,将LARS的发生防患于未然,采取各种措施进行前瞻性干预以预防LARS的发生或减轻术后LARS的严重程度也是今后医护人员需要努力的方向。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

