不同造模方式诱导的糖尿病小鼠肝肾组织中脂质异位沉积情况的研究*
刘露, 扈腊英, 王贵芳, 常雪冰, 黄亚莉, 宋铃榆, 周宇霞, 郭兵
不同造模方式诱导的糖尿病小鼠肝肾组织中脂质异位沉积情况的研究*
刘露, 扈腊英, 王贵芳, 常雪冰, 黄亚莉, 宋铃榆, 周宇霞△, 郭兵△
(贵州医科大学病理生理学教研室/贵州省常见慢性疾病发病机制及药物研究重点实验室, 贵州 贵阳 550025)
观察比较高脂饮食(high-fat diet, HFD)、链脲佐菌素(streptozocin, STZ)联合HFD(HFD/STZ)、单侧肾脏切除术(unilateral nephrectomy, UNx)+HFD/STZ和/小鼠4种糖尿病模型小鼠肝肾组织中脂质异位沉积情况。选取8周龄C57BL/6小鼠,随机分为正常饮食(normal chow diet, NCD)组(=10)、HFD组(=10)、HFD/STZ组(=10)和UNx+HFD/STZ组(=12)。NCD组给予NCD饲养;HFD组、HFD/STZ组和UNx+HFD/STZ组给予HFD饲养,诱导小鼠出现肥胖和胰岛素抵抗,且HFD/STZ组和UNx+HFD/STZ组给予55 mg/kg STZ腹腔注射,后以HFD饲养至40周龄。选取10周龄/小鼠和野生型小鼠各8只,NCD饲养至40周龄。记录分析小鼠血糖和体重变化;收集血液样本测定甘油三酯(triglyceride, TG)含量;肝肾组织样本石蜡包埋后进行苏木精-伊红染色观察组织病理变化;免疫荧光染色和Western blot检测脂滴包被蛋白2的表达;油红O染色和尼罗红染色观察脂滴沉积情况。HFD组小鼠体重显著升高(<0.05),血糖水平和血清TG含量升高不显著(>0.05);HFD/STZ组、Unx+HFD/STZ组及/组血糖水平和血清TG含量显著升高(<0.05),且肝肾组织中存在大量脂质异位沉积,均能诱导小鼠发生糖尿病肝肾脏损伤,其中Unx+HFD/STZ组最严重;HFD组肾脏未见明显脂质沉积,肝脏存在大量脂质沉积。Unx+HFD/STZ组小鼠的肝肾脂质沉积最严重,但存在死亡率较高、小鼠状态差等缺点。单纯HFD饮食的小鼠是研究非酒精性脂肪性肝病合适的模型。HFD/STZ和模型小鼠出现糖尿病肾脏脂毒性且呈现糖尿病肾病的肾脏病理改变,类似于2型糖尿病患者,适用于研究糖尿病及其并发症。
糖尿病;脂质沉积;脂毒性;链脲佐菌素;单侧肾脏切除术
糖尿病(diabetes mellitus, DM)是一种慢性代谢性疾病,其特征是异常升高的血糖水平(高血糖症),在大多数情况下,DM会导致外周组织如心血管系统、视网膜、神经系统、肝脏和肾脏等发生许多的并发症[1]。除了高血糖症之外,其他代谢因素如游离脂肪酸(free fatty acids, FFA)水平的增加、脂联蛋白(adiponectin)表达量的减少也会加快疾病的进程[2]。而脂质代谢紊乱可能导致大量脂质积累,一旦超过脂肪组织的储存能力,多余的脂质将沉积到非脂肪组织如心肌、胰腺、骨骼肌、肝脏和肾脏中,激活了生脂和生糖细胞信号通路,导致组织细胞功能障碍,正常生理过程遭到破坏,称为脂毒性(lipotoxicity)[3-4]。
2型糖尿病(type 2 diabetes mellitus, T2DM)的发生发展与肥胖导致的脂肪因子水平改变有关,而肥胖和高脂血症是慢性肾病(chronic kidney diseases, CKD)最常见的独立危险因素,肾脏近端小管细胞更是脂质积聚的主要部位之一,这提示肾实质中的脂质积聚对肾功能有害[2-3]。肝脏是一种胰岛素敏感组织,可通过调节葡萄糖利用和糖异生之间的相互作用维持体内葡萄糖水平,在糖尿病及其并发症的病程中起着重要的作用,而胰岛素抵抗也通过多种机制影响肝脏脂质代谢,包括促进肝脏中的脂肪从头合成等[5]。研究表明,脂毒性可通过激活炎症、氧化应激、线粒体功能障碍和细胞死亡对肝、肾组织产生毒性作用[6-7]。
根据国际糖尿病基金会(international diabetes foundation, IDF)的数据,预计到2025年受T2DM影响的人数将增加到3.8亿[8]。超过80%被诊断为T2DM的人是肥胖的,而早期DM患者,通过降低10%的体重可使肥胖个体的临床糖尿病消失[9]。因此,研究T2DM的发病与脂质沉积的关系尤为重要。
动物模型是科学研究中重要的工具,为了复制与人类病程最相似的疾病动物模型,为预防糖尿病及其并发症提供新策略,目前常选择小鼠作为实验动物,其生理结构与人类极为相似,且遗传资源非常丰富,造模方式包括单纯高脂饲料(high-fat diet, HFD)喂养、链脲佐菌素(strepyozocin, STZ)注射联合HFD喂养(HFD/STZ)、/小鼠以及近年出现的单侧肾脏切除术(unilateral nephrectomy, UNx)+HFD/STZ联合诱导[10]。这些模拟人类T2DM的方法各有利弊。本研究将观察对比以上4种不同造模方式诱导的DM模型小鼠肝、肾组织脂质沉积的严重程度,为深入研究T2DM与脂质沉积的关系选择更合适的动物模型提供实验依据。
材料和方法
1 材料与试剂
1.1动物SPF级10周龄/小鼠和野生型(wild-type, WT)小鼠各8只,雄性,体重(32±5) g,购自江苏集萃药康生物科技股份有限公司,合格证编号为202110143;SPF级8周龄C57BL/6小鼠42只,雄性,体重(20±3) g,购自北京华阜康生物科技股份有限公司,合格证编号为110322210102108625。所有动物研究实验方案均经贵州医科大学实验动物伦理委员会批准(文件编号:2000058),并按照美国国立卫生研究院指南进行实验动物的护理和使用。所有小鼠每4~5只一笼,饲养在标准实验室条件和温度下,可自由饮水,予正常饲料(normal chow diet, NCD)饲养或60 kcal%的HFD饮食。
1.2主要试剂尼罗红(Nile red)染料(Sigma-Aldrich,货号:19123);抗GAPDH抗体(货号:PMK053S)和辣根过氧化物酶标记的羊抗兔IgG(货号:PMK-014-090M)均购自Biopm;细胞甘油三酯(triglyceride, TG)含量酶法测定试剂盒(Applygen,货号:E1013);抗脂滴包被蛋白2(perilipin 2, PLIN2)抗体(Proteintech,货号:15294-1-AP);Smart-ECL Enhanced Solution I、II(Smart-Lifesciences,货号:H31500-1、H31500-2);BCA蛋白测定试剂盒(Thermo,货号:U1289373);Immobilon-NC转移滤膜(Millipore,货号:HATF00010);RIPA裂解液(组织)(货号:P0013B)和Western Ⅰ抗稀释液(货号:P0023A-100ml)均购自Beyotime;甲醇(Kermel,货号:867-56-1);抗荧光衰减封片剂(含DAPI)(Solarbio,货号:S2110);无毒快速油红O(oil red O)染液(Jiancheng Biotech,货号:D027-1);Alexa FluorTM555标记羊抗兔IgG(Invitrogen,货号:A21429);高脂饲料(Dyets,60 kcal%);STZ(Aladdin,货号:S110910);异氟烷(RWD,货号:R510-22)。
1.2主要仪器电泳仪电源(Liuyi Biotech,型号:DYY-7C型);化学发光成像系统(Tanon,型号:ChemiDoc);激光共聚焦显微镜(Olympus,型号:FV3000);正置显微镜(Olympus,型号:BX53);小鼠麻醉挥发罐(MSS,型号:MSS-3)。
2 模型构建
2.1分组选取8周龄C57BL/6小鼠42只,随机分组为NCD组(=10)、HFD组(=10)、HFD/STZ组(=10)和UNx+HFD/STZ组(=12);随机选取10周龄/小鼠8只,WT小鼠8只作为对照组。
2.2造模方法以空腹血糖浓度≥16.7 mmol/L为DM小鼠模型构建成功[11];NCD组始终给予NCD;HFD组自第9周起给予HFD饲养至40周;HFD/STZ联合诱导组先予以HFD饮食喂养12周,小鼠出现胰岛素抵抗且体重显著增加后腹腔注射STZ[小鼠饥饿8 h后,以55 mg/kg的剂量腹腔注射STZ,STZ溶解于50 mmol/L柠檬酸钠缓冲液(pH 4.4)中,每天1次,连续注射3 d,注射完毕后2 h允许进食],后继续给予HFD饲养至40周;UNx+HFD/STZ组选择8周龄小鼠在异氟烷麻醉状态下行UNx,术后存活12只,术后适应性喂养1周再腹腔注射STZ,剂量同上,后以HFD饲养至40周龄[10],见图1。/小鼠和WT型小鼠均以NCD饲养至40周。记录分析小鼠空腹血糖(小鼠禁食10 h后,针刺取小鼠尾静脉血,经血糖仪测定空腹血糖值)和体重变化,采集血液样本经试剂盒测定甘油三酯(triglyceride, TG)含量,采集肝肾组织样本进行苏木精-伊红(hematoxylin-eosin, HE)染色观察形态变化,免疫荧光(immunofluorescence, IF)染色和Western blot法检测PLIN2的表达,oil red O染色和Nile red染色观察脂滴沉积情况。

Figure 1. Diagram of diabetic mouse models.
3 实验方法
3.1HE染色观察各组肝、肾组织形态变化将切片放在80 ℃恒温箱内烤片30 min,后于二甲苯Ⅰ和Ⅱ内分别静置15 min脱蜡,再分别放入100%、100%、90%、80%、70%乙醇内依次脱水各2 min,再用纯水洗2 min×3次;片子置于苏木精染液中2 min,镜下观察染色情况,染色效果满意即可自来水终止染色,自来水返蓝;再将片子置于伊红染液中染色2 min,镜下观察,染色效果满意即可;将切片放入70%乙醇中约3秒钟,再依次于95%、100%和100%乙醇内各脱水1 min,二甲苯Ⅰ和Ⅱ内各透明5 min;中性树胶封片,镜下观察。
3.2试剂盒检测血清、肝及肾组织蛋白中TG含量组织样本收集后,按比例每1 mg组织加20 μL裂解液,取50 mg组织匀浆后静置裂解10 min,4 ℃、15 493×离心15 min,取上清转移至新1.5 mL离心管中,经BCA蛋白测定试剂测定蛋白含量,取50 μL上清于新离心管,70 ℃加热10 min,367×室温离心5 min,取10 μL上清或血清用96孔微板法经酶标仪测定值,建立标准曲线并计算TG含量(按试剂盒说明书配制工作液)。
3.3Western blot法检测PLIN2蛋白水平组织样本收集后,加入1 mL RIPA裂解液,冰上裂解1 h,每隔10 min涡旋震荡一次,后4 ℃、15 493×离心15 min,弃沉淀,上清分装保存,用BCA试剂盒测定蛋白吸光度,根据标准曲线计算蛋白浓度,加入适量2×上样缓冲液,充分混匀,于100 ℃中金属浴中加热7~10 min。所得蛋白样品经SDS-PAGE分离,转膜,使用0.1% TBST配制50 g/L的脱脂牛奶封闭1 h,0.1% TBST洗膜,5 min×3次,分别孵育Ⅰ抗(GAPDH抗体,1∶5 000;PLIN2抗体,1∶1 500),4 ℃垂直摇床孵育过夜。第2天,回收Ⅰ抗后,0.1% TBST洗膜10 min×3次,常温孵育相应的辣根过氧化物酶标记的Ⅱ抗(1∶8 000)1 h;0.1% TBST洗膜10 min×3次;ECL化学发光法显色,Tanon化学发光成像系统曝光。ImageJ软件统计灰度值。
3.4oil red O染色观察各组肝、肾组织中脂质沉积情况组织样本收集后,经OCT于-20 ℃冷冻包埋,切片,厚度8 μm,切片恢复至室温后,组化笔圈出组织位置,滴加油红染料(按试剂盒配制),静置染色15 min,PBS洗5 min×3次,擦干复染苏木素2 min,自来水返蓝10 min,擦干,封片。显微镜下观察。
3.5Nile red染色观察各组肝、肾组织中脂质沉积情况组织样本收集后,经OCT于-20 ℃冷冻包埋,切片,厚度8 μm,切片恢复至室温后,PBS洗5 min×3次,滴加Nile red染料(Nile red粉末按0.1 g/L溶解于DMSO,后使用20%甘油稀释为0.01 mg/L即为工作液),静置避光染色2 h,PBS避光洗5 min×3次,擦干,抗荧光淬灭封片剂(含DAPI)封片,激光共聚焦显微镜下观察。
3.6IF染色观察各组肝、肾组织中PLIN2蛋白表达情况组织样本收集后,经OCT于-20 ℃冷冻包埋,切片,厚度8 μm,切片恢复至室温后,PBS洗5 min×3次,4%多聚甲醛固定15 min,PBS洗5 min×3次,0.2% Triton打孔10 min,室温孵育Ⅰ抗(PLIN2抗体,1∶200)2 h,PBS洗5 min×3次,室温避光孵育对应荧光Ⅱ抗(1∶200)1 h,PBS洗5 min×3次,擦干,抗荧光淬灭封片剂(含DAPI)封片,激光共聚焦显微镜下观察。
4 统计学处理
GraphPad Prism 8.3软件进行统计学分析。数据均以均数±标准差(mean±SD)表示。组间均数比较使用单因素方差分析及LSD-检验。以<0.05为差异有统计学意义。
结果
1 各DM模型小鼠体重、血糖及血清TG变化情况
为评估DM小鼠模型构建效果,分别记录40周时各组DM小鼠血糖和体重变化。与WT组比较,/组血糖、体重以及血清TG含量均显著升高(<0.05);HFD组小鼠体重较NCD组显著升高(<0.05),血清TG含量和空腹血糖水平无显著差异(>0.05);与NCD组比较,HFD/STZ和UNx+HFD/STZ组小鼠体重无显著差异(>0.05),空腹血糖水平及血清TG含量显著升高(<0.05),见表1。
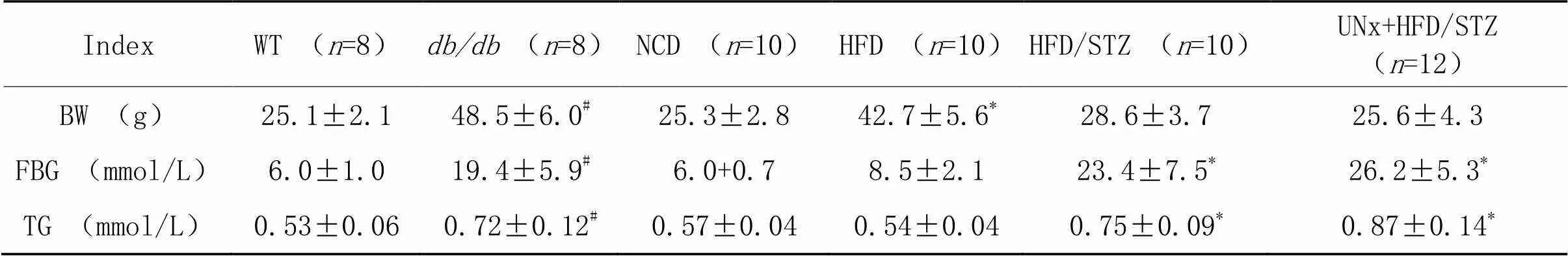
表1 各组DM模型小鼠体重、空腹血糖水平及血清TG含量
BW: body weight; FBG: fasting blood glucose; TG: triglyceride.#<0.05WT group:*<0.05NCD group.
2 HE染色观察各组DM模型小鼠肾组织形态变化
HE染色结果显示,与NCD组和WT组比较,HFD组出现了肾小管的增生和肥大;/、HFD/STZ和UNx+HFD/STZ组偶可见蛋白管型,细胞外膜基质增加,伴有肾小管代偿性和(或)失代偿性扩张,肾间质中存在大量淋巴细胞、单核-巨噬细胞等炎症细胞浸润,可见局灶状甚至片状肾小管萎缩;UNx+HFD/STZ组存在部分肾小管腔扩张,且可见急慢性炎症,见图2。

Figure 2. The pathological changes of kidney tissues of DM mice in each group (HE staining). Scale bar=200 μm (black) or 100 μm (red).
3 各组DM模型小鼠肾组织中脂质沉积情况及TG含量测定
oil red O及Nile red染色结果显示,与NCD和WT组比较,HFD组小鼠肾组织中未见明显脂滴沉积,而/、HFD/STZ和UNx+HFD/STZ组小鼠肾组织中存在大量脂滴沉积,其中UNx+HFD/STZ脂滴沉积较多;低倍镜下观察HFD/STZ和UNx+HFD/STZ组oil red O染色可见,脂滴大多沉积在肾脏皮质与髓质交界处,见图3。

Figure 3. The lipid deposition in kidney tissues of DM mice in each group. A and B: oil red O staining, scale bar=200 μm (black) or 100 μm (red); C and D: Nile red staining, scale bar=50 μm.
IF-PLIN2和Western blot结果与oil red O染色和Nile red染色结果一致,与NCD和WT组比较,HFD组PLIN2表达量较少,/、HFD/STZ和UNx+HFD/STZ组PLIN2表达水平较高,见图4A、B、D。经试剂盒测定肾脏组织中TG含量,结果显示,与NCD和WT组比较,HFD组TG含量较少,而/、HFD/STZ和UNx+HFD/STZ组TG含量较高,其中UNx+HFD/STZ组TG含量最高,见图4C。

Figure 4. The PLIN2 expression and TG content in kidney tissues of DM mice in each group. A and B: the expression of PLIN2 in each group was determined by IF (scale bar=50 μm); C: the TG content in each group; D: the expression of PLIN2 was determined by Western blot. Mean±SD. n=3. **P<0.01 vs NCD group; ##P<0.01 vs WT group.
4 HE染色观察各组DM模型小鼠肝组织形态变化
HE染色结果显示,NCD与WT组肝脏血窦较为清晰,以中央静脉为中心肝索呈现放射状,肝细胞核位于细胞中央,细胞质丰富且结构清晰;HFD组肝细胞出现脂肪变性,肝细胞体积明显增大,淋巴细胞、单核-巨噬细胞等炎症细胞浸润不明显;/组存在轻度脂肪变性,肝细胞体积稍增大,炎症细胞浸润不明显;HFD/STZ组存在肝细胞点状坏死和炎症细胞浸润;UNx+HFD/STZ组肝细胞体积明显增大呈空泡状,肝索排列紊乱,肝血窦狭窄甚至消失,少见正常肝细胞,无法判断炎性细胞浸润程度,见图5。

Figure 5. The pathological changes of liver tissues of DM mice in each group (HE staining). Scale bar=200 μm (black) or 100 μm (red).
5 各组DM模型小鼠肝组织中脂质沉积情况及TG含量测定
oil red O和Nile red染色结果显示,NCD和WT组仅存在极少量脂滴;HFD组肝细胞内存在大量脂滴沉积,脂滴小而多;UNx+HFD/STZ组存在大量脂滴沉积,脂滴大而多;HFD/STZ和组脂滴少且为点状,见图6。

Figure 6. The lipid deposition in liver tissues of DM mice in each group. A and B: oil red O staining, scale bar=200 μm (black) or 100 μm (red); C and D: Nile red staining, scale bar=50 μm.
IF-PLIN2和Western blot结果显示,与NCD和WT组比较,UNx+HFD/STZ组PLIN2表达水平较高,HFD组次之,见图7A、B、D。经试剂盒测定肝脏组织蛋白中TG含量,结果显示,与NCD和WT组比较,UNx+HFD/STZ组TG含量高于HFD组,HFD组TG含量略高于和HFD/STZ组,见图7C。

Figure 7. The PLIN2 expression and TG content in liver tissues of DM mice in each group. A and B: the expression of PLIN2 in each group was determined by IF (scale bar=50 μm); C: the TG content in each group; D: the expression of PLIN2 was determined by Western blot. Mean±SD. n=3. **P<0.01 vs NCD group; ##P<0.01 vs WT group.
讨论
高甘油三酯血症(hypertriglyceridemia)是DM人群中常见的血脂异常[12-13]。TG主要储存在脂滴(lipid droplets, LDs)中,其生理性脂解几乎只发生在脂肪组织中,调节取决于能量需求。一旦该过程遭到破坏,过多的脂质将以脂滴的形式大量积聚在非脂肪组织中(如肝脏、肾脏和心脏)[14-15]。近年来研究显示,降脂类药物(如贝特类、他汀类)对DM有益[16]。尽管DM患者的血脂异常不仅存在于肾脏中,还存在于肾外组织(如肝脏、胰腺和心脏)中,但肝脏和肾脏是身体中少数能够从其他能量底物(如甘油)产生葡萄糖的器官[3]。因此研究DM病程中肝肾组织脂质沉积尤为重要,选择合适的动物模型是其重要的部分。
本研究构建HFD、HDF/STZ、UNx+HDF/STZ以及小鼠这4种相关的DM模型以探讨选择何种模型小鼠研究肝肾脂质沉积最为合适。通过比较分析小鼠体重和血糖判断DM小鼠成模情况。而PLIN2已被证明与细胞内TG有高亲和力[17-18],TG是脂滴的主要成分,是脂质代谢紊乱的定量蛋白[19],所以本研究选择通过血清TG含量、PLIN2表达水平和脂滴沉积情况评估各组小鼠肝脏、肾脏中脂质沉积水平,为选择更合适的动物模型提供依据。
糖尿病肾病(diabetic nephropathy, DN)是T2DM一个重要且日益增长的并发症,可导致血浆脂质水平的恶化,是终末期肾病(end-stage renal disease, ESRD)的主要原因[20-22]。在小鼠实验中,持续的HFD饲养早期小鼠脂肪组织充分膨胀以储存多余的热量,当超过脂肪组织的储存能力,多余的脂质可沉积到非脂肪组织(如肾脏)中[23]。而超过肾脏能量需求的FFA将酯化为TG,以LDs的形式沉积[24]。有研究表明,经动静脉FFA浓度差实验,提示FFA增多时,肾脏可将多余脂质转入血液以保护肾脏,具体机制尚不清楚,理论上有可能是近端小管从初级尿液中摄取重要的亲脂性化合物(如维生素)并通过脂蛋白将其运输回到循环中[24]。单纯的HFD喂养可能是在小鼠中模拟早期T2DM的最佳饮食,能导致小鼠肥胖、轻微的高脂血症及严重的胰岛素抵抗和肾脏脂质积聚,其局限性在于造模时间较长且病理效果不稳定[6]。在本研究中HFD组肾脏中尚未见明显脂质沉积和组织形态变化,可能与饲养周期尚短有关。若想模拟具有DM病理变化特征仍需注射STZ诱导[19]。STZ可直接破坏胰岛β细胞功能,不能正常释放胰岛素,导致小鼠出现极高的血糖水平,导致肾脏对葡萄糖的摄取增加,同时产生过量的氧化剂,并削弱抗氧化机制等,引起肾小管萎缩、坏死和肾毒性,导致上皮-间质转分化和细胞外基质沉积等,最后致肾实质破坏和肾功能丧失[25-26]。在血糖升高、胰岛功能破坏的双重作用下,脂质沉积加重,肾脏不能进行代偿,导致TG含量进一步增高。而血脂异常本身不足以导致肾损伤,但可通过引起肾脂肪毒性直接影响肾脏,也可通过引起全身炎症和氧化应激、血管损伤以及激素和其他具有肾脏作用的信号分子的变化间接损伤肾脏组织及其功能[24]。故而HFD/STZ和UNx+HFD/STZ组存在大量脂质异位沉积、肾小管的萎缩及炎性细胞浸润等病理改变,HDF/STZ联合诱导的T2DM动物模型模拟了人类典型的自然疾病发展和代谢特征,可以有效的模拟T2DM的特征,被认为是T2DM合适的动物模型[5]。有研究表明,单独UNx只诱导了少量的肾小球病变和轻微的肾功能下降,而STZ+UNx则具有协同作用[10]。近期有研究表明,TG水平与DN病程呈正相关[27]。且UNx+HFD/STZ小鼠胰岛细胞遭到严重破坏,比其他组更早出现糖尿病表现[28]。在本研究中UNx+HFD/STZ诱导的糖尿病小鼠,不仅存在极高的血糖水平,小鼠体重减轻,糖尿病症状明显,小鼠状态较差,血清及肝肾组织中TG含量均处于较高水平,肾小球病变和肾功能减退更为迅速,病程更为严重,提示UNx+HFD/STZ模型鼠更适合于研究由T2DM引起的DN。而疾病晚期,小鼠精神状态差,食欲不振,能量摄入不足,加速了蛋白质的分解代谢,发生低蛋白血症型营养不良,出现持续负氮平衡、肠道微生物障碍、尿毒症毒素累积等可能是小鼠体重减轻的原因[29]。/小鼠为瘦素受体(leptin receptor,)缺陷型肥胖基因型小鼠,被认为是较好的T2DM模型小鼠,食物摄入量增加和能量消耗减少,可出现高血糖症、食欲过盛、脂肪肝、胰岛素抵抗等疾病表现[30-31]。因此本实验中40周龄的/小鼠肾脏出现大量脂质异位沉积以及肾小管的萎缩及炎症细胞浸润等病理改变。
肝脏是脂肪酸代谢的中心器官,处理大量FFA,但仅以TG形式少量储存。因此在本研究中可见WT和NCD组存在少量生理性脂质储存。由于进食后,食物中TG主要被胰脂肪酶水解后,经胆汁酸乳化形成乳糜微粒,转运到淋巴中,随后进入血液,导致餐后高血脂,故在收集血液前将小鼠禁食,自由饮水。转运到血浆中的FFA可被肝细胞摄取并在肝脏中重新进行生物合成,以极低密度脂蛋白(very low-density lipoprotein, VLDL)的形式从肝脏输出到血液中,根据能量需求经过脂肪动员和β氧化,为心脏、骨骼肌等提供能量,而胰岛素抵抗现象已被证明能刺激肝细胞中TG的合成[19, 32]。在本实验中,可能由于饲养周期尚短,HFD组小鼠状态良好,体重明显增加,尚未出现明显的高血糖症或糖尿病并发症,脂肪组织仍具备储存FFA的能力,机体能量需求仍处于正常水平,尚未完全激活TG的分解代谢途径,因此肝脏摄取并储存了大量脂质,而血清TG含量未见明显升高。但在持续营养过剩的情况下,代谢途径的活性改变会导致常见的慢性肝病——非酒精性脂肪性肝病(nonalcohol fatty liver disease, NAFLD)[32]。近期研究表明,胰腺组织中脂肪含量的增加与肥胖程度为正相关关系,并被认为会导致β细胞功能障碍,最终导致血糖水平恶化和治疗失败[33]。尽管如此,在小鼠DM模型的胰岛组织中,少见脂滴沉积[34]。而肝脏中脂质沉积与胰岛素抵抗所引起的高胰岛素血症(hyperinsulinemia)密切联系。T2DM的特征为相对胰岛素缺乏,胰岛素可抑制肝脏VLDL的产生和激活脂蛋白脂肪酶(lipoprotein lipase, LPL)以清除VLDL,而在胰岛素严重缺乏的情况下,肝脏不能对高水平的FFA做出反应[21]。LDs的巨自噬(macroautophagy)也被称为脂噬(lipophagy)。当LDs被运送到自噬体,FFA在溶酶体加工过程中被释放,发生脂噬的LDs随着脂质的分解代谢而收缩变小[35-37],可见自噬在减轻肥胖所致的脂肪组织慢性炎症方面具有重要作用[38]。本实验各组模型小鼠肝组织中脂滴粒径大小不一,可能与脂噬水平有关联。HFD/STZ组小鼠体重降低,机体处于负氮平衡状态,能量需求较大,肝脏及白色脂肪组织中储存的TG分解释放大量FFA,而机体存在组织器官的损伤,不能正常吸收利用FFA。因此该组小鼠脂质沉积不如HFD组明显,但血糖和血脂都处于较高水平,且存在一定程度的肝细胞损伤和炎症细胞浸润。而UNx+HFD/STZ组肝脏脂肪酸代谢平衡被严重破坏,脂质沉积对机体无特异性损害,脂毒性通过内质网应激、氧化应激和线粒体损伤,最终处于脂毒性状态的肝细胞发生凋亡,肝组织结构遭到严重破坏[2],导致血清、肝肾组织中TG含量均进一步积累,最终发生严重的高甘油三酯血症。/小鼠是较好的T2DM模型小鼠,因存在高血糖症和高胰岛素血症,肝脏TG含量显著增加,可能是由于基因的缺失,摄食过量而消耗过低,导致大量脂质储存。
综上所述,UNx+HFD+STZ组小鼠肝、肾组织中脂滴沉积较HFD/STZ和/组显著,且出现DM及其并发症的典型表现特征,肝肾脂质沉积及病理学改变最严重,但存在死亡率较高、小鼠状态差等缺点。单纯HFD饮食的小鼠肝脏中脂质沉积较多,是研究NAFLD合适的模型。HFD/STZ和/模型小鼠出现典型糖尿病表现,肝肾组织中存在大量脂质沉积以及DN的肾脏病理改变,类似于T2DM患者,适用于研究DM及其并发症。
[1] Demir S, Nawroth PP, Herzig S, et al. Emerging targets in type 2 diabetes and diabetic complications[J]. Adv Sci (Weinh), 2021, 8(18):e2100275.
[2] Mota M, Banini BA, Cazanave SC, et al. Molecular mechanisms of lipotoxicity and glucotoxicity in nonalcoholic fatty liver disease[J]. Metabolism, 2016, 65(8):1049-1061.
[3] Opazo-Rios L, Mas S, Marin-Royo G, et al. Lipotoxicity and diabetic nephropathy: novel mechanistic insights and therapeutic opportunities[J]. Int J Mol Sci, 2020, 21(7):2632.
[4] Nishi H, Higashihara T, Inagi R. Lipotoxicity in kidney, heart, and skeletal muscle dysfunction[J]. Nutrients, 2019, 11(7):1664.
[5] Kim DY, Kim SR, Jung UJ. Myricitrin ameliorates hyperglycemia, glucose intolerance, hepatic steatosis, and inflammation in high-fat diet/streptozotocin-induced diabetic mice[J]. Int J Mol Sci, 2020, 21(5):1870.
[6] Gai Z, Wang T, Visentin M, et al. Lipid accumulation and chronic kidney disease[J]. Nutrients, 2019, 11(4):722.
[7] Yang P, Xiao Y, Luo X, et al. Inflammatory stress promotes the development of obesity-related chronic kidney disease via CD36 in mice[J]. J Lipid Res, 2017, 58(7):1417-1427.
[8] Muthulakshmi S, Saravanan R. Efficacy of azelaic acid on hepatic key enzymes of carbohydrate metabolism in high fat diet induced type 2 diabetic mice[J]. Biochimie, 2013, 95(6):1239-1244.
[9] Malone JI, Hansen BC. Does obesity cause type 2 diabetes mellitus (T2DM)? Or is it the opposite?[J]. Pediatr Diabetes, 2019, 20(1):5-9.
[10] Uil M, Scantlebery AML, Butter LM, et al. Combining streptozotocin and unilateral nephrectomy is an effective method for inducing experimental diabetic nephropathy in the 'resistant' C57BL/6J mouse strain[J]. Scientific Reports, 2018, 8(1):5542.
[11] Barriere DA, Noll C, Roussy G, et al. Combination of high-fat/high-fructose diet and low-dose streptozotocin to model long-term type-2 diabetes complications[J]. Sci Rep, 2018, 8(1):424.
[12] Kane JP, Pullinger CR, Goldfine ID, et al. Dyslipidemia and diabetes mellitus: role of lipoprotein species and interrelated pathways of lipid metabolism in diabetes mellitus[J]. Curr Opin Pharmacol, 2021, 61:21-27.
[13] Wu L, Parhofer KG. Diabetic dyslipidemia[J]. Metabolism, 2014, 63(12):1469-1479.
[14] Walther TC, Chung J, Farese RV Jr. Lipid droplet biogenesis[J]. Annu Rev Cell Dev Biol, 2017, 33:491-510.
[15] Ryden M, Arner P. Subcutaneous adipocyte lipolysis contributes to circulating lipid levels[J]. Arterioscler Thromb Vasc Biol, 2017, 37(9):1782-1787.
[16] Sobczak AIS, Blindauer CA, Stewart AJ. Changes in plasma free fatty acids associated with type-2 diabetes[J]. Nutrients, 2019, 11(9):2022.
[17] Najt CP, Lwande JS, Mcintosh AL, et al. Structural and functional assessment of perilipin 2 lipid binding domain(s)[J]. Biochemistry, 2014, 53(45):7051-7066.
[18] Mcmanaman JL, Bales ES, Orlicky DJ, et al. Perilipin-2-null mice are protected against diet-induced obesity, adipose inflammation, and fatty liver disease[J]. J Lipid Res, 2013, 54(5):1346-1359.
[19] Verges B. Pathophysiology of diabetic dyslipidaemia: where are we?[J]. Diabetologia, 2015, 58(5):886-899.
[20] Glastras SJ, Chen H, Teh R, et al. Mouse models of diabetes, obesity and related kidney disease[J]. PLoS One, 2016, 11(8):e0162131.
[21] Hirano T. Pathophysiology of diabetic dyslipidemia[J]. J Atheroscler Thromb, 2018, 25(9):771-782.
[22] Samsu N. Diabetic nephropathy: challenges in pathogenesis, diagnosis, and treatment[J]. Biomed Res Int, 2021, 2021:1497449.
[23] Heydemann A. An overview of murine high fat diet as a model for type 2 diabetes mellitus[J]. J Diabetes Res, 2016, 2016:2902351.
[24] Bobulescu IA. Renal lipid metabolism and lipotoxicity[J]. Curr Opin Nephrol Hypertens, 2010, 19(4):393-402.
[25] Fischer AW, Cannon B, Nedergaard J. Leptin: is it thermogenic?[J]. Endocr Rev, 2020, 41(2):232-260.
[26] 吴艺璇, 彭维艳, 刘露, 等. 淫羊藿苷通过AMPK减轻脂肪酸诱导的肾小管上皮细胞线粒体损伤[J]. 中国病理生理杂志, 2022, 38(1):113-121.
Wu Yx, Peng WY, Liu L, et al. Icariin attenuates fatty acid-induced mitochondrial damage in renal tu⁃bular epithelial cells through AMPK signaling pathway[J]. Chin J Pathophysiol, 2022, 38(1):113-121.
[27] Chen D, Sun H, Lu C, et al. The association between hypertriglyceridemic-waist phenotype and chronic kidney disease: a cohort study and meta-analysis[J]. Sci Rep, 2022, 12(1):1935.
[28] Park KM, Hussein KH, Nam HS, et al. A novel mouse model of diabetes mellitus using unilateral nephrectomy[J]. Lab Anim, 2016, 50(2):88-93.
[29] Zha Y, Qian Q. Protein nutrition and malnutrition in ckd and esrd[J]. Nutrients, 2017, 9(3):208.
[30] Maekawa M, Maekawa T, Sasase T, et al. Pathophysiological analysis of uninephrectomizedmice as a model of severe diabetic kidney disease[J]. Physiol Res, 2022, 71(2):209-217.
[31] Berger C, Heyne HO, Heiland T, et al. A novel compound heterozygous leptin receptor mutation causes more severe obesity than inleprmice[J]. J Lipid Res, 2021, 62:100105.
[32] Alves-Bezerra M, Cohen DE. Triglyceride metabolism in the liver[J]. Compr Physiol, 2017, 8(1):1-8.
[33] Inaishi J, Saisho Y. Beta-cell mass in obesity and type 2 diabetes, and its relation to pancreas fat: A mini-review[J]. Nutrients, 2020, 12(12):3846.
[34] Tong X, Dai C, Walker JT, et al. Lipid droplet accumulation in human pancreatic islets is dependent on both donor age and health[J]. Diabetes, 2020, 69(3):342-354.
[35] Filali-Mouncef Y, Hunter C, Roccio F, et al. The menage a trois of autophagy, lipid droplets and liver disease[J]. Autophagy, 2022, 18(1):50-72.
[36] Singh R, Kaushik S, Wang Y, et al. Autophagy regulates lipid metabolism[J]. Nature, 2009, 458(7242):1131-1135.
[37] Walther TC, Farese RV Jr. Lipid droplets and cellular lipid metabolism[J]. Annu Rev Biochem, 2012, 81:687-714.
[38] 赵艳利, 毛雨, 康志强, 等. 瓜蒌皮提取物通过调控PI3K/AKT信号通路介导的自噬而减轻肥胖小鼠慢性炎症[J]. 中国病理生理志, 2022, 38(1):96-104.
Zhao YL, Mao Y, Kang ZQ, et al. Fructus Trichosanthis peel extract attenuates chronic inflammation inobese mice by regulating PI3K/AKT signaling pathway-mediated autophagy[J]. Chin J Pathophysiol, 2022, 38(1):96-104.
Comparative study on lipid deposition in liver and kidney tissues of diabetic mice induced by different modeling methods
LIU Lu, HU Laying, WANG Guifang, CHANG Xuebing, HUANG Yali, SONG Lingyu, ZHOU Yuxia△, GUO Bing△
(,,550025,)
To observe the lipid deposition in liver and kidney tissues of diabetic mice.Diabetes mellitus models were induced by high-fat diet (HFD), streptozocin (STZ) combined with HFD (HFD/STZ), unilateral nephrectomy (Unx)+HFD/STZ and/mice. Eight-week-old C57BL/6 mice were randomly divided into normal chow diet (NCD) group (=10), HFD group (=10), HFD/STZ group (=10), and Unx+HFD/STZ group (=12). The mice in NCD group were fed with NCD. The mice in HFD group, HFD/STZ group and Unx+HFD/STZ group were fed with HFD. The mice in HFD/STZ group and Unx+HFD/STZ group were injected with STZ (55 mg/kg) and then continuously fed with HFD until to the 40th week. Ten-week-old/and wild-type mice (=8) were fed with NCD until to the 40th week. Blood glucose level, body weight and serum triglyceride (TG) level of each group were detected. Tissue sections of the liver and kidney were made via dehydration and paraffin embedding. After hematoxylin-eosin staining, the histopathological changes of the liver and kidney tissues were observed by microscopy. The expression of perilipin 2 was detected by immunofluorescence staining and Western blot. Lipid deposition was observed by oil red O staining and Nile red staining.In HFD group, the body weight of the mice was significantly increased (<0.05), but the level of blood glucose and the content of serum TG were not significantly increased (>0.05). In HFD/STZ group, Unx+HFD/STZ group andgroup, both blood glucose level and serum TG content were significantly increased (<0.05), lipid deposition and tissue damage were observed in the liver and kidney tissues. The lipid deposition in the liver and kidney tissues was the most obvious in Unx+HFD/STZ group. In HFD group, lipid deposition was observed in the liver but not in the kidney.In the liver and kidney tissues, the lipid deposition is the most obvious in Unx+HFD/STZ group, but there are some shortcomings such as high mortality and poor state of mice. The HFD model is an ideal model to study nonalcohol fatty liver disease. The HFD/STZ andmodels are ideal models to study diabetes mellitus and its complications, which display lipotoxicity in the kidney, accompanied with the typical renal pathological changes of diabetic nephropathy, similar to the pathological change of type 2 diabetes mellitus patients.
diabetes mellitus; lipid deposition; lipotoxicity; streptozotocin; unilateral nephrectomy
R587.2; R363.2
A
10.3969/j.issn.1000-4718.2023.02.010
1000-4718(2023)02-0276-11
2022-09-19
2022-11-03
[基金项目]国家自然科学基金资助项目(No. 82000741; No. 32160207);贵州省科技厅计划项目(黔科合基础-ZK[2021]一般402号);中国博士后科学基金资助项目(No. 2020M683374);贵州省教育厅青年科技人才成长项目(黔科KY字[2021]170号);贵州医科大学优秀青年人才计划(No. 2021105)
周宇霞 Tel: 18750238963; E-mail: zhouyuxia_27@163.com; 郭兵 Tel: 13908518950; E-mail: guobingbs@126.com
(责任编辑:宋延君,罗森)
——细胞脂类代谢的细胞器

