杜仲WOX家族基因鉴定及在叶片发育中的表达
刘 俊,李 龙,陈玉龙,陈随清
(1.河南中医药大学 中医药科学院 河南省中医方证信号传导重点实验室,河南 郑州 450046;2.国际竹藤中心国家林业和草原局/北京市共建竹藤科学与技术重点实验室,北京 100102;3.国际竹藤中心 安徽太平试验中心,安徽 黄山 245716;4.西北农林科技大学 林学院,陕西 杨凌 712100;5.河南中医药大学 药学院,河南 郑州 450046)
Wuschel-related homeobox (WOX)是植物特有的新型转录因子,属于Homepbox (HOX)超家族,包含由60~65个氨基酸组成的螺旋-环-螺旋-转角-螺旋的保守结构域。WOX家族基因分为3个独立进化支,即现代进化支 (modern clade,WUS),中间进化支 (intermediate clade)和远古进化支 (ancient clade)[1−3],其中WUS是最早发现的WOX家族成员[4]。WOXs蛋白在植物胚胎形成[5]、干细胞维持[6]和花发育[7]等方面发挥重要作用。拟南芥Arabidopsis thaliana中WOX家族有15个成员,分别是AtWUS和AtWOX1~AtWOX14[4],其中,AtWOX10、AtWOX13和AtWOX14蛋白属于远古进化分支,AtWUS和AtWOX1~7等8个蛋白质属于WUS分支,AtWOX8、AtWOX9、AtWOX11和AtWOX12蛋白属于中间进化分支。AtWUS在胚珠、花药和茎尖分生组织中表达,是维持中央分生组织的关键基因,AtWOX11和AtWOX12参与新生根器官发生,在顶端分生组织发育阶段,AtWUS参与干细胞稳态维持[8]。超表达AtWUS促进棉花Gossypium hirsutum体细胞胚胎发育和器官发生[9]。水稻Oryza sativa中,OsWOX11激活冠根的萌发和生长,过表达OsWOX11可促进雌蕊增加[10];OsWOX3A参与水稻叶片、小穗、分蘖和侧根的发育[11];在茎顶端分生组织和腋分生组织中OsWOX4正调控干细胞[12]。超表达WOX11 (PeWOX11a和PeWOX11b)或WOX11/12a增加转基因植株不定根数量[13−14]。在小麦Triticum aestivum中超表达TaWUS影响外花轮状器官发育,TaWOX9促进转基因拟南芥根的发育[15]。
WOXs转录因子不仅调控植物生长发育,而且参与胁迫响应。在水稻中OsWOX12A和OsWOX12B等基因的表达受干旱、寒冷和盐胁迫差异调控,超表达OsWOX11通过促进根毛生长发育提高转基因植株干旱胁迫耐受性[16−17]。84K杨树Populus alba×P.glandulosa中,干旱胁迫诱导PagWOX11/12a基因强烈表达,促进根系伸长和生物量生长,上游调控因子PagERF35激活PagWOX11/12a表达[18],PagWOX11/12a通过调控PagCYP736A12 基因表达,调节活性氧 (reactive oxygen species,ROS )清除,提高杨树耐盐性[19]。
杜仲Ecommia ulmoides是杜仲科Eucommiaceae杜仲属Eucommia的落叶乔木,为中国二级保护植物,叶片、树皮和果皮中富含杜仲胶,是重要的胶用和药用经济树种,具有极高的开发利用价值[20]。杜仲叶片中含有绿原酸、黄酮类、木脂素类、环烯醚萜类、α-亚麻酸等药用成分,具有抗疲劳、抗衰老、抗肿瘤、增强免疫力等重要作用[21−22]。鉴于WOX基因在拟南芥、水稻、玉米Zea mays、杨树、油菜Brassica napus、铁皮石斛Dendrobium officinale等中的作用,推测WOX家族基因可能在杜仲叶芽的形成和激活过程中起关键作用。本研究以杜仲基因组数据为基础,对杜仲WOX家族基因进行了全基因组鉴定和生物信息学分析,基于转录组分析WOX在杜仲叶片不同发育时期以及杜仲胶形成中的表达模式,利用实时荧光定量PCR(RT-qPCR)检测杜仲WOX基因(EuWOXs)在‘紫叶’杜仲‘Ziye’叶片发育中的表达水平,以期为EuWOXs功能的深入研究奠定基础。
1 材料与方法
1.1 材料
自西北农林科技大学苗圃(陕西杨凌),取生长正常长势一致的2年生‘紫叶’杜仲幼苗的叶芽(茎尖)、生长叶(3 cm长叶片)、幼叶(完全展开的新叶),用液氮迅速处理,置于−80 ℃冰箱保存。
1.2 方法
1.2.1 杜仲WOX蛋白(EuWOXs)的鉴定及理化性质分析 拟南芥WOX蛋白序列下载于TAIR数据库(https://www.arabidopsis.org/index.jsp),根据Pfam号(PF00046)在杜仲基因组数据库中筛选出WOX家族基因候选序列,利用美国国立生物技术信息中心 (National Center for Biotechnology Information,NCBI)的保守结构域搜索服务(Conserved Domain Search Service,CD Search)检测蛋白质保守结构域,筛选出具有完整WOX结构域的蛋白质作为EuWOX家族成员,利用生物信息学方法[23]分析EuWOXs的理化性质。
1.2.2 杜仲WOX家族基因染色体定位及系统进化分析 通过杜仲基因组数据库搜索WOX基因在染色体上的位置及每条染色体长度,利用MapGene2Chromosome v2 (http://mg2c.iask.in/mg2c_v2.0/)软件绘制WOX家族基因染色体定位。利用DNAMAN进行蛋白序列比对,通过Clustal X 1.83对杜仲、拟南芥、毛果杨、水稻和玉米WOXs蛋白进行多序列比对,利用MEGA 6.0邻接法(neighbor-joining),重复次数设置为1 000次[24],构建系统发育树,根据拟南芥同源基因对EuWOXs蛋白命名。
1.2.3EuWOXs的结构、基序及启动子分析利用GSDS(http://gsds.gao-lab.org/index.php)软件分析EuWOXs的内含子和外显子分布。利用MEME (http://meme-suite.org/)软件分析EuWOXs基序,参数设置为:any number of Repetitions,maximum number of Motifs=20,minimum width≥6,and maximum width≤50。分离EuWOXs启动子 (ATG)上游 2 000 bp 序列,利用 Plant CARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/htmL/)分析EuWOXs启动子顺式作用元件。
1.2.4EuWOXs的表达模式分析 从 NCBI的 Short Read Arshive (SRA)数据库中下载‘秦仲 1 号’‘Qinzhong No.1’叶片不同发育时期(叶芽、初生叶、幼叶、老叶)(版本号:SRP218063)[25]及高产胶杜仲品种‘秦仲2号’‘Qinzhong No.2’、低产胶杜仲品种‘小叶’‘Xiaoye’(版本号:SRP158357)[26]的转录组数据,使用每1百万个映射上的碱基中映射到外显子的每1千个碱基上的碱基个数(fragments per kilobase million,FPKM)值表示EuWOXs相对表达丰度,取对数 (log2)进行统计分析,利用TBtools工具绘制基因表达图谱[27]。
使用Trizol(天根DP424)提取RNA,反转录成cDNA,通过Primer 3.0软件设计EuWOXs特异性引物 (引物序列见表 1),通过 Quant Studio 6(新加坡 Life Technologies公司),All-in-One SYBR Premix EX TaqTM kit(美国 Gene Copoeia公司)进行实时荧光定量 PCR(RT-qPCR)反应,10 μL 反应体系:2× mix 5.00 μL、正向引物/反向引物各 0.25 μL、cDNA 2.00 μL、ROX 0.20 μL、双蒸水 2.30 μL。反应程序:95 ℃预变性 5 min,95 ℃ 变性 10 s,60 ℃ 退火 10 s,72 ℃ 延伸 20 s,45 个循环。以UBCE2 为内参基因[26],通过 2−∆∆Ct法对3次生物学重复进行数据分析。

表1 引物序列Table 1 Primer sequences
1.2.5 EuWOXs蛋白互作关系分析 通过 STRING 软件 (https://string-db.org/)上传 EuWOXs蛋白质序列,利用拟南芥数据库,根据拟南芥WOXs蛋白已知互作关系,预测EuWOXs互作蛋白,通过Cytoscape 3.7.0软件对EuWOXs蛋白质互作信息进行评估和预测[28]。
2 结果与分析
2.1 杜仲WOX家族基因鉴定及其蛋白质理化性质
由表2可知:从杜仲基因组中共鉴定到8个EuWOXs,分布在8条染色体上(图1);均含有HD保守结构域,其中EuWOX1序列最长,编码352个氨基酸,EuWOX13-2序列最短,编码191个氨基酸。EuWOXs分子量为22.12~40.36 kDa,EuWOX11等电点最小,为5.62,EuWOX4-1等电点最大,为9.04;亚细胞定位预测结果显示:EuWOXs均定位在细胞核中,均为亲水性蛋白。

图1 EuWOXs 染色体位点Figure 1 Chromosome site of EuWOXs genes

表2 EuWOXs 蛋白质序列特征及亚细胞定位Table 2 Sequence characteristics and subcellular location of E.ulmoides WOX proteins
2.2 EuWOXs的保守结构域
利用DNAMAN软件对8个EuWOXs及12个拟南芥WOXs蛋白(AtWOXs)保守结构域进行序列分析。结果(图2)显示:WOXs蛋白质HD结构域氨基酸及其分布具有显著的相似性,均包含由60个氨基酸组成的螺旋-环-螺旋-转角-螺旋,螺旋较环和转角保守。谷氨酰胺(Q)、亮氨酸(L)和脯氨酸(Pro)是螺旋Ⅰ (Helix Ⅰ)结构域的保守氨基酸,脯氨酸、异亮氨酸(Ile)和亮氨酸是螺旋Ⅱ (Helix Ⅱ)结构域的保守氨基酸,相比之下,螺旋Ⅲ (Helix Ⅲ)结构域最为保守,其中保守氨基酸有天冬酰胺(N)、缬氨酸(V)、色氨酸(W)、苯丙氨酸(F)、谷氨酰胺、天冬酰胺和精氨酸(R)。EAR-like仅存在于EuWOX1、EuWOX2、EuWOX4-1、EuWOX4-2和EuWOX5中,属于WUS,暗示EuWOXs在进化过程中具有保守性。
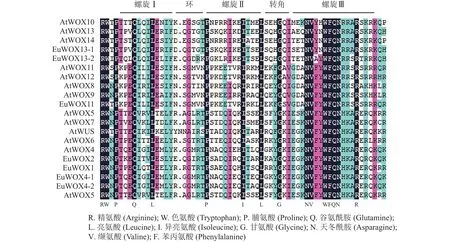
图2 拟南芥和杜仲 WOXs的蛋白质同源结构域序列分析Figure 2 Sequence analysis of WOX proteins homeo domain in A.thaliana and E.ulmoides
2.3 不同物种WOX家族蛋白的系统发育树
对8个杜仲EuWOXs、15个拟南芥AtWOXs、18个毛果杨Populus trichocarpaWOX蛋白(PotriWOXs)、13个水稻OsWOXs、20个玉米ZmWOXs的蛋白质序列进行多重比对,构建无根系统发育树。结果如 图3所示:74个WOXs蛋白共分为3组[远古进化支、中间进化支和现代进化支(WUS)],其中远古进化支含有12个WOXs蛋白,中间进化支含22个WOXs蛋白,现代进化支包含的蛋白数量最多,共有40个。8个EuWOXs中,EuWOX13-1和EuWOX13-2属于远古进化支,EuWOX11属于中间进化支,EuWOX1、EuWOX2、EuWOX5、EuWOX4-1和 EuWOX4-2等 5个蛋白质属于WUS。进化结果显示:杜仲与毛果杨亲缘关系最近。

图3 杜仲、拟南芥、毛果杨、水稻和玉米WOXs蛋白系统发育树Figure 3 WOX proteins phylogenetic trees of E.ulmoides, A.thaliana, P.trichocar, O.sativa and Z.mays
2.4 EuWOXs基因结构及蛋白质的保守结构域
利用GSDS软件构建EuWOXs基因内含子-外显子结构图,结果如图4显示:EuWOXs含有1~3个内含子,EuWOX13-2、EuWOX2和EuWOX5基因含有2个外显子,EuWOX11、EuWOX13-1、EuWOX4-1和EuWOX4-2含有3个外显子,EuWOX1含有4个外显子。不同进化分支基因结构差异显著,同一分支基因结构也存在差异。属于中间进化支的EuWOX11含有3个外显子,同属远古进化支的EuWOX13-1和EuWOX13-2分别含有3个和2个外显子,在WUS中,EuWOX2和EuWOX5含有2个外显子,EuWOX4-1和EuWOX4-2含有3个外显子,而EuWOX1含有4个外显子。
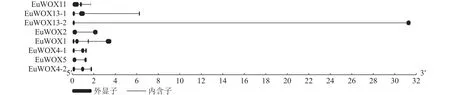
图4 杜仲 WOX 家族基因的结构分析Figure 4 Structural analysis of WOX gene family in E.ulmoides
蛋白质保守基序分析显示:EuWOXs含有10个保守基序,分别命名为Motif 1~Motif 10 (图5),其中Motif 1和Motif 2最为保守,是WOX的核心基序,存在于所有EuWOXs中。Motif 6较为保守,存在于4个EuWOXs蛋白质(EuWOX4-2、EuWOX2、EuWOX1和EuWOX5)中。相同分支EuWOXs含有相似的保守基序,不同分支EuWOXs基序之间存在显著差异,Motif 4~Motif 10只存在于现代进化分支,Motif 3只在EuWOX13-1和EuWOX13-2蛋白质中存在。

图5 杜仲 WOX 基因家族保守基序分析Figure 5 Conserved motifs analysis of E.ulmoides WOX gene family
2.5 杜仲 EuWOXs启动子顺式作用元件分析
顺式作用元件分析结果(图6)显示:EuWOXs启动子中主要包括脱落酸(ABRE)和水杨酸反应元件(TCA-element)、厌氧响应元件(ARE)、光响应元件(Box 4)及玉米蛋白代谢调节元件(O2-site)。所有顺式作用元件中光响应元件最多,达77个,其中Box 4元件有26个,所占比例是34%;G-box和GT1-motif元件均有9个,占比为12%,表明EuWOXs基因表达可能与光合作用有关。EuWOXs共含有46个激素响应元件,32个胁迫响应元件,其中ABRE和ARE元件数量最多,均含有14个,所占比例分别为31%和44%,暗示EuWOXs参与杜仲激素及胁迫响应。此外EuWOXs共含有12个生长发育调控相关元件,其中O2-site有6个,占50%。
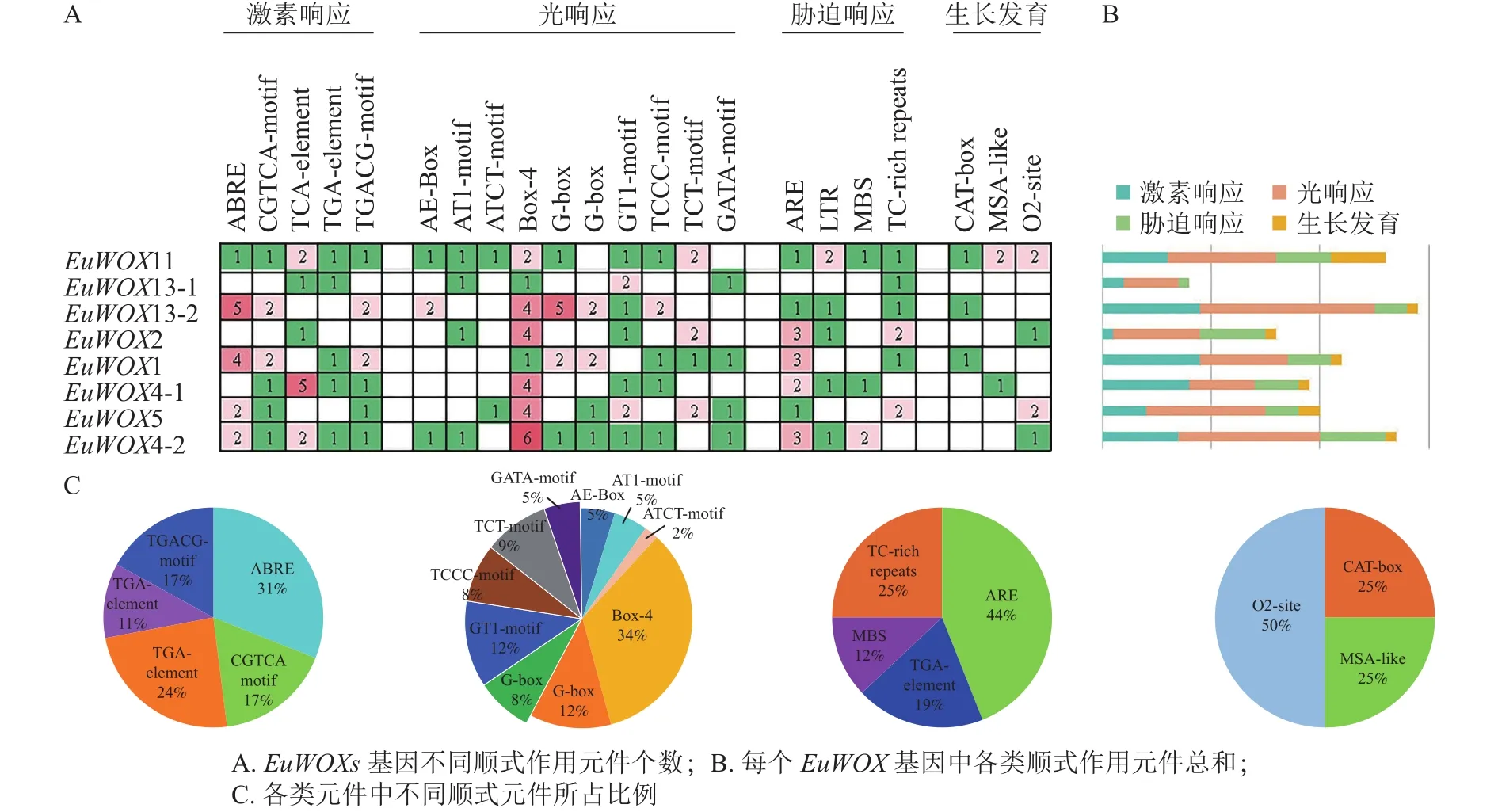
图6 EuWOXs 基因启动子顺式作用元件分析Figure 6 Cis-element analysis of EuWOX genes promoter
2.6 EuWOXs基因表达模式分析
利用‘秦仲1号’叶片不同发育时期转录组数据对EuWOXs基因的表达模式进行分析。结果(图7)可见:EuWOXs在叶片不同发育时期表达丰度存在显著差异,EuWOX11和EuWOX2在杜仲叶芽、初生叶、幼叶、老叶时期均不表达,EuWOX5仅在叶芽和老叶中低表达,EuWOX13-2在4个时期中的FPKM值均大于20,推测EuWOX13-2参与杜仲叶片的整个发育过程;EuWOX13-1和EuWOX4-1在叶芽中表达丰度最高,随着叶片发育表达水平逐渐降低,表明EuWOX13-1和EuWOX4-1主要在叶芽中发挥作用;EuWOX1在生长叶中表达量相对较高,其余EuWOXs基因表达丰度较低,FPKM值小于5。
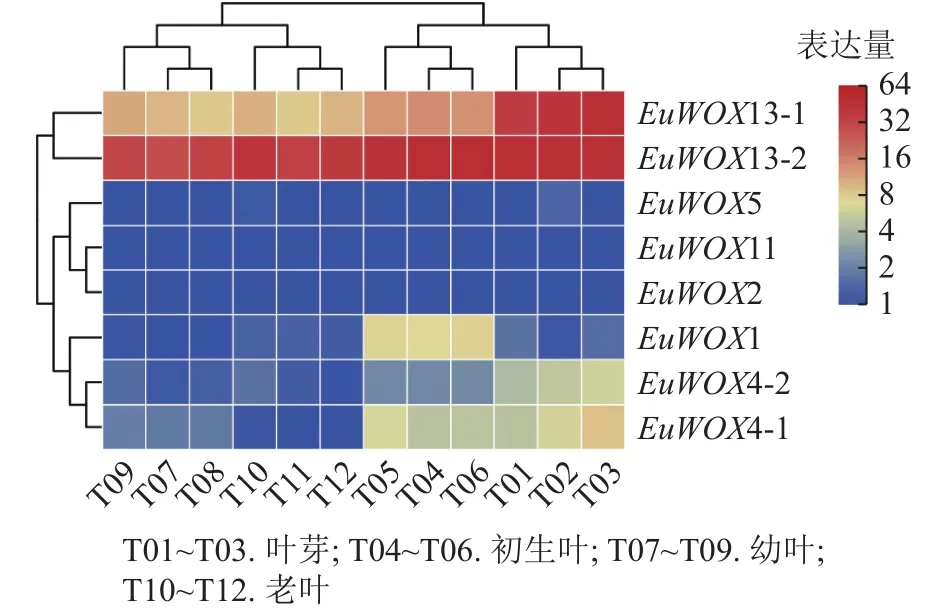
图7 EuWOXs 在杜仲叶片不同发育阶段的表达模式Figure 7 Expression patterns of EuWOXs at different developmental stages in E.ulmoides leaves
利用RT-qPCR检测EuWOXs在‘紫叶’杜仲叶片不同发育阶段(叶芽、生长叶、幼叶)的表达水平。结果(图8)可见:EuWOX1、EuWOX2、EuWOX4-1、EuWOX5和EuWOX13-2在生长叶中表达量最高,随着叶片发育表达水平呈先升高后降低趋势,EuWOX4-2在幼叶中表达量最高,EuWOX13-1在叶芽中表达量最高,随着叶片发育,表达量逐渐降低,暗示EuWOX13-1在叶片发育的起始阶段发挥重要作用。EuWOX1、EuWOX13-1和EuWOX13-2在‘紫叶’杜仲叶片中的表达趋势与‘秦仲1号’一致。

图8 杜仲EuWOXs基因在杜仲叶片不同发育时期的表达模式Figure 8 Expression pattern of EuWOX genes in E.ulmoides leaves at different developmental stages
利用‘秦仲2号’和‘小叶’杜仲成熟叶片转录组数据检测EuWOXs的表达模式。由如图9可见:大部分EuWOXs转录水平较低,其中有6个EuWOXs基因几乎不表达,EuWOX13-2表达水平最高,FPKM值>40,不同胶含量样品之间无显著差异,推测EuWOXs在杜仲胶形成过程中发挥作用较小。
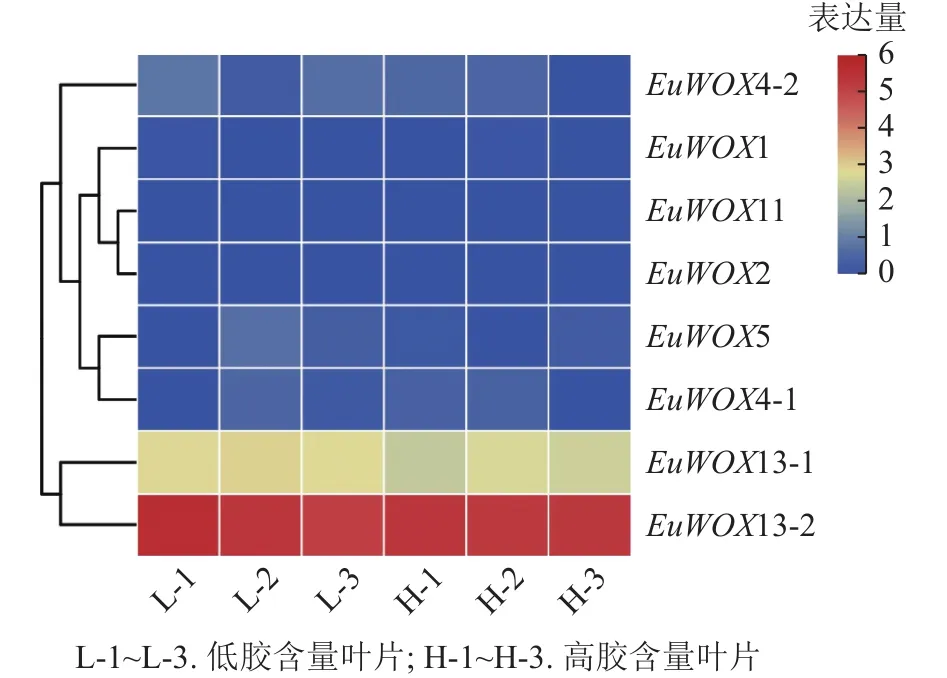
图9 EuWOXs 在杜仲胶形成中的表达模式Figure 9 Expression patterns of EuWOX genes in the form of Eu-rubber
2.7 EuWOXs蛋白互作网络预测分析
植物WOXs蛋白由多基因家族编码,蛋白质之间可能存在相互作用。利用STRING数据库,构建EuWOXs蛋白相互作用网络。图10显示:该网络包含21个节点(互作蛋白)和82条边(相互作用组合)。EuWOX4-1可与20个蛋白质互作,其中包含干细胞分化抑制因子(CLE41和CLE44),细胞增殖和愈伤组织形成蛋白(CLV1、CLV3和ACT7),胚胎发育相关蛋白(TPL、BBM和APM1),维管组织发育蛋白(PXY、HB-8、ATHB-15、MOL和RUL1),细胞程序化死亡调控因子(LOL1),参与DNA的复制和延伸(MCM1、POLD2)以及信号转导蛋白(F14K14),花药发育关键调控因子(RPK2),参与DNA的复制植物发育相关转录因子GRAS(HAM3和SCL27)等,推测EuWOXs全面参与了杜仲的生长发育。
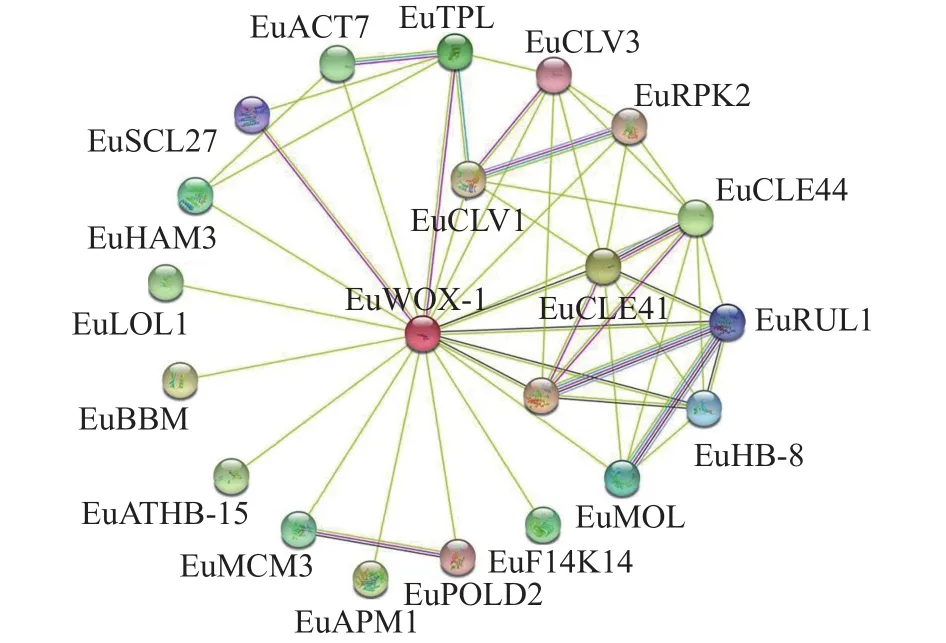
图10 EuWOXs 蛋白互作网络预测Figure 10 Prediction of interaction network between EuWOX proteins
3 讨论
WOX蛋白是植物特有的高度保守的一类转录因子,广泛参与植物的生长发育、干细胞维持、组织器官发生和形成等多种生物学过程。到目前为止,WOX家族基因已在多个物种进行了研究报道,如拟南芥中含有15个、毛果杨18个、水稻中有13个、玉米中有20个、毛竹Phyllostachys edulis中存在27个[29],小麦中有 26个[30]、茶树Camellia sinensis中包含 18个[31],黄瓜Cucumissativus中有 11个[3],陆地棉Gossypium hirsutum中含有 38 个[32]。小麦 (17 Gb)[33]、玉米 (2 300 Mb)[34]和毛竹 (2 021 Mb)[35]基因组大于杜仲 (1.2 Gb)[36],拟南芥 (164 Mb)[37]、水稻 (441 Mb)[38]和毛果杨 (392.3 Mb)[39]基因组小于杜仲。杜仲WOX数量低于拟南芥、毛果杨、水稻、玉米、小麦和毛竹,表明WOXs基因的丰富程度与基因组大小无关,这可能与基因重复有关。
杜仲基因组中共鉴定出8个EuWOXs,分布在8条染色体上。EuWOXs均为核定位蛋白,在现代进化支(WUS)、中间进化支和远古进化支分别含有5、1和2个成员,其系统发育模式与拟南芥、水稻、陆地棉等类似[29,31−32]。EuWOXs基因启动子中含有多种生长发育、激素响应、非生物胁迫以及光周期响应元件。在水稻中,WUS的OsWOX5和中间进化支的OsWOX11、OsWOX12A和OsWOX12B基因表达受生长素、细胞分裂素和赤霉素调节,超表达OsWOX11可提高水稻抗旱性[16−17]。细胞分裂素强烈促进苹果Malus pumilaWOX1和WOX3基因表达,生长素诱导黄瓜CsWOX1b和CsWOX3基因表达[3]。在拟南芥中,生长素反应因子 5 (AUXIN RESPONSE FACTOR,ARF5)上调AtWOX1 和PRS(AtWOX3)基因的表达,ARF2、ARF3和ARF4抑制AtWOX1和PRS的表达[40]。OsWOX3A参与水稻器官发育、叶片横向轴伸长、颖花外稃形态发生以及分蘖和侧根发育[10],MtWOX1的同源基因STENOFOLIA是蒺藜苜蓿Medicago truncatula叶片生长和维管组织形成的必须基因[41],PttWOX4在杨树形成层中特异表达,PttWOX4a/b RNAi干扰后导致维管形成层宽度缩小,次生生长减弱[42]。推测EuWOXs可能在杜仲生长发育、激素和胁迫响应等生物学过程中发挥重要作用。
WOX家族基因参与叶片发育。属于中间支的AtWOX9/STIMPY过表达导致拟南芥叶缘波浪化[43],SlLAM1主要在番茄Solanum lycopersicum叶片、花和果实中表达,SlLAM1缺失导致叶片变窄,次生小叶数量减少[44],超表达黄瓜CsWOX9导致转基因拟南芥角果变短,莲座叶和分枝数目增加[3]。来源于WUS的AtWOX3是拟南芥侧托叶发育的必需基因,Atwox1和Atwox3缺失突变体导致叶片和花器官变窄,影响叶片横向扩张和花瓣融合[45−46];GhWOX9_At,GhWUSa_At和GhWUSb_Dt主要在棉花幼叶中高量表达[47]。远古进化分支中的OsWOX13在水稻叶、茎、根维管组织中表现为空间表达调控,在花和发育中的种子中是时间表达调控[48]。在杜仲中,EuWOX13-1在叶芽中表达量最高,随着叶片发育,转录水平逐渐降低,暗示EuWOX13-1主要在杜仲叶片发育的早期阶段发挥作用。EuWOX13-2在生长叶中表达量较高,在叶片发育过程中呈现先升高后降低的趋势。EuWOX13-1和EuWOX13-2是一对重复基因,其表达水平的差异可能与基因结构不同有关,也可能是EuWOX13-1和EuWOX13-2在重复后发生了功能分化。在甘蓝型油菜Brassica napus中,BnCWOX13a与BnCWOX13c互为同源基因,然而它们的表达趋势完全不同[49],在拟南芥中,AtWOX13在初生根、侧根、雌蕊和胚发育中动态表达,而AtWOX13的直系同源基因AtWOX14只在侧根形成的早期阶段和发育的花药中特异表达[50],由此推测EuWOX13-2可能只获得了EuWOX13-1基因的部分功能,具体功能还需要进一步研究。

