多模态超声鉴别非肿块型乳腺原位癌与浸润癌的临床价值
谢 芸 何佳丽 骆韵青
近年乳腺癌呈年轻化趋势,发病率也日益升高,目前已成为我国女性的首位恶性肿瘤[1]。乳腺癌的早期诊断和治疗对改善患者的预后和提高患者生存质量十分关键。超声是目前乳腺疾病和早期乳腺癌首选的影像学检查方法,研究[2-3]发现非肿块型乳腺病变在不同超声切面上呈现片状低回声区,且不具备空间占位效应,无明显的边界和形态,与周边正常乳腺组织无法明确区分。常规超声、超声造影、超声弹性成像均可从不同角度对非肿块型乳腺癌提供鉴别诊断依据。本研究应用Logistic回归分析非肿块型乳腺癌超声造影、超声弹性成像、常规超声特征,并建立方程式模型,旨在为临床鉴别非肿块型乳腺原位癌与浸润癌提供参考。
资料与方法
一、临床资料
选取2020年5月至2022年5月在我院行手术切除的单侧非肿块型乳腺癌患者52例,均为女性,年龄22~77岁,平均(46.52±12.47)岁;其中16例处于绝经期,7例伴有压痛,6例出现溢液,17例可触及肿块。共59个病灶,其中原位癌31个,浸润癌28个。纳入标准:①超声图像清晰可靠且均为非肿块型;②均在术前2周内行超声检查;③临床资料、病理资料及超声资料齐全。排除标准:①超声表现为肿块型乳腺癌;②既往有乳腺癌病史,接受过内分泌治疗、化疗和放疗等治疗。本研究经我院医学伦理委员会批准(2019-HM-034),所有患者及其家属均知情同意。
二、仪器与方法
1.仪器与试剂:使用Philips EPIQ 7彩色多普勒超声诊断仪,线阵探头,频率5~14 MHz;造影剂采用SonoVue(意大利Bracco公司),使用前加入5.0 ml 0.9%氯化钠溶液,用力振摇形成六氟化硫微泡混悬液备用。
2.常规超声检查:嘱患者取仰卧位,平静呼吸,同时自然上举双手,将双侧腋窝及乳房充分暴露,以乳头为中心,从外上象限开始顺时针行放射状扫查,且邻近的扫查范围需重叠。如扫查过程中发现病灶,则对其进行多方位扫查,观察病灶的大小、方位、边缘、形态、后方回声、有无钙化,以及双侧腋窝淋巴结的大小、边缘、形态、淋巴门结构、皮质厚度、血流分级等[4]。血流分级参考Adler半定量法[5]。
3.超声造影检查:常规超声选择有丰富血流的最大片状低回声切面,包含片状低回声及部分周边乳腺正常组织,将4.8 ml配制好的造影剂混悬液快速团注入肘静脉后,随后以5.0 ml 0.9%生理盐水进行快速冲管。观察造影剂增强水平、增强方向、分布方式、片状低回声区内有无灌注缺损区、放射状增强或穿入血管,以及片状低回声区在造影前后范围变化、形态、边界情况等[6]。
4.超声弹性成像检查:将感兴趣区调整为适宜大小,采用静态加压法,检测片状低回声区及周围正常组织硬度。弹性成像评分标准[7-8]:1分,病灶区域整个变形明显,病灶大部分或整体呈绿色;2分,病灶区域大部分扭曲变形,病灶表现为蓝绿相间的马赛克状;3分,病灶区域的边缘扭曲变形,病灶中心为蓝色,周围部分为绿色;4分,整个病灶区域无变形,表现为蓝色;5分,病灶区域及周围无明显变形,整个病灶及其周围组织均为蓝色。我院彩色多普勒超声诊断仪经调试,绿色表示取样框内组织的平均硬度,红色表示较平均硬度更硬,蓝色表示较平均硬度更软。
三、统计学处理
结 果
一、单因素分析
非肿块型乳腺原位癌与浸润癌最大径分别为(16.76±5.96)mm、(18.36±7.51)mm;二者病灶最大径、方位、形态、后方回声、边缘、淋巴结形态、微钙化、血流分级,造影后片状低回声区有无放射性增强或穿入血管、范围变化、形态、边界、增强水平,以及弹性成像评分比较差异均有统计学意义(均P<0.05)。见表1和图1,2。

表1 单因素分析 个

图1 乳腺原位癌患者(47岁)声像图

图2 乳腺浸润癌患者(56岁)声像图
二、Logistic回归分析
将单因素分析中差异有统计学意义的超声特征纳入Logistic回归分析,结果显示病灶边缘不光整、非平行位、微钙化、血流分级(Ⅱ/Ⅲ级)、造影后片状低回声区范围扩大及放射性增强或穿入血管、弹性成像评分4~5分是鉴别非肿块型乳腺原位癌与浸润癌的影响因素。见表2。建立多模态超声诊断模型:Logit(P)=-18.544+边缘不光整×2.691+非平行位×1.321+微钙化×2.185+血流分级(Ⅱ/Ⅲ级)×1.152+造影后放射性增强或穿入血管×1.868+造影后片状低回声区范围扩大×2.118+弹性成像评分(4~5分)×1.698。
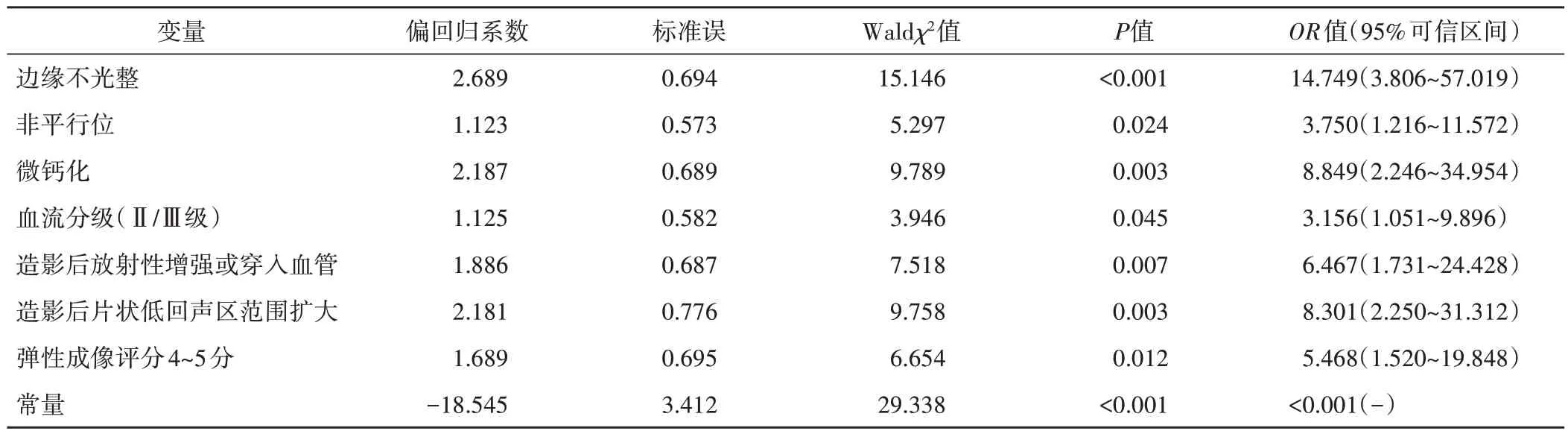
表2 Logistic回归分析
三、多模态超声诊断模型鉴别非肿块型乳腺原位癌与浸润癌的诊断效能
多模态超声诊断模型鉴别非肿块型乳腺原位癌与浸润癌的灵敏度、特异度、准确率、曲线下面积分别为84.5%、73.5%、86.4%、0.836。见图3。

图3 多模态超声诊断模型鉴别非肿块型原位癌与浸润癌的ROC曲线图
讨 论
乳腺原位癌是指乳腺小叶或乳腺导管内上皮细胞异常增生但未突破基底膜的病变。浸润癌则指上皮细胞异常增生且突破基底膜。乳腺癌肿瘤进展及分期与5年生存率关系密切,就诊时间延误超过3个月,则5年生存率降低12%。早期乳腺癌患者进行改良根治术及保乳治疗的生存质量无明显差异,说明乳腺癌患者预后的改善及生存质量的提高与早诊断、早发现、早治疗有直接关系。但临床对非肿块型乳腺癌的诊断和识别仍存有较大差异[9],其中非肿块型乳腺原位癌与浸润癌的鉴别诊断更是困难,非肿块型乳腺原位癌因其病理特征,超声表现常无特征性,与部分良性病变相似,又缺乏典型的浸润性特征。Logistic回归分析可深入分析各个因素之间的交互作用,有效控制各种混杂因素的影响,基于此,本研究对非肿块型乳腺原位癌与浸润癌进行Logistic回归分析,筛选有诊断意义且关系最为密切的影响因素,并建立多模态超声诊断模型,以期为临床准确鉴别提供依据。
本研究对常规超声、超声造影及超声弹性成像各特征进行单因素分析,结果显示两组病灶最大径、方位、形态、后方回声、边缘、淋巴结形态、微钙化、血流分级,造影后放射性增强或穿入血管及片状低回声区范围变化、形态、边界、增强水平,以及弹性成像评分比较差异均有统计学意义(均P<0.05)。分析其机制为[10-12]:非肿块型原位癌的乳腺终末小叶或导管单位内的上皮细胞异形性增生,沿着小叶或导管方向扩展、蔓延,穿行于正常乳腺组织中,未突破基底层,且无远处转移。因其多水平延伸,局限于小叶或导管内,未发生纵向浸润,故纵横比较小,肿块常混杂正常组织,内部回声不均匀,后方回声未见明显衰减;彩色多普勒未探及血流信号或星点状血流信号,以0~Ⅰ级多见。与原位癌不同,浸润癌呈浸润性生长,侵犯周围组织,边界不清晰,边缘呈毛刺状,肿块内部间质胶原纤维成分增多,后方回声可见衰减,且其浸润生长脱离正常组织水平面,故纵横比增大;另外,而浸润癌新生血管数目增多、新生血管壁薄,易形成动静脉瘘,彩色多普勒显示血流信号交织成网或丰富,血流分级多为Ⅱ~Ⅲ级。与胡浩[13]研究结论一致。本研究中浸润癌弹性成像评分多为4~5分,而原位癌多为1~3分,与其病理基础相符合,浸润癌伴有不同程度的间质反应,主要表现为结缔组织增生,活性结缔组织(如淋巴细胞、组织细胞和成纤维细胞等)活跃,随着癌组织的浸润生长,与恶性基质化平行进行,微环境纤维化,细胞外基质重构,硬度增加[14]。本研究非肿块型乳腺原位癌与浸润癌均表现为高灌注模式,但前者更多,分析原因为浸润癌肿瘤细胞生长迅速,内部易出现坏死、液化或钙化,加之肿瘤本身存在大量纤维化,导致病灶内部血供相对较差,因此其病灶灌注较原位癌稍差[15]。另外,浸润性乳腺癌肿瘤组织的血管生成较早,外周血管较中心区域密集,二维超声无法将肿瘤边缘癌细胞浸润范围明确显示,因此超声多表现为形态不规则、边界不清晰、放射性增强及范围扩大等。
由于多模态超声征象多样,相同的乳腺肿块存在相互矛盾的诊断结果,因此需联合应用多模态技术进行相互补充,以提供更多诊断信息。本研究对非肿块型乳腺癌患者的多模态超声特征进行Logistic回归分析并建立多模态超声诊断模型,结果显示该模型鉴别非肿块型乳腺原位癌与浸润癌的灵敏度、特异度、准确率、曲线下面积分别为84.5%、73.5%、86.4%、0.836,表明多模态超声诊断效能好。
综上所述,多模态超声在鉴别诊断非肿块型乳腺原位癌与浸润癌中有一定临床价值。但本研究为保证每一分类中有足够的样本量和估算可靠的参数,合并了一部分自变量征象,导致本身具有较高诊断价值的征象差异不显著。后期将扩大样本量进行深入探讨。

