中国南亚热带和北温带地区禾本科C3与C4草本植物花果期差异研究
张浩萍, 宋柱秋, 叶楠, 陈新兰, 练琚愉,3,4, 刘慧,3,4*
中国南亚热带和北温带地区禾本科C3与C4草本植物花果期差异研究
张浩萍1,2,3,4,5, 宋柱秋1,2,6, 叶楠1,2,3,7, 陈新兰1,2, 练琚愉1,2,3,4, 刘慧1,2,3,4*
(1. 中国科学院华南植物园,广州 510650;2. 华南国家植物园,广州 510650;3. 中国科学院退化生态系统植被恢复与管理重点实验室,广东省应用植物学重点实验室,广州 510650;4. 南方海洋科学与工程广东省实验室(广州),广州 511458;5. 中国科学院大学,北京 100049;6. 中国科学院植物资源保护与可持续利用重点实验室,广州 510650;7. 赣南师范大学生命科学学院,江西 赣州 341000)
为揭示不同地区禾本科C3与C4植物花果期受气候因子的影响,以广东省和内蒙古自治区分别代表南亚热带和北温带地区,从植物志中分别获得两地395和265种禾本科草本植物的3个花果期特征(始花期、末花果期和生殖期长),比较开花物候的差异,并通过一般线性模型探究其与气候因子(年均温与年均降水量)的相关性。结果表明,南亚热带与北温带地区C3植物的始花期均比C4植物早。两地C4共有种在南亚热带地区具有更早的始花期、更晚的末花果期和更长的生殖期,而C3共有种的末花果期在两地无显著差异,但在南亚热带地区始花期更早,生殖期更长。随年均温升高,北温带地区禾本科植物的始花期提前,而南亚热带地区则延后;随年均降水量升高,两地禾本科植物始花期与末花果期均延迟;禾本科植物生殖期长与年均温和年均降水量均不存在相关性。跨地区分析表明,末花果期、生殖期长与年均温和年均降水量均正相关,而与始花期不相关。禾本科C3植物比C4植物对地区间气候差异响应更敏感是两地共有种始花期差异显著的原因,而共有种生殖期长的显著差异则是由C4植物末花果期结束较晚驱动的,其末花果期对地区间气候差异更敏感。这阐明了禾本科植物生殖物候差异的原因,以及禾本科植物花果期对不同气候区温度、降水的适应策略。
禾本科;光合类型;气候因子;生殖物候
花果期属于植物的生殖物候,其中开花时间和生殖期长短是植物个体繁殖和种群延续的关键指标[1]。物种间开花物候在时间上错开可以减少物种间的直接竞争,对维持群落物种多样性具有重要意义[1]。对大量物种的研究表明,开花起始时间受温度和日照时长共同影响[4],并且不同的光质[5]、温度[4]、CO2浓度[5]及干旱程度[8]等都会影响开花物候,因此开花物候对气候变化非常敏感[9]。而最近在物种间的比较研究表明,开花起始时间不仅与微生境的气候条件紧密相关[2],还受到不同物种间功能型(如生活史、光合类型和传粉类型)等差异的影响[8]。因此,同时在种内和种间尺度探究植物功能型、气候因子如何影响开花物候,可以更好地理解和预测开花物候的生态响应。
禾本科(Poaceae)是维管植物中的第5大科,超过12 000种,为人类提供了必需的食物和畜牧饲料, 如水稻()、小麦()和玉米()等。在全球变暖的背景下,禾本科开花物候的潜在变化可能会带来巨大的生态和经济后果[8]。C3和C4光合类型是禾本科植物功能型的一个主要划分[11–12],两者表现出不同的结构和生理功能以及生态适应策略[13–15]。基于禾本科C4比C3植物拥有更高的光合速率和水分利用效率,具备生长和资源竞争上的优势,故能分布在更干旱、温暖的生境中[16–19],我们提出如下假设:在两者共存的地区,禾本科C3植物会比C4植物开花更早,以占据更早的时间生态位,利用生殖上的优势来补偿它们在竞争上的劣势;同时C4植物的花期可能比C3植物更短,因为C4植物多分布在更温暖的生境中, 而温暖的气候会延迟开花起始时间并缩短花期[19]。野外长期物候监测中,由于禾本科开花和结果阶段在形态上难以区分,对其生殖物候期的研究相对较少[21],前人研究多为记录几种主要禾本科牧草的展叶期和枯黄期,但实际上禾本科花果期对气候变化同样非常敏感,并且直接影响物种的生殖成功率, 亟需加强相关研究。
前人在区域和群落尺度下对不同环境因子影响植物物候的研究表明,随纬度、经度和海拔等因素带来的气候因子(光照、温度、水分等)改变,植物物候均有显著变异,且在物种内和物种间的响应趋势一致,但响应程度不同[22–24]。在种内水平,基于10 a的气象和物候观测,高山嵩草()种群在高海拔地区的返青期和黄枯期比低海拔地区提前更多,更容易受气候变化的影响[21]。从内蒙古东部到西部,优势禾本科植物贝加尔针茅()和羊草()等27 a的气象和物候观测表明,平均每10 a增温0.8℃,开花期提前1~8 d;但是开花期和降水量的关系比较复杂,在降水较多的草甸草原,开花期与年均降水量呈正相关(降水多,开花推迟),生长季延长最明显;而在降水较少的荒漠草原和草甸草原,开花期与年均降水量呈负相关,因为该地区的春季降水而非温度才是限制两种植物开花的主要因子;几种植物的开花期在3个地区间的种内差异并不显著,小于种间差异[25]。在亚洲,绶草()的开花物候温度敏感性随纬度降低(即年均温越高)而增强,说明在不同的纬度地带,植物对温度的响应程度存在差异[26]。在种间水平,内蒙古典型草原27 a的气象和物候观测发现该地区年均温升高明显、暖干化趋势明显,导致优势牧草的开花期提前,黄枯期延后,不同物种有不同程度的生长季延长[27]。在评估光合途径、生活史和气候生态位对中国亚热带地区的190个禾本科植物生殖物候的影响时,发现C3植物的开花时间更早,且生殖期更长[27]。但上述禾本科物候的研究基本都基于一个地区,缺乏跨地区对比及对物种内和物种间差异的同时研究。
为进一步了解禾本科不同光合类型植物的开花物候适应策略,深入理解开花物候对气候因子的生态响应,本研究基于中国南亚热带395种和北温带265种禾本科草本植物的花果期特征(始花期、末花果期和生殖期长)、功能类型(C3和C4光合类型)及其相关的气候因子(年均温和年均降水量),拟验证以下假设:(1) 禾本科C3植物比C4植物始花期更早;(2) 为了适应南亚热带更高的温度与降水量,两个地区的禾本科共有种在南亚热带地区比北温带地区始花期更早,花果期持续时间更长;(3) 无论是地区内,还是地区间,随着温度、降水量的增加, 禾本科草本植物的开花时间提前,花果期持续时间延长。
1 材料和方法
1.1 研究地和物种概况
对照中国被子植物分布数据库[29]与禾本科草本物种名单,禾本科物种数从北向南逐渐增加。其中位于北温带地区的内蒙古自治区,禾本科植物是群落中的优势物种,而地处南亚热带的广东省,其禾本科植物的物种多样性高于北温带(广东禾本科草类有395种,内蒙古有265种,为保持生长型统一,广东还去除了竹亚科153种,仅保留草本物种),且其C4物种的比例很高(广东禾本科C4植物占禾本科草类植物的53%,而内蒙古仅占21%)(表1)。物种及其物候数据来自《广东植物志》和《内蒙古植物志》,物种的光合类型分类来自禾本科光合类型数据库[32]。
两地共有616种禾本科草本植物,占中国禾本科草本植物总数的68.52%。广东省属于南亚热带湿润地区,而内蒙古自治区属于北温带半干旱区[31], 分别代表了我国南亚热带与北温带地区的典型气候, 气候差异明显,是了解禾本科植物花果期南北差异和研究物候对气候响应方式的理想区域。内蒙古自治区地处北温带,属温带大陆性季风气候,寒冷干旱。年均温–3.7 ℃~8.6 ℃,年均降水量120~460 mm,干湿季明显,全年降雨量的80%集中于4—9月。广东省地处南亚热带,属亚热带季风气候,高温多雨,年均温19 ℃~24 ℃,夏季日均温高于22 ℃长达6个月以上,年均降水量1 600~1 800 mm,干湿季明显,全年降雨量的80%集中于4—9月。

表1 广东省和内蒙古自治区禾本科草本物种的光合类型
1.2 花果期特征数据和气候数据
物候数据 选择3个花果期特征:始花期,开花开始的月份(initial flowering time, FT1);末花果期,花果期结束的月份(final flowering time, FT2), 由于禾本科开花和结果的过程很难在野外区分,因此将开花和结果时期统一表达为生殖期(reproduc- tive period, RP),即末花果期减去始花期。从《广东植物志》和《内蒙古植物志》筛选出两地禾本科草本物种,记录始花期与末花果期,计算生殖期长度,另外还记录其光合类型。若某物种的末花果期延续到第2年,月份数值加12并计算生殖期长(如花果期从10月延续到次年3月,3个花果期特征分别记录为10、15和5)。此方法不仅保证了开花和结果持续时间的正确计算,也避免了物候研究中的年份循环问题[32]。
气候数据 首先根据《广东植物志》和《内蒙古植物志》,获得物种在两地的详细分布信息[如柳叶箬()分布于广东乳源、连州、和平、深圳、惠东、博罗、广州、台山、高要、封开、阳春]; 其次通过中国气象数据网(http://data.cma.cn/ site/index.html)获取两地的地面气象观测站年均温和年均降水量(1981—2010年)数据。根据物种的分布信息,计算物种分布县市的气候数据,得到年均温和年均降水量的平均值,作为该物种在区域水平的气候参数。
1.3 数据的统计分析
数据整理、模型分析和作图用R语言V 3.5.1[33]完成。通过Welch Two Sample-test和Paired--test,对比C3和C4植物在跨地区和地区内的花果期特征和气候参数的差异,分析共有种(两地共有种虽然记载有44种,但完整记录3个花果期特征的仅24种)的生殖物候性状在两地的差异,以准确表征花果期特征在物种内对不同地区气候变化的响应趋势。以一般线性模型跨地区和地区内分别检验花果期特征和气候参数的相关性。
2 结果和分析
2.1 花果期特征和气候参数
禾本科C3和C4植物的始花期都在6月中下旬,无显著差异,末花果期差异显著,C4植物的末花果期比C3晚1.4个月,因而生殖期也比C3植物显著长了1.2个月(表2)。在北温带地区,3个花果期特征在光合类型间均差异显著,C3植物的始花期比C4植物更早,但由于其末花果期结束较早,C4的花果期比C3植物长。而在南亚热带地区,C3和C4植物的3个花果期特征没有显著差异(表2)。
每种植物对应的当地气候参数在C3和C4植物物种间差异显著,其中C4植物的花果期年均温(MAT)比C3植物高近10 ℃,年均降水量(MAP)也是C3植物的2倍。北温带C3、C4植物对应的气候因子仅MAT的差异显著,MAP差异不显著,而南亚热带的C3、C4植物对应的MAT和MAP差异均不显著(表2)。
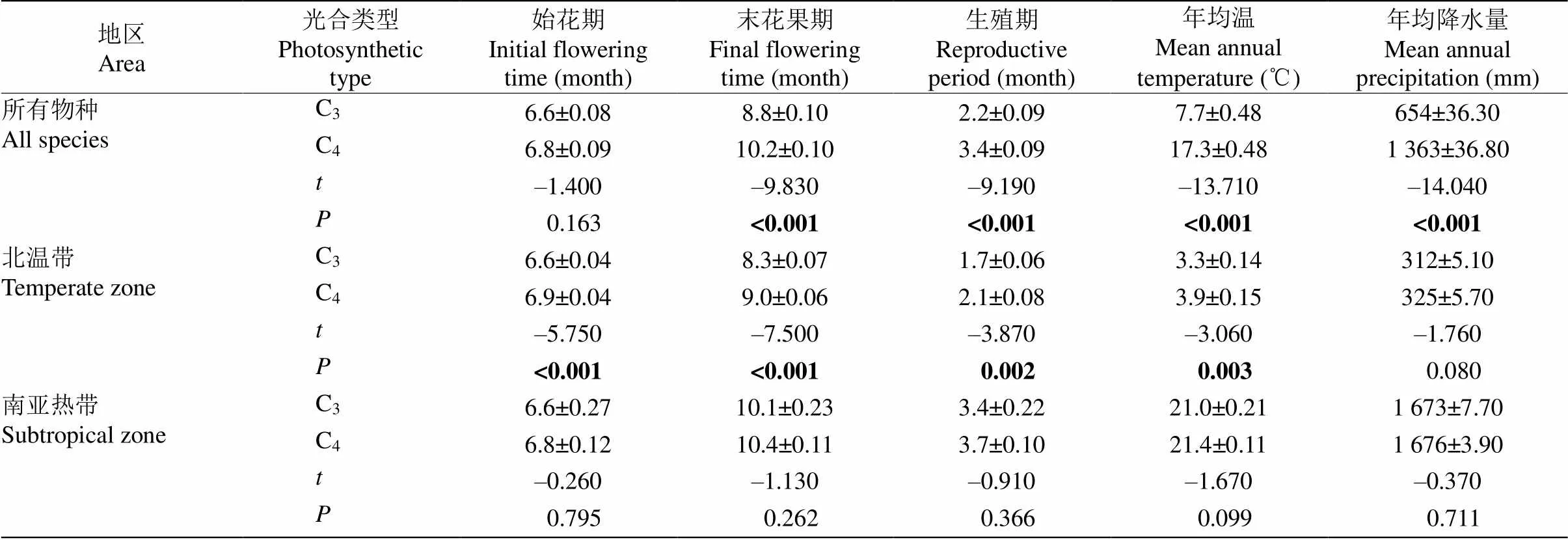
表2 两地不同光合类型禾本科草本物种的花果期特征和气候参数
2.2 两地共有种的花果期特征及气候参数
北温带与南亚热带禾本科24种共有种的花果期特征存在显著差异,南亚热带共用种的始花期比北温带的早1个月,而末花果期比北温带晚1个月,因此北温带的生殖期为2.1个月,南亚热带为4.0个月,比北温带长约2个月(表3)。6种C3共有种在南亚热带的始花期比北温带早2个月,末花果期无显著差异,因此在南亚热带的生殖期比北温带长2个月。18种C4共有种在南亚热带的始花期比北温带早0.7个月,末花果期在南亚热带比在北温带晚1.8个月,因此虽然南亚热带C4植物的生殖期同样比北温带长2个月,但和C3植物生殖期长的南北差异形成的原因不同。无论是所有共有种、还是C3或C4共有种,对应的气候参数都在南北两地差异显著,即南亚热带禾本科草本植物生活环境的MAT和MAP都显著高于北温带(表3)。
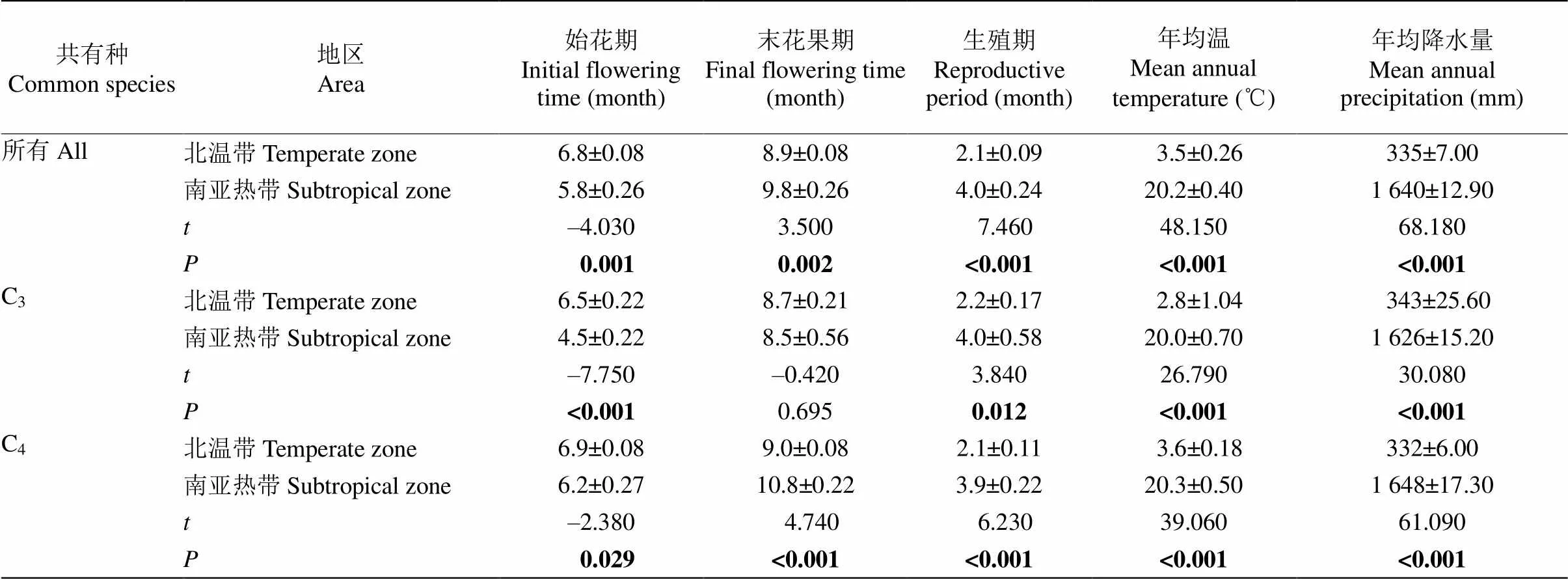
表3 两地禾本科草本共有物种的花果期特征和气候参数
2.3 花果期特征和气候因子的相关性
在北温带地区(图1中灰色点和蓝色线),温度升高,禾本科植物开花时间提前(图1: A);降水增加, 开花时间则延后(图1: B)。而在南亚热带地区内(图1中黑色点红色线),随着温度升高与降水增加,始花期均延后(图1: A, B)。在北温带与南亚热带地区, 随温度升高与降水增加,末花果期也延后(图1: C, D,除图1: C中灰色点),同时MAT、MAP与生殖期无相关性(图1: E, F无蓝色和红色线)。

图1 两地禾本科草本物种生殖物候和气候参数的相关性
跨地区(南亚热带与北温带)来看(图1中黑色线), 始花期与MAT、MAP都不相关,这与地区内部存在相关性的结果不同(图1: A, B无黑色线)。同时,末花果期(图1: C, D黑色线)和生殖期(图1: E, F黑色线)与MAT、MAP均有显著的正相关性,随着温度与降水增加,禾本科植物的花果期更长,即南亚热带禾本科植物的花果期比北温带更长。
3 结论和讨论
3.1 开花物候差异反映禾本科C3和C4植物的不同适应策略
无论是在北温带还是南亚热带地区,禾本科C3植物始花期均早于C4植物,但仅在北温带地区差异显著,这个结果支持了假设1,且与前人[8]研究结果一致,即C3植物相较于C4植物更早开花。这是由于C3禾本科植物竞争空间和资源的能力较C4植物弱[18],它们会采取开花开始时间提前的繁殖策略,在时间尺度上抢占空间与资源,完成生殖,从而避免生态位重叠,弥补其在生长和竞争上的劣势。虽然在全球范围内,早开花已被证明有利于自然选择,但这种自然选择的压力在温带地区比在热带地区更强[35],因此在北温带地区禾本科C3和C4植物始花期的差异更显著。而亚热带地区的植物很少经历寒冷的早春,C3和C4禾本科植物的差异不显著。另一方面,植物自身的演化位置也是导致C3比C4植物开花早的关键因素。本研究中36.45%的C3植物来自早熟禾亚科(Pooideae),这个亚科比其他亚科普遍开花早[34],且早熟禾亚科主要分布在温带地区[11],并对早春冷刺激比较敏感[36]。因此,本研究结果反映了不同光合类型禾本科草本类植物在不同环境下的适应策略。
与南亚热带相比,在北温带地区C3和C4植物在末花果期和生殖期上差异显著。尽管C3植物的开花时间比C4植物早,但总体来看两者的始花期差异并不显著。而导致C3和C4植物生殖期差异显著的原因是C4植物的末花果期比C3植物晚了1.4个月。这提示在气候变化下的物候研究中, 即使物种的始花期和末花期发生了显著的响应,物种的生殖期也可能没有发生变化,因此其带来的生物学和生态学的后果尚需更多的控制试验和长期监测研究。
3.2 北温带与南亚热带禾本科共有种的物候差异
在比较北温带与南亚热带地区禾本科植物物候差异时,基于共有种来探究种内花果期特征,可以减少不同地区之间种间差异导致的物候特征差异[26],从而可以更准确的评价物种对不同地区气候响应与适应的策略[37]。
南亚热带地区温度与降水显著高于北温带,禾本科共有种在南亚热带地区更早开花,生殖期更长,且无论是C3还是C4共有种都是如此,这支持了假设2,且与前人[37–42]报道的随温度升高,植物开花提前,花期延长的物候规律一致。将共有种按C3和C4类型分开考虑,可见造成所有共有种始花期差异显著的主要驱动因素是C3植物而不是C4植物, 因为C3共有种在南亚热带比北温带的始花期早了2个月,而C4共有种的差异仅有0.7个月。与之不同的是,造成南亚热带生殖期比北温带长2个月的驱动因素则是C4共有种末花期的推迟。这说明C3共有种的始花期对地区间气候差异更敏感,与前人[35]的研究结果一致;而C4共有种的末花果期地区间气候差异更敏感,说明C4植物本身的生理特性更适应于高温地区,在温度充足的情况下积累生长,并延长生殖期,从而在热带和亚热带地区占据优势[19]。
3.3 花果期特征与气候因子的关系
有研究表明,随着温度升高,植物提前开花[43–44],禾本科植物始花期在北温带地区遵循了这一规律, 但在南亚热带,禾本科植物始花期存在随温度升高延后的现象。这可能是因为南亚热带地区全年气温较高,没有霜冻等胁迫因素对禾本科春化和开花造成限制和分化压力[19],从而随温度升高,开花时间顺延。另一个原因是禾本科C4植物的物种比例在南亚热带随温度上升而增加(从18 ℃的55.56%上升到24 ℃的77.78%),而C4相对C3植物所需的开花温度更高,且开花时间更晚[27],从而导致了南亚热带整体的禾本科草本物种始花期随温度升高而后移。此外,随温度跨地区升高,末花期延后和生殖期延长的现象,原因前已详述,即前者是由C4植物驱动,后者是由C3植物驱动。
在南亚热带和北温带各自的地区内,随着降水量升高,始花期延迟,但与假设3不同的是跨地区间并无相关性。这与前人[25]在内蒙古降水较多的草甸草原连续物候观测的结论一致,也与在北美西部广泛分布的延龄草开花物候的研究结论[44]一致。原因可能是地区内降水增加促进植物的营养生长[45–46],从而降低并推迟了对生殖生长的营养分配。也有可能在温带地区内,春季降水的蒸发会降低土壤温度,从而推迟了开花日期[46]。还有对温带草原的研究结果相反,即降水量减少会使花期延迟,降水量增加花期提前[47],这可能是因为降水与温度之间存在交互作用,从而对禾本科植物生殖期产生影响[28]。因此,降水量的变化对植物生殖期产生的影响需要考虑到生态系统的环境以及与温度的相互作用等多种因素。
综上所述,本研究结果表明禾本科C3植物始花期比C4植物更早,C3共有种在南亚热带地区开花更早并且生殖期更长。禾本科草本植物的末花果期、生殖期与MAP、MAT存在正相关关系。禾本科C3比C4植物对地区间气候差异响应更敏感是两地共有种始花期差异显著的原因,而共有种生殖期长的显著差异则是由C4植物末花期结束较晚驱动的,其末花果期对地区间气候差异更敏感。作为植物个体生殖和种群延续的关键指标,通过分析南亚热带与北温带禾本科花果期的差异,阐明了禾本科植物花果期在不同光合类型和地区气候条件下的种内和种间差异,对预测未来气候变化下禾本科花果期的生态响应具有重要参考价值。
[1] Rathcke B, Lacey E P. Phenological patterns of terrestrial plants [J]. Annu Rev Ecol Evol Syst, 1985, 16: 179–214. doi: 10.1146/annu rev.es.16.110185.001143.
[2] Elzinga J A, Atlan A, Biere A, et alTime after time: Flowering phenology and biotic interactions [J]. Trends Ecol Evol, 2007, 22(8): 432–439. doi: 10.1016/j.tree.2007.05.006.
[3] CRAINE J M, WOLKOVICH E M, TOWNE E G, et al. Flowering phenology as a functional trait in a tallgrass prairie [J]. New Phytol, 2012, 193(3): 673–682. doi: 10.1111/j.1469-8137.2011.03953.x.
[4] Evans L T. The physiology of flower induction: Paradigms lost and paradigms regained [J]. Aust J Plant Physiol, 1993, 20(6): 655–660. doi: 10.1071/PP9930655.
[5] Cerdán p d, CHORY J. Regulation of flowering time by light quality [J]. Nature, 2003, 423(6942): 881–885. doi: 10.1038/nature01636.
[6] Fitter A H, FITTER R S R. Rapid changes in flowering time in British plants [J]. Science, 2002, 296(5573): 1689–1691. doi: 10.1126/ science.1071617.
[7] Springer C J, Ward J K. Flowering time and elevated atmospheric CO2[J]. New Phytol, 2007, 176(2): 243–255. doi: 10.1111/j.1469- 8137.2007.02196.x.
[8] Franks S J. Plasticity and evolution in drought avoidance and escape in the annual plant[J]. New Phytol, 2011, 190(1): 249– 257. doi: 10.1111/j.1469-8137.2010.03603.x.
[9] Anderson J T, Inouye D W, Mckinney A M, et al. Phenotypic plasticity and adaptive evolution contribute to advancing flowering phenology in response to climate change [J]. Proc Roy Soc B: Biol Sci, 2012, 279(1743): 3843–3852. doi: 10.1098/rspb.2012.1051.
[10] Munson S M, Long A L. Climate drives shifts in grass reproductive phenology across the western USA [J]. New Phytol, 2017, 213(4): 1945–1955. doi: 10.1111/nph.14327.
[11] Ehleringer J R, Cerling T E, Helliker B R. C4photo- synthesis, atmospheric CO2, and climate [J]. Oecologia, 1997, 112(3): 285–299. doi: 10.1007/s004420050311.
[12] SAGE R F, SAGE T L, KOCACINAR F. Photorespiration and the evolution of C4photosynthesis [J]. Annu Rev Plant Biol, 2012, 63: 19–47. doi: 10.1146/annurev-arplant-042811-105511.
[13] Edwards E J, Osborne C P, STRÖMBERG C A E, et al. The origins of C4grasslands: Integrating evolutionary and ecosystem science [J]. Science, 2010, 328(5978): 587–591. doi: 10.1126/science. 1177216.
[14] Taylor S H, Ripley B S, Martin T, et al. Physiological advan- tages of C4grasses in the field: A comparative experiment demon- strating the importance of drought [J]. Glob Change Biol, 2014, 20(6): 1992–2003. doi: 10.1111/gcb.12498.
[15] Lundgren M R, Dunning L T, Olofsson J K, et al. C4ana- tomy can evolvea single developmental change [J]. Ecol Lett2019, 22(2): 302–312. doi: 10.1111/ele.13191.
[16] Ehleringer J R. Implications of quantum yield differences on the distributions of C3and C4grasses [J]. Oecologia, 1978, 31(3): 255–267. doi: 10.1007/BF00346246.
[17] Murphy B P, Bowman D M J S. Seasonal water availability predicts the relative abundance of C3and C4grasses in Australia [J]. Glob Ecol Biogeogr, 2007, 16(2): 160–169. doi: 10.1111/j.1466-8238. 2006.00285.x.
[18] Way D A, Katul G G, MANZONI S, et al. Increasing water use efficiency along the C3to C4evolutionary pathway: A stomatal opti- mization perspective [J]. J Exp Bot, 2014, 65(13): 3683–3693. doi: 10. 1093/jxb/eru205.
[19] Atkinson R R L, Mockford E J, Bennett C, et al. C4photo- synthesis boosts growth by altering physiology, allocation and size [J]. Nat Plants, 2016, 2(5): 16038. doi: 10.1038/nplants.2016.38.
[20] Sherry R A, Zhou X G, Gu S L, et al. Changes in duration of reproductive phases and lagged phenological response to experimental climate warming [J]. Plant Ecol Divers2011, 4(1): 23–35. doi: 10. 1080/17550874.2011.557669.
[21] Primack R B, Gallinat A S. Insights into grass phenology from herbarium specimens [J]. New Phytol, 2017, 213(4): 1567–1568. doi: 10.1111/nph.14439.
[22] Song Z Q, Du Y J, Primack R B, et al. Surprising roles of climate in regulating flowering phenology in a subtropical ecosystem [J]. Eco- graphy, 2021, 44(9): 1379–1390. doi: 10.1111/ecog.05629.
[23] Song Z Q, Fu Y H, Du Y J, et al. Global warming increases latitudinal divergence in flowering dates of a perennial herb in humid regions across eastern Asia [J]. Agric For Meteorol, 2021, 296: 108– 209. doi: 10.1016/j.agrformet.2020.108209.
[24] Song Z Q, FU Y H, Du Y J, et al. Flowering phenology of a wide- spread perennial herb shows contrasting responses to global warming between humid and non-humid regions [J]. Funct Ecol, 2020, 34(9): 1870–1881. doi: 10.1111/1365-2435.13634.
[25] Wang L, Li F X, Zhou W F, et al. Impacts of climate change onphenophase at different altitude regions in Qinghai Plateau [J]. Pratacul Sci, 2012, 29(8): 1256–1261. [王力, 李凤霞, 周万福, 等. 气候变化对不同海拔高山嵩草物候期的影响 [J]. 草业科学, 2012, 29(8): 1256–1261.]
[26] Gu R Y, Zhou W C, Bai M L, et al. Impacts of climate change on phenological phase of herb in the main grassland in Inner Mongolia [J]. Acta Ecol Sin, 2012, 32(3): 767–776. [顾润源, 周伟灿, 白美兰, 等. 气候变化对内蒙古草原典型植物物候的影响 [J]. 生态学报, 2012, 32(3): 767–776. doi: 10.5846/stxb201106300979.]
[27] Li X Z, Guo C Y, Han G D. Impacts of climate change on phenol- logical phases of dominant grass species in the desert steppe in Inner Mongolia [J]. Ecol Environ Sci, 2013, 22(1): 50–57. [李夏子, 郭春燕, 韩国栋. 气候变化对内蒙古荒漠化草原优势植物物候的影响 [J]. 生态环境学报, 2013, 22(1): 50–57. doi: 10.16258/j.cnki.1674-5906. 2013.01.001.]
[28] Li K X, Wang J Y, Qiao L, et al. Diversity of reproductive phenol- logy among subtropical grasses is constrained by evolution and climatic niche [J]. Front Ecol Evol, 2020, 8: 181. doi: 10.3389/fevo. 2020.00181.
[29] Lu L M, Mao L F, Yang T, et al. Evolutionary history of the angiosperm flora of China [J]. Nature, 2018, 554(7691): 234–238. doi: 10.1038/nature25485.
[30] Osborne C P, Salomaa a, Kluyver t A, et al. A global database of C4photosynthesis in grasses [J]. New Phytol, 2014, 204(3): 441–446. doi: 10.1111/nph.12942.
[31] Zheng J Y, Yin Y H, Li B Y. A new scheme for climate regiona- lization in China [J]. Acta Geogr Sin, 2010, 65(1): 3–12. [郑景云, 尹云鹤, 李炳元. 中国气候区划新方案 [J]. 地理学报, 2010, 65(1): 3– 12. doi: 10.11821/xb201001002.]
[32] Staggemeier V G, CAMARGO M G G, DINIZ-FILHO J A F, et al.The circular nature of recurrent life cycle events: A test comparing tropical and temperate phenology [J]. J Ecol, 2020, 108(2): 393–404. doi: 10.1111/1365-2745.13266.
[33] R Core Team. R: A language and environment for statistical computing [R]. Vienna, Austria: R Foundation for Statistical Computing, 2018.
[34] MUNGUÍA-ROSAS M A, OLLERTON J, PARRA-TABLA V, et al. Meta-analysis of phenotypic selection on flowering phenology suggests that early flowering plants are favoured [J]. Ecol Lett, 2011, 14(5): 511–521. doi: 10.1111/j.1461-0248.2011.01601.x.
[35] Liu H, Taylor S H, Xu Q Y, et al. Life history is a key factor explaining functional trait diversity among subtropical grasses, and its influence differs between C3and C4species [J]. J Exp Bot, 2019, 70(5): 1567–1580. doi: 10.1093/jxb/ery462.
[36] SCHUBERT M, GRØNVOLD L, SANDVE S R, et al. Evolution of cold acclimation and its role in niche transition in the temperate grass subfamily Pooideae [J]. Plant Physiol, 2019, 180(1): 404–419. doi: 10.1104/pp.18.01448.
[37] Xu Q Y, Liu H, Ye Q. Intraspecific variability of ecophysiological traits of four Magnoliaceae species growing in two climatic regions in China [J]. Plant Ecol, 2017, 218(4): 407–415. doi: 10.1007/s11258- 017-0699-9.
[38] Auffret A G. Historical floras reflect broad shifts in flowering phenology in response to a warming climate [J]. Ecosphere, 2021, 12(7): e03683. doi: 10.1002/ecs2.3683.
[39] Williams T M, Schlichting C D, Holsinger K E. Herba- rium records demonstrate changes in flowering phenology associated with climate change over the past century within the Cape Floristic Region, South Africa [J]. Glob Change Biol, 2021, 1: 100006. doi: 10. 1016/j.ecochg.2021.100006.
[40] HASSAN T, HAMID M, WANI S A, et al. Substantial shifts in flowering phenology ofin the Himalaya: Supple- menting decadal field records with historical and experimental evidences [J]. Sci Total Environ, 2021, 795: 148811. doiI: 10.1016/j. scitotenv.2021.148811.
[41] Cong N, Shen M G. Variation of satellite-based spring vegetation phenology and the relationship with climate in the Northern Hemi- sphere over 1982 to 2009 [J]. Chin J Appl Ecol, 2016, 27(9): 2737– 2746. [丛楠, 沈妙根. 1982—2009年基于卫星数据的北半球中高纬地区植被春季物候动态及其与气候的关系 [J]. 应用生态学报, 2016, 27(9): 2737–2746. doi: 10.13287/j.1001-9332.201609.028.]
[42] Miller-Rushing A J, Primack R B. Global warming and flowering times in Thoreau’s Concord: A community perspective [J]. Ecology, 2008, 89(2): 332–341. doi: 10.1890/07-0068.1.
[43] Olesen J E, Børgesen C D, Elsgaard L, et al. Changes in time of sowing, flowering and maturity of cereals in Europe under climate change [J]. Food Addit Contam Part A, 2012, 29(10): 1527– 1542. doi: 10.1080/19440049.2012.712060.
[44] Matthews E R, Mazer S J. Historical changes in flowering phenology are governed by temperature × precipitation interactions in a widespread perennial herb in western North America [J]. New Phytol, 2016, 210(1): 157–167. doi: 10.1111/nph.13751.
[45] Liu L, Monaco t a, Sun F D, et al. Altered precipitation patterns and simulated nitrogen deposition effects on phenology of common plant species in a Tibetan Plateau alpine meadow [J]. Agric For Meteorol, 2017, 236: 36–47. doi: 10.1016/j.agrformet.2017.01.010.
[46] Niu S l, Wu M y, Han Y, et al. Water-mediated responses of ecosys- tem carbon fluxes to climatic change in a temperate steppe [J]. New Phytol, 2008, 177(1): 209–219. doi: 10.1111/j.1469-8137.2007.02237.x.
[47] Moore L M, Lauenroth W K. Differential effects of temperature and precipitation on early- vs. late-flowering species [J]. Ecosphere, 2017, 8(5): e01819. doi: 10.1002/ecs2.1819.
[48] Zhou Z x, Li Y, Song J, et al. Growth controls over flowering phenology response to climate change in three temperate steppes along a precipitation gradient [J]. Agric For Meteorol, 2019, 274: 51–60. doi: 10.1016/j.agrformet.2019.04.011.
Studies on the Difference of Flowering and Fruity Period Between C3and C4Herbaceous Plants of Poaceae in South Subtropical and North Temperate Climatic Zones of China
ZHANG Haoping1,2,3,4,5, SONG Zhuqiu1,2,6, YE Nan1,2,3,7, CHEN Xinlan1,2, LIAN Juyu1,2,3,4, LIU Hui1,2,3,4*
(1. South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China; 2. South China National Botanical Garden, Guangzhou 510650, China; 3. Key Laboratory of Vegetation Restoration and Management of Degraded Ecosystem, Chinese Academy of Sciences, Guangdong Provincial Key Laboratory of Applied Botany,Guangzhou 510650, China; 4. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China; 5. University of Chinese Academy of Sciences,Beijing 100049, China; 6. Key Laboratory of Plant Resources Conservation and Sustainable Utilization, Chinese Academy of Sciences,Guangzhou 510650, China; 7. School of Life Science, Gannan Normal University, Ganzhou 341000, Jiangxi, China)
Reproductive phenology is a key indicator of plant individual reproduction and population succession. to reveal the influence of climate factors on the flowering and fruity period of C3and C4plants of Poaceae in different regions, Guangdong Province and Inner Mongolia Autonomous Region represent the south subtropical and north temperate climatic zones of China, and three reproductive phenological traits of 395 and 265 herbaceous species of Poaceae were obtained based on floras, respectively. The differences in initial flowering time, final flowering time and flowering duration between the two regions were compared, and the correlations between phenological traits and climatic variables (mean annual temperature and mean annual precipitation) were studied. The results showed that the start flowering stage of C3grasses in two regions was earlier than that of C4grasses. The C4common species of two zones had earlier initial flowering time, later final flowering time and longer reproductive period in south subtropical zone, while there was no significant difference in final flowering of C3common species, but the initial flowering stage was earlier and the reproductive period was longer in the south subtropical region. With the increase of annual temperature, the initial flowering time in north temperate region was advanced, but it was delayed in south subtropical region. With the increase of annual precipitation, the initial flowering time and final flowering time were delayed, and the reproductive period had no relation with neither mean annual temperature nor mean annual precipitation. The cross-regional analysis showed that the final flowering time and reproductive period were positively correlated with the mean annual temperature and annual precipitation, but did not the initial flower time. The significant difference in initial flowering time of common species was caused by higher sensitivity of C3grasses to climatic difference between two zones than C4grasses. The significant difference in reproductive period of common species was driven by the late end of final flowering time of C4grasses, which was more sensitive to regional climate differences. Therefore, it was clarified patterns and reasons of different reproductive phenology of Poaceae herbaceousspecies, and their adaptation strategies to temperature and precipitation across climatic zones.
Poaceae; Photosynthetic type; Climatic variable; Reproductive phenology
10.11926/jtsb.4562
2021-11-09
2022-02-19
南方海洋科学与工程广东省实验室(广州)人才团队引进重大专项(GML2019ZD0408);中国科学院青年创新促进会项目(2019339)资助
This work was supported by the Key Special Project for Introduced Talents Team of Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou) (Grant No. GML2019ZD0408), and the Youth Innovation Promotion Association of Chinese Academy of Sciences (Grant No. 2019339).
张浩萍(1999年生),女,硕士研究生,从事植物生理生态学研究。E-mail: chunbaiping@163.com
E-mail: hui.liu@scbg.ac.cn

