纸上微型实验室在食品检测领域的研究进展
陈 洋,杨湛森,王 鑫,宋光春,黄荟娴,徐瑗聪,罗云波,黄昆仑,程 楠,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京工业大学环境与生命学部,北京 100024)
消费者对食品安全、健康、营养更高标准的要求为食品检测带来新的机遇和挑战。食源性致病微生物、农兽药残留、重金属、食品添加剂、非法添加物、毒素和外源性污染物等食品安全风险因子不仅极大地危害人类健康,而且对生态环境、社会稳定和经济发展造成了严重威胁[1]。加强对上述风险因子的快速检测显得尤为重要。然而,常用的实验室检测方法,如聚合酶链式反应[2]、荧光光谱分析技术[3]、分光光度法[4]、高效液相色谱[5]等虽然精密度很高,但存在时滞性、操作复杂性、要求专业性等众多制约,难以满足现场快速检测需求[6]。
纸作为传感器常用的基材之一,已广泛应用于快速检测领域,这得益于纸的众多优点:1)由多层纤维素组成,内部形成的多孔网状结构可为大颗粒物质和液体提供储存空间,并能避免气溶胶的产生;2)内含大量羟基,依靠毛细管力使液体流动,无需外源泵阀;3)含有多种官能团,能够提供较好的反应活性和生物兼容性;4)作为一种质量轻的柔性材料,可折叠、易切割,为简便化检测提供可能;5)纸一般呈白色,添加试剂后颜色均匀,具有良好的比色分析背景;6)价格低廉,加工处理简单,可大规模生产;7)使用后可降解、可回收,环境友好[7-8]。随着新型生物、化学制剂和高新材料的引入,“纸”已不仅仅局限于传统意义上的纤维素纸(滤纸、色谱纸、打印纸等),多种表面改性方法赋予纸新的性能,各种具有柔性和多孔结构的由纤维素和聚合物组成的离子交换膜或复合膜为纸基分析装置添加了分离、过滤、扩增等功能[8-9]。
“纸上微型实验室”是以纸为基底建立的微分析系统,利用固定在纸基表面的识别元件与靶标分子识别反应,将分析物的浓度转化为光学、电化学或其他信号进行定性、半定量或定量检测[10-11],其原理如图1所示。近年来,“纸上微型实验室”因兼具快速、便携、灵敏、经济等优势,已成为食品快速检测技术领域的研究热点。
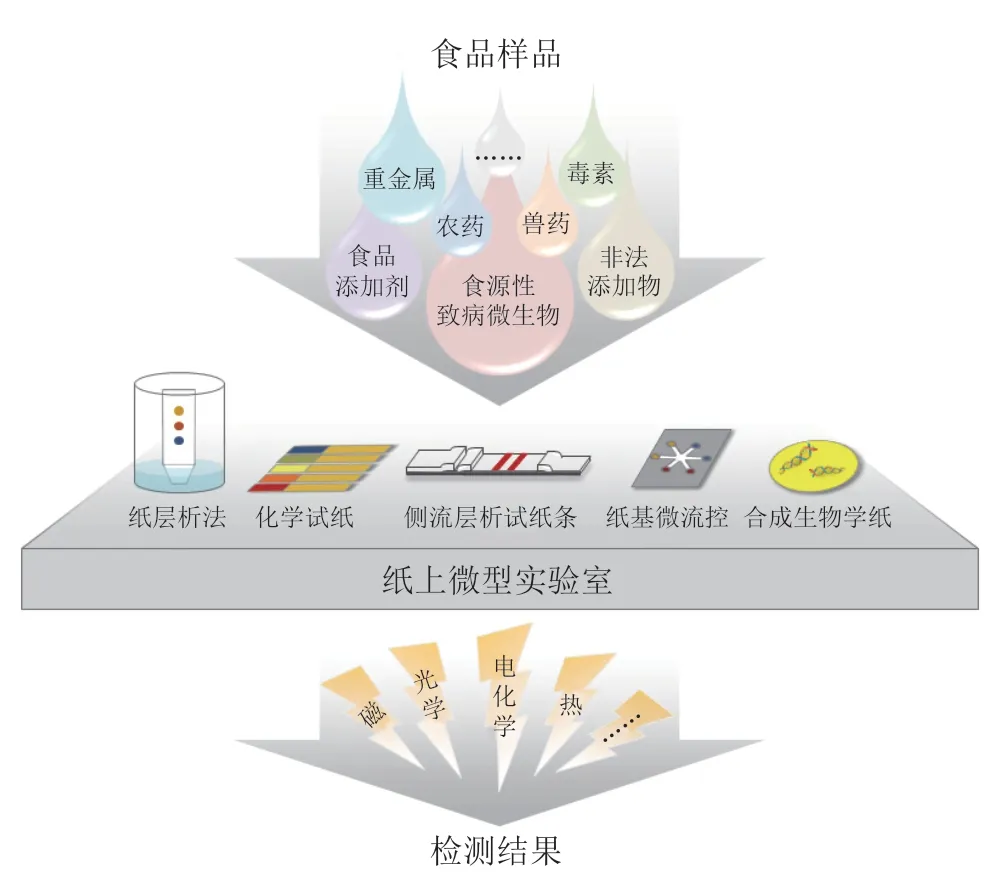
图1 “纸上微型实验室”的原理Fig.1 Principle of “lab on paper”
本文综述了纸层析法、化学试纸、侧流层析试纸条、纸基微流控分析装置(microfluidic paper-based analytical devices,μPADs)和合成生物学纸的原理、分类、优缺点及研究进展,并总结了以上5 种纸基分析方法在食品检测领域的应用情况,最后展望了“纸上微型实验室”面临的挑战和未来的发展趋势,以期拓宽纸基分析方法在食品检测领域的应用前景。
1 纸基分析技术
1.1 纸层析法
纸层析法又称纸色谱法,是基于相似相溶原理利用纸纤维(固定相)和溶剂(流动相)分离有色组分的分析方法,属于以纸为支撑物的薄层层析技术。分离时将混合样品点在色谱纸的下端,并放置在装有展开剂的密闭展开缸中,由于样品中各组分在同一介质中分配系数不同,因此会形成相互分离的斑块,从而实现各组分的高效分离和快速鉴定[12]。
纸层析法适用于氨基酸[13]、色素[14]、有机酸[15]等食品中小分子化合物的检测,能满足组分数较少样品初步分离、鉴定的需求。为了进一步实现微量、定量测定,纸上涂覆纳米材料和联用高精度检测仪器是提高灵敏度常用的策略,如Zhang Min[16]和张建云[17]等分别联用酶标仪法和分光光度法检测微生物发酵液中的γ-氨基丁酸和L-丝氨酸;Weatherston等[18]将表面增强拉曼散射(surface-enhanced Raman scattering,SERS)与纸层析法联用,通过在超细玻璃纤维滤纸上镀纳米银增强SERS信号,用来分离和鉴定食品中的番茄红素和β-胡萝卜素。
1.2 化学试纸法
化学试纸法通常将显色试剂固定在试纸条上,与靶标接触时发生化学反应产生颜色变化,再与标准比色卡进行比较,从而完成样品的目视定性或半定量分析[19]。
化学试纸是包容性很强的微型检测平台,如常用的pH试纸[20]、亚硝酸盐试纸[21]、过氧化物试纸[22-24]等,适合反应步骤少、颜色变化明显的物质检测。然而,简单的化学试纸只能粗略地指示待测物浓度,且指示剂容易老化、稳定性较差[25]。由此衍生出许多提升化学试纸法性能的方法,如熊慧娟等[26]将化学试纸法与树脂吸附富集法联用,使亚硝酸根离子检测精度大幅提高;也可以配合图像分析装置进行比色,Iacono等[20]针对啤酒生产过程中的昏暗环境设计了pH值测试仪,避免阴影和光照对比色结果的影响,扩大了酸碱度检测范围。
1.3 侧流层析试纸条
侧流层析即侧向流动分析(lateral flow assays,LFAs),LFAs试纸条一般由5 个部分组成,依次为样品垫、结合垫、硝酸纤维素(nitrocellulose,NC)膜、吸收垫和聚氯乙烯背板,相邻的垫彼此重叠一部分以保证液体连续流动,背板在最下面提供机械支撑[27]。待测样品被滴加在样品垫上,在毛细管力作用下输送至结合垫,与其上所储存识别靶标的有色纳米材料标记的抗体(如金标抗体)相互作用,形成肉眼可见的免疫复合物[28]。NC膜负责捕获分析物,抗体通过静电作用、氢键和/或疏水力沉积在NC膜上,构成一条或多条测试(test,T)线和一条控制(control,C)线。样品流过膜的过程中,免疫复合物和多余的标记试剂分别被T线和C线捕获,由于标记材料(如纳米金)的光学性质,T线和C线上形成并保留可视线,并以T线区域信号的强弱判定检测结果。最后,多余的液体由吸收垫截留,吸收垫具有强大的持液能力,并为整个流动分析过程提供芯吸力[29]。
LFAs分为夹心型和竞争型两种反应模式。夹心型反应模式如图2A所示,在T线上捕获复合物,形成有色纳米材料-分析物-识别元件的“三明治”结构,T线上分析物浓度与信号强度呈正相关。不含分析物的粒子通过T线,但被另一种捕获分子捕获,形成C线。夹心型多用于检测蛋白质和核酸等具有多个抗原表位的大分子物质[30]。竞争型反应模式如图2B所示,分析物在T线上与捕获分子竞争结合位点,导致免疫复合物在测试线上不聚集,即分析物浓度和T线上的信号强度呈负相关。样品中不存在分析物时,可以在T线和C线处捕获有色纳米材料-识别元件复合物。竞争型反应模式适用于检测类固醇类的小分子抗原、农药和兽药等具有单个抗原表位的小分子分析物[27,31]。

图2 LFAs夹心型(A)和竞争型(B)反应模式示意图[28]Fig.2 Schematic diagram of LFAs sandwich (A) and competitive (B)response formats[28]
如何提高LFAs灵敏度是研究人员长久以来面临的挑战,而识别元件和标记材料的创新和发掘为此难题带来新的机遇。抗体作为识别元件存在稳定性差、批次差异大、生产经济和时间成本高等不足[32]。为了突破上述局限性,许多抗体替代品应运而生,如功能核酸[33]、多糖[34]、噬菌体[35]、抗生素[36]等,它们具有较高的特异性和亲和力、高重现性、低成本的优点。LFAs通常使用20~80 nm的纳米颗粒进行偶联,其中金纳米粒子(Au nanoparticles,AuNPs)因其完美的球形结构和惰性成为LFAs法中应用最广泛的标记材料[31]。不同形状的AuNPs具有可控的形貌特征和优异的化学、电学性质,如金纳米棒[37]、金纳米花[38]、金纳米簇[39]以及有机物和贵金属包被的纳米金等[32],不仅具有胶体金的优点,而且相比球状AuNPs比表面积更大,能弥补其发光强度较弱的不足,从而提高检测灵敏度。此外,各种金属氧化物纳米颗粒[40]、氧化石墨烯[41]、碳纳米颗粒[42]、量子点[43]、荧光纳米颗粒[44]等新型敏感材料因具有独特的优势,在LFAs应用中表现出巨大的潜力。
1.4 纸基微流控分析装置
μPADs是利用微加工技术在纸上设计并组装各种结构,如通道、反应池、微泵、微阀等功能单元,引导液体沿指定通路流动并完成反应的技术[11]。自2007年Whitesides团队首次提出μPADs的概念[45],随后μPADs引起学界广泛关注并持续至今。μPADs的基本原理是将纸芯片直接切割或采用化学改性[46]、物理沉积[47]堵塞纤维素纸内的孔隙来改变纸的亲/疏水性,以纸为基底构建图案化亲水区域和疏水通道[48],如图3A所示。在毛细作用力的驱动下,液体按图案定向流动并反应,后经分析器件转化为其他信号进行比较分析。

图3 通过折叠纸掩模制作μPADs的接触印刷示意图(A)[48]和基于角度(B)[53]、直径(C)[54]、长度(D)[55]的无需仪器读出装置的μPADs[48]Fig.3 Schematic representation of contact printing for fabrication of μPADs by a folded paper mask (A) and μPADs without instrument readout device[48]based on angle (B)[53],diameter (C)[54],and length (D)[55] signals
根据不同的折叠方式,μPADs有二维和三维两种形式。二维μPADs对平面上简单的反应有较良好的性能,但当需要过滤或储存、有多种试剂加入或发生多步反应时,二维μPADs便无法充分满足检测需求。此时,三维μPADs成为实现多功能、高通量检测更好的选择。纸的柔性为三维μPADs的结构和功能提供了更多的可能性,如折纸、堆叠、3D打印[49]和制成可穿戴式[50]装置等形式。为了消除复杂分析中多步骤试剂操作的不必要程序,Yakoh等[51]开发了按顺序输送流体的μPADs,其由折纸和可移动试剂储存垫两个部件构成;Shen Yu等[52]通过堆叠和折纸建立了蜡屏障和“纸桥”,实现纸基传感器阵列均匀分割和个体功能化。
根据μPADs分析准确度的不同,可分为定性、半定量和定量检测。对于有沉淀、气体生成或明显颜色变化的反应,通过肉眼即可初步定性;对于反应生成变色不溶性物质的待测物,可配合小型读出装置,如图3B~D所示,分别依靠目视显色范围的角度[53]、半径[54]或长度[55],配合量角器和直尺实现半定量检测。为了进一步实现定量检测,μPADs常联用光学和电化学检测仪器对转化信号进行分析。光学检测法是根据反应的光学特征变化对待测样品进行分析,包括比色法[56]、荧光法[57]、化学发光[58]和电化学发光法[59]以及拉曼光谱分析[60]等。光学检测法较为直观且灵敏度较高,但对反应区污染情况、生成的显色化合物以及纸基的稳定性有严格要求。电化学检测法是建立在待测物的电化学性质基础上的分析方法。在电化学纸基传感器中,反应产生可测定的电流[61]、电位[62]、电导[63]、电阻和电抗[64],从而将直接或间接的氧化还原反应结果转化成电信号。与光学检测法相比,电化学传感器的优势在于响应速度快、抗干扰性强,但高背景电流一直是电化学检测面临的难题[65]。为了提升μPADs的灵敏度,常采用导电油墨或丝网制备电极、纳米材料修饰电极,或采用抗污染材料改性等措施[66]。随着食品成分复杂化和检测分析技术的快速发展,衍生出许多检测仪器与μPADs联用的检测新方法,如X射线衍射[67]、质谱[68]等。
1.5 合成生物学纸
合成生物学是生命科学与工程学科交叉的新兴领域,根据承载各种生物功能的基础单元——“基因元件”,在工程学及计算机指导下设计基因序列,利用DNA合成与组装技术编程遗传信息,然后移入底盘细胞或无细胞反应体系中发挥功能[69]。合成生物学纸是在纸基上构建的可编程的体外诊断平台,如图4所示,以纸为基底嵌入生物系统并建立成套的“纸基传感器+开关/逻辑门”基因回路,通过感应由靶标引起的特定变化,反应体系将开启、关闭或切换特殊功能,完成分子识别、信号转化与传感过程,从而达到检测的目的[70-72]。近些年,合成生物学模型、工具包和基因回路的多样化和模块化极大推进了纸基传感器的可持续发展,基于合成生物学的“纸上微型实验室”日益成熟,并在食品检测领域崭露头角[73]。

图4 合成生物学纸的检测原理[74]Fig.4 Principle of food safety detection by paper-based synthetic biology[74]
根据人工设计的生物系统对活细胞的依赖性可分为全细胞体系和无细胞体系,在大多数情况下,合成生物学与活细胞紧密相连[75]。在胞内合成生物学传感器中,活细胞可以感应到特定的生化分子或物理刺激,结合开关、逻辑门、负反馈回路、转录级联或环形振荡器等组件,整合一个或多个基因逻辑电路[76]。例如,Wan Xinyi等[77]基于细胞的生物传感器进行模块化信号放大处理,包括识别外部信号并将其转导为细胞内转录信号的传感模块、调制转导传感器信号的计算模块以及执行生理反应的输出驱动模块,并结合水凝胶和微流控技术设计了可生成梯度体积模式响应砷离子污染水平的微生物传感阵列。这种超灵敏细菌传感器首次证明了胞内串联放大转导信号的可行性,为工程微生物传感器阵列的发展奠定了基础。
全细胞体系的优势在于活细胞的自我复制,然而复杂的胞内体系和细胞膜的阻碍不可避免地加大了工程难度[75]。降低对细胞的依赖性能够提高细胞工程的灵活性,因此,无细胞系统成为合成生物学应用的关键平台,与体内蛋白质合成相比,无细胞体系安全且易于调节[78]。目前,无细胞系统已发展形成提取、纯化和合成酶途径3 种类型[75],功能化组件、工具包以及能量系统日益成熟并形成体系。Takahashi等[79]将两种合成生物学技术——基于RNA Toehold开关的分子传感器和无细胞转录-翻译系统集成于纸片上,从10 种肠道微生物中检测其特异性mRNA,经核酸序列扩增后,检测限低至3 fmol/L,另外,该平台能以冻干的形态在室温下稳定保存,这是无细胞合成生物学纸常用的保存方式,方便储存和运输;检测时复水即可激活反应体系,使用场景不再受限于实验室。
与传统实验室检测技术相比,“纸上微型实验室”轻巧便携、操作简单、成本低廉,在现场快速检测领域有巨大优势,与此同时,日益普遍的新业态、新资源食品以及消费者对食品的更高标准也为“纸上微型实验室”带来了新挑战(表1)。

表1 “纸上微型实验室”的优势与挑战Table 1 Advantages and disadvantages of “lab on paper”
2 “纸上微型实验室”在食品检测领域的应用
近些年,由于“纸上微型实验室”耗时短、成本低、体积小等诸多优势,能够突破传统实验室检测方法耗时长、操作复杂、成本高的局限性,并满足现场快速检测对灵敏度和选择性的需求。“纸上微型实验室”为食源性致病微生物、重金属、农药残留、兽药残留、食品添加剂、非法添加物以及毒素等食品安全风险因子的检测提供快速、便捷、可靠的平台,从而拓宽了其在食品检测领域中的应用前景。目前“纸上微型实验室”在食品检测中的应用汇总如表2所示。

表2 “纸上微型实验室”在食品检测领域的应用Table 2 Applications of “lab on paper” in food detection

续表2
2.1 食源性致病微生物
通过摄取食物而使病原体进入人体,以致人体患感染性或中毒性疾病的致病菌和病毒,统称为食源性致病微生物,其侵入和感染对食品安全和人体健康造成巨大威胁。经典的微生物快速测试纸片通过检测致病菌代谢产物、观察菌落特征检测少量样品,其检测范围窄、耗时较长、精度较低甚至只能定性分析[113]。无论是致病菌还是病毒,其免疫机制和遗传物质分别提供了两种高特异性检测手段,因此LFAs、μPADs和合成生物学纸成为检测食源性致病微生物的有力平台。Ilhan等[35]以噬菌体为识别元件建立了肠炎沙门氏菌LFAs试纸条,检出限和检测时间分别低至7 CFU/mL和0.5 h,良好的灵敏度、特异性和检测速度证明噬菌体可以作为细菌LFAs中抗体的替代分析物特异性试剂。Trinh等[82]发明了基于环介导等温扩增的μPADs,将注入扩增试剂和特异性引物的纸芯片包埋在微装置的反应室中,实现了对3 种致病菌(大肠杆菌、沙门氏菌、金黄色葡萄球菌)的纯化、扩增和荧光快速检测。Ma Duo等[114]基于Toehold开关的RNA传感建立了纸基无细胞转录-翻译系统检测GII.4型诺如病毒,如图5所示,首先用磁珠富集诺如病毒,然后用核酸序列扩增或逆转录重组酶聚合酶等温扩增病毒RNA,扩增的核酸被添加到基于纸张的无细胞体系中,触发序列特异性的Toehold开关产生β-半乳糖苷酶α肽和ω肽,互补后形成活性β-半乳糖苷酶,通过对氯酚红-β-D-半乳吡喃糖苷的切割,纸片颜色由黄色转变为紫色。该检测方法经磁珠富集后可将检测限降低至270 zmol/L;相比使用完整β-半乳糖苷酶作为输出产物,可将纸基分析时间缩短41%(23 min)。合成生物学纸相比LFAs和μPADs,对于能被活细胞识别或以核酸为遗传信息的靶标,能深入分子层面进行检测,选择性和灵敏度更高。为了降低检出限,往往先对微生物进行分离、富集和扩增,扩大检测范围的同时降低试剂和样品损耗,但时间成本和价格成本随之增加。

图5 基于Toehold开关的无细胞合成生物学纸检测诺如病毒的示意图[114]Fig.5 Schematic diagram of cell-free synthetic biology paper detection of norovirus based on toehold switch[114]
2.2 重金属
重金属是指密度大于5.0 g/cm3的金属元素,包括镉、铅、铜、汞等约45 种,不仅会导致人体慢性中毒,而且具有富集效应、难分解,已成为食品安全领域的突出问题。Song Yuqi等[86]利用4-MBA@AuNPs分子的“三明治”结构,将其修饰到层析滤纸和AuNPs上以连接重金属离子并作为SERS信号分子,成功检出糙米中的Cd2+、Cu2+和Ni2+。Zhang Dong等[87]在鲁棒亲水荧光水凝胶涂层的柔性纸/纺织薄膜上建立“微型实验室”,基于Hg2+和硫脲之间的氧化还原反应诱导由绿色到蓝色的荧光发射颜色的变化,制造出荧光水凝胶涂层可穿戴传感手套,方便视觉观测的同时,能有效保护食品安全监测人员远离有毒的Hg2+污染产品。Zhou Junrui等[89]基于无毒、环保的新型荧光ZnSe量子点的离子印迹技术,在3D旋转μPADs平台实现Cd2+和Pb2+的特异性和多通道检测。合成生物学纸为As2+的检测搭建快速、便捷的平台,Lin Xiaomei等[78]将调控LacZ的基因回路和无细胞系统嵌入到纸上,通过切割底物氯酚红-β-D-半乳吡喃糖苷介导色度输出,As2+的检出限为0.5 mmol/L;相比之下,Wan Xinyi等[77]基于大肠杆菌全细胞体系中应用模块化、级联的信号放大方法,首先调整细胞内感觉受体的密度来提高灵敏度,然后设计多层转录放大器依次提高输出表达水平,最终将输出信号提高了750 倍,检测限低于0.1 μg/kg。此外,根据重金属的特征显色反应、氧化还原反应、拉曼效应、与功能核酸和蛋白质特异性结合等特性搭建多种“纸上微型实验室”,能够为重金属检测提供安全可靠的纸基平台。
2.3 农药残留和兽药残留
农药和兽药是为保障果蔬和肉品质量所采取的施药措施,其残留对人类健康和可持续发展极其不利。Song Yuqi等[86]将纸层析法与SERS联用,对3 种兽药(孔雀石绿、亚甲基蓝、结晶紫)进行高效分离检测,检测限可达10 nmol/L。Wang Qin等[91]将双量子点与高活性纳米卟啉结合,建立基于双纳米信号放大的可视化荧光纸基传感器,通过对3 种有机磷农药(乐果、敌敌畏、内吸磷)产生的不同颜色变化响应,实现半定量分析。Shi Qiaoqiao等[95]开发了由AuNPs结合抗新霉素单克隆抗体和SERS探针分子4-氨基噻吩的双标记免疫探针,并依此建立了用于牛奶中抗生素检测的竞争型LFAs试纸条,分析物浓度与高分辨SERS信号成反比,检出限低至216 pg/mL。金蕊[92]基于AChE-ChO-Cu3(PO4)2·3H2O纳米花搭建了电化学和比色双重信号输出的μPADs,利用集成纳米酶与生物酶于一体的多酶级联催化特性,将对氧磷农药即时检测的检测限降至fg/mL级别。Arduini等[62]利用集成多种纸基丝网印刷电极的三维μPADs和便携式电位器,以折叠和展开为基础操作,利用计时电流法监测酶活性与农药残留量相关的抑制关系,无需添加任何试剂或对样品进行任何处理(如稀释、过滤、调节pH值)即可实现对有机磷类杀虫剂、苯氧酸类除草剂、三嗪类除草剂农药的多功能分析。农药和兽药种类丰富,大部分为有机化合物,适合在化学试纸、LFAs及μPADs平台上检测,相比之下,合成生物学纸的优势难以在此类无核酸结构的靶标的检测中体现。
2.4 食品添加剂
食品添加剂主要包括一些盐类和小分子化合物,其错用、滥用和超标使用将影响新陈代谢并对人体器官造成危害。如图6所示,Gharaghani等[97]将纸层析法与μPADs结合,反复折叠色谱纸构建3D微色谱平台,以碳酸氢盐缓冲液为流动相,纵向层析并同时比色测定了两种偶氮食品着色剂(酒黄石和靛蓝胭脂红)。陈敏[21]制备了亚硝酸盐化学试纸,利用亚硝酸盐与氨基苯磺酸重氮化反应后,再与萘乙二胺发生显色反应,只能完成定性或半定量检测;相比之下,Thinikan等[99]以环保的蜂蜡作为疏水材料,采用丝网印刷μPADs,基于Griess偶联反应同时比色检测食品中硝酸盐和亚硝酸盐,检出限分别为0.4 mg/L和0.1 mg/L。因此,食品添加剂可采用纸层析法分离和初步测定,在化学试纸或μPADs平台实现定量检测。

图6 基于纸层析法和折叠3D μPADs检测食品着色剂的示意图[97]Fig.6 Schematic diagram of food colorant detection based on paper chromatography and folded 3D μPADs[97]
2.5 非法添加物
不法商贩在食品生产中加入非法添加物,不仅危害消费者身体健康,还可能造成社会对食品添加剂的恐慌。杨若朦等[101]根据古蔡氏法制备乙酸铅试纸检测食品中的亚硫酸盐,设计的反应装置可用于多种挥发性有害气体(如SO2、甲醛)的快速检测。Li Yingying等[102]首次将基于AuNPs的LFAs应用于减肥保健食品中滥用药物呋塞米的检测中,检测限为1.0~1.2 mg/kg,12 min内即可完成样品前处理、特异性检测和肉眼读数全过程。Xie Liping等[48]以聚二甲基硅氧烷为阻隔剂,通过折纸建立了快速检测三聚氰胺的三维μPAD,三聚氰胺使AuNPs聚集导致检测区由浅粉色变为蓝紫色,比色分析的检出限为0.1 mg/kg。
2.6 毒素
食品中的毒素通常是会干扰人体生理生化反应的有机化合物,包括细菌性、真菌性和其他生物毒素,LFAs是其主要纸基检测方法。Pei Pengxiang等[104]合成了一种基于不对称双嗪衍生物的纸基化学传感器,以水杨醛腙作为结合位点和荧光信号基团识别苦杏仁中的CN-,荧光光谱的检测限降至0.947 μmol/L。Wang Chongwen等[105]将羧基化量子点固定在聚乙烯亚胺改性Fe3O4磁性纳米颗粒表面,构成磁性量子点纳米颗粒并应用于LFA试纸条,实现了食品中蛋白质毒素的捕获、富集和多重检测,A型肉毒毒素和葡萄球菌肠毒素的检出限分别为2.52 pg/mL和2.86 pg/mL。牛群峰等[106]基于LFAs和隧道磁阻传感器建立了黄曲霉毒素B1检测系统,检测时间仅需40 s,且该系统可与多重检测磁性层析纸结合实现多靶标的现场快速检测;Zhang Ting等[108]基于Fe3O4@Au超粒子复合材料显著的光热效应、磁性和直接吸附抗体的性能,建立了定量检测赭曲霉毒素A的LFA试纸条,在808 nm波长辐射下用便携式红外热像仪记录试纸条的光热图像以实现定量分析,并选取玉米、花生和大豆为样品验证了其实际应用潜力。
2.7 其他
随着食品种类多样化和成分复杂化,新型食品材料潜在有害组分对人体的危害无法忽视。除上述风险因子外,转基因食品、生物源掺假、食品包装释出物等物质的检测也可依赖于“纸上微型实验室”。Zhang Qian等[110]基于便携式3D打印生物传感装置实现了特异性重组酶聚合酶扩增和LFAs的一体化操作,该装置能在5 min内实现基因组的提取,并在25 min内完成转基因玉米MON810的定性检测,还可巧妙地应用于基于等温反应和LFAs的其他检测领域。Bougadi等[111]从基于特异性DNA探针-AuNPs建立了乳源(奶牛、绵羊、山羊)检测的LFAs,检测能力比其他方法高10 倍,还可用于肉类、橄榄油和豆类等其他掺假食品的检测。Jin等[115]基于比率荧光探针设计了三磷酸腺苷的可逆识别试纸;Liu等[112]建立了由μPAD和微型盒组成的甲醛检测系统,为食品包装的安全性提供了快速的纸基检测方法。
3 结语
“纸上微型实验室”为食品检测建立了便捷、灵敏、经济的新平台。不可否认,纸基分析方法仍存在灵敏度较低、易受污染、稳定性较差等局限性,只能作为快速筛选的手段而不能作为最终诊断的依据。因此,兼具快速和准确两大优点是“纸上微型实验室”追求的目标,基于此目标,众多改进方法有待发掘:1)选择更高效的样品预处理方法或增添过滤和浓缩组件,以缩短检测耗时;2)开发更好的显信号方法和专门的阅读分析仪器,以提高检测灵敏度;3)将纤维素纸与新兴材料结合、拓展纸基分析装置的新结构,以最大化发挥纸基便携、快速的优势。综上,“纸上微型实验室”正顺应现代检测技术简捷化、高通量化、多功能化的趋势迅猛发展,可为资源匮乏地区的现场快速检测提供简便工具,并为食品检测提供安全、可靠的技术平台。

