短链菊粉与高脂饲粮对不同基因型小鼠血清葡萄糖含量及盲肠微生物区系关联性的影响
冯 焱 蒙 爱* 冯江浩 薛智权 赵 燕,2** 崔 洁
(1.山西农业大学生命科学学院,太谷030800;2.山西农业大学动物科技学院,太谷030800;3.山西省太原市食品药品检验所,太原030000)
肥胖已经成为21世纪对人类健康影响最大的因素之一,是一种日益严重的流行病,影响着全球5亿多成年人的健康[1]。肥胖会导致代谢综合征、心脑血管疾病和呼吸系统等多种疾病的潜在发病概率上升[2-4]。目前对于肥胖成因的认知:一是由饮食摄入导致;二是个体基因表达的差异[5-6]。食物摄入后在肠道内被微生物分解代谢产生的物质被机体吸收产生影响,在此过程中肠道微生物发挥的作用对于肥胖形成至关重要。此外,通过遗传性肥胖的研究发现肥胖基因的调控机制[7]。研究指出,肥胖与膳食结构和遗传因素关系密切[8]。肠道微生物显著影响肠道内环境和宿主健康[9-11]。宿主遗传因素和饮食结构是决定肠道微生物的主要因素,且与宿主肥胖密切相关。高脂饮食会降低肠道内菌群多样性,影响肠道内微环境稳态[9]。适量摄入膳食纤维能够改变肠道菌群结构及多样性,促进宿主健康[12]。菊粉是一种天然的水溶性膳食纤维,是一个涵盖不同聚合度的线性β-(2,1)果糖和果糖化合物的统称,包含聚合度(DP)为2~60的不同链长的果糖化合物,其中DP为2~9是短链菊粉,又称低聚果糖。摄入菊粉后能增强食欲和胃肠道蠕动,促进盲肠内微生物发酵产生的短链脂肪酸的吸收和利用,提高机体免疫力。由于DP的不同,其被微生物利用的能力也不同,因此,短链、中链和长链菊粉在肠道内被微生物利用的效率也存在差异[13]。对于肥胖在遗传因素方面的研究发现,瘦素(Leptin)基因是一个关键基因[14-15]。Leptin基因相关蛋白能够作用于神经系统调控饮食摄入,同时刺激脂肪组织加速代谢,维持体重处于正常水平[16]。在肥胖个体的研究中,Leptin的抵抗和Leptin基因的突变均会使其在各个代谢通路中的作用降低而导致个体能量代谢失衡造成肥胖[17-18]。已证实饮食干预对于肠道微生物对肥胖的影响是关键。本研究主要关注短链菊粉和高脂饲粮在不同基因型间与盲肠微生物的互作关系。拟采用CRISPR-Cas9基因编辑手段构建Leptin基因敲除小鼠,通过饲喂高脂饲粮及添加短链菊粉,研究其对小鼠生长、糖耐受能力及盲肠微生物菌群区系的影响。验证短链菊粉以及高脂饲粮对不同基因型小鼠盲肠微生物的作用是否相同,进一步研究盲肠微生物在不同条件下的微生物区系的差异,探究饲粮、基因型与盲肠微生物间的关系,为研究肥胖相关的影响因素提供更具有指向性的理论依据。
1 材料与方法
1.1 试验设计及试验饲粮
无特定病原体(SPF)级的C57BL/6J小鼠和C57BL/6JLeptin基因敲除小鼠均由北京唯尚立德生物科技有限公司提供,C57BL/6JLeptin基因敲除小鼠构建由公司完成,gRNA活性检测、繁育筛选及基因型鉴定由公司和作者共同完成。试验通过唯尚立德动物伦理委员会审核(审核编号:20200048),符合试验动物伦理要求。饲养于SPF级饲养间,每组饲养于1个独立通气鼠笼,12 h光照和12 h黑暗模拟昼夜节律,自由采食与饮水。8周龄的Leptin基因敲除小鼠已表现出明显的肥胖表型,同时可能导致血清葡萄糖含量和肠道微生物结构发生改变,因此,选择8周龄40只雄性野生型C57BL/6J小鼠与40只雄性Leptin基因敲除小鼠,分为8组,每组10只,单笼饲养。1~4组为野生型小鼠不同处理组:野生型对照组(CT组)、野生型+10%短链菊粉组(CI组)、野生型+高脂组(CH组)、野生型+高脂+10%短链菊粉组(CHI组);5~8组为Leptin基因敲除小鼠不同处理组:Leptin基因敲除对照组(OT组)、Leptin基因敲除+10%短链菊粉组(OI组)、Leptin基因敲除+高脂组(OH组)、Leptin基因敲除+高脂+10%短链菊粉组(OHI组)。持续饲喂8周。
普通饲粮和高脂饲粮购自北京科澳协力饲料有限公司。其中普通饲粮(营养物质含量:粗蛋白质18.2%、粗脂肪7.4%、粗纤维1.8%、粗灰分4.18%、钙1.05%和有效磷0.71%)、高脂饲粮(营养物质含量:粗蛋白质26.2%、碳水化合物26.3%和粗脂肪34.9%)和10%菊粉复合型高脂饲粮的脂肪来源于豆油和猪油,经辐射灭菌后饲喂。短链菊粉(DP为2~9,纯度95%)由比利时Orafti公司提供。
1.2 样品采集
于第8周将小鼠脱臼处死,测定体重与体长、肝脏和生殖腺脂肪重量。取盲肠内容物分装于冻存管,-80 ℃保存待测。
1.3 体重及相关指标计算
试验期间每3 d测1次采食量,每6 d测1次体重。数据记录后,分别计算小鼠体重增长率、Lee’s指数、脂肪系数及肝重比,计算公式如下:
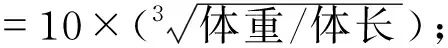
1.4 糖耐受测定
于第8周腹腔注射葡萄糖,小鼠饥饿14 h,期间禁食不禁水,于第2日进行测试。6 g葡萄糖配制30 mL 20%葡萄糖溶液。注射前剪取尾尖取血,使用便携式血糖仪测定空腹血清葡萄糖含量,记为0 min血清葡萄糖含量,之后每只按照2 g/kg葡萄糖剂量腹腔注射葡萄糖溶液,并分别于腹腔注射葡萄糖溶液后的15、30、60、120 min测定并记录血清葡萄糖含量,绘制血清葡萄糖含量变化曲线。计算曲线下面积(AUC),单位表示为mmol/(L·h),计算公式如下:
AUC=(Bg0+Bg15)×0.5/2+(Bg15+Bg30)×
0.5/2+(Bg30+Bg60)×0.5/2+(Bg60+
Bg120)×0.5/2。
式中:Bg0、Bg15、Bg30、Bg60、Bg120为不同时间血清葡萄糖含量。
1.5 肠道菌群分析
以Solarbio Bacterial Genomic DNA Extraction Kit对内容物进行细菌基因组DNA的抽提。使用通用上游引物338F(5’-ACTCCTACHGGAGGCAGCAG-3’)和通用下游引物806R(5’-GGACTACHVGGGTWTCTAAT-3’)对基因组16S rDNA的V3~V4区进行扩增,采用Trans Gene AP221-02: Trans Start Fast Pfu DNA Polymerase试剂盒。采用Illumina高通量测序平台的MiSeq测序技术获得并统计模板DNA片段的序列信息。
1.6 数据统计
采用SPSS 20统计软件对数据进行汇总及统计学分析,SNK法分析多组间差异,LSD法进行多重比较。P<0.05为差异显著,P<0.01为差异极显著。使用Graph Pad Prism 8.0绘制图表。微生物多样性分析使用美吉生物云计算平台(https://www.i-sanger.com/)。
2 结果与分析
2.1 体重变化
由表1可知,野生型小鼠在第12天CHI组体重显著低于CI组(P<0.05),第42~54天CH组体重显著低于CI组(P<0.05);Leptin基因敲除小鼠组间体重无显著差异(P>0.05)。野生型小鼠各组体重均显著低于Leptin基因敲除小鼠各组(P<0.05)。
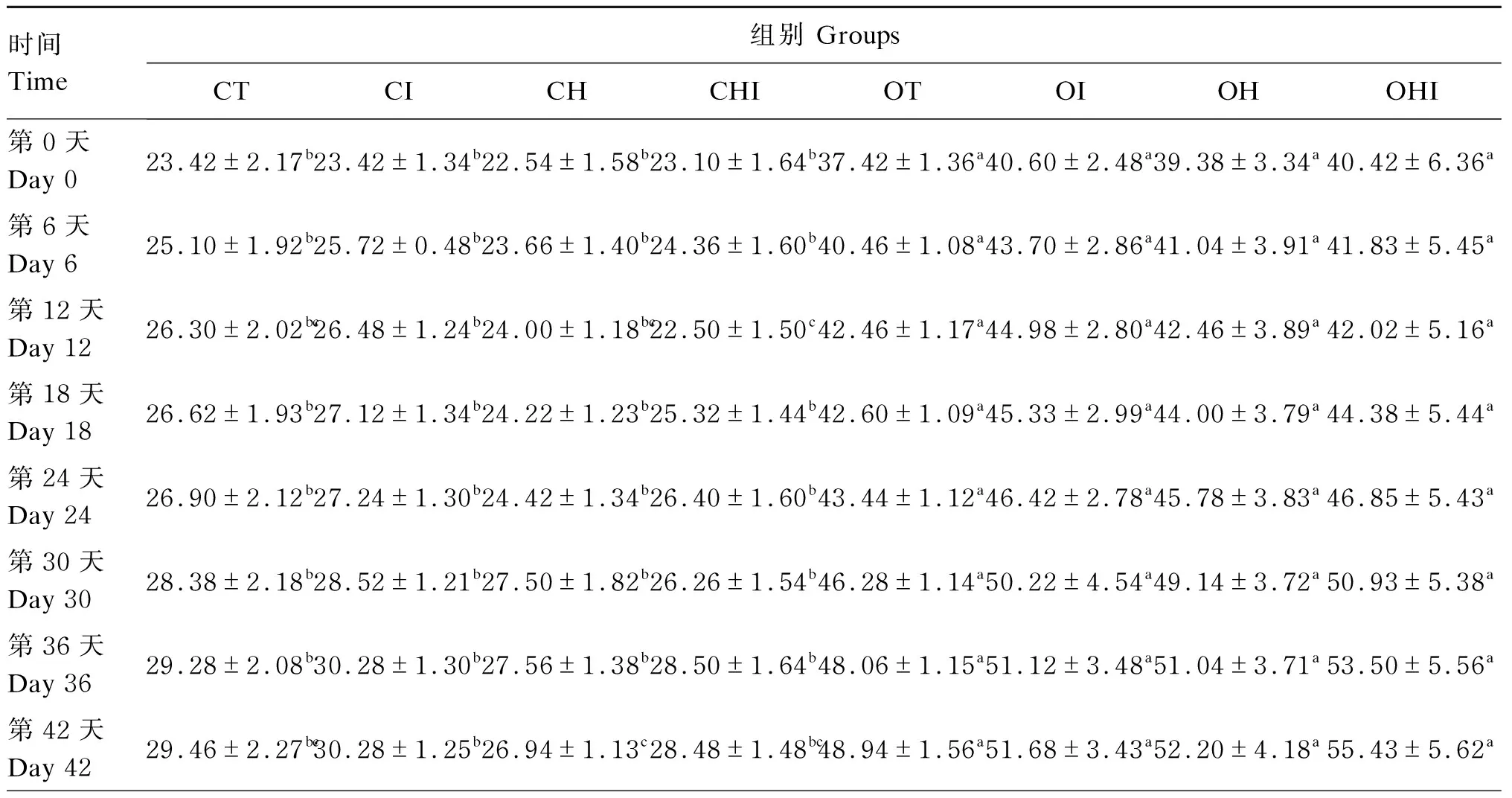
表1 体重变化

续表1时间Time组别 GroupsCTCICHCHIOTOIOHOHI第48天Day 4830.22±2.51bc31.48±1.50b27.70±1.32c29.42±1.48bc50.32±1.94a52.85±3.73a54.06±4.31a56.05±5.74a第54天Day 5428.82±4.06bc31.34±1.35b27.26±0.47c29.50±1.41bc51.84±1.85a54.02±3.90a54.30±4.88a57.03±6.04a第60天Day 6030.72±1.99b32.28±1.59b28.90±1.21b30.50±1.82b51.10±4.98a53.98±3.66a56.66±4.75a58.37±5.88a
2.2 体重增长率与肥胖相关指标
由表2可知,野生型组中CH组和CHI组体重增长率显著低于Leptin基因敲除组中OH组和OHI组(P<0.05)。野生型组中CH组和CHI组的Lee’s指数低于CT组和CI组,其中CHI组和CI组间差异显著(P<0.05),CHI组和CI组间差异显著(P<0.05),Leptin基因敲除组中OHI组的Lee’s指数则略高于OT组和OI组(P>0.05)。与CT组相比,高脂饲粮显著增加脂肪系数(P<0.05),短链菊粉能够略微降低脂肪系数但与高脂饲粮结合则表现出增加脂肪系数的情况。与CT组相比,野生型组中短链菊粉降低肝重比,而Leptin敲除组中短链菊粉提高高脂饲粮导致的肝重比上升,但均未表现出显著差异(P>0.05)。
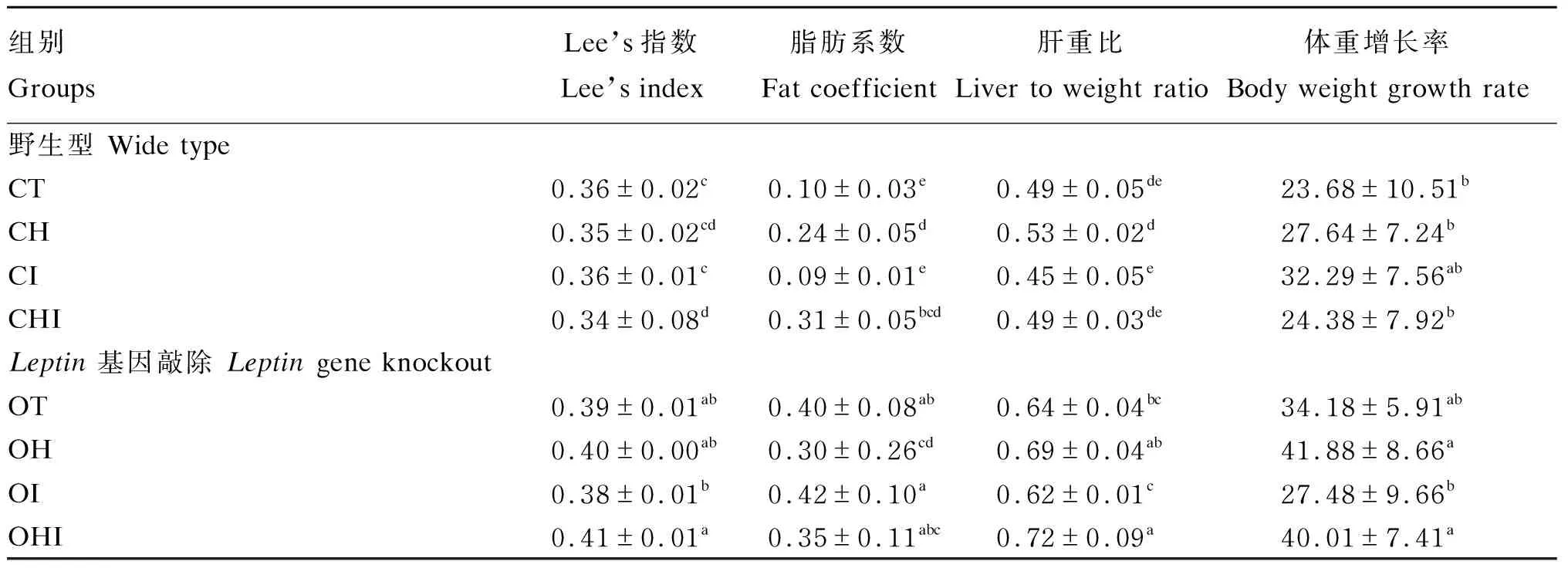
表2 体重增长率与肥胖相关指标
由表3可知,Leptin基因敲除与高脂饲粮间交互作用对Lee’s指数和脂肪系数有显著影响(P<0.05)。

表3 体重增长率与肥胖相关指标多因素方差分析(P值)
2.3 糖耐受测定
由表4可知,所有时间点野生型组空腹血清葡萄糖含量均低于Leptin基因敲除组,只有CH组和OH组、CHI和OHI组间达到显著差异(P<0.05)。30 min时,CH组和CHI组血清葡萄糖含量显著高于CT组和CI组(P<0.05),OH组和OHI组显著高于OT组(P<0.05)。60 min时,CHI组血清葡萄糖含量显著高于CI组(P<0.05),OH组显著高于OT组(P<0.05),OHI组显著高于OI组(P<0.05)。120 min时,野生型组间血清葡萄糖含量无显著差异(P>0.05),Leptin基因敲除组中OT组显著低于OH组和OHI组(P<0.05)。除OH组外,其他各组血清葡萄糖含量在15 min时出现峰值,之后开始降低,于120 min时达到最低接近初始血清葡萄糖含量。CT组和CI组AUC显著低于CH组和CHI组(P<0.05),OT组和OI组AUC显著低于OH组和OHI组(P<0.05);方差分析结果表明,短链菊粉和高脂饲粮与Leptin基因敲除间不存在显著交互关系(P>0.05)。
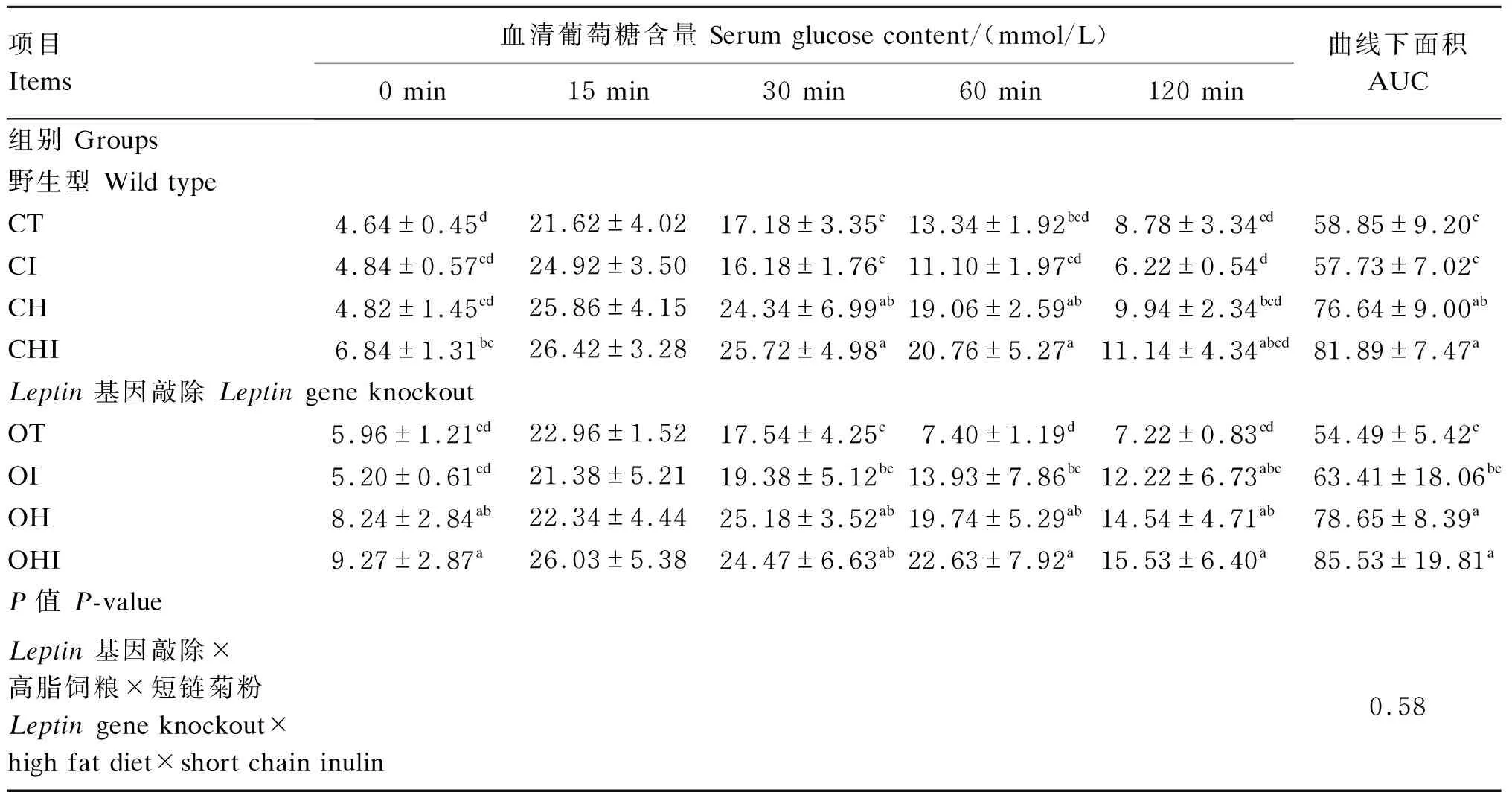
表4 葡萄糖耐受测定
2.4 盲肠微生物分析
2.4.1 盲肠微生物alpha分析
由表5可知,不同组间盲肠微生物在操作分类单元(OTU)水平进行alpha多样性分析。与CT组相比,CI组、CH组和CHI组Sobs指数显著降低(P<0.05),同时CHI组显著低于CI组(P<0.05);OI组、OH组和OHI组Sobs指数显著低于OT组(P<0.05)。CT组Shannon指数显著高于CI组、CH组和CHI组(P<0.05),CHI组显著低于CI组(P<0.05);OT组Shannon指数显著高于OI组、OH组和OHI组(P<0.05),OI组显著高于OHI组(P<0.05)。CHI组Simpson指数显著高于CT组、CH组和CI组(P<0.05),CI组显著低于CHI组(P<0.05);OI组、OH组和OHI组Simpson指数显著低于OT组(P<0.05)。CHI组与CI组Chao1指数显著低于CT组(P<0.05);OT组显著低于OH组、OI组和OHI组(P<0.05)。CT组Chao1指数显著高于野生型其他组(P<0.05);OT组显著高于Leptin基因敲除其他组(P<0.05)。
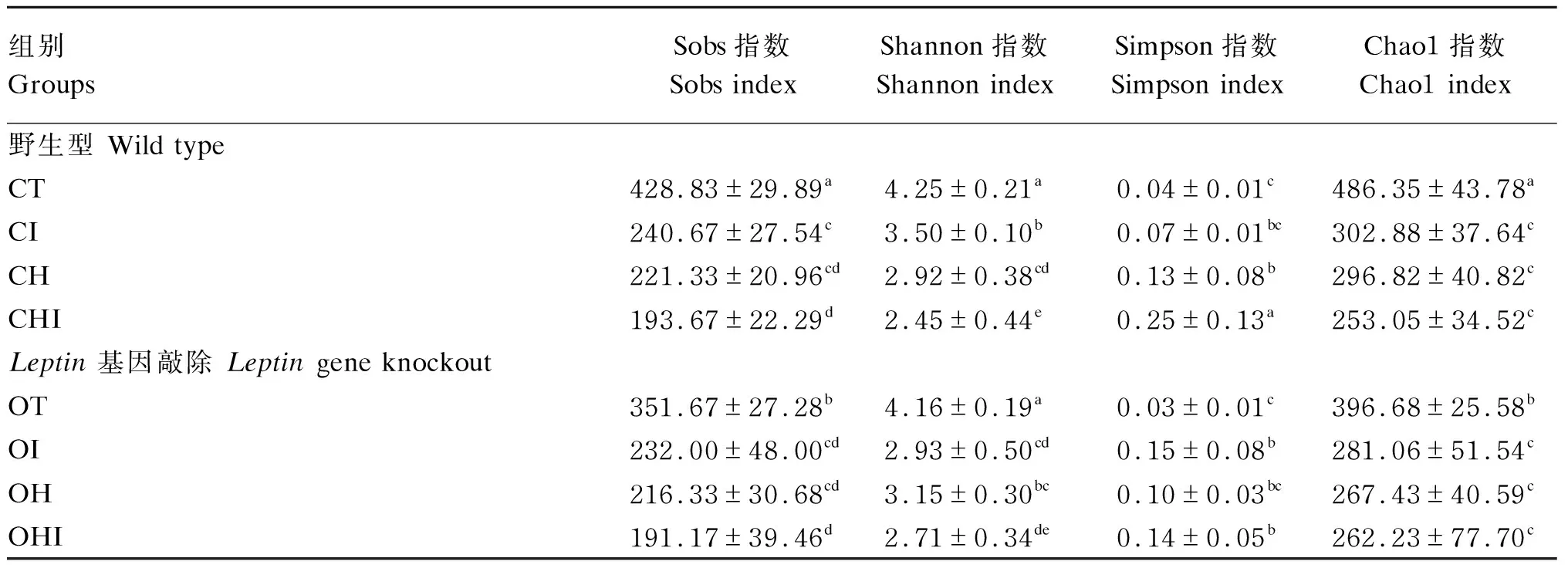
表5 盲肠微生物菌群alpha多样性
2.4.2 盲肠微生物在门水平和属水平的分析
在门水平,野生型组厚壁菌门(35.80%~90.70%)、放线菌门(5.00%~49.70%)、拟杆菌门(0.28%~52.10%)和脱硫杆菌门(0.12%~12.30%)相对丰度较高(图1-A),Leptin基因敲除组厚壁菌门(24.40%~78.40%)、放线菌门(1.40%~36.60%)、拟杆菌门(0.20%~61.70%)和脱硫杆菌门(0.05%~19.20%)相对丰度较高(图1-B)。在所有48个样品中共检测出196个属。野生型组盲肠微生物相对丰度前20的菌属占野生型各组所有菌属比例的81.50%~89.50%(图1-C),Leptin基因敲除组中盲肠微生物相对丰度前20的菌属占野生型组所有菌属比例的83.40%~92.00%,高于野生型组(图1-D)。

A:野生型组门水平 wild-type groups at phylum level;B:Leptin基因敲除组门水平 Leptin gene knockout groups at phylum level;C:野生型组属水平 wild-type groups at genus level;D:Leptin基因敲除组属水平 Leptin gene knockout groups at genus level。
2.4.3 盲肠微生物条件性致病菌相对丰度的分析
高脂饲粮增加盲肠内的条件性致病菌的相对丰度,肠球菌属和大肠杆菌-志贺菌属在普通饲粮以及短链菊粉饲粮饲喂的小鼠盲肠内未检测到,但在高脂饲粮饲喂的小鼠盲肠内的相对丰度均上升。CHI组中大肠杆菌-志贺菌属(P=0.000 8)和肠球菌属(P=0.037 9)的相对丰度出现显著下降,10%短链菊粉的添加降低条件性致病菌的相对丰度,减少盲肠内由致病菌大量繁殖引发疾病的机率(图2-A)。在Leptin基因敲除组中,OHI组和OH组间存在相同表征,短链菊粉的添加显著降低OHI组盲肠内大肠杆菌-志贺菌属(P=0.000 6)和肠球菌属(P=0.034 2)的相对丰度(图2-B)。

A:野生型组 wild-type groups;B:Leptin基因敲除组 Leptin gene knockout groups。
由表6可知,高脂饲粮与短链菊粉间存在交互作用,短链菊粉对于双歧杆菌属(Bifidobacterium)和乳酸杆菌属(Lactobacillus)相对丰度有影响显著(P<0.05),且与高脂饲粮间存在显著交互作用(P<0.05)。布劳特氏菌属(Blautia)和肠球菌属相对丰度受高脂饲粮影响显著(P<0.05),并与短链菊粉与Leptin基因敲除间存在显著交互作用(P<0.05),高脂饲粮与Leptin基因敲除对肠球菌属相对丰度的影响存在显著交互作用(P<0.05)。对于大肠杆菌-志贺菌属相对丰度的影响主要是Leptin基因敲除、高脂饲粮和短链菊粉共同导致(P<0.05)。
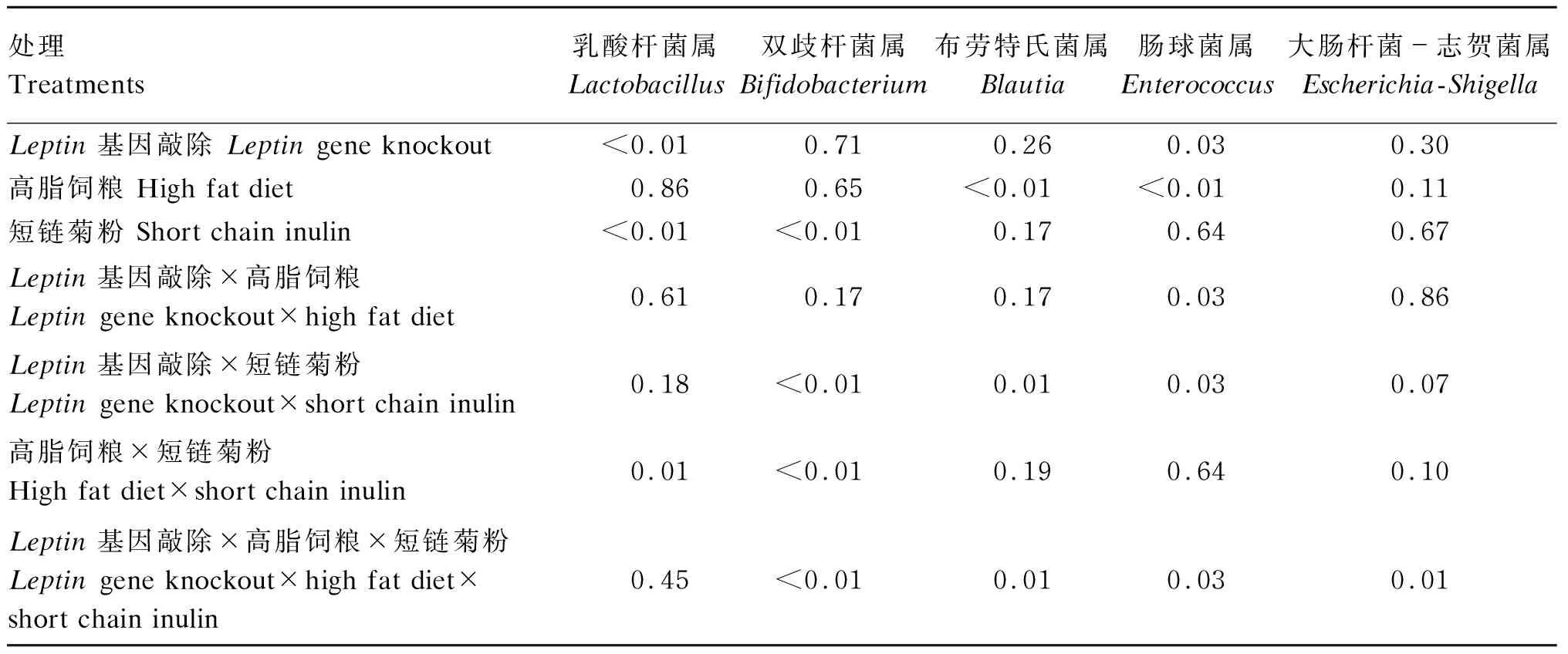
表6 属水平菌群多因素方差分析(P值)
2.4.4 菌群与表型关联性
选取在盲肠内相对丰度最高的20个属,进行Mantel Test,分析其与血清葡萄糖含量、Lee’s指数、脂肪系数、肝重比及体重增长率间的相关性。乳酸杆菌属相对丰度与体重生长率、肝重比、Lee’s指数呈极显著正相关(P<0.01),双歧杆菌属相对丰度与肝重比呈显著负相关(P<0.05),布劳特氏菌属相对丰度与血清葡萄糖含量(P<0.01)和体重增长率(P<0.05)呈显著或极显著正相关。拉克氏梭状芽孢杆菌属(Lachnoclostridium)、粪杆菌属(Faecalibaculum)、脱硫弧菌属(Desulfovibrio)、杜博西拉属(Dubosilla)相对丰度与血清葡萄糖含量呈极显著正相关(P<0.01),回肠杆菌属(Ileibacterium)相对丰度与血清葡萄糖含量呈极显著负相关(P<0.01)(图3)。

Lachnospiraceae_NK4A136_group:毛螺菌科_NK4A136_群;norank_f_norank_o_Clostridia_UCG-014:未命名梭菌纲_UCG-014属;norank_f_Muribaculaceae:未命名穆里巴库莱科;Ileibacterium:回肠杆菌属;Lactobacillus:乳酸杆菌属;Lachnospiraceae_UCG-006:毛螺菌科_UCG-006;Enterorhabdus:肠杆菌属;norank_f_Desulfovibrionaceae:未命名脱硫弧菌科;Romboutsia:罗姆布茨菌属;unclassified_f_Lachnospiraceae:未分类毛螺菌科;Desulfovibrio:脱硫弧菌属;norank_f _Lachnospiraceae:未命名的毛螺菌科;Blautia:布劳特氏菌属;Faecalibaculum:粪杆菌属;Lachnoclostridium:拉克氏梭状芽孢杆菌属;Dubosilla:杜博西拉属;Bifidobacterium:双歧杆菌属;Coriobacteriaceae_UCG-002:红蝽菌科_UCG-002;norank_f_Eubacterium_coprostanoligenes_group:未命名真杆菌_产粪甾醇真细菌群。
3 讨 论
近年来,有大量文献报道菊粉具有降低血糖血脂的功能,但鲜有关于短链菊粉与血清葡萄糖相关的研究[19-20]。糖耐受结果表明,普通饲粮添加短链菊粉能够降低Leptin基因敲除组的空腹血清葡萄糖含量,但高脂饲粮中添加短链菊粉反而使2种基因型小鼠的空腹血清葡萄糖含量均有所提升,虽未至显著水平,但也提示在高脂饲粮饲喂下添加短链菊粉具有潜在刺激空腹血清葡萄糖含量升高的能力。短链菊粉对于腹腔注射葡萄糖后120 min内血清葡萄糖含量变化的影响不显著。Gao等[21]研究表明,菊粉能够降低Ⅱ型糖尿病小鼠的炎症和血液中的脂多糖含量。本研究发现,短链菊粉虽然能够加速血清葡萄糖含量降低但未能显著降低,表明在不同DP的膳食纤维菊粉中,发挥降血糖功能的成分不是短链菊粉。高脂饲粮在2种基因型小鼠中均表现出对糖耐量的负面影响,同时在Leptin基因敲除组中更易诱发糖尿病,空腹血清葡萄糖含量高于正常值的是OH组和OHI组。这说明高脂饲粮对血清葡萄糖含量变化的影响较大,与Nagy等[22]研究结论一致。Leptin基因敲除组的初始血清葡萄糖含量略高于野生型组,表现出糖尿病症状的数量较多。Nagy等[22]和Wang等[23]的研究发现,高脂饲粮与Leptin基因敲除更容易导致血清葡萄糖含量的升高,与本试验结果相同。方差分析也显示,高脂饲粮是影响AUC的主要因素,其变化与短链菊粉和基因型的关联性较低。但根据AUC来看,普通饲粮饲喂的Leptin基因敲除小鼠则表现出较好的血清葡萄糖调控能力,OT组血清葡萄糖含量下降高于CT组,最终血清葡萄糖含量更低,但未能达到显著水平。这一现象未被以往的研究发现,推测其原因可能是Leptin基因敲除对血清葡萄糖含量变化较为敏感,而敏感程度受饲粮影响较大。此外,肥胖评判标准除体重差异外,体脂率、肝重比也应考虑在内。在本研究中,Leptin基因敲除组体重均高于野生型组,这是Leptin基因敲除的纯和小鼠最显著的表型[24]。但是短链菊粉对体重的影响较低,野生型组间体重未表现出显著差异,Leptin基因敲除组中OH组与OHI组体重略高于OT组。结果与Koch等[25]在菊粉与体重方面的研究结果一致,短链菊粉与菊粉的表现相同,同样对于体重的影响较小。
关于短链菊粉与肥胖相关的研究表明,短链菊粉能够在一定程度上降低体脂[26]。结合其他肥胖指标,高脂饲粮在一定程度上增加脂肪系数及肝重比,短链菊粉饲喂能略微降低Lee’s指数、脂肪系数及肝重比。有趣的是两者共同饲喂后,脂肪系数有所增加,同时Leptin基因敲除组中的肝重比也增加,但两者间交互影响未达显著水平。这些现象一方面表明短链菊粉对于肥胖的影响是基于饲粮水平,另一方面也表明Leptin基因缺失导致小鼠对肥胖的控制能力低下,野生型小鼠降低肥胖程度在Leptin基因缺失后失去效果。研究表明,Leptin基因编码的Leptin蛋白能够影响下丘脑,抑制食欲从而控制能量摄入,同时加速脂肪代谢。通过神经系统调节能量的摄入与输出从而达到控制体重的效果[27]。也有研究发现,Leptin基因在心血管疾病中同样发挥作用[28]。Leptin基因敲除后表现出自发性的肥胖,不受摄入食物种类的影响,且盲肠微生物结构也发生了显著的改变。Landman等[29]发现,肠道微生物的失调与肥胖有显著关系。Leptin基因敲除不仅导致肥胖,使盲肠菌群失调进一步加剧肥胖进展。在本研究中证实这一观点,在alpha多样性分析中,Leptin基因敲除组盲肠微生物相对丰度普遍低于野生型组。通过对盲肠内微生物相对丰度检测,门水平上相同饲粮组间Leptin基因敲除和野生型间盲肠微生物的构成存在显著差异。在Leptin基因敲除组中含有多种致病菌的脱硫杆菌门(Desulfurobacter)的相对丰度显著上升,而这一菌门在野生型组中相对丰度均较低。在对属水平的菌群相对丰度差异进行分析,2种不同基因型的小鼠在相同饲喂条件下菌群的构成差异更为显著。2种条件性致病菌属——肠球菌属和大肠杆菌-志贺菌属的相对丰度在Leptin基因敲除型小鼠盲肠内均高于野生型小鼠,这2个菌属相对丰度升高对个体健康具有潜在的威胁。此外,在属水平的分析发现,布劳特氏菌属的相对丰度变化与之前研究存在差异。以往的研究表明,布劳特氏菌属相对丰度与个体肥胖间存在关系,在肥胖个体以及高脂饮食个体中相对丰度均下降,因此,其被视为一种新的肥胖相关标志菌属[30-31]。而通过本研究发现,布劳特氏菌属的相对丰度在高脂饲粮饲喂下出现上升,同时Leptin基因敲除组盲肠内布劳特氏菌属相对丰度高于野生型组,这一结果与先前的研究结果相反,只有普通饲粮饲喂的2组间,CT组布劳特氏菌属的相对丰度高于OT组。结果表明,Leptin基因对于布劳特氏菌属作为新型肥胖标准菌,其与肥胖的关系及作用方式值得进一步深入探究。通过多因素方差分析发现,饲粮类型、短链菊粉添加与否,以及Leptin基因敲除对盲肠微生物的菌群结构存在交互作用,不同情况下短链菊粉对于盲肠微生物的影响是有差异的,这现象在乳酸杆菌属上表现尤为明显,同时也能由此推测试验结果中布劳特氏菌属相对丰度与以往文献中不一致的变化可能是由短链菊粉与基因型交互作用所导致。
肠道微生物作为膳食纤维发挥作用的主体,承担着膳食纤维与宿主间的桥梁作用。短链菊粉作为一种菊粉,同属于膳食纤维,也具有膳食纤维共有的功能,但因其DP低,所发挥的作用与中链和长链菊粉不同,更易降解,所以对盲肠微生物的影响更大[32-33]。高脂饮食能够降低盲肠菌群种类,而短链菊粉的添加进一步降低盲肠菌群种类,这一结果与以往关于菊粉的研究所得结论不同[34]。有可能是短链菊粉摄入的方式、剂量、时间和对象等存在差别,对盲肠的微生物区系的变化发酵程度产生细微变化,优化肠道有益菌成为优势菌群。双歧杆菌属多为益生菌,能够改变肠道环境,抑制致病菌的繁殖[35]。So等[36]的研究,菊粉能够提高双歧杆菌属和乳酸菌属的相对丰度。本研究的结果显示,短链菊粉同样能够显著提高双歧杆菌属的相对丰度。同时Nova等[37]的研究表明,乳酸杆菌属有抵抗肥胖的潜在能力。但本试验中,在野生型小鼠饲粮中添加短链菊粉会降低乳酸杆菌属的相对丰度,只有在Leptin基因敲除组中短链菊粉促进乳酸杆菌属的相对丰度上升[38]。除此也证实,短链菊粉对于不同基因型的小鼠肠道微生物影响也是不同的。菌群丰度分析进一步证明这点,高脂饲粮对肠道菌群结构具有负面影响,而短链菊粉能够改善盲肠菌群结构,一定程度上恢复受高脂饲粮影响的菌群,重新构建盲肠微生物的菌群平衡。
4 结 论
高脂饲粮或敲除Leptin基因导致小鼠肥胖,显著影响盲肠菌群结构,高脂饲粮破坏盲肠菌群多样性,并增强肠道能量代谢能力,短链菊粉对肥胖影响较小,但能降低代谢相关通路,有效降低条件性致病菌相对丰度,提高双歧杆菌属在盲肠内的相对丰度,优化盲肠内菌群结构。

