太湖西山岛河网秋季浮游生物群落结构特征及其影响因子分析
李清濯,华跃洲,杜成栋,何尚卫,吴召仕,潘继征①
(1.中国科学院南京地理与湖泊研究所/ 湖泊与环境国家重点实验室,江苏 南京 210008;2.中国科学院大学,北京 100049;3.苏州科技大学环境科学与工程学院,江苏 苏州 215009)
浮游生物是水生态系统的重要组成部分,对水生态系统的物质循环、能量流动以及水生态平衡起着至关重要的作用[1]。浮游生物群落结构对水体中环境因素的变化极为敏感,是衡量水体富营养化程度和水生态系统健康状态的重要生物指标之一[2-3]。不同水体中浮游生物群落结构的主要影响因子存在差异,分为非生物因素(如水温[4]、营养盐[5]等)和生物因素(如捕食、竞争[6]等)。研究浮游生物的群落结构特征及其影响因素有助于准确评估水体环境质量变化及明确治理目标,并对后续水体生态环境监测、评价具有重要参考意义。
太湖西山岛位于太湖东侧,是我国淡水湖泊中最大的岛屿。西山岛上河道众多、分布密集。岛内绝大部分河道连通太湖,是太湖健康生态系统维护的关键节点和生态屏障之一。随着西山岛经济的不断发展,人类活动的不断加强,西山岛河网的水质也持续恶化。2021年,苏州市吴中区发布了《太湖生态岛发展规划思路》,指出要开展生态环境修复和生态综合整治,以逐步优化西山岛全域水质。目前针对太湖浮游生物的研究主要集中于太湖湖区及湖滨带[7-8],太湖岛屿西山岛河网浮游生物的研究尚鲜见报道。秋季是太湖地区浮游生物密度和生物量较高的时期[7,9]。受太湖水位影响,河道多为往复流动,汛期受到梅雨季节大量降水影响,河道处于顺流状况;到了秋季汛后期,太湖水位仍然较高,湖水倒灌而入,水流以滞留为主。在此水利条件下河道形成了复杂的水质条件和水生态环境,故了解这一时期浮游生物群落的变化对认识太湖与西山岛河网水环境之间的作用关系极其重要。
该研究调查了太湖西山岛河网中的浮游生物群落结构特征,分析了浮游生物空间分布特征及其与水环境因子之间的关系,可为太湖西山生态岛河网水环境和水生态健康评价提供依据,对太湖生态岛的建设和太湖生态环境保护具有重要意义。
1 材料与方法
1.1 采样点布设及采样时间
根据西山岛河网水体类型和生境特点,将河网分为城镇区、水产养殖区和农业区河道3个类别,共设置34个采样点位(图1)。其中,S1~S13为城镇区河道,是西山岛金庭镇中心的主要河道。S14~S16为水产养殖区河道,2018年以前为太湖大闸蟹的养殖基地,现逐步腾退整治为农田和生态湿地。S17~S34为农业区河道,以园地、林地、耕地为主。样品采集和分析时间为2020年10—11月。
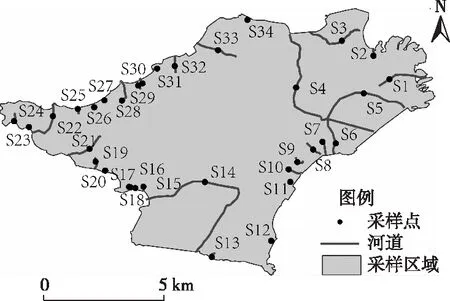
图1 采样点分布Fig.1 Distribution of sampling points
1.2 样品采集及分析方法
1.2.1水体样品采集与水质指标测定
采用多参数水质测定仪(YSI,美国)现场测定河流表层水样的温度(WT)、pH值、溶解氧(DO)浓度、氧化还原电位(ORP)、矿化度(TDS)和电导率(EC)等环境参数。采用采水器采集水面以下0.5 m深处的水样,倒入聚乙烯瓶中低温保存,48 h内运回实验室分析测定。参照文献[10]中的方法,测定水样中的化学需氧量(CODCr)、总氮(TN)、氨氮(NH4+-N)、总磷(TP)、溶解性正磷酸盐(SRP)和叶绿素a(Chl-a)浓度。
1.2.2水体样品采集与浮游植物鉴定
取1 L水面以下0.5 m深处的水样倒入聚乙烯瓶中,并添加φ=15‰的鲁哥试剂进行固定,静置48 h后吸去上清液,将剩余水样浓缩至30 mL。选取面积为20 mm×20 mm、容量为0.1 mL的计数框,在显微镜下进行鉴定和计数[11]。
1.2.3水体样品采集与浮游动物鉴定
轮虫样品的采集和处理方法与浮游植物相同。选取1 mL计数板,在显微镜下鉴定和计数。枝角类、桡足类样品采用水面以下0.5 m深处10 ~50 L水样,经25号浮游生物网过滤后,把过滤物放入50 mL标本瓶中,并添加φ=7%的甲醛溶液固定,静置48 h后吸去上清液,将剩余水样浓缩至30 mL。选取1 mL计数板,在显微镜下鉴定和计数[12-13]。
1.3 数据分析
1.3.1多样性指数
生物群落特征采用物种优势度指数(Y)、Shannon-Wiener多样性指数(H′)、Margalef丰富度指数(D)、Pielou均匀度指数(J)表述。
(1)物种优势度指数(Y)
Y=fi×ni/N。
(1)
式(1)中,ni为第i种的数量;N为群落中所有种的数量;fi为该种在各点位出现的频率。其中Y≥0.02的判定为优势种。
(2)Shannon-Wiener多样性指数(H′)
H′=∑ni/N×lnni/N。
(2)
(3)Margalef丰富度指数(D)
D=(S-1)/lnN。
(3)
式(3)中,S为样品中的种类数。
(4)Pielou均匀度指数(J)
J=H′/lnS。
(4)
1.3.2水质状况评价
采用对数型幂函数普适指数公式计算河道水体营养状态综合指数(E)[14]。选取Chl-a、TP、SRP、TN、NH4+-N和DO浓度作为评价指标,并根据方法对应的富营养状态分级标准(表1)评价各监测断面水体营养状态。
(5)
式(5)中,E为营养状态综合指数;Wj为第j种指标的归一化权重值,将各指标视作等权重;Ej为第j种指标的富营养化评价普适指数;xj为第j种指标的规范值,计算方法见文献[14];n为评价指标个数。
1.3.3统计分析
使用SPSS 25.0和Origin 2019软件对数据进行统计分析和作图,太湖西山岛河网采样点分布图在ArcGIS 10.2软件中绘制。对河道中的浮游生物物种进行筛选(物种在各采样点出现的频率≥30%,且至少1个采样点的相对密度≥1%[15]),将筛选物种密度数据和环境因子数据分别进行Hellinger转换和标准化后,使用R语言中的vegan包对筛选物种数据和环境因子进行去趋势分析(DCA)。DCA结果表明,排序轴梯度最大值均小于3,故对数据进行线性冗余分析(RDA)。营养状态综合指数(E)≤20为贫营养,>20~39.42为中营养,>39.42~61.29为富营养,>61.29~76.28为重富营养,>76.28~99.77为极富营养。
2 结果与分析
2.1 环境因子特征
各类型河道水质参数特征和综合营养状态评价结果如表1和图2所示。
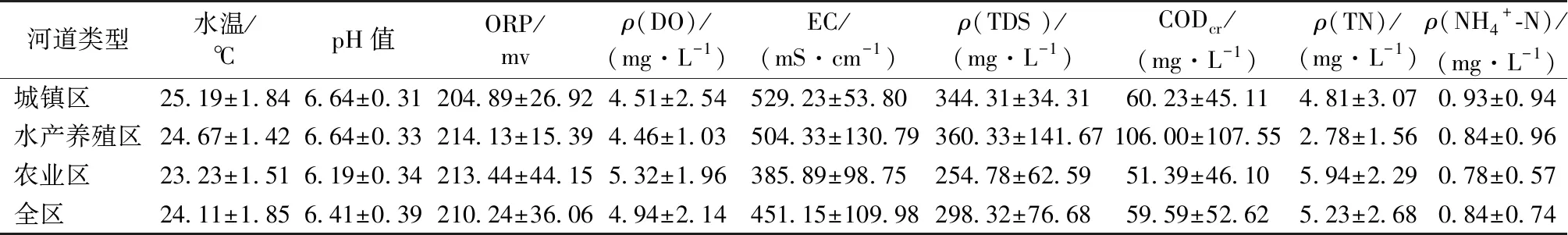
表1 各类型河道水质参数特征
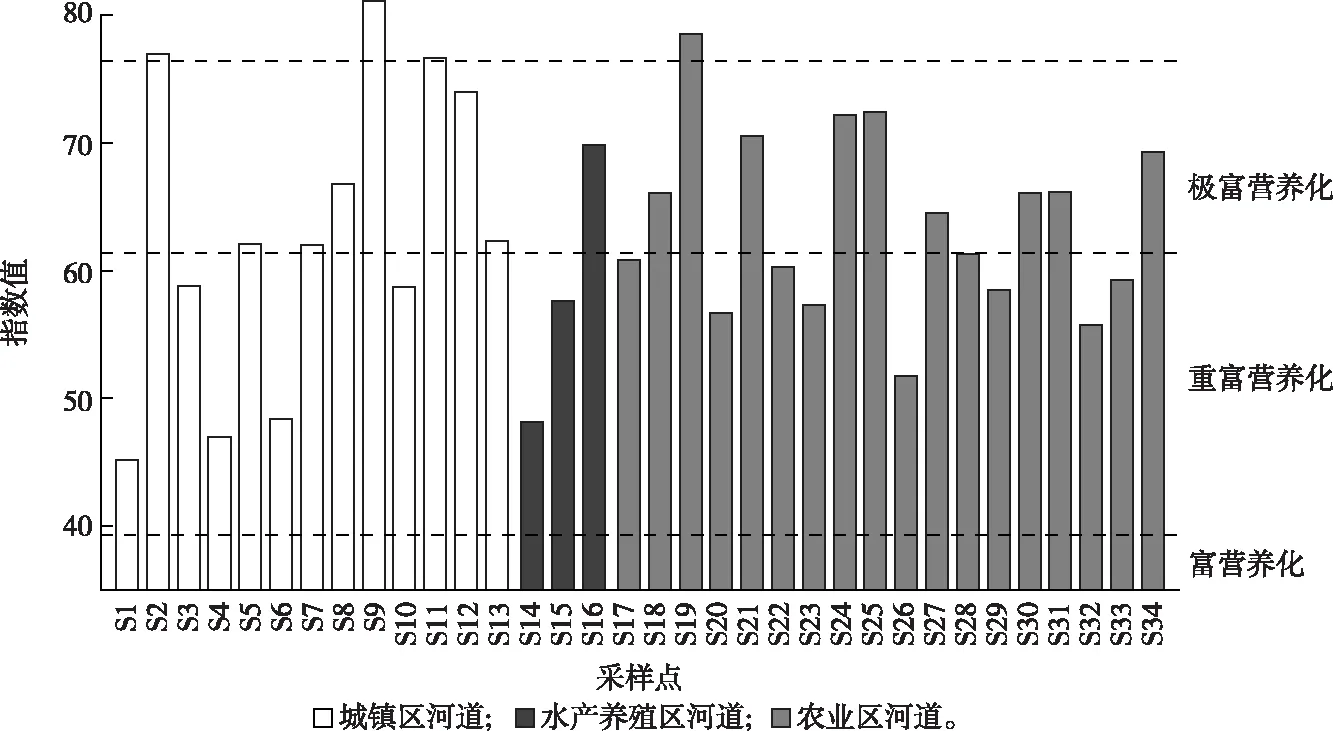
图2 营养状态评价(E)指数Fig.2 Evaluation results of nutritional status
太湖西山岛河网pH平均值为6.41,整体为弱酸性。各类型河道水体ORP和DO浓度差别不大,平均值分别为210.24 mV和4.94 mg·L-1。其他环境因子在不同类型的河道中存在一定的差异。农业区河道水体EC、TDS、CODCr和Chl-a浓度整体较低,但氮、磷营养物浓度较高;水产养殖区河道与之呈现相反的规律,水体EC、TDS、CODCr整体较高,氮、磷营养物浓度较低;城镇区河道水体介于两者之间,但水体中TDS、NH4+-N和Chl-a浓度整体高于前2类河道水体。根据GB 1318—2002《地表水环境质量标准》和综合营养评价结果,河网水质总体评价为劣Ⅴ类,均处于富营养状态。
2.2 浮游植物群落特征
2.2.1浮游植物物种组成与优势种
调查共鉴定出浮游植物68种,隶属于6门56属。绿藻种类最多,有27种,占总种数的39.71%;其次是硅藻,有21种,占30.88%;蓝藻9种,占13.24%;甲藻和裸藻种类较少,分别为3种和4种。就河道类型而言,城镇区河道共鉴定出35种,平均种类数最多;水产养殖区和农业区河道各27种,平均种类数较接近且较少(图3和表2)。各地区优势种整体相似(表3),微囊藻(Microcystissp.)占据绝对优势,全区优势度为0.55,各地区优势度也在0.5以上。
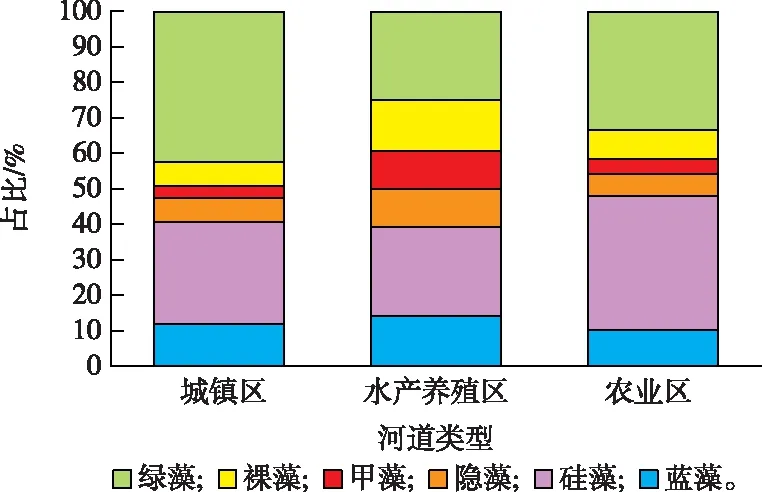
图3 各类型河道浮游植物种类占比Fig.3 Ratio of phytoplankton species in different types of waterway
2.2.2浮游植物密度与生物量
河网中浮游植物密度变化范围为1.59×105~1.37×107L-1,均值为1.32×106L-1,其中城镇区样点S8密度最高,为1.37×107L-1。城镇区样点密度与农业区样点密度之间差异性显著(P<0.05)。浮游植物密度呈现城镇区河道>农业区河道>水产养殖区河道的规律(图4~5)。其中,城镇区样点平均密度最高,为2.46×106L-1,是水产养殖区(4.54×106L-1)的5.42倍。蓝藻密度在各类型河道中均占比最高,占总藻密度的71.10%,其次是绿藻门(14.48%)。
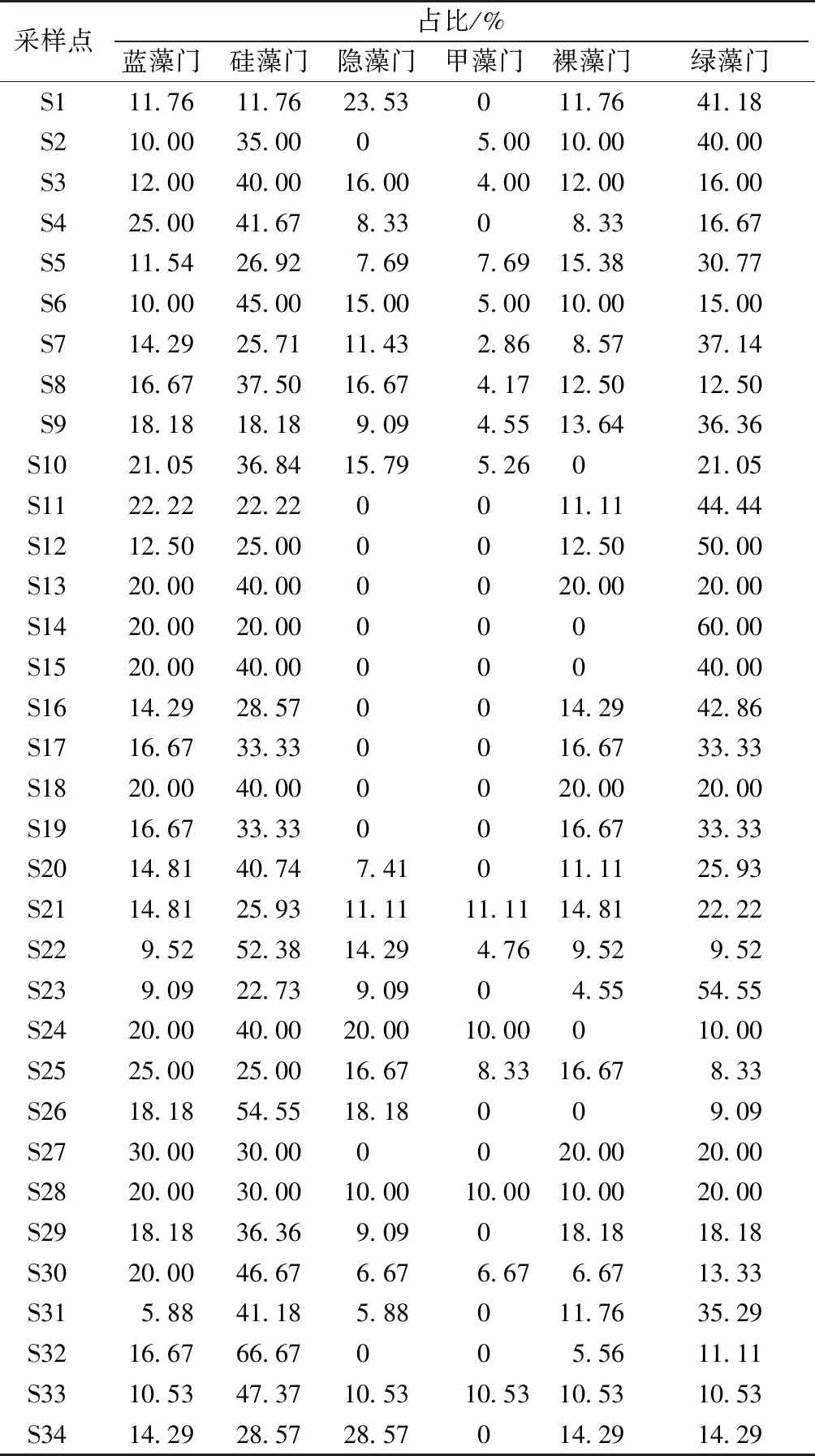
表2 各采样点浮游植物种类比例
浮游植物生物量变化范围为0.02~5.20 mg·L-1,平均值为0.72 mg·L-1。城镇区样点S1和S2的生物量最高,均超过4.50 mg·L-1。其次为S7和S8,均在2.50 mg·L-1左右,其他采样点(除S5外)生物量均不超过1 mg·L-1。各类型河道中浮游植物生物量具有显著的空间差异(P<0.05)。浮游植物生物量呈现城镇区河道>水产养殖区河道>农业区河道的空间分布特征。硅藻门生物量在城镇区河道和农业区河道占比最高,分别为34.22%和49.69%;裸藻门生物量在水产养殖区河道占比最高(21.86%);绿藻门生物量在城镇区河道也有较高的占比(26.43%)。
从密度数据来看,城镇区样点平均密度最高,以蓝藻门为主;从生物量数据来看,城镇区样点平均生物量也最高,其中硅藻门和绿藻门占优。
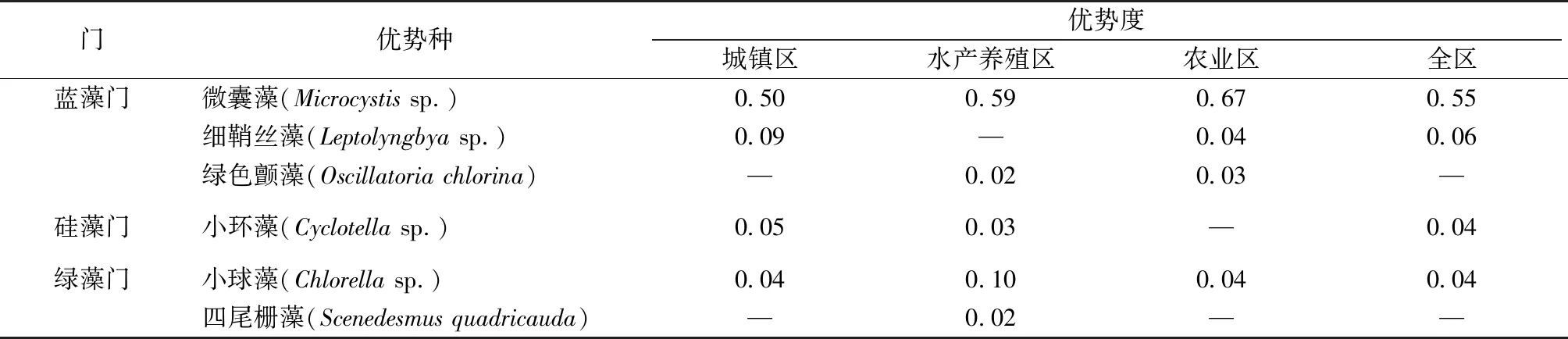
表3 各类型河道浮游植物优势种及优势度
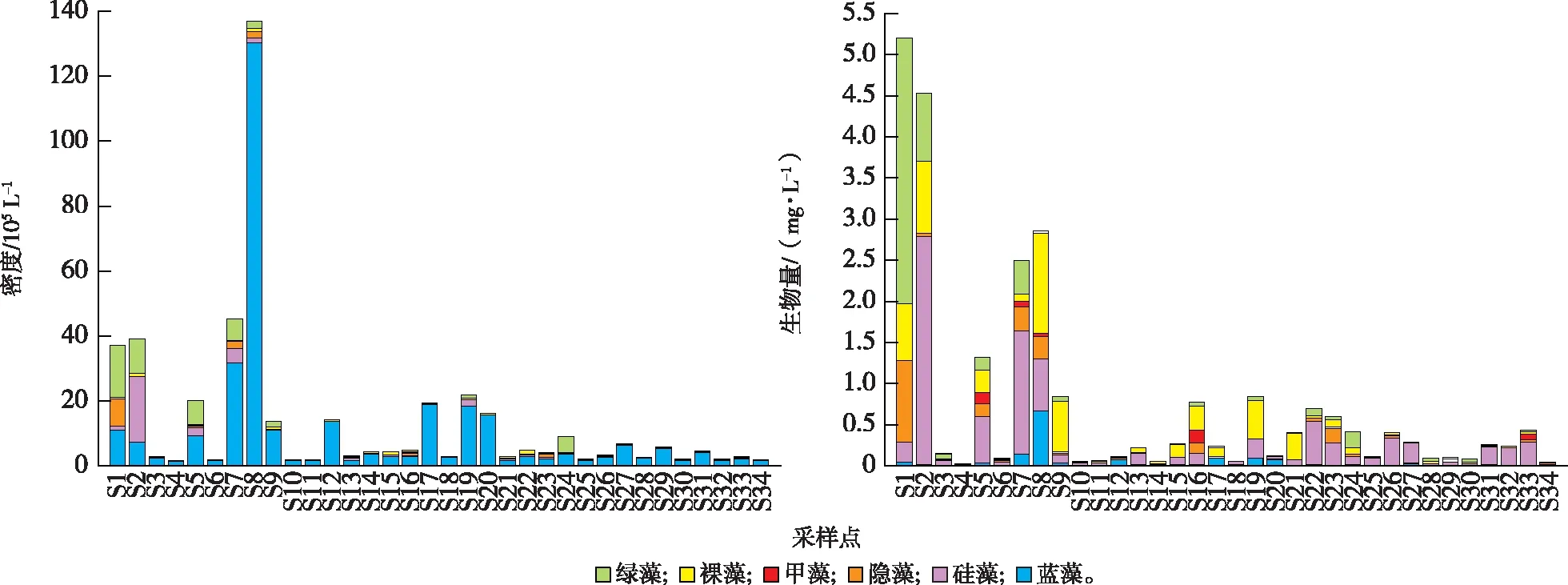
图4 各采样点浮游植物密度与生物量Fig.4 Density and biomass of phytoplankton at different sampling points
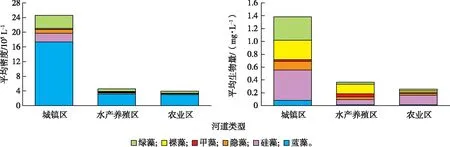
图5 各类型河道浮游植物平均密度与生物量Fig.5 Average density and biomass of phytoplankton in different types of waterway
2.2.3浮游植物多样性指数
河网各河道的浮游植物多样性指数如图6所示,Shannon-Wiener指数(H′)变化范围在0.15~2.39之间,均值为1.28。最大值出现在水产养殖区样点S16,最小值在农业区样点S17。Margalef丰富度(D)指数变化趋势与H′较为一致,变化范围在0.28~2.22之间,均值为1.05,最大值出现在城镇区样点S7,最小值在城镇区样点S12。均匀度指数(J)各点位的变化幅度较小,均值为0.48,最大值出现在农业区样点S21为0.79,最小值出现在农业区样点S17,为0.07。整体而言,城镇区河道H′、D和J指数较高,农业区河道最低。
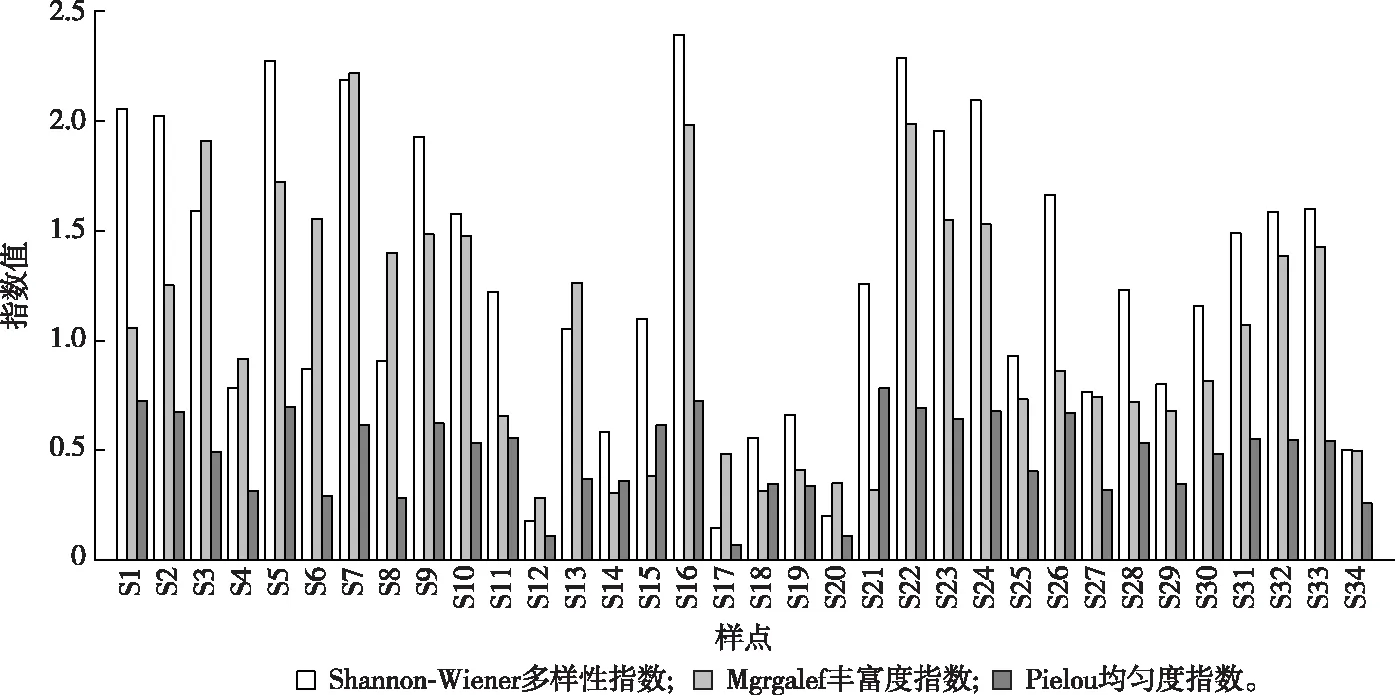
图6 各采样点浮游植物多样性指数、均匀度指数和丰富度指数Fig.6 Diversity index, evenness index and richness index of phytoplankton at different sampling points
2.3 浮游动物群落特征
2.3.1浮游动物物种组成与优势种
调查共鉴定出浮游动物30种,其中轮虫23种,占总物种数的76.67%;枝角类4种,占13.33%;桡足类3种,占10%。从不同河道类型来看,水产养殖区河道共鉴定出18种,种类数最少;城镇区和农业区河道分别为25和26种,种类数较多(图7、表4~5)。优势种在城镇区和农业区河道以轮虫、桡足类为主,在水产养殖区河道以轮虫类为主(表5)。
2.3.2浮游动物密度和生物量
浮游动物密度变化范围在0.53~521.33 L-1之间,均值为113.93 L-1,其中城镇区样点S8密度最高,农业区样点S31密度最低(图8)。水产养殖区与农业区样点密度之间具有显著的差异性(P<0.05)。浮游动物密度和物种组成呈现水产养殖区河道>城镇区河道>农业区河道的规律(图9)。轮虫密度在城镇区(58.28%)和水产养殖区(63.14%)河道占据优势,桡足类在农业区河道占比最高(52.57%)。
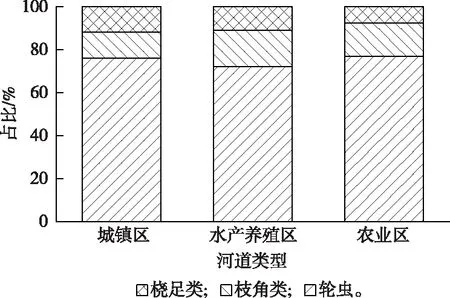
图7 各类型河道浮游动物种类比例Fig.7 Ratio of zooplankton species in different types of waterway
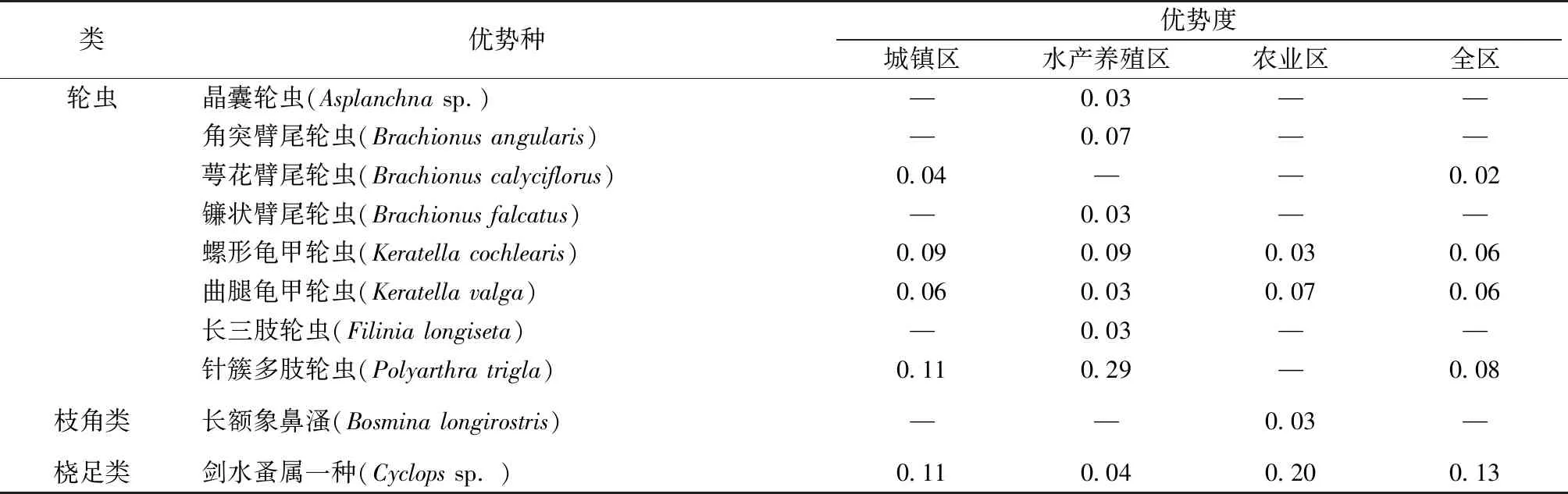
表4 各类型河道浮游动物优势种及优势度
浮游动物生物量变化范围在6.00×10-5~5.64 L-1之间,平均值为0.87 mg·L-1,最大值出现在农业区样点S20,最小值出现在样点S32,其他有25个点位的生物量小于1 mg·L-1。浮游动物生物量呈现农业区河道>水产养殖区河道>城镇区河道的规律,桡足类是各类型河道生物量的主要贡献者。
从密度数据来看,水产养殖区样点平均密度最高,以桡足类为主;从生物量数据来看,农业区样点平均生物量最高,同样桡足类占优。
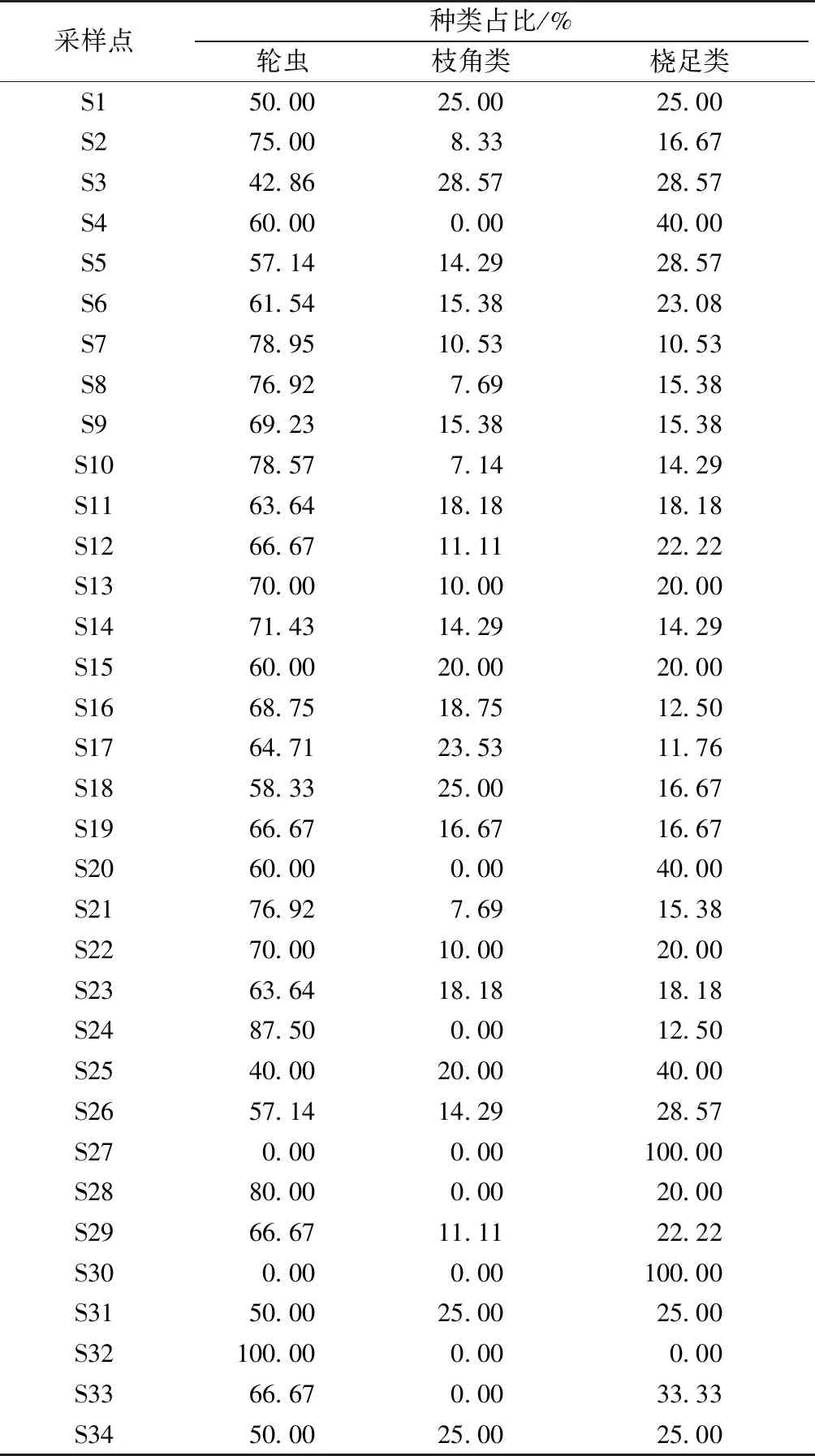
表5 各采样点浮游动物种类比例
2.3.3浮游动物多样性指数
河网各河道的浮游动物多样性指数如图10所示。Shannon-Wiener指数(H′)均值为1.32,城镇区样点S7的H′指数最高,为2.23。由于农业区样点S28和S31仅检出1种无节幼体,导致其H′指数为0。Margalef丰富度指数(D)均值为2.40;农业区样点S32最高,达15.49,这主要是由于该点位的总密度较低引起的。最低值同样出现在农业区样点S28和S31(0)。与浮游植物类似,浮游动物的均匀度变化幅度也较小,均值为0.61,最大值出现在城镇区样点S4,为0.84,最小值出现在S28和S31(0)。总体而言,水产养殖区样点H′和J指数较高,城镇区样点其次,农业区样点最低。D指数农业区样点最高,水产养殖区样点次之,城镇区样点最低。
2.4 浮游生物密度与环境因子的关系
浮游植物RDA分析结果(图11、表6)显示,前2轴可以解释总方差的50.17%,轴1和轴2的特征根分别为0.056和0.028,解释率分别占总解释率的48.95%和23.96%。
采用蒙特卡洛置换检验评估环境因子与物种群落组成相关的显著性,结果表明水温、ORP、CODCr、Chl-a浓度与轴1呈正相关,DO浓度、TN浓度、NH4+-N浓度、TP浓度和pH值与轴1呈负相关(表7)。水温和Chl-a浓度与轴2呈正相关,其余环境因子呈负相关。浮游植物群落结构的变化与ORP、CODCr、TN浓度、Chl-a浓度和NH4+-N浓度显著相关(P<0.05)。
将浮游植物密度(PHY)作为生物因子,与环境因子一起对浮游动物群落进行RDA分析,结果显示,前2轴可以解释总方差的32.85%,轴1和轴2的特征根分别为0.038和0.036,解释率分别占总解释率的29.50%和27.16%(图12、表8)。蒙特卡洛置换检验结果(表9)表明,ORP、CODCr、TN浓度和TP浓度与轴1呈正相关,其他环境因子与轴1呈负相关。ORP、TN浓度、NH4+-N浓度、Chl-a浓度和TP浓度与轴2呈正相关,其余环境因子与其呈负相关。浮游动物群落结构的变化与水温、Chl-a浓度、NH4+-N浓度和pH值4种环境因子显著相关(P<0.05),与浮游植物密度变化极显著相关(P<0.01)。从图12可以看出,农业区河道和水产养殖区河道聚集于第1、2象限,TP浓度、TN浓度和NH4+-N浓度是影响其水体浮游动物分布的主要环境因子;城镇河道聚集于第3、4象限,WT、CODCr和pH值是其主要的影响因子。
3 讨论
3.1 浮游植物和浮游动物群落特征分析
西山岛河网秋季浮游植物种类组成主要以绿藻、硅藻、蓝藻为主,与汾河太原河段[16]和苏州河[17]等富营养化河流结果相似,符合富营养化水体的特征[18]。浮游植物各门类在不同类型的河道中所占比例相似,但种类数存在差异。城镇区和农业区河道种类数较多,水产养殖区种类数较少。
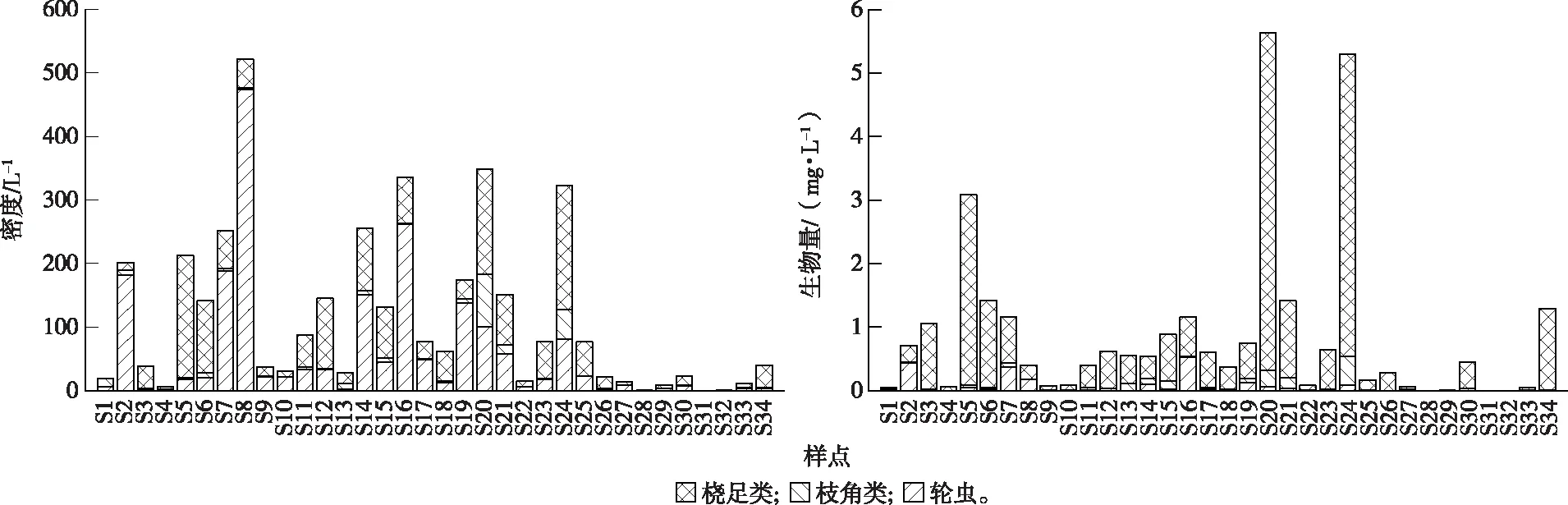
图8 各采样点浮游动物密度与生物量Fig.8 Density and biomass of zooplankton at different sampling points
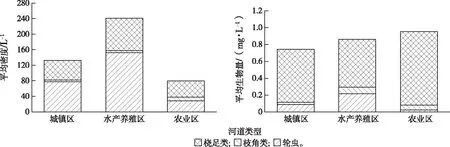
图9 各类型河道浮游动物平均密度与生物量Fig.9 Average density and biomass of zooplankton in different types of waterway
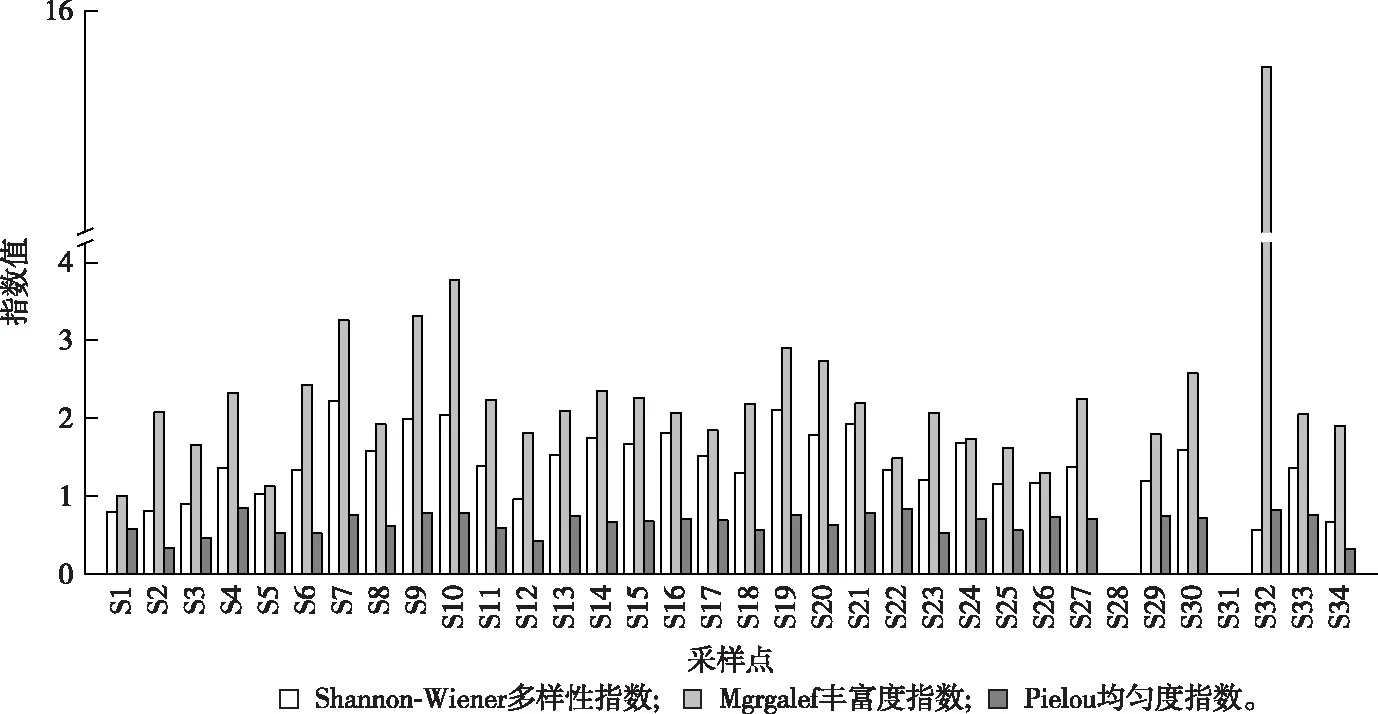
图10 各采样点浮游动物多样性指数、均匀度指数和丰富度指数Fig.10 Diversity index, evenness index and richness index of zooplankton at different sampling points
浮游植物密度主要由蓝藻、绿藻和硅藻贡献,河网浮游植物密度整体差异性不显著(P>0.05)。这是因为西山岛河网主要受农业或城市化活动的影响,污染源类型较简单。此外河网河道均与太湖相通,水系连通性较高,造成整体空间异质性较低[19]。但城镇区河道与农业区河道之间浮游植物密度具有显著差异(P<0.05)。
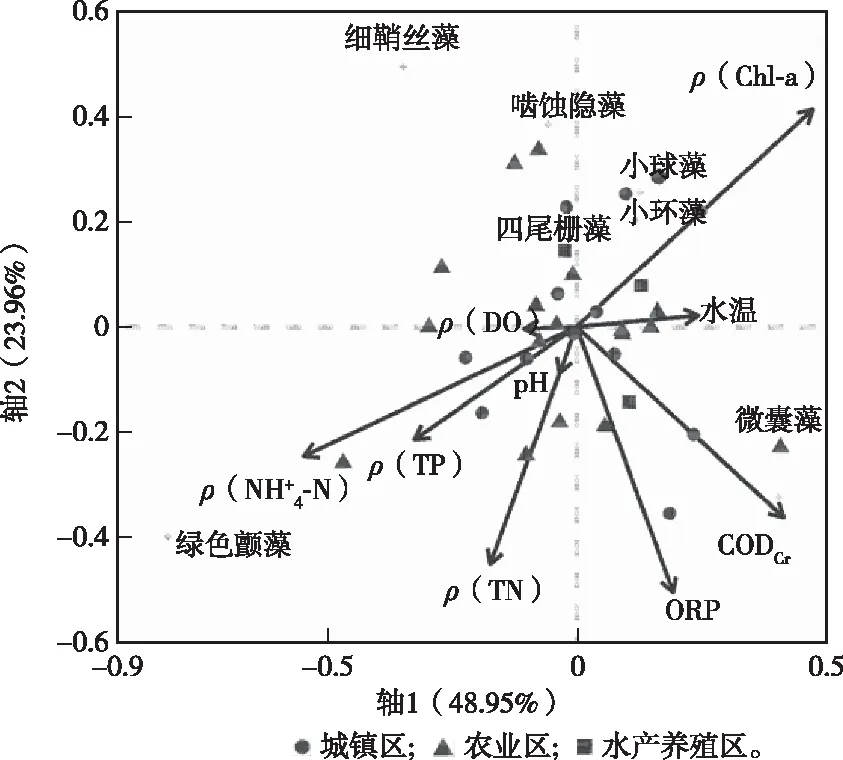
图11 浮游植物群落结构与环境因子RDA排序Fig.11 RDA sorting diagram of phytoplankton and environmental factors
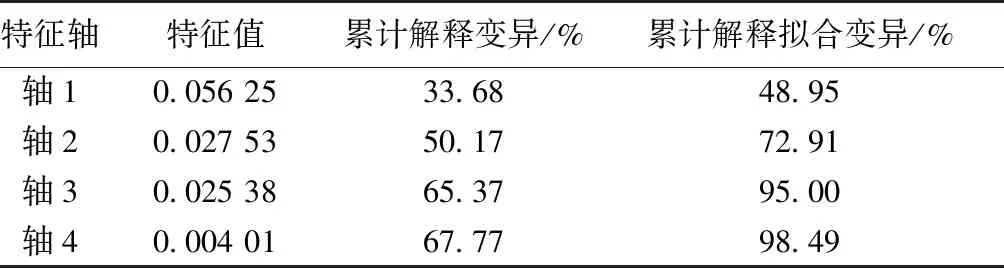
表6 浮游植物与环境因子RDA分析结果
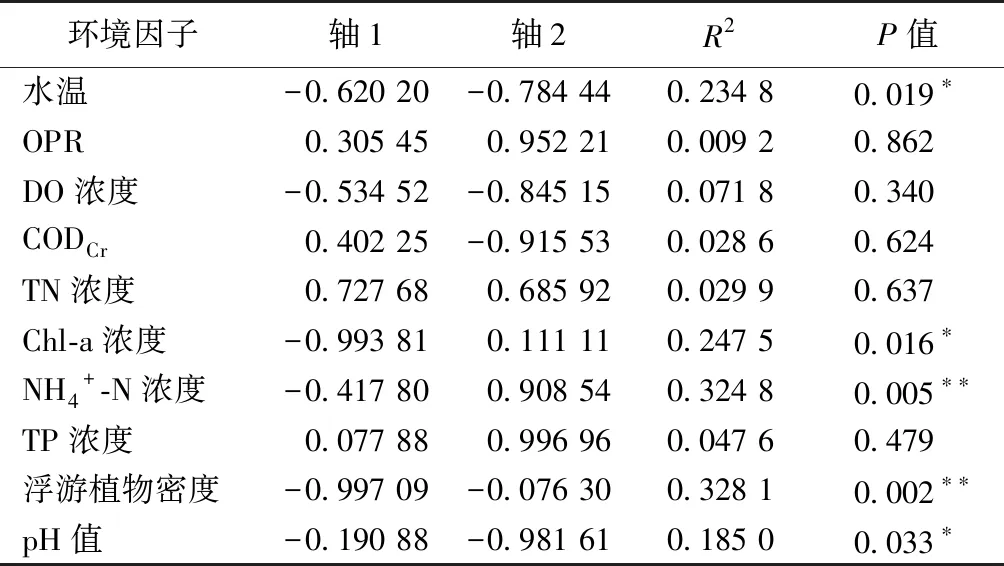
表7 浮游植物群落组成与环境因子的蒙特卡洛置换检验结果
具体来看,城镇区河道平均密度最高,蓝藻、绿藻和硅藻占优,主要优势种为微囊藻、细鞘丝藻、小环藻和小球藻,这与城镇区河道(流经金庭镇镇区)河流污染较为严重,水体富营养化程度高,造成蓝藻、绿藻等大量繁殖[20]相吻合。此外,城镇区河道整体较长,流速较快,适宜硅藻生长[21]。农业区河道平均密度其次,蓝藻和绿藻占优,主要优势种为微囊藻、细鞘丝藻、绿色颤藻和小球藻。这是因为农业区河道较短和窄,部分存在断头浜的现象,水体交换能力差,富营养化程度较高,利于蓝藻、绿藻中耐污种的大量繁殖[22]。水产养殖区河道平均密度最低,蓝藻、绿藻和硅藻占优,优势种类型较多,主要优势种为微囊藻、绿色颤藻、小环藻、小球藻和四尾栅藻。蓝藻门的微囊藻在秋季河网中占据绝对优势地位,是农村河道、湖库水华常见的藻类,多出现于营养水平较高的水体中[23]。同时,微囊藻会在水体中产生微囊藻毒素[24],严重影响水生系统的安全,对灌溉和娱乐用水造成威胁。因此,政府有关部门应加强河道浮游植物群落的监控。

图12 浮游动物群落结构与环境因子RDA排序Fig.12 RDA sorting diagram of zooplankton and environmental factors
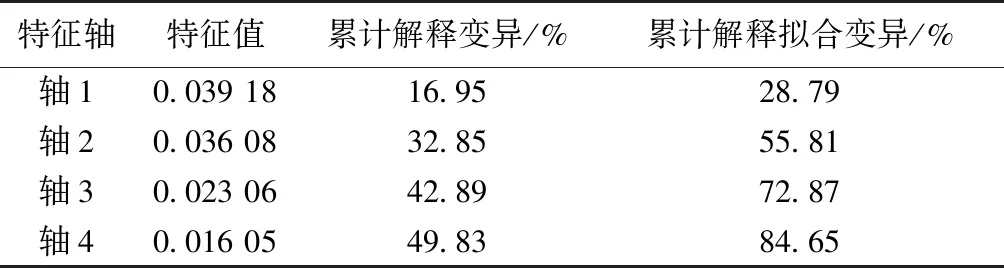
表8 浮游动物与环境因子RDA分析结果
西山岛河网浮游动物种类组成主要以轮虫为主,与大清河[25]、渭河[26]和灞河[27]等城市河流的浮游动物种类组成特征相符。轮虫具有个体小、周期短、发育快等特点,能快速适应水体中理化环境的改变和水文条件的变化,因此在河湖生境中轮虫常居优势地位[28]。从河道类型上来看,水产养殖区河道种类数量明显高于城镇区和农业区河道,优势种种类较多,群落结构相对稳定。这可能与周边蟹塘养殖有关。养殖过程中鱼、蟹未能摄食的饵料分解产生有机碎屑,为浮游动物提供了良好的食物来源,利于其生长[29]。
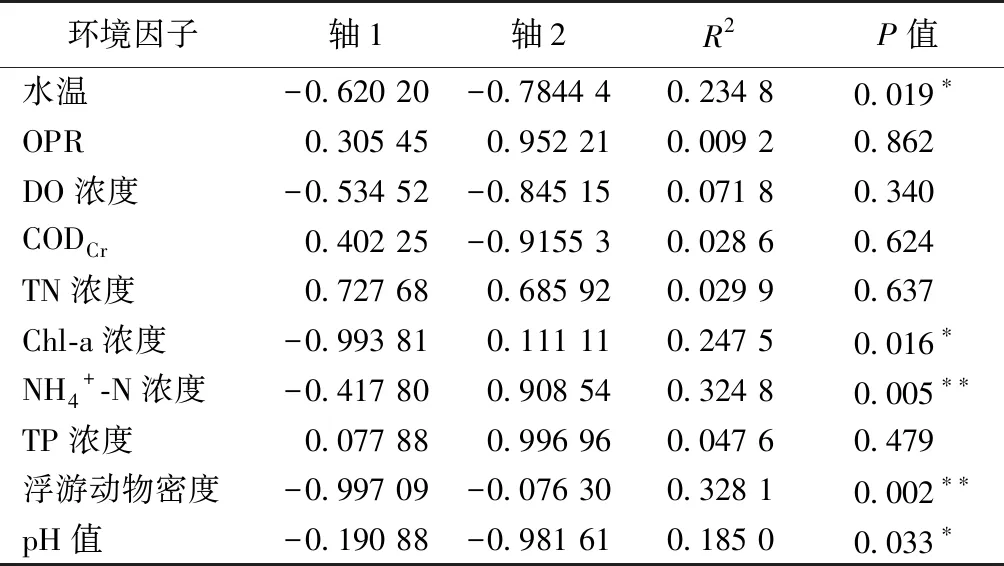
表9 浮游动物群落组成与环境因子的蒙特卡洛置换检验结果
在河网浮游动物密度组成上,轮虫和桡足类的总密度较高,以无节桡足幼体和轮虫等小型浮游动物为主,臂尾轮属和龟甲轮属等广温性物种[30]检出较多,枝角类检出的种类少且密度低,这可能与西山岛河网秋季水温有关。水温被认为是影响浮游动物生长发育和物种组成的重要因子,也是影响浮游动物空间分布的重要因素[31-32]。黄祥飞等[33]对武汉东湖轮虫长期的调查研究表明,轮虫总数的高峰一般出现在20 ℃以上的水温中。当水温超过20 ℃后,溞属的数量通常较低[34]。秋季西山岛河网水温均在20 ℃以上,较高的水温一定程度上影响了浮游动物群落结构。从河道类型上来看,水产养殖区样点密度与农业区样点密度之间具有显著的差异性(P<0.05)。水产养殖区样点的平均密度高于其他2类河道,臂尾轮虫属、龟甲轮虫属和多肢轮虫属等富营养水体指示物种占据该地区的优势地位[35-36]。农业区样点则以象鼻溞属和剑水蚤属等占据优势地位。这是因为受到养殖鱼类的影响,个体较大的浮游动物通常会被优先捕食,因而水产养殖区的种类数量和密度都以小型浮游动物占优,造成空间分布上的差异。
3.2 浮游植物和浮游动物群落影响因素分析
浮游植物优势种与环境因子的冗余分析(RDA)结果表明,ORP、CODCr、TN浓度和NH4+-N浓度是主要影响西山岛河网浮游植物分布的环境因子。其中,CODCr和氮浓度对浮游植物有显著影响,并与蓝藻门呈正相关关系。这可能是因为CODCr在一定程度上可反映水体中的有机质含量[37],而有机质和营养盐是浮游植物生长繁殖的物质基础,其浓度影响着浮游植物的密度和生物量[38],也会影响浮游植物群落结构。此外在合适的浓度范围内,氮营养盐能促进浮游植物密度的增加[39],藻类也会优先利用NH4+-N。NH4+-N浓度越高,越有利于蓝藻门的生长[40]。
水温、pH值、Chl-a浓度和NH4+-N浓度是影响浮游动物分布的主要环境因子,浮游植物密度也显著影响浮游动物群落结构,表明其受非生物因子和生物因子共同作用。RDA分析结果显示,曲腿龟甲轮虫、方形臂尾轮虫、长三肢轮虫、长额象鼻溞等多数优势种与水温呈正相关关系,浮游动物密度和生物量与水温呈显著正相关性(P<0.05),这与上节中秋季西山岛河网水温适宜轮虫生长的分析结论一致。水体pH值同样也具有密切影响,不同的浮游动物其适宜生长的pH值不同,造成物种组成差异。西山岛河网水体pH值范围在5.5~7.0之间,属弱酸性水体,轮虫种类较多,生物量小于桡足类。这可能是因为轮虫在酸性水体中分布时呈现种类多数量少的规律[41]。
浮游动物主要以浮游植物为食物来源,水体中浮游动物的生长发育与浮游植物的密度密切相关[42]。营养盐通过影响水中浮游植物的生长进而间接影响浮游动物[43]。此外,Chl-a浓度是表征浮游植物生物量的重要指标,因此Chl-a浓度与浮游动物物种组成也有密切关系。轮虫与Chl-a浓度呈正相关,桡足类与Chl-a浓度呈负相关,这可能是因为蓝藻大量爆发对浮游动物的生长发育、摄食产生较大影响,如微囊藻分泌的毒素会对大型浮游动物产生毒害作用,致使水体浮游动物小型化[44]。
除了上述环境因子的影响以外,浮游生物群落结构还可能受到河网自身水动力因素的影响。西山岛河网与太湖水系连通性较高,夏秋季容易受到太湖湖水涨漫倒灌的影响。研究表明,秋季太湖湖区浮游植物群落主要包括蓝藻门、绿藻门、硅藻门和隐藻门[45],优势种以蓝藻门的微囊藻属为主[9,42];浮游动物优势种以臂尾轮虫属、多肢轮虫属和剑水蚤属[8,46]为主,这与秋季西山岛河网浮游生物群落的结构特征相近,因此太湖回水倒灌也可能是西山岛浮游生物群落结构形成的影响因素。
4 结论
秋季西山岛河网34个采样点共鉴定出浮游植物6门56属68种,浮游动物3类18属30种。河网中绿藻种类最多,有27种,占39.71%,硅藻21种,占30.88%,蓝藻、裸藻和甲藻分别为9种、4种和3种。浮游植物平均密度为1.32×106L-1,蓝藻占据绝对优势,浮游植物密度呈现城镇区河道>农业区河道>水产养殖区河道的规律。ORP、CODCr、TN浓度和NH4+-N浓度是影响浮游植物群落结构的主要因子。浮游动物中轮虫种类最多,达23种,占76.67%,枝角类4种占13.33%,桡足类占10%。浮游动物平均密度为113.93 L-1,浮游动物密度呈现水产养殖区河道>城镇区河道>农业区河道的规律。水温、pH值、Chl-a浓度、浮游动物密度和NH4+-N浓度是引起浮游动物群落变化的主要因子。
——以莲花县为例

