氧气浓度对小麦-玉米轮作农田土壤剖面N2和N2O产生的影响
高永欣,潘占磊,王睿,王琳,姚志生,郑循华,梅宝玲,张翀,巨晓棠
(1.内蒙古大学生态与环境学院,呼和浩特 010021;2.中国科学院大气物理研究所大气边界层物理和大气化学国家重点实验室,北京 100029;3.中国科学院大学地球与行星科学学院,北京 100049;4.海南大学热带作物学院,海口 570228)
华北集约化管理农田因氮肥施用量高,导致土壤剖面累积了大量的硝态氮(-N)。据报道,华北玉麦轮作农田0~1 m土体-N累积量高达900 kg·hm-2[1];Meta分析结果也表明,华北夏玉米收获后0~4 m 土体-N 累积量达749 kg·hm-2[2-3]。累积的-N 可通过淋溶进入地下水,导致华北平原浅层地下水-N超标率高达14%(世界卫生组织饮用水标准为10 mg·L-1)[4],而山东设施蔬菜种植区的地下水-N超标率高达100%[5],严重危胁到饮用水安全。
反硝化作用是微生物在无氧或微氧条件下,利用可溶性有机碳(DOC)底物氧化提供的电子和能量,以硝酸盐作为呼吸的电子受体,将其逐步还原成亚硝酸盐、一氧化氮(NO)、氧化亚氮(N2O)和氮气(N2)的过程[6]。该过程是土壤剖面-N 去除的重要途径,亦是维持生态系统氮平衡的重要过程[7-8];其中间产物N2O 是重要的温室气体,也是破坏平流层臭氧的主要组分[9]。深入理解土壤N2O 还原为N2的过程,对制定合理的N2O 减排措施至关重要[10]。但由于大气背景N2浓度高和反硝化速率时空变异性较大[11],导致对大部分农田土壤的反硝化N2损失研究不足,尤其缺乏对土壤剖面N2损失速率的定量[12-14]。
关于土壤剖面反硝化N2损失速率的定量,大多是基于完全厌氧条件下的测定[12,14]。如Chen 等[15]观测到华北玉米-小麦轮作农田剖面土壤N2的反硝化潜势(无氧,-N添加量为50 mg·kg-1,以N计)约为208 μg·h-1·kg-1(0~0.2 m)和42 μg·h-1·kg-1(0.5~1.0 m),该N2排放速率显著高于Wang等[16]在有氧条件下观测的玉米季土壤N2排放峰值(约10 μg·h-1·kg-1)。N2O还原酶促进N2O还原为N2,其活性比反硝化级联反应中的其他酶更容易被O2抑制,因此,O2会导致高的N2O/(N2O+N2)值[17]。而与有氧条件相比,完全厌氧下的观测可能会导致对土壤N2排放的高估和对N2O/(N2O+N2)值的低估,进而影响对N2排放速率的准确定量。土壤O2浓度在田间原位观测中很少被测定[18],对剖面不同深度土壤O2浓度的变化特征认知较缺乏。因此,本研究以华北集约化小麦-玉米轮作农田土壤为研究对象,基于田间原位观测的土壤O2浓度变化,设置不同的O2浓度,采用氦环境培养-直接测定N2法(GFSC 法),对剖面不同深度的土壤N2O 和N2产生速率进行定量,以期了解土壤剖面N2O和N2产生速率和N2O/(N2O+N2)值的变化特征,明确土壤剖面O2浓度变化规律,及其对不同深度土壤N2产生和N2O/(N2O+N2)值变化的影响,为估算土壤剖面反硝化N2损失量提供科学依据。
1 材料与方法
1.1 试验点概况
本研究依托不同碳氮管理的冬小麦-夏玉米轮作田间长期定位试验(始于2006 年)[18]。试验点位于中国农业大学上庄试验站(39°48′N,116°28′E)。该地区气候类型为典型的大陆性季风气候,年均气温为12.5 ℃,年均降水量为500~700 mm,其中60%~70%的降雨集中在夏季(7—9 月)。土壤类型为石灰性潮土,质地为粉砂质黏壤土(美国制),其中黏粒含量为28%、粉粒含量为32%、砂粒含量为40%;SOC 含量为7.1 g·kg-1;TN 含量为0.8 g·kg-1;土壤容重为1.40 g·cm-3;pH为8.1[19]。
选择农民传统施肥处理(Ncon)为研究对象,其管理方式:整个玉米-小麦轮作季N 素(尿素)施用量为560 kg·hm-2。其中夏玉米季于玉米四叶期和十叶期分别施用130 kg·hm-2,施用方式为开沟条施,施用深度为5 cm;冬小麦季施用基肥和返青-拔节肥,均为150 kg·hm-2,施用方式均为撒施,基肥随翻耕(0~20 cm)施入农田,追肥随灌溉施入农田。磷、钾肥只施用一次,在每季作物第一次施肥时,随氮肥一起施用,施用量为P2O5100 kg·hm-2和K2O 100 kg·hm-2。锌肥只在玉米季的四叶期随氮肥一起施用,为30 kg·hm-2(ZnSO4)。作物秸秆收获后不还田。冬小麦于每年10 月初播种,次年6 月中旬收获后播种夏玉米,夏玉米于10月初收获。
1.2 土壤样品采集
供试土壤取自传统施肥处理,采集时间为2021年3 月底,即小麦季返青拔节前。该处理设3 个重复小区,每个小区面积64 m2(8 m×8 m)。在每个小区内随机选择3 个采样点(3 个重复小区共9 个采样点),进行0~2.5 m 剖面原状土柱的采集。在每一个采样点采用原位取土钻(美国犀牛,S1 单人手持土壤取样机),对土壤剖面进行连续、分层(0~1.0、1.0~2.0 m 和2.0~2.5 m)采集。该土钻为双层采样管设计,外层为带刀口的不锈钢管,可连续打入土壤3 m 深,以保证在一个点位对样品的连续采集,不会因分层取样时,上次洞壁掉落的土壤样品污染下层样品。内层为PVC 管(内径3.8 cm,即采集的原状土柱直径),实现对剖面3 层土柱依次采集,以减少对土壤的压实。采样后用保护区的土壤回填孔穴并压实。
将采集后的剖面土柱样品两端密封,以减少O2接触和水分散失,土样当天带回实验室,4 ℃低温保存直到试验开始。
1.3 试验方案
样品前处理:从采集的土柱剖面样品中选择3 个目标深度的土层,分别为0~0.2、0.5~0.7 m 和2.0~2.2 m(图1 中大括号所示),每次对同一个土层深度的样品进行气体产生速率(N2和N2O,1.4 节)和碳氮底物含量的测定,共测3次。具体操作:每次选择一个目标深度的土层进行切割,切割长度为20 cm,每次样品切割完,其余样品仍放回冷藏箱低温保存。对切割后的每一个土层深度样品做二次切割,即将一个20 cm 高的样品分割为3个4 cm 高的小土柱(图1 灰色部分)和4 个2 cm 高的小土柱(图1白色部分)。因为每个重复小区内设有3个采样点,在每个采样点采集的土柱做同样切割处理,所以3 个采样点的样品共切割出9 个4 cm 高的小土柱,将其置于氦培养-气体直接测定系统(GFSC 系统)的一个培养罐(GFSC 系统共有3 个培养罐,每一个罐子对应装入一个重复小区的样品),用于N2和N2O 产生速率的测定。与此同时,每重复小区的3 个采样点的样品共切割出12 个2 cm 高的小土柱,将其混合均匀后,用于土壤初始碳氮底物含量的测定。
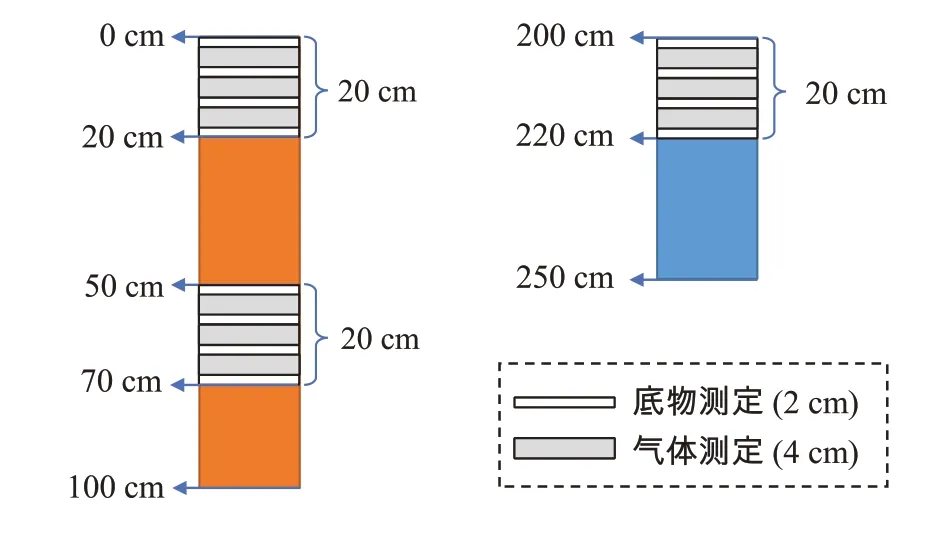
图1 土壤剖面样品(0~1.0 m和2.0~2.5 m)的分割示意图Figure 1 Segmentation diagram of collected intact soil samples in profile(0-1.0 m and 2.0-2.5 m)
气体排放速率测定的培养条件设置(表1,P3测定阶段):培养土壤O2浓度和温度的设定依据为玉米生长季(2017 年6 月15 日—10 月1 日)田间原位观测的不同深度(0.1、1.0 m 和2.0 m)土壤剖面O2浓度和温度数据(2.1 节)。本试验设置3 个不同土壤O2浓度水平:0(反映反硝化气体产生速率潜势[13])、15.0%(依据原位不同深度观测的平均值)和2.5%(0.2 m 和0.5 m深土层原位观测的极小值)或12.0%(比2.0 m 深土层原位观测的极小值低14%,为了与15.0% O2水平区分,而假设12.0%是原位可能出现的最低浓度)。培养温度设定接近土壤不同深度原位观测的平均值:0.2 m 和0.5 m 为26 ℃,2.0 m 为20 ℃。土壤湿度的设定依据利于反硝化发生的湿度条件,浅层土壤(0.2 m和0.5 m)补充水分后湿度为68%~72%WFPS(土壤充水孔隙度),深层土壤(2.0 m)不调节湿度,为83%WFPS。每次试验针对同一个土层深度的样品,分别在上述3个O2浓度水平下进行气体产生速率的测定。
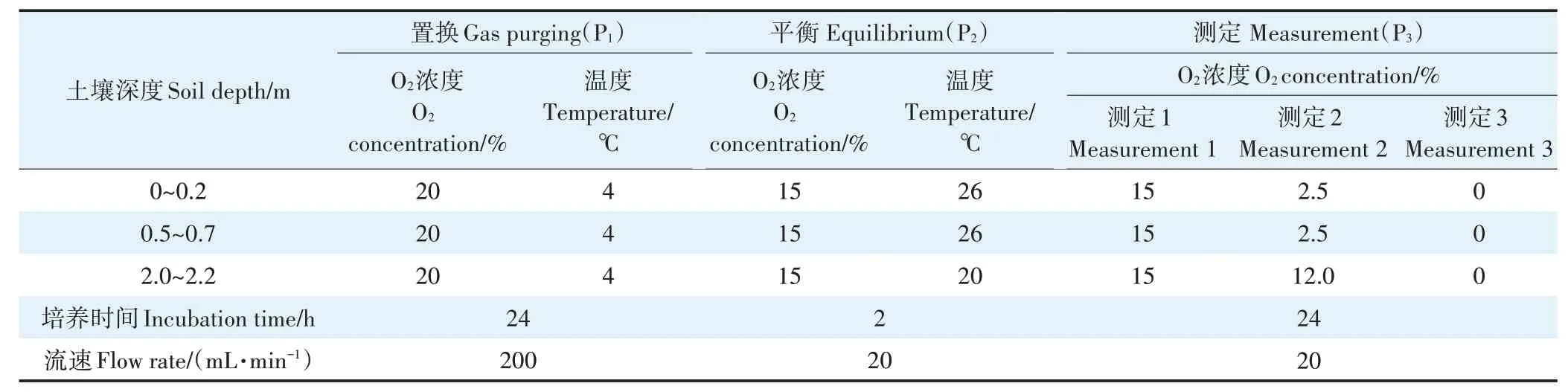
表1 土壤剖面样品培养条件的设置Table 1 Setup of soil incubation conditions
1.4 土壤N2和N2O产生速率的测定
气体产生速率的测定采用GFSC 系统[20-21],其原理是用高纯氦气(He)和20%的氧气(O2)置换土柱内的气体,使土壤空气全部被He 和O2所取代,然后以一定时间间隔测定培养容器内N2和N2O 浓度的变化来确定其排放速率。GFSC 系统可实现对气体置换、平衡和气体样品的自动在线采集和分析(表1);可将培养罐内的气体样品自动注入两台气相色谱仪,一台配有微池热导检测器(micro GC 3000,安捷伦,美国加州)用于分析N2浓度,另一台配有电子捕获检测器(GC 6820,安捷伦,中国上海)用于分析N2O 浓度。系统详细介绍参见Wang 等[20]和曹娜等[21]的研究。
试验采用三阶段培养法,即在测定气体产生速率(P3)之前,需进行低温有氧置换(P1)及调整温度和O2浓度的平衡(P2)。P1阶段:采用氦氧混合气(80%He和20%O2)在低温(4 ℃)条件下进行气体置换21~24 h,置换气流速200 mL·min-1,低温利于保存底物,有氧利于保存底物。P2阶段:切换培养O2浓度为15%,采用氦氧混合气(15% O2)以20 mL·min-1流速吹扫培养罐的顶部空间约2 h 后,将培养温度升高至设定温度,保持约2 h。P3阶段:开始气体产生速率的测定,测定时间为24 h(测定1);改变两次培养O2浓度(测定2 和测定3),每个O2浓度条件下均测定24 h。每次速率测定时间为3 h 或6 h,即24 h 共测定8或4 次气体产生速率。每次气体产生速率的测定均基于自动采集5 次培养罐气室内的N2和N2O 的浓度,计算公式如下:
式中:F为N2和N2O 的产生速率(以N 计),μg·h-1·kg-1;Vh为培养罐气室体积,mL;M为每摩尔被测气体的N 质量,g·mol-1;ΔCi/Δt为经过稀释矫正后的培养罐气室内被测气体浓度的变化率,μmol·mol-1·h-1;ΔCl/Δt为培养罐的气体渗漏率,μmol·mol-1·h-1;Mds为培养土壤样品的干质量,g;Vc为在培养的温度和压力下气体的摩尔体积,L·mol-1。
该系统测定N2和N2O 气体排放速率的检测限(95%置信区间)分别为0.5 μg·h-1·kg-1和0.006 μg·h-1·kg-1。
1.5 土壤环境因子测定
土壤采用1 mol·L-1KCl 浸提(水土比5∶1,振荡1 h)后,使用流动分析仪(SEAL AA3,德国)测定和-N 含量;土壤采用去离子水浸提(水土比5∶1,振荡1 h)、离心(8 000 r·min-1)并过滤(0.45 μm 无碳滤膜)后,使用流动分析仪(SEAL AA3,德国)测定DOC含量。
在玉米生长季(2017 年6 月15 日—10 月1 日)田间原位传统施肥处理的每个小区内,在土壤剖面3 个不同深度(0.1、0.5 m 和2.0 m)处,埋设土壤温度和O2含量的传感器(SO-100,Apogee,美国),自动在线记录数据,频率为0.5 h一次。土壤质量含水量(W)采用铝盒称质量的方法计算[22]。土壤容重(BD,g·cm-3)根据采集的原状土柱的体积(V,cm3)和质量(Mfs,g),及W计算得到,BD=Mfs/[V×(1+W)]。WFPS通过W、BD和比重(2.65 g·cm-3)计算得到,WFPS=BD×W/(1-BD/2.65)。
1.6 数据处理与统计分析
采用Excel 2010 进行数据处理;采用Origin 8.0绘图;采用SPSS 16.0 对土壤不同O2浓度影响土壤剖面N2和N2O 排放及N2O/(N2O+N2)值的差异进行单因素方差分析(ANOVA)及LSD 多重比较(P<0.05水平的显著性检验),对N2和N2O 排放及N2O/(N2O+N2)值与土壤环境因子(O2浓度、温湿度及-N、-N、DOC 含量等)间的定量关系采用线性和非线性回归分析。
2 结果与分析
2.1 土壤环境因子
在玉米生长季(2017年6月15日—10月1日),不同深度土壤剖面O2浓度和温度的变化规律不同(图2)。土壤O2浓度的变化受降雨事件影响显著。土壤剖面0.1 m 和0.5 m 处的O2浓度变化趋势较一致,表现为同升同降,变化范围分别为3.4%~21.0%(平均值为18.1%)和2.5%~18.8%(平均值为15.6%)。受降雨影响后的表层土壤O2浓度可恢复到背景大气O2浓度(21.1%),而0.5 m 处的O2浓度恢复较慢,观测季末(约18.6%)仍显著低于背景大气。2.0 m 深土壤O2浓度变化范围较窄,为13.8%~18.4%(平均值为15.0%)。土壤剖面0.1、0.5 m 和2.0 m 处的温度变化范围分别为14.2~32.9、18.2~28.4 ℃和15.3~20.5 ℃,平均值为24.4、23.8 ℃和19.1 ℃。
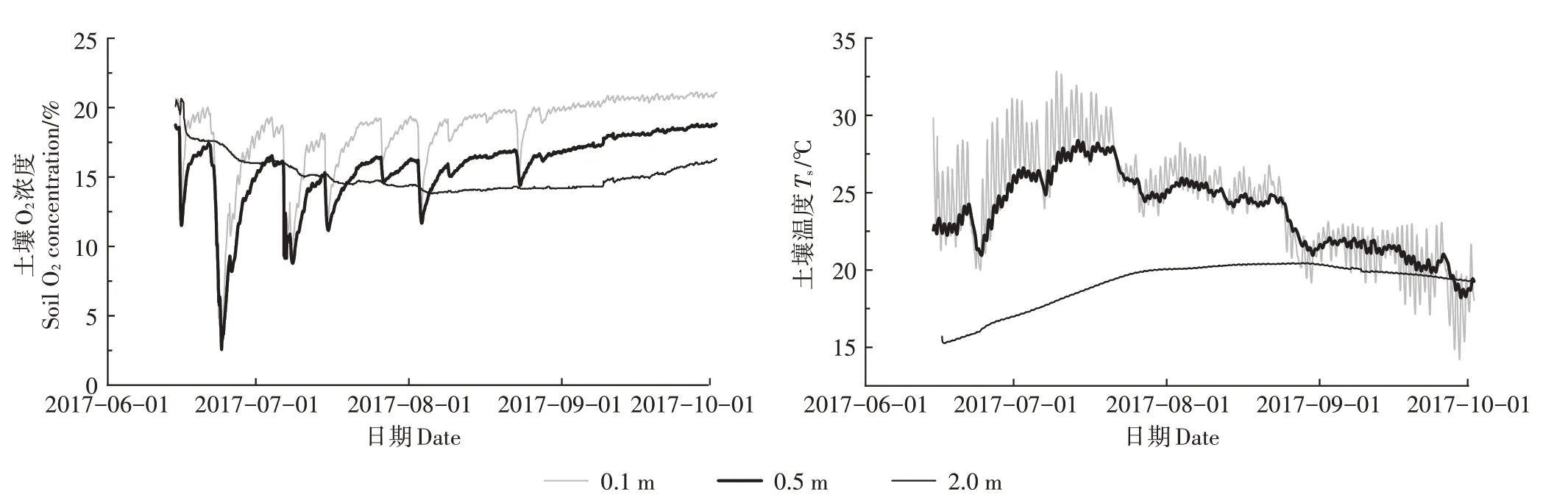
图2 不同深度土壤剖面的O2浓度和温度(Ts)动态变化Figure 2 Dynamics of soil O2 concentration and temperature(Ts)at different depths of soil profile
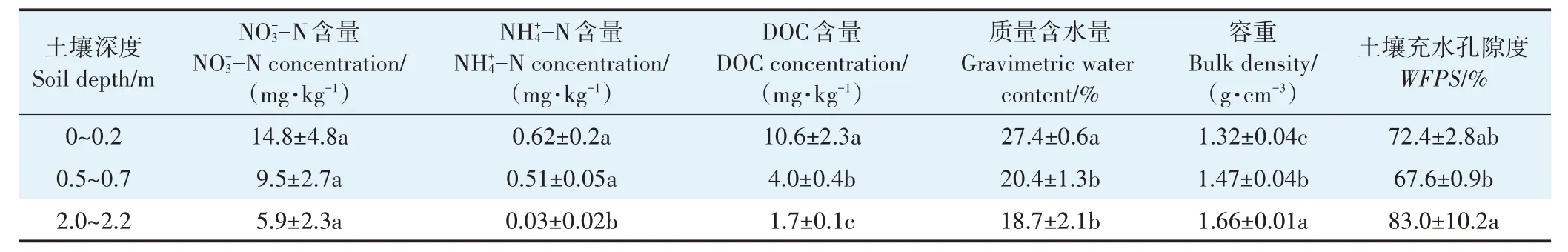
表2 不同深度土壤剖面的初始碳氮底物含量和含水量Table 2 Initial soil concentrations of carbon and nitrogen substrates and soil water content in different soil depths
2.2 土壤剖面N2和N2O产生速率和N2O/(N2O+N2)值
在同一土壤O2浓度条件下,土壤N2和N2O产生速率随着土层深度的增加而降低(图3a和图3b)。有氧条件下(2.5%和15.0%),表层土壤(0.2 m)的N2产生速率为5.3 μg·h-1·kg-1和7.1 μg·h-1·kg-1,显著高于深层土壤(0.5~2.3 μg·h-1·kg-1,0.5 m和2 m)。同样地,N2O产生速率也是表层高于深层,分别为1.1 μg·h-1·kg-1和0.062 μg·h-1·kg-1(P<0.05)。无氧条件下,气体产生速率亦是表层高于深层(P<0.05),0.2、0.5 m 和2.0 m 土层N2产生速率分别为88.1、25.9 μg·h-1·kg-1和10.4 μg·h-1·kg-1,N2O 产生速率分别为6.7、5.2 μg·h-1·kg-1和0.33 μg·h-1·kg-1。
对于同一深度的土壤,无氧条件下气体产生速率均显著高于有氧条件(P<0.05)。无氧条件下的N2和N2O 产生速率分别为10.4~88.1 和0.3~6.7 μg·h-1·kg-1,是有氧条件下的11~26 倍(平均17 倍)和6~257倍(平均89 倍)(P<0.05)。同时,无氧较有氧条件下N2O 产生速率的增量随着土层深度的增加而增加,即平均高约6 倍(0.2 m)、44 倍(0.5 m)和112 倍(2.0 m),但N2产生速率的增量随土层深度变化较窄(14~16倍)。N2O 和N2产生速率随着O2浓度的增加而降低,但有氧条件下不同O2浓度对N2产生速率影响差异不显著(图3a)。
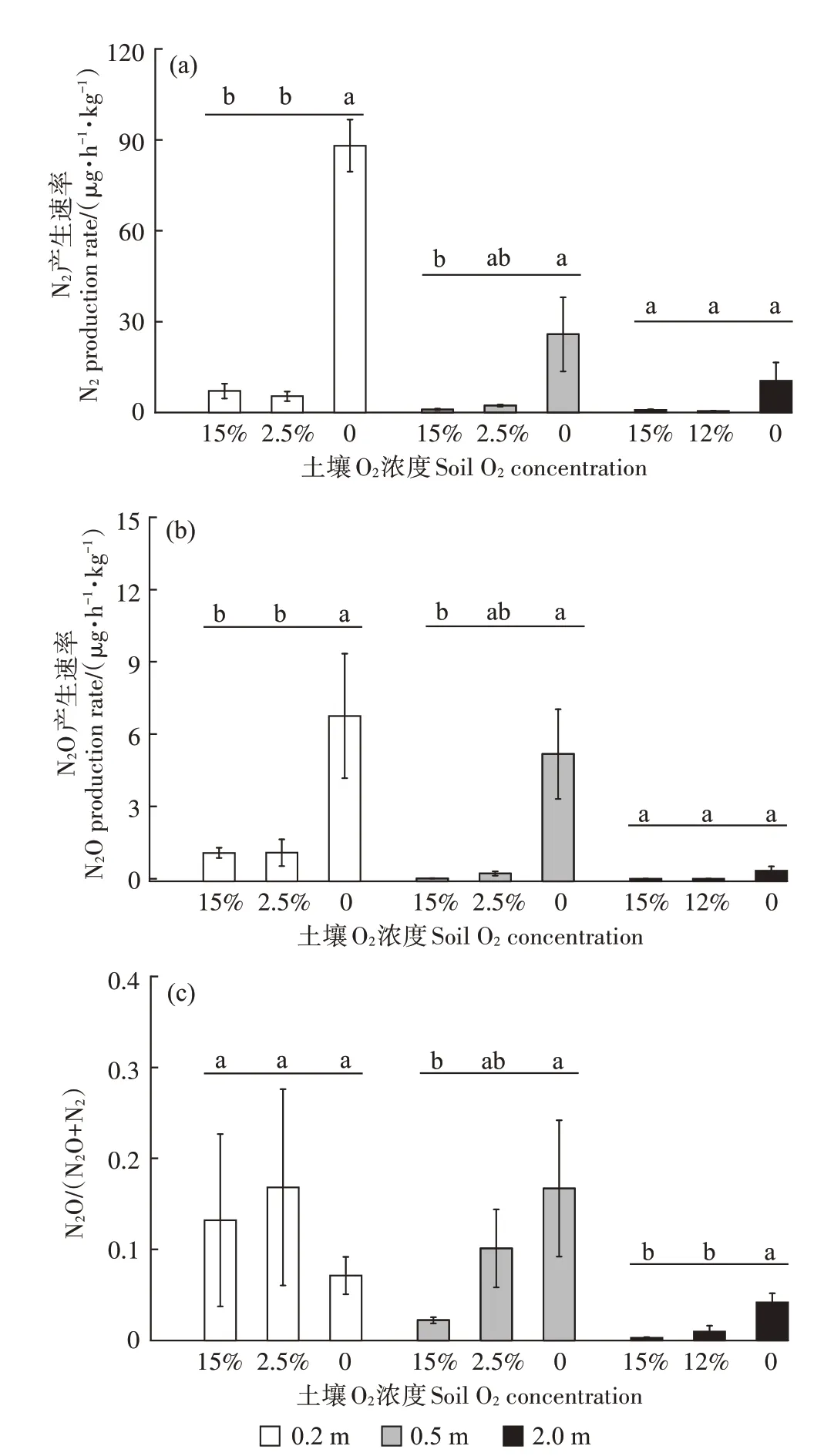
图3 不同O2浓度条件下土壤剖面N2和N2O产生速率及N2O/(N2O+N2)摩尔比变化Figure 3 Changes in soil N2 and N2O production rates and N2O/(N2O+N2)molar ratio under different soil O2 concentrations
不同深度剖面土壤的N2O/(N2O+N2)值变化表现为表层高于深层(图3c)。0.2 m 处土壤的N2O/(N2O+N2)值受O2影响不显著,变化范围为0.07~0.13;而深层土壤N2O/(N2O+N2)值均随着O2浓度降低而增加,表现为0.5 m 深土层的该比值由0.02(15.0%O2)增加至0.17(无氧);2.0 m 土层由0.003(15.0% O2)增加至0.042(无氧)。
2.3 环境因子对不同深度土壤剖面N2和N2O 产生速率的影响
不同深度土壤剖面的N2和N2O 产生速率受多因素(如土壤湿度、O2浓度和DOC 含量)的共同影响(表3)。土壤N2和N2O 产生速率与土壤O2浓度显著负相关(P<0.01,表3、公式2和公式6),而与土壤质量含水量显著正相关(P<0.05,表3、公式1 和公式5)。除O2浓度外,土壤DOC 含量是影响N2和N2O 产生的重要因子,DOC 含量和O2浓度变化可共同解释剖面土壤N2产生速率的89%和N2O 产生速率的46%(P<0.01,表3、公式8和公式4)。
N2O/(N2O+N2)值变化受土壤DOC、-N 和-N含量的影响,其中DOC和含量可共同解释该比值变化的41%(表3、公式13)。此外,土壤深度也是影响N2O 产生速率和N2O/(N2O+N2)值变化的因子之一(表3、公式3和公式12)。
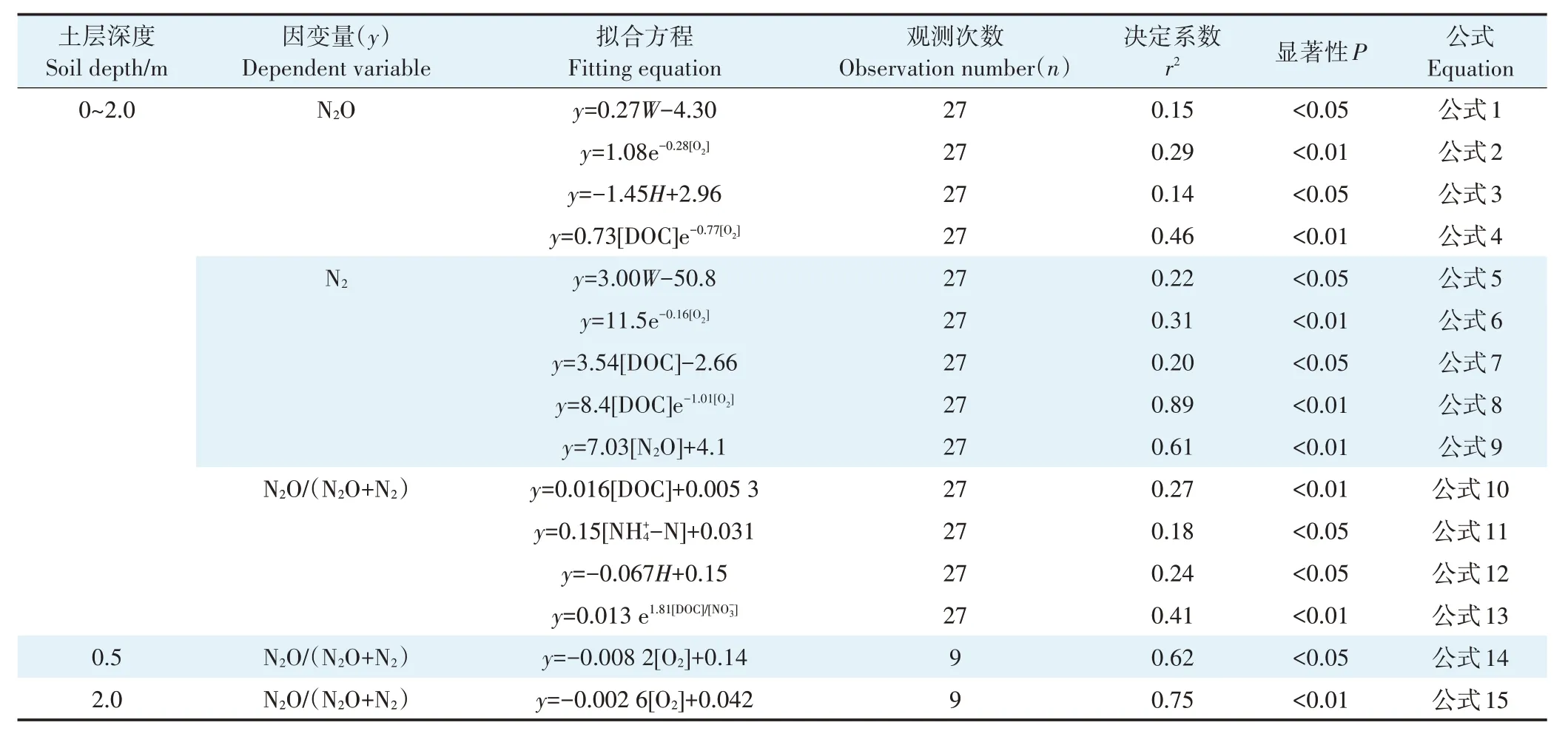
表3 土壤剖面N2和N2O产生速率和N2O/(N2O+N2)值与土壤环境因子的定量关系Table 3 Quantitative relationships between soil N2 and N2O production rates and N2O/(N2O+N2)ratio and soil environmental factors
2.4 土壤剖面N2和N2O产生量估算
本研究田间原位观测的0~2.0 m 土壤剖面O2浓度均大于2.5%,而没有观测到O2浓度为0 的情况,因此采用有氧条件下测定的N2产生速率(FN2-有氧)估算田间剖面土体N2产生量。依据土壤容重和土层深度(H,以0~0.2 m 观测代表0~0.5 m 土层,0.5~0.7 m 代表0.5~1.0 m 土层,2.0~2.2 m 代表1.0~2.0 m 土层),换算得到各层土壤N2的损失速率(FN2-有氧×BD×H×24/100)为0.85~1.12(0~0.5 m)、0.17~0.40 kg·hm-2·d-1(0.5~1.0 m)和0.18~0.35 kg·hm-2·d-1(1.0~2.0 m)(表4)。3层累加得到0~2.0 m 土体的N2平均损失量为1.54 kg·hm-2·d-1,换算为整个玉米生长季(120 d)为198 kg·hm-2。深层土壤N2O向表层土壤/大气溢出的过程中,在田间适宜条件下会被逐渐还原为N2,假设N2O(0.19 kg·hm-2·d-1,以N 计)全部还原为N2,则0~2.0 m土体反硝化损失量(N2O+N2)最高可达219 kg·hm-2。
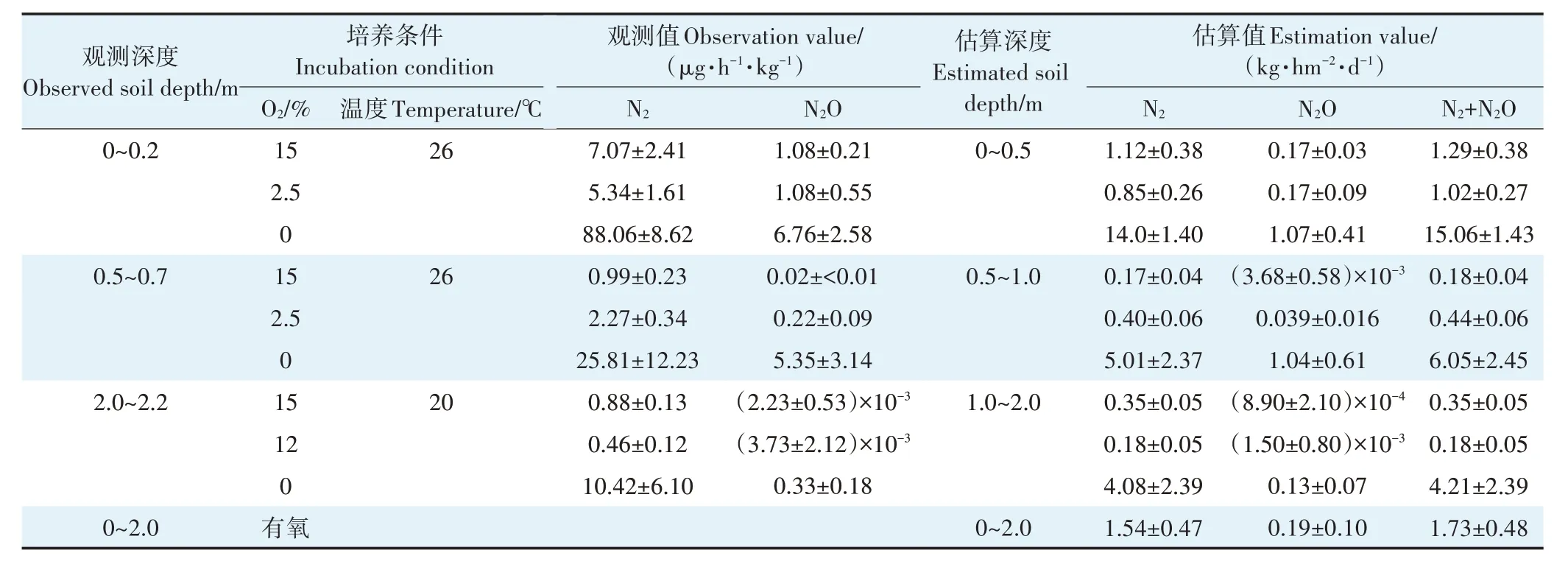
表4 0~2.0 m土体N2和N2O产生量估算Table 4 Estimation of soil N2 and N2O production in 0-2.0 m soil profile
3 讨论
3.1 不同深度土壤剖面N2和N2O产生速率
无论是有氧还是无氧条件,本研究观测到土壤剖面N2和N2O 的产生速率均表现为表层高于深层(图3)。有氧条件下(2.5%和15.0%O2)的表层土壤N2平均产生速率6.2 μg·h-1·kg-1,约为深层土壤的5 倍(图3a)。该表层N2产生速率与在华北玉米-小麦轮作农田夏玉米季观测的N2排放峰值的量级较一致,为2~10 μg·h-1·kg-1[20,23];但低于英国放牧草地N2排放量(17.6 μg·h-1·kg-1)[24],这主要是由于其研究的土壤碳氮底物浓度高,且水分充足。无氧条件下的表层土壤N2和N2O 产生速率分别为2.0 m 深土壤的8倍和20倍(图3a和图3b)。该表层土壤N2产生速率(88 μg·h-1·kg-1)显著低于碳或氮添加的农田土壤N2排放潜势(208 μg·h-1·kg-1和590 μg·h-1·kg-1)[15,25];但高于长期施用石灰的农田土壤N2排放潜势(25~60 μg·h-1·kg-1)[26],尽管其土壤-N 含量(22~89 mg·kg-1)高于本研究,这可能是由于本研究的土壤pH、土壤湿度和培养温度均较高,有利于反硝化N2产生[27-28]。
类似地,前人研究也观测到反硝化潜势(N2+N2O)随着土壤深度的增加而降低[13,15]。本研究表层土壤较深层土壤产生更多的含氮气体,可能的原因有:①表层土壤的-N 和DOC 含量较深层高(表2),高的碳氮底物含量促进反硝化过程,进而促进N2O 和N2产生[28],该解释可由土壤N2O 和N2产生速率与土壤DOC 含量间的正相关关系来体现(表3 公式4和公式7);②表层土壤的培养温度较底层高(26 ℃>20 ℃),进而促进硝化、反硝化过程的速率[29];③前人研究显示表层土壤的细菌丰度(16S rRNA 基因拷贝数)较深层土壤高约2 个数量级[15],同时反硝化基因丰度(nirK、nirS和nosZ)也高1~3 个数量级[12,15],这表明表层土壤具有更高的反硝化能力,支持本研究观测到的表层土壤含氮气体产生量更高的结果。
3.2 O2对土壤剖面N2和N2O 产生及N2O/(N2O+N2)值的影响
土壤O2浓度被认为是控制反硝化速率和产物组成的首要因子[30]。但O2浓度在田间原位观测中很少被测定,从而限制了对土壤剖面O2浓度变化规律的认识[18]。本研究发现浅层土壤O2浓度变化剧烈(2.5%~21.0%),而深层土壤O2波动范围较窄(14.0%~18.0%),但均未观测到O2浓度为0 的情况(图2)。当土壤中有O2存在时,微生物不优先以-N 作为电子受体,反硝化作用较弱或不发生,因为O2是兼性厌氧微生物最容易利用的电子受体,且其氧化释放的能量最高[31]。当O2浓度逐渐降低时,土壤反硝化速率增强[17,32],这与本研究结果相符,即N2和N2O 产生速率与土壤O2浓度呈指数负相关关系(表3 公式2 和公式6);而且,无论表层还是深层土壤,无氧条件下的气体产生速率显著高于有氧条件(图3a和图3b),N2和N2O产生速率分别平均高出16倍和88倍。本研究观测的土壤剖面O2浓度均大于2.5%,表明在无氧条件下的观测会高估土壤真实条件下的N2和N2O产生速率。
通常认为反硝化作用下N2O/(N2O+N2)值随着土壤O2浓度的降低而降低[18,33],这是因为O2的存在对N2O 还原酶合成及活性的抑制比对还原酶和还原酶的抑制更大[18,34]。相反地,本研究观测到深层(0.5 m 和2.0 m)土壤该比值与O2浓度呈负相关关系(表3 公式14 和公式15),表明当深层土壤出现O2限制时,会有更大的N2O 损失风险。这可能是由于深层土壤N2O/(N2O+N2)值的变化还同时受到其他多因子的影响,如土壤值等[26,35-36]。尽管无氧显著地促进了反硝化作用,但深层土壤的DOC含量更缺乏以及比值更小(表2),反硝化作用因缺少电子供体进行不彻底,而以中间产物N2O 为主,导致N2O/(N2O+N2)值增加[37]。类似地,前人研究也观测到缺碳土壤增加水分(即降低O2)会促进反硝化中间产物N2O,进而增加比值[16]。通常N2O/(N2O+N2)值被用作估算点位、区域和全球土壤N2排放的重要参数[38-39],本研究结果显示基于厌氧条件下的观测高估深层土壤的该比值,进而低估N2排放。因此该结果的适用性仍需进一步的研究,尤其是对高-N 累积的土壤剖面。但前人的研究显示高的土壤-N 含量,更利于作为电子供体和对N2O 还原酶的抑制作用,导致高的中间产物N2O 产生及增加N2O/(N2O+N2)值[26,35],进而导致对土壤N2排放的低估更多。
3.3 土壤剖面N2产生量
受限于土壤反硝化速率的时空变异性和现有方法的局限性,目前仅有较少的研究测定了不同深度土壤剖面的反硝化潜势损失量。如Chen 等[15]报道玉米-小麦轮作农田土体N2+N2O 排放量为1(0.5~2.0 m)~5 μg·g-1·d-1(0~0.2 m),按土层深度2.0 m和容重1.4 g·cm-3换算后,为39.4 kg·hm-2·d-1;Jahangir等[13]的测定结果显示放牧草地土壤剖面(0~1.3 m)N2平均排放量为0.40 mg·kg-1·d-1,范围为0.13~0.55 mg·kg-1·d-1,按土层深度2.0 m 和容重1.4 g·cm-3换算后为11.2 kg·hm-2·d-1。上述估算结果均高于本研究有氧条件下的N2估算值(1.54 kg·hm-2·d-1),而与无氧观测下的N2量级一致(23 kg·hm-2·d-1,表4)。由于不同研究采用不同类型的土壤,其初始碳氮底物含量不同,甚至培养条件和测定方法也不同,因此测定结果之间很难直接比较。
基于本研究设定的培养条件为不同深度土壤的平均温度、有氧和利于反硝化发生的水分条件,估算得到的土壤剖面N2产生量是对应于土壤初始碳氮底物测定值(表2)的0~2.0 m 土体的平均状况。但该估算仍存在很大的不确定性,因为:①土壤剖面-N含量的时空变异性大[1,14]。如Huang 等[1]的研究报道华北玉米-小麦轮作农田0~1 m 土体累积的-N平均为585 kg·hm-2(范围:320~890 kg·hm-2),折合为42 mg·kg-1(23~64 mg·kg-1,按容重1.40 g·cm-3计,表2)。但本研究测定的土壤-N 含量较其低65%~77%,由此会导致对0~2 m 土体N2产生量低估65%~77%,在此假设N2产生与-N 含量线性正相关[20]。②土壤温湿度的非线性影响。前人研究显示N2排放与土壤温湿度的关系遵循阿伦尼乌斯动力学机制,即气体排放随着温湿度的增加而指数增加[16],表层土壤表现为更剧烈的水热变化(图2)。因此,采用平均温度亦会导致对N2产生的低估。未来研究可关注土壤剖面不同氮底物含量、温湿度与O2浓度的交互作用,提升对土壤剖面反硝化损失的估算。
4 结论
(1)对于同一深度的土壤,无氧条件下的气体产生速率均显著高于有氧条件,原位观测的0~2.0 m 土体O2浓度均大于2.5%,表明在无氧条件下的观测会高估土壤剖面真实条件下的N2和N2O产生速率。
(2)深层(0.5 m 和2.0 m)土壤N2O/(N2O+N2)值与O2浓度呈负相关关系,表明基于厌氧条件下的测定会高估深层土壤的该比值。
(3)本研究对玉米生长季0~2.0 m 土体剖面的反硝化N2损失量进行估算,表明该土壤对累积的-N具有很强的脱氮能力。但考虑到土壤剖面-N 含量的时空变异性,未来研究可关注不同氮底物含量与土壤O2浓度的交互作用,进而提升对土壤剖面反硝化损失估算的准确度。
致谢:感谢对本研究提供技术支持和帮助的马巨红、李宝江和李来港,谨此致谢!
——工程地质勘察中,一种做交叉剖面的新方法