大黄鱼养殖海域沉积物中抗生素抗性基因分布特征及其影响因素
黄薇,刘洋,饶秋华,罗钦,王为刚,宋永康*,罗土炎*
(1.福建省农业科学院农业质量标准与检测技术研究所/福建省农产品质量安全重点实验室,福州 350003;2.福建师范大学生命科学学院,福州 350108;3.连江县水产技术推广站,福州 350500)
抗生素在医疗、畜禽养殖和水产养殖中都发挥着十分重要的作用。在水产养殖过程中,抗生素被用于防治各种细菌性疾病,同时兼具促进水生动物生长等功效[1]。为了提高养殖产量、降低养殖成本,抗生素在水产养殖过程中被长期过度使用,这导致了水产养殖环境和养殖动物体内耐药菌和抗生素抗性基因(Antibiotic resistance genes,ARGs)[2]的产生。ARGs于2006 年由Pruden 等[3]首次确认为新型的环境污染物,由于可以通过水平基因转移在环境和生物体内长久持续传播,ARGs 的危害性相对于抗生素和耐药菌更强,因此其被世界卫生组织列为21 世纪人类医疗健康面临的三大威胁之一[4]。
水产养殖环境被证明是ARGs 的潜在储藏库,ARGs 在水产养殖环境(水体、沉积物)及水产养殖对象中普遍存在[5-7]。Hedberg 等[8]证实沿海水域的ARGs 主要来源于水产养殖。水产养殖环境中的ARGs可以通过食物链直接与人类肠道菌群进行水平基因转移传播[9]。Yang 等[10]的研究显示,海水养殖沉积物中的ARGs 序列与人体致病菌中的ARGs 序列高度相似。因此,随着全球水产养殖业的快速发展,水产养殖环境中的ARGs 引起了更多的关注,尤其是沉积物。与水不同,沉积物中的ARGs 具有更稳定、更持久的特点,其ARGs 赋存量显著大于水,被认为是ARGs 的“汇”[11]。Yuan 等[12]认为随着时间的推移,水中的ARGs 会在沉积物中不断积累,沉积物很可能增强了抗生素抗性的传播。
不同养殖区域、不同养殖对象以及不同养殖模式造成的ARGs赋存情况显著不同[11]。大黄鱼是我国养殖规模最大的海水鱼,也是海区网箱养殖最主要的品种[13],然而对大黄鱼养殖海域沉积物ARGs 赋存特征的研究尚未见报道。目前,ARGs 的检测方法主要以PCR 技术为主,虽然很多研究人员已经利用PCR 方法对水产养殖环境中的ARGs 进行了定量研究,且取得了一定成果,但对研究ARGs 的种类有限制,很难得到环境中微生物抗生素抗性基因组的全面且详细的信息[14]。近年来,随着高通量测序和功能基因组筛选技术的发展,宏基因组测序分析技术不再局限于PCR引物设计,可以为研究环境抗生素抗性基因组提供ARGs 的广谱特征,从而全面客观地反映环境中ARGs 的多样性。因此,本文以大黄鱼养殖海域沉积物为研究对象,利用宏基因组测序分析技术调查大黄鱼养殖海域内ARGs 的污染状况,并探讨ARGs 与环境因子以及微生物群落结构之间的相关性,揭示ARGs 在水产养殖环境中的扩散和传播规律,以期为评价大黄鱼养殖区域ARGs 的生态风险和污染控制提供参考依据。
1 材料与方法
1.1 采样点及样品采集
2022年1月选取6个大黄鱼养殖密集区采集养殖鱼排下的沉积物样品,具体采样点分布如图1所示,采样点信息见表1。每个采样点选取3个不同的网箱(分别用A、B、C 表示),选取的网箱之间至少间隔一个网箱,在选取的网箱框架踏板上使用抓斗采泥器采集沉积物样品,样品采集后立即放入无菌的聚乙烯塑料袋中,放到低温(冰浴)冷藏箱中运至实验室,置于-80 ℃冰箱保存待测。
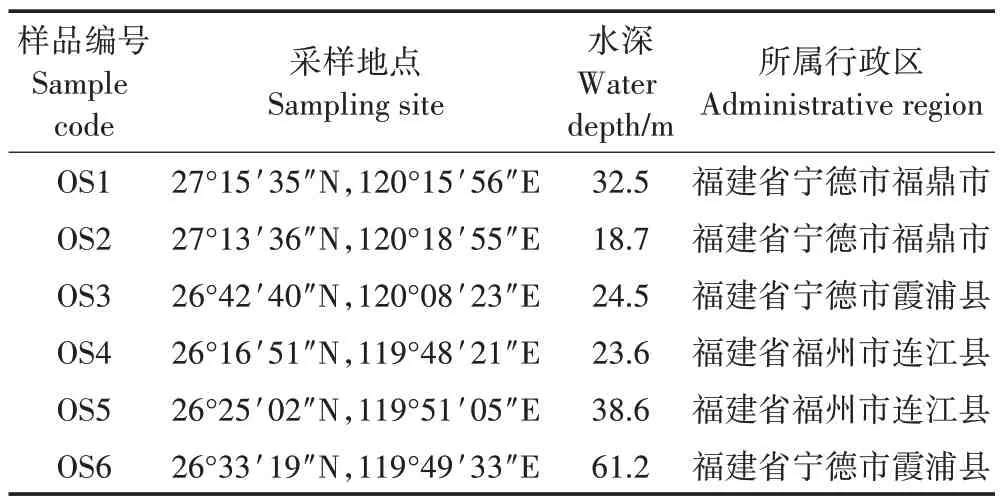
表1 样本的基本信息Table 1 Basic information of the samples
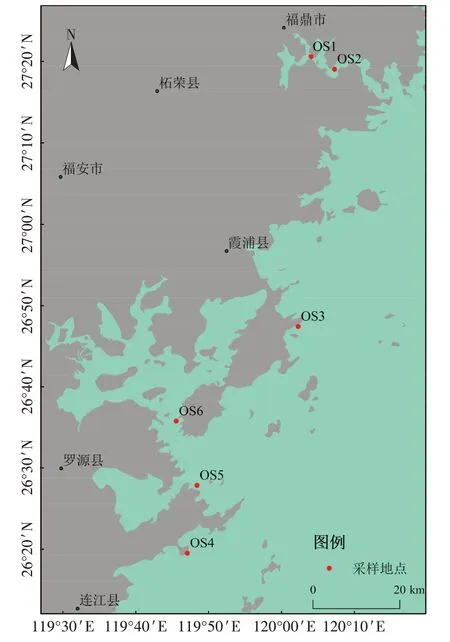
图1 采样点分布示意图Figure 1 Location of sampling sites
1.2 沉积物理化因子测定
样品pH和电导率(含盐量)通过出海采样实时检测得到,pH 使用便携式pH 计(METTLER TOLEDO,瑞士)获取,电导率通过便携式电导率仪(METTLER TOLEDO,瑞士)测定。有机碳(TOC)采用重铬酸钾氧化-还原容量法测定,总氮(TN)采用凯氏滴定法测定,总磷(TP)采用分光光度法测定。
1.3 沉积物微生物DNA提取
使用PowerSoil DNA Isolation Kit 试剂盒(MOBIO,Carlsbad,CA,美国),参照试剂盒说明书进行沉积物总基因组DNA 的提取,使用Qubit 2.0 Fluorometer(Invitrogen,Carlsbad,CA,美国)检测DNA 样品的浓度,然后将DNA 样品放置于-80 ℃下保存备用。16S rRNA 基因高通量测序样品为每个采样点的3 个平行沉积物样品分别提取DNA,宏基因高通量测序样品为每个采样点的3 个平行沉积物样品等质量混合后提取DNA,最后共获得18 个用于16S rRNA 基因高通量测序的基因组DNA 样品和6 个宏基因组高通量测序的基因组DNA样品。
1.4 16S rRNA基因高通量测序及生物信息学分析
16S rRNA基因高通量测序DNA样品送上海美吉生物医药科技有限公司,于Illumina MiSeq 平台进行测序,16S rRNA 基因高通量测序扩增16S rRNA 基因V3~V4 可变区,通用引物为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′ -GGACTACHVGGGTWTCTAAT-3′)。Miseq 测序得到的原始序列首先根据overlap 关系进行拼接,之后裁切序列中的正反向引物,同时对序列质量进行质控和过滤,区分样本后按97%序列相似度进行OTU 聚类分析划分分类操作单元(OTUs),再运用Ribosomal Database Project(RDP)classifier进行物种注释,得到每条序列从门到属各个水平的分类信息,基于分类学信息,统计每个生物样本的多样性指数。
1.5 宏基因组高通量测序及生物信息学分析
宏基因组高通量测序DNA 样品送上海美吉生物医药科技有限公司,于Illumina Hiseq 2500 测序平台进行测序。Hiseq 测序得到的原始序列首先进行质控,剪切接头序列、低质量序列及含N碱基序列,然后利用Megahit 与Newbler 拼接软件对质控数据进行拼接组装,再使用MetaGene 软件对拼接结果中的contigs进行ORF预测。预测出的基因序列按相似度95%进行聚类,每类取最长的基因作为代表序列,构建非冗余基因集;将数据上传CARD数据库进行比对,获得基因对应的ARGs功能注释信息,包括基因名称、抗生素抗性类型、耐药机制以及基因如何与抗生素药物有关的描述等;ARGs 的相对丰度使用百万分率(10-6)表示,即在1 000 000 个质控序列中有一个被标注为ARG的序列。
1.6 统计分析
采用Excel 软件计算数据的平均值和标准偏差。采用SPSS软件进行方差分析和相关性分析,方差分析采用LSD检验,相关性分析选择spearman算法。应用R 语言vegan、gplots、venn diagram 和pheatmap 等软件包绘制PCoA图、柱状图、韦恩图、热图和相关性热图。
2 结果与分析
2.1 大黄鱼养殖海域沉积物中抗生素抗性基因分布特征
本研究从6 个沉积物底泥样本中共获得了80 604 948~94 023 130条(平均89 055 467条)宏基因组高通量测序质量过滤序列,其中275 976~557 910条(0.32%~0.36%)序列被注释为CARD 抗性基因序列(BLASTp,e-value≤10-5)。图2 为丰度前50 的ARGs,OS1~OS6 位点丰度最高的ARG 均为macB(254.31 × 10-6~436.85 × 10-6),其次均为tetA(58)(131.64×10-6~241.69×10-6)、evgS(87.00×10-6~193.42×10-6)和bcrA(76.75×10-6~128.89×10-6),上述优势ARGs分别占ARGs序列总数的15.44%~16.48%,表明不同大黄鱼养殖海域沉积物中的优势抗生素抗性基因种类基本一致。
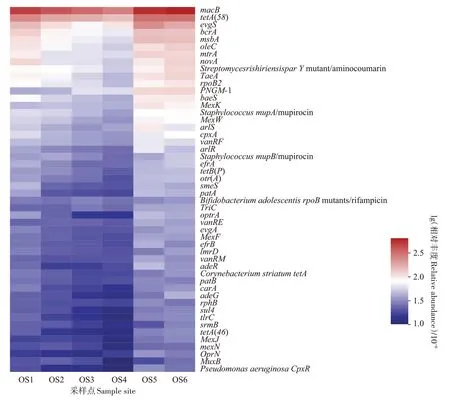
图2 大黄鱼养殖海域沉积物中ARGs赋存特征Figure 2 Occurrence characteristics of ARGs in the different sediment samples from large yellow croaker culture area
根据统计结果,在大黄鱼养殖海域沉积物样品中共识别出38 种抗生素抗性类型,781 个ARGs 亚型。图3a为不同抗生素抗性类型ARGs的相对丰度,在大黄鱼养殖海域沉积物中,ARGs 的主要抗生素抗性类型为四环素类(Tetracyclines,1 049.03×10-6~2 061.39×10-6)、大环内酯类(Macrolides,999.59×10-6~1 946.88×10-6)和氟喹诺酮类(Fluoroquinolones,660.02×10-6~1 292.33×10-6)。图3b 为不同耐药机制的ARGs 占ARGs 序列总数的相对百分比情况,从结果中可以看出,不同大黄鱼养殖海域沉积物样品中ARGs 引起细菌耐药的机制基本一致,其中外排泵(Antibiotic efflux)是主要的耐药机制,占ARGs 序列总数的62.63%~63.84%,其次为抗生素靶点改变(Antibiotic target alteration),占ARGs序列总数的18.76%~20.03%。
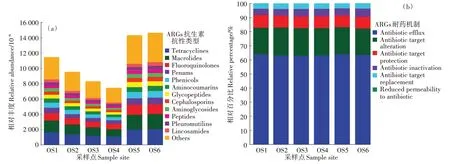
图3 大黄鱼养殖海域沉积物中ARGs的抗生素抗性类型和耐药机制Figure 3 Antibiotic resistance types and resistance mechanisms of ARGs in different sediment samples from large yellow croaker culture area
2.2 大黄鱼养殖海域沉积物ARGs与环境因子之间的关系
2.2.1 大黄鱼养殖海域沉积物中环境因子分布特征
大黄鱼养殖海域沉积物中5 种环境因子的检测结果见表2。6 个位点的大黄鱼养殖海域沉积物样品的pH 和电导率相似,但TOC、TN 和TP 存在显著差异(P<0.05),TOC 范围为0.48%(OS1)~0.59%(OS4),TN含量范围为398(OS1)~563 mg·kg-1(OS6),TP 含量范围为546(OS5)~777 mg·kg-1(OS1)。根据我国《海洋沉积物质量》(GB 18668—2002),6 个位点的TOC 均超过第三类海洋沉积物质量标准,根据加拿大安大略省环境和能源部1992 年制定的沉积物标准,OS6中TN 属轻度污染,OS1、OS2、OS3 和OS6 中TP 为轻度污染。
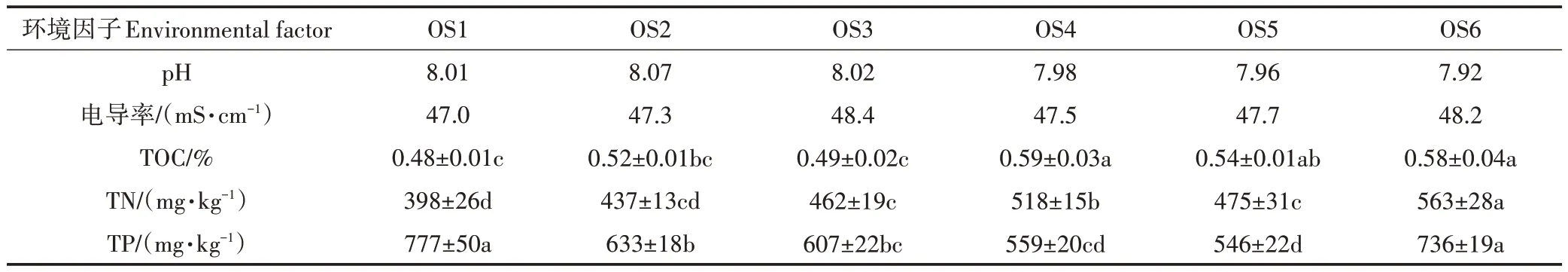
表2 大黄鱼养殖海域沉积物中环境因子分布特征(平均值±标准误,n=3)Table 2 Distribution characteristics of environment factors in different sediment samples from large yellow croaker culture area(Mean±SEM,n=3)
2.2.2 沉积物中环境因子与ARGs之间的相关性
为探究大黄鱼养殖海域沉积物中环境因子对ARGs 分布特征的影响,使用相关性分析解析6 个位点大黄鱼养殖海域沉积物中的5 种环境因子与丰度前20 的ARGs 之间的关系,结果见图4。如图4 所示,大黄鱼养殖海域沉积物中,pH 与丰度前20 的ARGs均存在负相关关系,TN 与丰度前20 的ARGs 均存在正相关关系,但除PNGM-1 与电导率和TN 呈显著正相关(P<0.05)外,其余ARGs 与所检环境因子之间的相关性均不显著(P>0.05)。
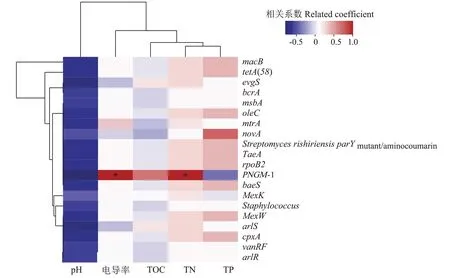
图4 大黄鱼养殖海域沉积物中ARGs和环境因子的关系Figure 4 Correlation between ARGs and environmental factors in the sediment of large yellow croaker culture area
2.3 大黄鱼养殖海域沉积物ARGs与微生物群落的关系
2.3.1 大黄鱼养殖海域沉积物中细菌群落结构
18 个大黄鱼养殖海域沉积物样品Illumina MiSeq测序数据统计分析结果见表3。从表3 可知,18 个沉积物样品获得的16S rRNA 序列数为56 007~66 002条,OTUs 为2 066~3 451,每个样品的OUT 覆盖率均大于96%,表明Illumina MiSeq 测序获取的数据量能够很好地反映特定样品的细菌多样性情况。Alpha多样性分析结果表明,尽管OS2、OS3和OS4沉积物样品的覆盖率要显著低于OS1、OS5 和OS6(P<0.05),但是OS2、OS3 和OS4 的OTUs、ACE 指数和Chao 指数要显著高于OS1、OS5 和OS6(P<0.05),表明OS2、OS3 和OS4 样品中的物种数要高于OS1、OS5 和OS6。此外,除OS1 的Shannon 指数外,各样本的Shannon 指数和Simpson 指数的差异不显著(P>0.05),说明各样品间的物种丰度和多样性差异不显著。Beta 多样性分析(PCoA 分析,图5)结果表明,除OS3 和OS4 微生物组成结构相似外,不同采样点的微生物组成结构存在明显差异。
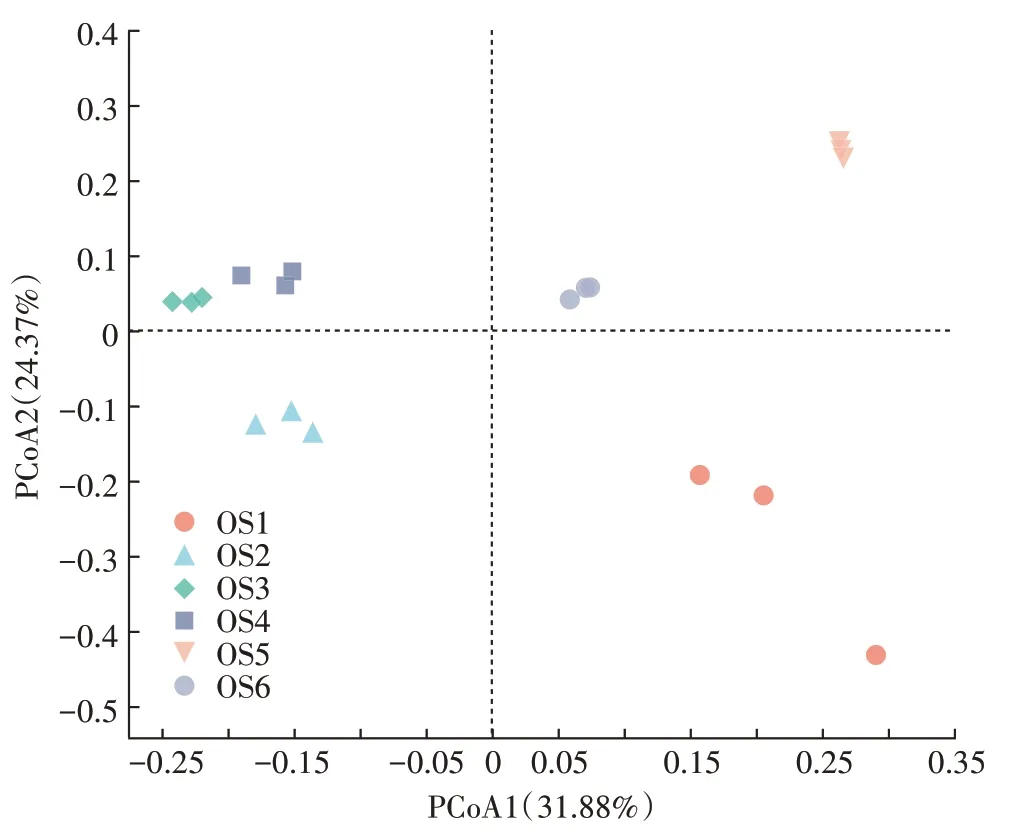
图5 大黄鱼养殖海域沉积物样品细菌群落结构PCoA分析Figure 5 Principal coordinates analysis(PCoA)of bacterial community compositions in the different sediment samples from large yellow croaker culture area
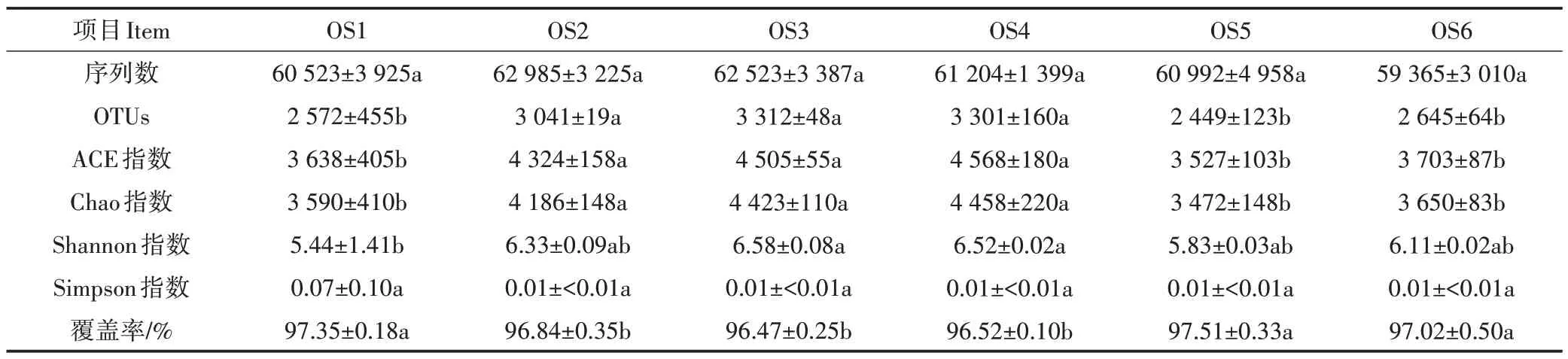
表3 Illumina MiSeq测序数据统计分析(平均值±标准误,n=3)Table 3 Statistical indexes calculated based on the Illumina MiSeq sequencing data(Mean±SEM,n=3)
通过构建韦恩图分析了不同大黄鱼养殖海域沉积物样品中所共有的和特有的OTU 数目(图6)。如图6 所示,18 个大黄鱼养殖海域沉积物样品共有1 059 个OTUs,统计分析表明,共有的OTUs 序列分别占样品序列总数的13.68%~22.85%,特有OTUs 序列分别占样品序列总数的0.26%~1.39%。从物种注释结果来看,本研究共得到细菌59 个门(图7a),981 个属(图7b)。对注释结果进行统计分析,从门水平上看,除OS3 外,其余大黄鱼养殖海域沉积物中丰度最高的细菌门均为Proteobacteria,其占样品序列总数的21.36%±0.86%~44.19%±22.59%,OS3 丰度最高的细菌门为Desulfobacterota;其次,OS1、OS2 和OS6 为Bacteroidota(13.45% ± 6.97%、14.72% ± 1.57% 和15.82%±0.38%),OS5 为Acidobacteriota(11.22%±1.38%),OS4为Desulfobacterota(16.13%±0.87%),OS3为Proteobacteria(20.09%±0.67%);对样品中前20 的门的丰度进行差异显著性分析,结果显示这些门类的细菌在不同大黄鱼养殖海域沉积物中均存在显著差异(P<0.05)。从属水平上看,OS1 丰度最高的属为Pseudoalteromonas,OS2、OS4 和OS5 丰度最高的属为Woeseia,OS3丰度最高的属g_no rank_o_Sva1033,OS6丰度最高的属为g_no rank_f_unclassified。同时对样品中前20 的属的丰度进行差异显著性分析,结果显示 除g_no rank_o_Actinomarinales、Pseudoalteromonas不显著(P>0.05)外,其他属类细菌在不同大黄鱼养殖海域沉积物中均存在显著差异(P<0.05)。以上说明不同点位的大黄鱼养殖海域沉积物的细菌丰度组成存在明显差异。
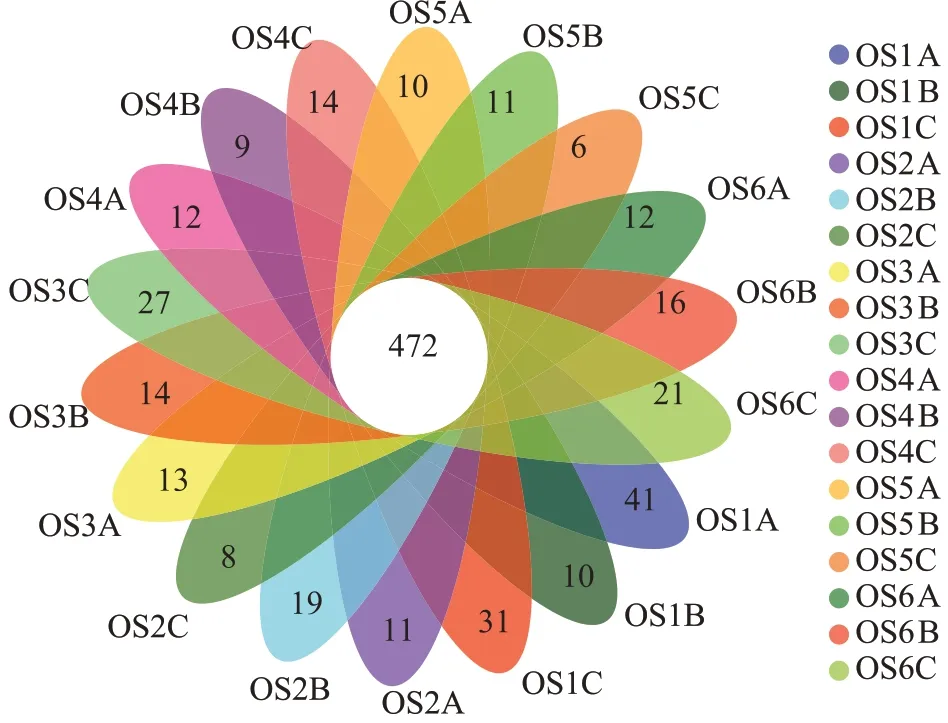
图6 不同大黄鱼养殖海域沉积物中共有和特有的OTUsFigure 6 Venn diagram displaying the number of shared and unique OTUs in the different sediment samples from large yellow croaker culture area
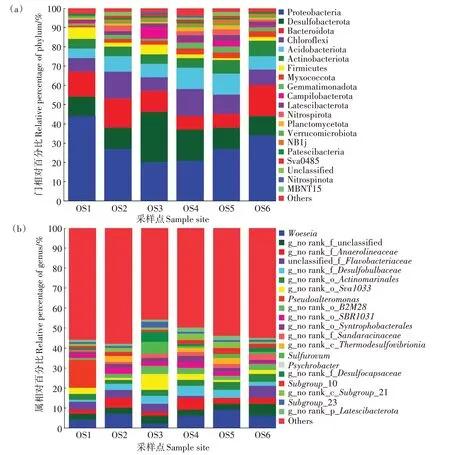
图7 门水平下和属水平下不同大黄鱼养殖海域沉积物中细菌群落结构组成Figure 7 Bacterial community compositions in the different sediment samples from large yellow croaker culture area at the phylum level and at the genus level
2.3.2 沉积物中细菌群落对ARGs分布特征的影响
在大黄鱼养殖海域沉积物中,丰度前20 的细菌属与丰度前20 的ARGs 之间的相关关系如图8 所示。由图8可知,除PNGM-1外,大部分ARGs之间呈显著或极显著正相关(P<0.05 或P<0.01)。从微生物群落结构与ARGs之间的关系来看,丰度前20的微生物菌属中有8 种与ARGs 呈显著或极显著相关。其中,g_no rank_c_Subgroup_21 与丰度前20 种的15 种ARGs 呈显著或极显著负相关(P<0.05 或P<0.01),涉及8 种抗生素抗性类型和2 种耐药机制;unclassified_f_Flavobacteriaceae与13种ARGs呈显著或极显著正相关(P<0.05 或P<0.01),涉及6 种抗生素抗性类型和2 种耐性机制;g_no rank_c_Thermodesulfovibrionia与8 种ARGs 呈显著负相关(P<0.05),涉及5 种抗生素抗性类型和1 种耐药机制;g_no rank_f_Desulfocapsaceae与6 种ARGs 呈显著或极显著正相关(P<0.05或P<0.01),涉及2种抗生素抗性类型和2种耐药机制;g_no rank_f_unclassified 与4 种ARGs 呈显著正相关(P<0.05),涉及3 种抗生素抗性类型和3 种耐药机制;g_no rank_f_Anaerolineaceae与4种ARGs呈显著负相关(P<0.05),涉及4 种抗生素抗性类型和1 种耐药机制;g_no rank_o_Syntrophobacterales与2 种ARGs呈显著或极显著负相关(P<0.05 或P<0.01),涉及2 种抗生素抗性类型和1 种耐药机制;Woeseia与2 种ARGs 呈显著负相关(P<0.05),涉及1 种抗生素抗性类型和1种耐药机制。从ARGs与微生物群落之间的关系来看,丰度前20 的ARGs 均与丰度前20 的菌属有不同程度的显著相关性,其中,macB、tetA(58)、evgS、bcrA、msbA、oleC、mtrA、novA、TaeA、rpoB2、PNGM-1、baeS、Staphylococcus mupA/mupirocin、MexW、vanRF和arlR分别与1种菌属呈显著或极显著正相关(P<0.05 或P<0.01),分别与1、3、3、3、1、3、3、4、1、1、0、2、1、1、1 种和0 种菌属呈显著或极显著负相关(P<0.05 或P<0.01);Streptimyoes rishiriensis parYmutant/aminocoimarin、MexK、arlS和cpxA与2 种菌属呈显著或极显著正相关(P<0.05 或P<0.01),与0、0、1 种和2种菌属呈显著或极显著负相关(P<0.05或P<0.01)。
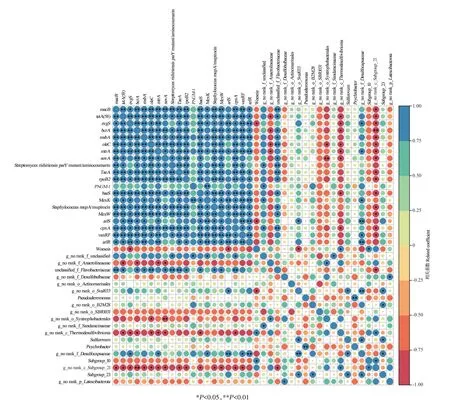
图8 ARGs与微生物菌属相关性分析Figure 8 Correlation analysis between ARGs and microbial genus
3 讨论
本研究利用宏基因组高通量测序技术首次对大黄鱼养殖海域沉积物中ARGs 赋存特征进行了分析。宏基因组高通量测序方法可以使检出的ARGs 更加全面[9,15]。从测序分析结果可知,本研究在6 个大黄鱼养殖海域沉积物中共检测出781 个ARGs 亚型,其中有许多未曾在大黄鱼养殖环境中报道,如fusH、QnrS7等。从ARGs 注释结果来看,大黄鱼养殖海域沉积物中ARGs 最主要的抗生素抗性类型为四环素类、大环内酯类和氟喹诺酮类,而在多数以PCR 检测方法研究抗性基因的报道中,磺胺类抗性基因被认为是我国海水养殖场中常见的抗性基因,其丰度占环境总ARGs 的比例较高[5,16-17],存在这种差异的原因可能与PCR 检测目标ARGs种类的局限性造成ARGs统计结果产生差异有关。在本研究中,大黄鱼养殖海域沉积物中优势ARGs 的种类与已报道的珠江三角洲[18]、海南东寨港[19]、东海近海(杭州湾、象山湾和台州湾)[20]等沉积物中的ARGs赋存特征存在明显的差异。ARGs 的产生和环境残留机制较为复杂,如抗生素是ARGs 发生和传播的主要应激源,但抗生素与其相应的ARGs 也并非总是同时出现,使用单一类型的抗生素也可能出现复杂的ARGs 污染[21-22]。近年来的研究表明,水产养殖环境ARGs 与养殖动物肠道菌群特征、环境因子、养殖药物和饲料以及养殖模式等诸多因素均有密切联系[23-25]。目前,有关大黄鱼养殖环境中ARGs 污染情况的研究尚处在初期阶段,ARGs 污染特征的时空分布特征以及影响因子还有待进一步深入研究。同时在本研究中,大黄鱼养殖海域沉积物中优势ARGs 的丰度为76.75×10-6~436.85×10-6,这比相同算法的对虾养殖沉积物的丰度大得多[26]。明确ARGs耐药机制对防止或延缓耐药性的产生具有重要意义[27]。本研究结果显示大黄鱼养殖海域沉积物中ARGs主要的耐药机制为外排泵,这与杭州湾、我国沿海水域沉积物样品中ARGs 的主要耐药机制一致[28-29]。研究表明,抑制外排系统中外排泵蛋白的表达量可以降低细菌对药物的外排作用,减缓耐药性的产生[30]。
环境因素可能会驱动和增强ARGs 在环境中的传播[31]。本研究测定了所取大黄鱼养殖海域沉积物样品中的5 种环境因子,探究了其分布规律,并解析了这5 种环境因子与ARGs 之间的关系。结果发现,大黄鱼养殖海域沉积物中的TOC、TN 和TP 的含量较高,存在污染情况。TOC、TN 和TP 代表养殖环境中的污染状况[11],侧面反映出渔业养殖是近海环境质量恶化的主要原因之一。对所检环境因子与ARGs 进行相关性分析,发现除PNGM-1 与电导率和TN 呈显著正相关(P<0.05)外,其余ARGs 均与环境因子之间相关性不显著(P>0.05),这一结果与陈嘉瑜[20]的研究结果相似,但与Guo 等[31]的研究结果存在差异。水产养殖环境的理化因子复杂多变,除所检的5 种环境因子外,还包括温度、化学耗氧量、溶解氧、营养物质和重金属等多种环境因子,且这些因子与气候条件、饲料组分、投饵量和吸收率等都有较密切的关系[11]。考虑到环境因子的复杂性,在自然条件下确定哪种因素决定了ARGs 的赋存特征很难,未来需要扩大环境因子的检测种类,增加样品数量,构建综合模型来更好地研究ARGs在环境介质中的行为。
ARGs 与细菌群落之间存在着连锁效应、协同选择和进化的关系[32-33]。本文利用16S rRNA 基因高通量测序技术对不同位置的大黄鱼养殖海域沉积物的细菌群落结构进行分析,结果显示不同采样点的微生物组成结构存在明显差异,其中OS2、OS3和OS4样品中的微生物种类要显著高于OS1、OS5 和OS6(P<0.05)。进一步将6 个位点的大黄鱼养殖海域的水深(表1)与沉积物细菌群落Alpha 多样性指数(表3)进行相关性分析,结果显示物种总数指数(OTUs、ACE指数和Chao 指数)均与水深呈极显著或显著负相关(P<0.01 或P<0.05),说明海水深度越深,微生物种类越少[34]。尽管不同采样位置大黄鱼养殖海域沉积物中的菌群结构和优势菌群存在显著差异(P<0.05),但是不同海域沉积物中的ARGs基因类型基本一致。这个结果表明即使在不同地理位置上,同一养殖品种和同一养殖模式的海水养殖沉积物中ARGs的赋存状况也较相似,这也从侧面反映出海水养殖沉积物ARGs 的主要来源为水产养殖。这个结果与Hedberg 等[8]的研究结果一致。
ARGs 在不同种类的细菌群落之间迁移、转化和传播,使其在环境中持续残留,这比抗生素自身的残留对生态环境的危害更大[35]。因此,对大黄鱼养殖海域沉积物中ARGs 和微生物群落之间进行相关性分析至关重要。本研究的结果显示,丰度前20 的微生物菌属中有3 种菌属与ARGs 呈显著正相关(P<0.05),5 种菌属与ARGs 呈显著负相关(P<0.05)。徐秋鸿等[36]认为当微生物与目的ARGs 呈显著正相关时,这些微生物可能是ARGs 的潜在宿主;当微生物与目的ARGs 呈显著负相关时,这些微生物可能会影响ARGs 的水平转移。在本研究中,尽管有些菌属在沉积物样品中的相对丰度较低,但其却与多种ARGs存在显著相关性,说明在研究微生物与ARGs 的关系时,应尽可能扩大研究范围。此外,部分菌属与多种抗生素抗性类型ARGs 显著相关涉及多种耐药机制,而有些菌属仅与1 种抗生素抗性类型ARGs 显著相关,表明部分微生物可能是多种ARGs 的共同潜在宿主,这种存在也可能对ARGs 的分布特征和水平转移产生影响,导致细菌产生多重耐药性[37]。而少数ARGs 与2 种菌属之间呈显著或极显著正相关(P<0.05 或P<0.01),显示这些ARGs 可能有多个潜在的微生物宿主[38]。不同微生物携带ARGs 的偏好不同[36],后续研究也应积极探索ARGs 对养殖环境微生物之间转移的机理,为通过控制相关菌属丰度来消减ARGs提供理论基础。
4 结论
(1)利用宏基因组高通量测序方法能够获得更加全面的ARGs 信息。在大黄鱼养殖海域沉积物中,共检测出38种抗生素抗性类型,781个ARGs亚型,丰度最高的ARG 为macB(254.31×10-6~436.85×10-6),其次为tetA(58)(131.64×10-6~241.69×10-6)、evgS(87.00×10-6~193.42×10-6)和bcrA(76.75×10-6~128.89×10-6),不同站点沉积物中的优势ARGs 种类基本一致,主要的ARGs 抗生素抗性类型为四环素类、大环内酯类和氟喹诺酮类,主要的ARGs耐药机制为外排泵。
(2)对大黄鱼养殖海域沉积物中的pH、电导率、TOC、TN和TP进行检测,结果显示大黄鱼养殖海域沉积物已受到污染;相关性分析结果显示,除PNGM-1与电导率和TN 呈显著正相关(P<0.05)外,其余ARGs均与环境因子之间相关性不显著(P>0.05)。
(3)Proteobacteria 是各大黄鱼养殖海域沉积物样品中丰度最高的细菌门,但各站点沉积物中的微生物组成结构存在明显差异,且微生物群落结构对环境ARGs 的产生和分布具有显著影响,丰度前20 的微生物菌属中有8 种与ARGs 呈显著或极显著相关(P<0.05 或P<0.01),丰度前20 的ARGs 均与丰度前20 的菌属呈显著或极显著相关(P<0.05或P<0.01)。