燕麦K+,Na+积累与AsSOS1基因表达对盐胁迫的响应
杨 莉, 赵桂琴, 周向睿, 柴继宽, 杜文盼
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730000)
土壤盐渍化是最主要的非生物胁迫之一,严重影响作物的产量和品质,是植物生产的限制因素[1]。迄今为止,全球仍有7%的土地面积和20%的灌溉耕地受到土壤盐渍化的影响,而且这一数字还在增加[2]。我国盐渍土地面积约为9.913×104hm2,其中西北地区盐渍土地面积占全国总面积的69%,因此,如何改善土地盐渍化是西北地区面临的严峻挑战。已有的文献表明,种植耐盐植物是改良盐渍土地的有效方法之一,不仅可以取得生态效益,还能有一定的经济收益[3]。燕麦(AvenasativaL.)是禾本科燕麦属一年生草本植物,适口性好、富含碳水化合物和矿质营养,是优质的饲草[4],在我国北方地区广为种植[5]。要提高燕麦在盐渍土壤上的生产效益、扩大其种植区域,就必须要了解和掌握燕麦的耐盐性及其耐盐机理。
盐胁迫下植物因吸收水分较少而引起渗透胁迫,同时植物根系会吸收大量Na+离子而引起离子毒害[6-7]。Na+的液泡区域化是植物在高盐浓度下减少细胞质离子毒害和提高细胞渗透调节能力的一种重要适应机制[8-9],进入根细胞的Na+部分还会被根表皮细胞以主动运输的方式重新外排到土壤溶液中,抵消部分的Na+单向内流而使植物体内离子水平相对平衡[10];或者在外界的盐进入植物体内后将其集中在根部,防止其进入地上部分来适应盐胁迫[11]。番茄(Solanumlycopersicum)可通过使Na+在茎部的滞留来提高其耐盐能力[12]。
植物在正常生理条件下,细胞内K+浓度较高,Na+浓度相对较低,K+/Na+比例较高[13]。植物地上部限制Na+积累能力和保持K+/Na+值的能力与植物耐盐性有关,根系对K+的吸收能力和向叶片的转运能力也是耐盐性评价的重要指标之一。植物可选择性吸收K+并将其转运到体内,提高K+在叶片中的浓度[14]。盐胁迫下小麦(Triticumaestivum)地上部K+含量和K+/Na+比值均高于根系[15];盐敏感品种‘中国春’的K+流失速度显著高于耐盐品种‘长武134’(P<0.05)[16]。在NaCl胁迫下也可适当增加外源K+浓度来缓解盐胁迫[17]。外源添加KCl增强了红豆草(Onobrychisviciifolia)对盐渍环境的适应[18]。盐胁迫下按一定的K+/Na+比施用钾肥可缓解小麦的盐害并提高产量[19]。
植物的耐盐性可通过增加关键基因的表达量而得到提高。质膜定位的Na+/H+转运蛋白SOS1、高亲和性K+转运蛋白HKT以及液泡膜Na+/H+逆向转运蛋白NHX1都是参与植物耐盐性的关键转运蛋白[20]。Zhang等[21]构建了这些转运蛋白在星星草(Puccinelliatenuiflora)Na+稳态中的功能模型,盐胁迫下SOS1,HKT1;5和NHX1可以控制整个Na+转运系统,从而协同调节植物体内Na+稳态。在低盐胁迫下,叶中的PtNHX1缓慢地将Na+分隔到液泡中,反馈调节螯合Na+的能力增强,通过PtSOS1将叶片液泡中的Na+负载到根木质部。在高盐胁迫下,Na+通过PtNHX1快速且持续地被截留到叶肉细胞的液泡中,限制了长距离从根到茎的转运,以此来缓解盐胁迫造成的伤害。盐胁迫盐过度敏感(Salt overly sensitive,SOS)信号还影响其他亚细胞膜蛋白对Na+的区隔化的作用。质膜Na+/H+逆向转运蛋白SOS1主要介导Na+从细胞质向根际外排,同时阻止Na+从根系运输到地上部分[22]。高浓度NaCl能诱导盐地碱蓬(Suaedasalsa)根中SsSOS1的表达[23]。
目前已发现盐胁迫可诱导水稻(Oryzasativa)[24]、小麦[25]等的SOS1基因的表达。过表达SOS1可有效调节胞内K+/Na+平衡,提高耐盐能力。缺失突变体功能互补实验显示,SOS1显著提高了水稻、小麦的耐盐能力,使之较野生型更具耐盐性[24-25]。目前燕麦质膜Na+/H+转运蛋白SOS1的研究未见报道,其是否在燕麦耐盐性方面发挥作用以及作用机理如何尚未可知,因此本试验以转录组测序数据筛选到的编码SOS1转运蛋白的序列为基础,研究不同盐胁迫及K+,Na+互作胁迫下燕麦离子含量的变化及AsSOS1的表达模式,以期初步揭示燕麦耐盐的分子机理。
1 材料与方法
1.1 试验材料
课题组前期筛选出的耐盐材料‘青永久195’和盐敏感材料‘709’[26],均由甘肃农业大学草业学院提供。
1.2 育苗及盐处理
挑选籽粒饱满的燕麦种子,用75%的乙醇浸泡消毒1 min,然后用蒸馏水冲洗干净。播种在装有沙子的育苗杯(直径9 cm、高13 cm)中,放入光照培养室,生长条件为16 h(23±1)℃光照,8 h(20±1)℃黑暗,相对湿度为55%。在种子萌发前每天浇灌少量的蒸馏水,待幼苗长出两片真叶后,每3 d浇灌1 L的Hoagland营养液。生长3周后对幼苗进行以下处理:(1)不同浓度NaCl(0,30,60,90,120,150 mmol·L-1)处理24 h;(2)不同浓度KCl处理(0,0.5,1,2,4,8 mmol·L-1)处理24 h;(3)在含有30 mmol·L-1或150 mmol·L-1NaCl的Hoagland营养液中添加0.5 mmol·L-1KCl,分别处理0,12,36,72 h;(4)在含有30 mmol·L-1或150 mmol·L-1NaCl的Hoagland营养液中添加8 mmol·L-1KCl,分别处理0,12,36,72 h。每个处理3个重复。处理结束后,将一半新鲜燕麦叶片和根系于液氮中速冻后保存于—80℃超低温冰箱,用于检测AsSOS1基因表达量;一半烘干粉碎用于测定K+,Na+含量。
1.3 总RNA的提取及反转录
利用植物总RNA抽提纯化试剂盒(Sangon,B518661)提取燕麦叶片和根系总RNA,用MightyScript Plus第一链cDNA合成试剂盒(Sangon,B639251)反转成cDNA,放入—20℃冰箱保存备用。
1.4 荧光定量PCR分析
在NCBI Primer Blast中设计AsSOS1引物和Actin引物,引物序列如表1。按照SYBR Greenq RT-PCR试剂盒(天根,FP205)说明书在Roche Light Cycler 9 PCR荧光仪上进行qRT-PCR,采用 20 μL的反应体系,反应程序为:95℃ 15 min,不采集荧光信号;95℃ 10 sec,不采集荧光信号,60℃ 30 s,采集荧光信号,总共40个循环。具体成分和体积为:10 μL 2X SuperRealPreMix Plus,1 μL正向引物,1 μL反向引物,5 μL cDNA模板,3 μL ddH2O。以Actin基因作为内参,每个样本三个重复,采用2-ΔΔct相对定量法计算相对表达量。
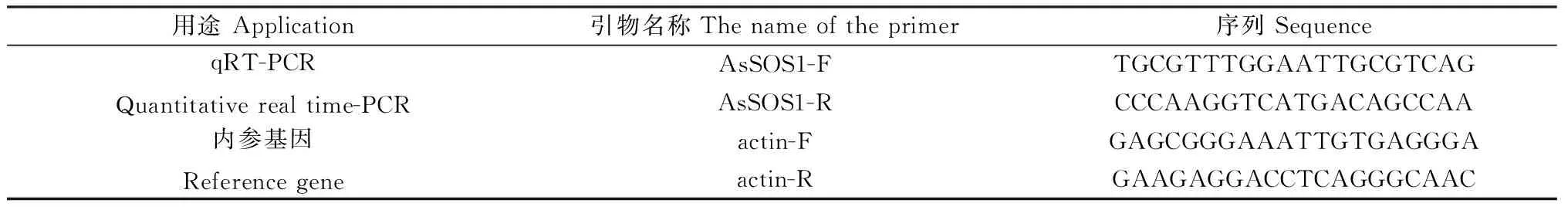
表1 试验所用引物及其序列Table 1 Cloning primers and sequences
1.5 离子含量测定
称取粉碎各植物组织0.1 g,放入20 mL试管中,加入100 mmol·L-1的冰乙酸10 mL,密封试管,90℃水浴2 h,冷却后过滤,利用滤液在火焰光度计上测定K+,Na+含量。
1.6 数据分析
使用Excel 2016对所有试验数据进行整理,用SPSS 26.0分析软件对数据进行单因素方差分析。
2 结果与分析
2.1 盐胁迫对燕麦K+,Na+含量的影响
2.1.1不同浓度NaCl,KCl对燕麦离子含量的影响 盐胁迫显著影响燕麦叶片和根中K+,Na+含量。随着NaCl浓度的增加,燕麦中K+含量呈下降趋势且叶片K+含量均高于根中(图1A)。在120 mmol·L-1处理下,‘青永久195’叶片、‘709’叶片和根中的K+含量最低,较对照分别下降了38.16%,18.47%和3.25%。‘青永久195’根中K+含量在150 mmol·L-1处理下最低,较对照下降40.31%。与此相反,燕麦叶片和根中含量随着NaCl浓度的增加呈上升趋势,且‘青永久195’的升幅小于‘709’(图1B)。在120 mmol·L-1NaCl处理下,‘709’叶片和根系中Na+含量分别是‘青永久195’的1.93倍和1.39倍。
燕麦叶片和根中K+含量随KCl浓度的增加呈下降-升高-下降的趋势(图2A)。在0.5 mmol·L-1处理下‘青永久195’和‘709’叶片中K+含量最低,较对照分别下降14.54%和5.34%,根中K+含量则在2 mmol·L-1处理下最低,较对照分别下降37.11%和33.95%。燕麦叶片和根中Na+含量随KCl浓度的增加呈先升后降的趋势(图2B)。在0.5 mmol·L-1处理下‘青永久195’叶片中Na+含量最高,较对照升高1.6倍,而根中Na+含量均低于对照。‘709’叶片和根中Na+含量则在2 mmol·L-1处理下最高,较对照分别升高了2.4倍和1.5倍。绝大多数KCl处理下‘青永久195’叶片和根系中的Na+含量均低于‘709’。
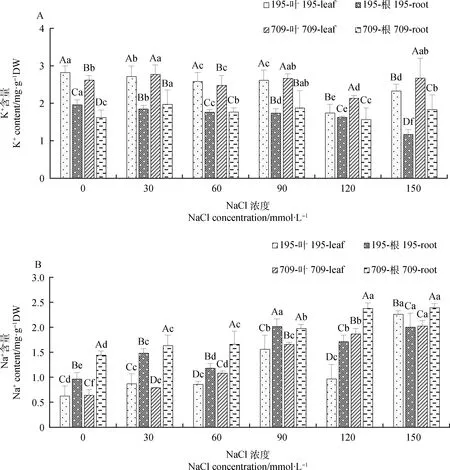
图1 不同浓度NaCl处理下燕麦的K+,Na+含量Fig.1 K+ and Na+ contents of oat under different concentrations of NaCl注:不同大写字母表示同一处理下不同材料不同组织间差异显著(P<0.05);不同小写字母表示不同处理下同一材料同一组织间差异显著(P<0.05)。下同Note:Different uppercase letters indicated significant differences among different materials and tissues under the same treatment (P<0.05);Different lowercase letters indicate significant differences between the same material and the same tissue under different treatments (P<0.05). The same as below
2.1.2不同浓度NaCl与0.5 mmol·L-1KCl互作对燕麦离子含量的影响 低浓度(30 mmol·L-1)NaCl与0.5 mmol·L-1KCl互作下,随着处理时间的增加,除‘709’叶片中K+含量无变化外,‘709’根系、‘青永久195’叶片和根系中K+含量均较对照下降(图3A)。Na+含量随处理时间的延长而增加(图3B),处理72 h时‘青永久195’的叶片和根系中Na+含量较对照分别增加了331.03%和113.24%,‘709’的叶片、根系中Na+含量较对照分别增加了228.21%和104.94%。所有处理时间下燕麦叶片中K+含量均高于根系,Na+含量低于根系,‘青永久195’叶片和根系中Na+含量均较‘709’低。
在高浓度(150 mmol·L-1)NaCl与0.5 mmol·L-1KCl互作处理下,K+含量随处理时间的延长总体呈先升高再下降的趋势(图3C)。‘青永久195’叶片中K+含量变化较小,根系中K+含量在处理72 h时也仅较对照下降了4.94%;而‘709’叶片和根系中K+含量则降低了17.45%和21.30%(P<0.05)。Na+含量随处理时间延长呈上升趋势(图3D),72 h时‘709’叶片和根系Na+含量分别是‘青永久195’的1.74倍和1.40倍。
2.1.3不同浓度NaCl与8 mmol·L-1KCl互作对燕麦离子含量的影响 在30 mmol·L-1NaCl与8 mmol·L-1KCl互作处理下,燕麦叶片中K+含量无变化,但‘青永久195’和‘709’根系中K+含量随处理时间的增加逐渐下降,分别在处理36 h和72 h时达到最低(图4A);二者叶片和根系中Na+含量随处理时间的延长逐渐增加(图4B)。72 h时‘青永久195’的叶片、根系中Na+含量较对照分别增加了121.74%和100.76%,而‘709’则分别增加了238.50%和107.32%。高浓度(150 mmol·L-1)NaCl与高浓度(8 mmol·L-1)KCl互作处理下,燕麦叶片和根系中K+含量随处理时间的延长先增后减(图4C),但Na+含量随处理时间的延长逐渐增加(图4D),且均在处理72 h时达到最大(P<0.05)。
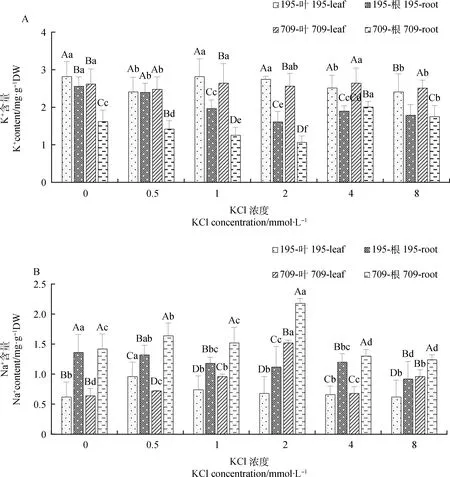
图2 不同浓度KCl处理下燕麦的K+,Na+含量Fig.2 K+ and Na+ contents of oat under different concentrations KCl treatment
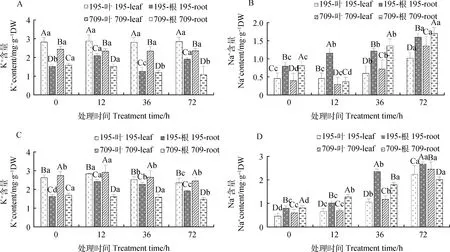
图4 30 mmol·L-1 NaCl与8 mmol·L-1 KCl(A和B)及150 mmol·L-1 NaCl与 8 mmol·L-1 KCl(C和D) 处理下燕麦K+,Na+含量Fig.4 K+ and Na+ contents of oat under 30 mmol·L-1 NaCl and 8 mmol·L-1 KCl (A and B) and 150 mmol·L-1 NaCl and 8 mmol·L-1 KCl (C and D) treatments
2.2 盐胁迫对燕麦K+/Na+平衡的影响
2.2.1不同浓度NaCl,KCl对燕麦离子平衡的影响 盐胁迫对燕麦离子平衡影响显著(P<0.05),叶片和根中的K+/Na+比随NaCl浓度的增加呈下降趋势(图5A)。最高浓度下‘青永久195’叶片和根系中K+/Na+比最低,分别为1.03和0.58;而‘709’在120 mmol·L-1NaCl处理下K+/Na+比最低。随着KCl浓度的增加,燕麦叶片和根中的K+/Na+比呈先下降再上升的趋势(图5B)。大多KCl处理下,‘青永久195’叶片和根系中K+/Na+比均显著高于‘709’(P<0.05)。

图5 不同浓度NaCl,KCl处理下燕麦的K+/Na+Fig.5 K+/Na+ of oat under treatments of different concentrations of NaCl and KCl
2.2.2不同浓度NaCl和KCl互作对燕麦离子平衡的影响 不同浓度NaCl和KCl互作下,燕麦叶片和根中的K+/Na+随处理时间的增加呈下降趋势(图6)。处理72 h时K+/Na+最低。绝大多数互作处理下,‘青永久195’和‘709’叶片中的K+/Na+显著高于根系中(P<0.05)。
2.3 盐胁迫对燕麦AsSOS1基因表达的影响
2.3.1不同浓度NaCl,KCl对燕麦AsSOS1基因表达的影响 不同种类及浓度的盐胁迫对燕麦AsSOS1基因表达有显著影响(P<0.05)。与对照相比,30~150 mmol·L-1NaCl处理均显著增加了燕麦叶片和根中AsSOS1基因的表达(P<0.05),且在根中的相对表达量增幅更大(图7A)。120 mmol·L-1和150 mmol·L-1NaCl处理下AsSOS1在‘青永久195’叶片和根系中相对表达量最大,是对照的5.9倍和7.6倍;而‘709’的叶片和根系在120 mmol·L-1和90 mmol·L-1NaCl处理下其AsSOS1的相对表达量最大,是对照的2.8倍和4.9倍。150 mmol·L-1NaCl处理下‘青永久195’叶片和根系中AsSOS1的相对表达量分别比‘709’高224.86%和141.49%。
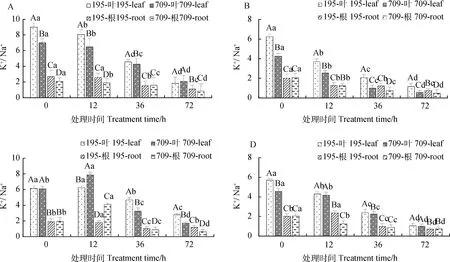
图6 NaCl与KCl互作下燕麦的K+/Na+Fig.6 K+/Na+ of Oat under interaction of NaCl and KCl注:图A-D分别为30 mmol·L-1 NaCl与0.5 mmol·L-1 KCl,150 mmol·L-1 NaCl与 0.5 mmol·L-1 KCl,30 mmol·L-1 NaCl与8 mmol·L-1 KCl和150 mmol·L-1 NaCl与 8 mmol·L-1 KCl处理下燕麦的K+/Na+Note:A-D shows K+/Na+ of oat under 30 mmol·L-1 NaCl and 0.5 mmol·L-1 KCl,150 mmol·L-1 NaCl and 0.5 mmol·L-1 KCl,30 mmol·L-1 NaCl and 8 mmol·L-1 KCl,and 150 mmol·L-1 NaCl and 8 mmol·L-1 KCl,respectively
燕麦叶片和根中的AsSOS1相对表达量随KCl浓度的增加而增加(图7B)。‘青永久195’在低浓度(0.5 mmol·L-1)处理下根中的表达量高于叶片,高浓度(1~8 mmol·L-1)处理下则相反,其叶片和根中AsSOS1 的相对表达量均在8 mmol·L-1KCl处理下达到最大,较对照增加了308.71%和188.47%。‘709’的叶片和根分别在4 mmol·L-1和8 mmol·L-1KCl处理下其AsSOS1表达量最大,较对照增加了95.69%和171.44%。


图7 不同浓度NaCl,KCl胁迫下燕麦AsSOS1的相对表达量Fig.7 Relative expression of oats AsSOS1 under different concentrations of NaCl and KCl
2.3.2不同浓度NaCl和KCl互作对燕麦AsSOS1表达量的影响 NaCl和KCl互作也显著影响了AsSOS1基因的表达(P<0.05)。随着处理时间的增加,燕麦叶片和根中的AsSOS1相对表达量呈上升趋势,均在处理72 h时达到峰值。在30 mmol·L-1NaCl与0.5 mmol·L-1KCl互作下,燕麦叶片中的AsSOS1相对表达量在处理12 h和36 h时增幅大于根系中(图8A)。在30 mmol·L-1NaCl与8 mmol·L-1KCl互作下‘青永久195’叶片中AsSOS1相对表达量均大于根系,而‘709’在处理36 h时根系中AsSOS1相对表达量大于叶片,72 h时相反(图8B)。在150 mmol·L-1NaCl与0.5 mmol·L-1KCl互作处理72 h时,燕麦根系中AsSOS1相对表达量的增幅大于叶片(图8C)。150 mmol·L-1NaCl与8 mmol·L-1KCl互作下,也基本表现为根系中的相对表达量大于叶片中(图8D)。
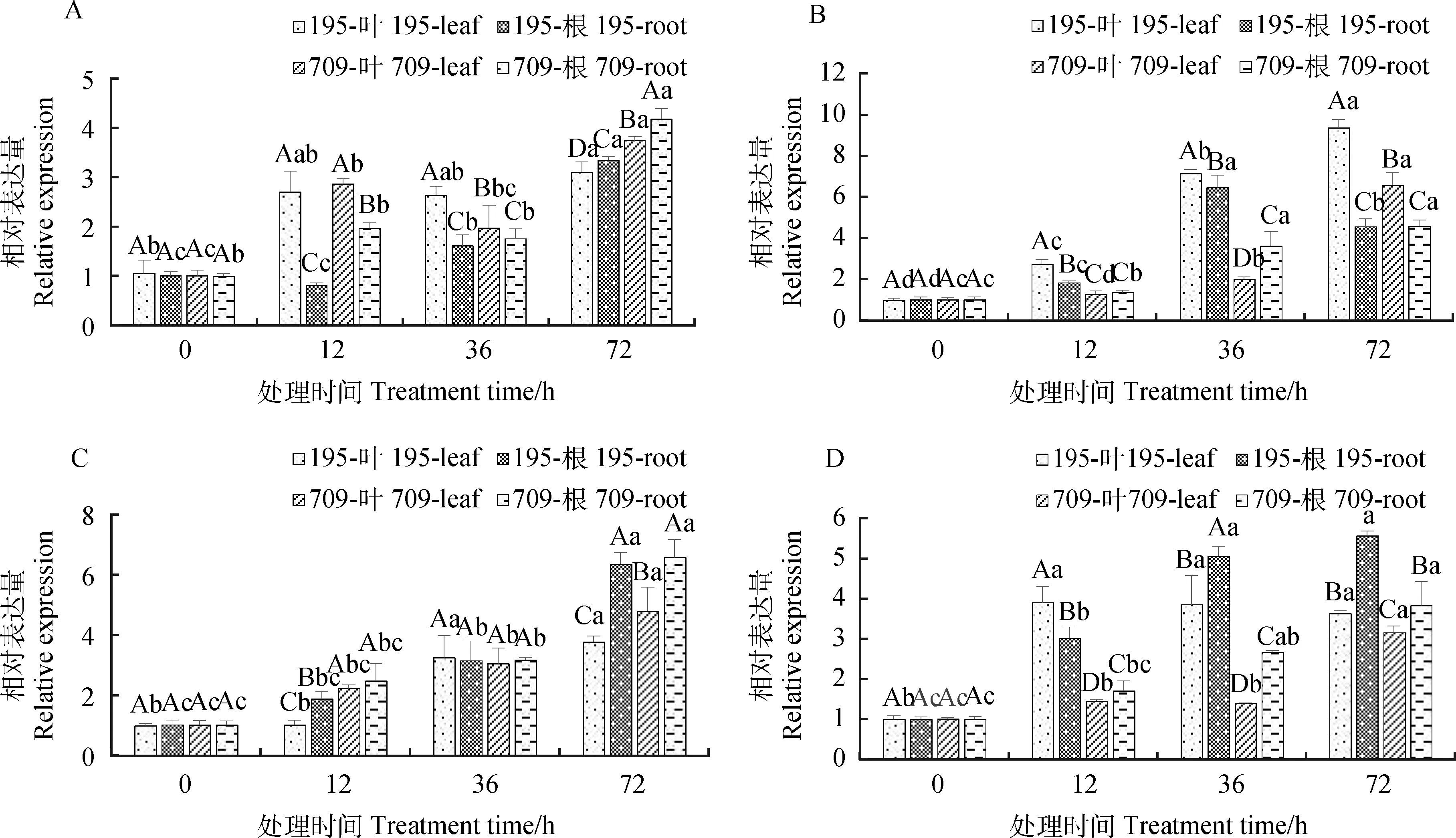
图8 NaCl与KCl互作下燕麦AsSOS1相对表达量Fig.8 The relative expression of AsSOS1 in oat under NaCl and KCl interaction注:图A-D分别为30 mmol·L-1 NaCl与0.5 mmol·L-1 KCl,30 mmol·L-1 NaCl与8 mmol·L-1 KCl,150 mmol·L-1NaCl与0.5 mmol·L-1 KCl和150 mmol·L-1 NaCl与 8 mmol·L-1 KCl处理下燕麦AsSOS1相对表达量Note:Figure A-D shows the relative expression of AsSOS1 in oat under 30 mmol·L-1 NaCl and 0.5 mmol·L-1 KCl,30 mmol·L-1 NaCl and 8 mmol·L-1 KCl,150 mmol·L-1 NaCl and 0.5 mmol·L-1 KCl and 150 mmol·L-1 NaCl and 8 mmol·L-1 KCl,respectively
3 讨论
细胞质中过多的Na+会引起离子毒害,影响植物对K+的吸收[27-28]。维持胞质中低Na+含量和细胞内离子稳态,尤其是K+和Na+稳态,对于活细胞的一系列生理生化过程以及植物对盐胁迫的适应至关重要[29]。植物在盐碱地必须排出吸水时吸收的过多Na+,否则就会在体内中达到非常高的浓度[30]。由于茎叶的叶肉细胞对盐的敏感性高于根系,所以排出茎叶中的Na+对作物的耐盐性非常重要[31]。玉米(Zeamays)在盐胁迫10 d后Na+含量随NaCl浓度的增加逐渐升高,耐盐品种根中Na+含量大于盐敏感品种,而茎叶中的Na+含量小于盐敏感品种;K+含量逐渐降低但耐盐品种K+含量降幅小于盐敏感品种[32]。本研究中随着盐浓度的增加和处理时间的延长,燕麦叶片和根系中K+含量逐渐降低,而Na+含量逐渐升高。‘青永久195’叶片和根系中K+含量高于‘709’、Na+含量低于‘709’,说明其可能通过限制Na+吸收及其从根向地上部运输并促进地上部K+的吸收来维持叶片K+/Na+平衡。而维持较高的K+/Na+对植物适应高盐环境至关重要,盐胁迫下燕麦耐盐型K+/Na+比值均高于盐敏感型[33]。NaCl胁迫下大麦(Hordeumvulgare)幼苗地上部K+/Na+均明显低于对照,且随盐浓度的增加而减小[34]。盐胁迫下耐盐小麦品种‘济麦22’体内K+/Na+高于敏盐品种‘河农6425’[35]。与低浓度(0.1 mmol·L-1)KCl处理相比,10 mmol·L-1KCl显著提高了盐胁迫下燕麦幼苗的鲜重、干重和相对含水量[36]。本研究中燕麦叶片中K+/Na+显著高于根中(P<0.05),耐盐材料‘青永久195’叶片和根系中K+/Na+均显著高于敏盐材料‘709’(P<0.05)。
SOS1主要介导Na+从细胞质向根际外排,同时还能阻止Na+从根系长距离运输到地上部,从而维持细胞离子的平衡,以缓解盐胁迫对植物造成的伤害[37-39]。程玉祥[40]在对星星草质膜型SOS1蛋白的qRT-PCR分析结果显示,PtSOS1基因受盐胁迫诱导表达明显上调。刘雪华等[41]对苦荞(Fagopyrumtataricum)拒盐基因FtSOS1在盐胁迫下的表达量研究发现,随着NaCl浓度的增加,FtSOS1基因在苦荞根部、茎基部和叶片的相对表达量显著(P<0.05)增加,且在新株系‘川荞1号-1’中的表达量明显高于‘川荞1号’,这可能是新株系耐盐性提高的重要原因。本研究发现,盐胁迫下燕麦AsSOS1基因在根和叶片均有表达,且表达量随盐胁迫浓度的增加和胁迫时间的延长呈增加趋势,说明燕麦AsSOS1基因的表达明显受盐胁迫诱导和调节,且K+和Na+均能诱导其表达。在不同盐处理下,耐盐材料‘青永久195’的AsSOS1基因表达均高于盐敏感材料‘709’,说明其耐盐性的提高可能是通过大幅提高AsSOS1基因的表达量来实现的,这与Zhang等[42]的结果一致。
由于根部分生组织没有液泡,盐胁迫下不能进行Na+区隔化[43],只有通过上调AsSOS1基因的表达,一方面将进入根系的Na+及时排出体外,以维持较低的Na+含量;另一方面有利于将木质部蒸腾流中的Na+及时吸收以减少地上部Na+含量。Shi等[44]在拟南芥(Arabidopsisthaliana)中过表达AtSOS1基因,发现它是控制Na+从根到地上部长距离运输的关键。黄坤勇[45]在研究黄花草木樨(Melilotusofficinalis)SOS1基因表达模式时发现根部MoSOS1表达水平高于地上部,本试验中燕麦在NaCl、高浓度NaCl与KCl互作处理下也得到相同的结论。植物在正常生理条件下,细胞内K+浓度较高,Na+浓度相对较低,K+/Na+比值较高[13]。当K+/Na+比值较低时,植物会限制Na+向体内转运,选择性吸收K+并将其转运到体内,提高K+在叶片中的浓度,从而提高其耐盐性[44]。‘青永久195’在高浓度KCl处理、多数NaCl与高浓度KCl互作处理下AsSOS1基因在叶片中的表达量均高于根系中,可能是燕麦根部吸收了较多K+、较少Na+,维持着较高的K+/Na+比值;而K+对Na+转运无影响,使叶片中Na+含量增加,进而增加了AsSOS1在叶片中的表达量。
4 结论
盐胁迫下耐盐材料‘青永久195’中K+含量高于盐敏感材料‘709’而Na+含量低于后者,因而拥有较高的K+/Na+比值,且叶片中的比值高于根系。AsSOS1基因在燕麦根、叶中均有表达,盐胁迫会显著提高其表达水平。AsSOS1是燕麦响应盐胁迫的重要基因,通过限制Na+向地上部运输、维持较高的K+/Na+比值来减缓高盐胁迫造成的伤害。

