EBUS-TBNA联合ROSE对肺门纵隔疾病的诊断价值
严正平
张家港市中医医院 呼吸与危重症医学科,江苏 张家港 215600
引言
肺门和纵隔是人体组织解剖结构中一个最复杂的区域,其病变多位于气管腔外并多靠近纵隔大血管,常缺乏特征性临床表现,影像改变不明显导致影像学检查的误诊率较高,而且病理检查标本的获取有一定困难。早期广泛使用的经皮肺穿刺活检仅能对一部分肺内病变进行诊断,目前尚无法用于纵隔病变的诊断[1];尽管纵隔镜获取的标本较为满意,但操作时需气管插管,创伤大且费用昂贵,使其临床应用受到限制[2]。经气管镜超声引导针吸活检(Endobronchial Ultrasound-Guided Transbronchial Needle Aspiration,EBUS-TBNA)是在超声小探头实时监测下,对病灶内的血流及其周边血管的关系进行观察,在避免误穿血管的同时透过气管壁对病灶进行精准穿刺活检,提高了安全性[3]。快速现场评价(Rapid On-Site Evaluation,ROSE)是由细胞或微生物病理学家对介入操作获取的穿刺标本进行现场制片、染色及快速评价,进而将穿刺成功与否反馈给操作者,以指导下一步操作[4-6]。目前已有多项文献报道,经支气管超声引导鞘、电子支气管镜、LungPro导航支气管镜等技术联合ROSE在肺外周结节、肺癌以及肺部感染的诊断中均有较高价值[7-8]。然而鲜有将EBUS-TBNA联合ROSE用于肺门纵隔淋巴结肿大的诊断报道,因此本研究旨在探讨EBUS-TBNA联合ROSE对肺门纵隔疾病的诊断价值。
1 材料和方法
1.1 研究对象
回顾性收集2016年3月至2020年1月于我院就诊的127例肺门或纵隔淋巴结肿大患者的临床资料,其中仅行EBUS-TBNA者52例,记为非C-ROSE组,行EBUS-TBNA联合快速现场细胞学评价(Cytological ROSE,C-ROSE)者75例,记为C-ROSE组。
纳入标准:① CT、胸部增强CT影像学提示肺门或纵隔淋巴结肿大且直径≥15 mm;② 常规纤维支气管镜检查未发现支气管腔有明显外压和肿物;③ 检查前未确诊其他肺部疾病及无超声支气管镜检查禁忌证;④ 术前心电图检查、血液生化指标以及其他基础项目检查均完善。
排除标准:① 合并严重心肝肾肺以及凝血功能异常者;② 有心、肺等重要脏器手术史者;③ 对麻醉镇静药物有过敏史者;④ 临床资料不完整者。本研究已经我院医学伦理委员会批准同意(伦理批准号:ZYGZY2016-LL-01)。
1.2 方法
1.2.1 EBUS-TBNA
所有患者于检查前禁食、禁饮≥4 h,建立静脉通道,取仰卧位,吸入雾化2%利多卡因进行局部麻醉,全程监护心电图、监测指脉氧,先采用常规支气管镜观察管腔,清理呼吸道,再将超声支气管镜的凸面探头与气道壁贴近并到达目标位置,在超声模式下对肿物或肿大淋巴结的大小和部位进行探查,以确定行病灶和/或淋巴结EBUS-TBNA,再次给予2%利多卡因充分麻醉,调整超声支气管镜至合适的穿刺部位,并对病灶大小和穿刺距离进行测量,在彩色多普勒超声模式下对病灶内的血供情况以及病灶与邻近血管的关系进行观察,并确定穿刺部位和方向,将穿刺针(OLYMPUS NA-201SX-4021,21 G)经工作通道送入,连接负压空针反复抽吸20次左右,解除负压后拔除穿刺针,用针管将穿刺物用力推出。非C-ROSE组由手术医师根据经验和获得的标本情况确定穿刺针数,C-ROSE组则依据C-ROSE结果、有无临床特殊需求等确定穿刺针数。所有患者的手术均由气管镜室同一组有资质的手术和麻醉医师操作完成。
1.2.2 C-ROSE
若获得组织条样的穿刺标本,则将其轻推至干净玻片中央,以滚片法制片;若仅获得细胞液穿刺标本,则将穿刺针内液体推出,以喷片法制片,C-ROSE采用迪夫染色试剂盒,严格参照说明书完成染色,于显微镜下由细胞病理学医师根据细胞学特征进行现场快速对标本充分性和初步诊断评估,当穿刺标本为非诊断材料、恶性细胞比例低以及因临床特殊需要等时,则再次进行穿刺。若为阳性C-ROSE结果即可于原部位穿刺,若为阴性C-ROSE结果则需更换部位获取穿刺标本并重新进行C-ROSE分析,每例患者穿刺针数不超过7针。当穿刺标本为阳性且满意时,则需进行恰当分检,记录镜下细胞学特征以及C-ROSE诊断结果,结束操作即可。所有组织标本均经固定后送至病理科进行病理学检查,并由病理科医师判断是否行免疫组化检查,细胞学涂片则进行细胞病理学检查。所有送病理学检查的标本制片后分别由2名有资质的病理科医师进行阅片,所有C-ROSE操作和判定均由相同的2名细胞病理室的细胞病理学医师操作完成;若出现结果不一致,则由2名医师协商最终决定结果。
1.3 判定标准
1.3.1 穿刺标本合格性判定
所有组织条标本均进行组织学检查,细胞液标本进行细胞学检查,显微镜观察任一标本可见数个淋巴细胞团、明显异型细胞等可将该穿刺标本判定为合格。若显微镜下可见大量呼吸道黏膜细胞、红细胞,仅少量有核细胞,则可将该穿刺标本判定为不合格[9]。
1.3.2 C-ROSE结果判定
所有获取的染色涂片由细胞病理学医师于显微镜下根据细胞学特征进行现场快速对标本充分性判断和初步诊断评估,发现癌细胞,则认为穿刺结果阳性;未发现癌细胞,则认为穿刺结果阴性。每例患者任何一个部位ROSE结果阳性,则认为总结果阳性;全部部位ROSE结果阴性,则认为总结果阴性。
1.3.3 诊断结果判定
送检的穿刺组织或细胞学标本若有明确的病理诊断结果,即可作为最终诊断结果。若送检的穿刺组织或细胞学标本病理诊断为阴性,则征求患者意愿,采用经皮肺穿刺活检、纵隔镜、胸腔镜及开胸手术等有创操作收集标本,病理诊断明确者即作为最终诊断结果[10];由于各种原因未能进一步接受有创检查的患者,行经验性治疗并随访至少6个月,将被验证后的临床诊断作为最终诊断结果。
1.3.4 诊断学指标
真阳性指受试者有病且实际被判为阳性;假阳性是指受试者无病,但被判为阳性;真阴性是指受试者无病且实际被判为阴性;假阴性是指受试者有病,但被判为阴性。真阴性率(特异性)=真阴性例数/(真阴性例数+假阳性例数)×100%。真阳性率(敏感度)=真阳性例数/(真阳性例数+假阴性例数)×100%。阴性预测值=真阴性例数/(假阴性例数+真阴性例数)×100%。阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%。准确度=(真阳性例数+真阴性例数)/(真阳性例数+真阴性例数+假阳性例数+假阴性例数)×100%[11]。
1.4 评价指标
2组患者的一般资料、EBUS-TBNA情况、穿刺标本合格率、并发症发生情况、最终诊断结果、对肺癌的诊断价值以及一致性。
1.5 统计学分析
实验数据采用SPSS 16.0进行统计分析,以n(%)表示计数资料,采用χ2检验比较;以±s表示计量资料,采用独立样本t检验比较。一致性采用Kappa检验分析,0.80<Kappa≤1.00表示一致性强,0.60<Kappa≤0.80表示一致性较强,0.40<Kappa≤0.60表示一致性中等。以α=0.05为检验水准,以P<0.05为差异有统计学意义。
2 结果
2.1 C-ROSE显微镜下形态学特征
C-ROSE显微镜下主要细胞学特点:① 腺癌,肿瘤细胞呈粘附紧密的小/中等细胞簇、癌细胞较大且胞浆较丰富、核仁大而清楚(图1a);② 鳞状细胞癌,大部分肿瘤细胞呈粘附紧密的大细胞簇、癌细胞大、核仁部分呈多个(图1b);③ 淋巴瘤,细胞体积大、染色质丰富、形态异常(图1c)。
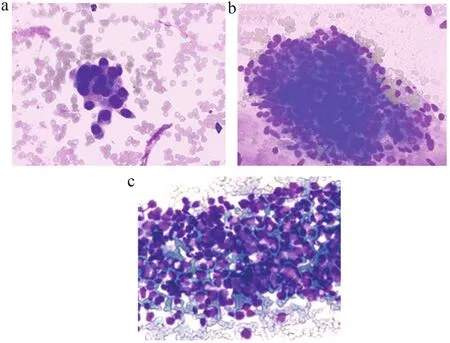
图1 C-ROSE显微镜下形态学特征(迪夫快速染色方法,×400倍)
2.2 2组患者的一般资料
2组患者的性别、年龄、吸烟史、淋巴结部位以及淋巴结直径差异均无统计学意义(P>0.05),见表1。
表1 2组患者的一般资料[(±s),n(%)]

表1 2组患者的一般资料[(±s),n(%)]
组别 年龄/岁 性别/例 吸烟史/例 淋巴结部位/例 淋巴结直径/例男女隆突下 非隆突下 >2 cm ≤2 cm非C-ROSE组(n=52) 53.87±6.59 30(57.69) 22(42.31) 29(55.77) 24(46.15) 28(53.85) 22(42.31) 30(57.69)C-ROSE组(n=75) 55.24±6.68 47(62.67) 28(37.33) 48(64.00) 31(41.33) 44(58.67) 36(48.00) 39(52.00)t/χ2值 1.143 0.318 0.872 0.291 0.401 P值 0.255 0.573 0.351 0.590 0.527
2.3 2组患者EBUS-TBNA情况
非C-ROSE组52例患者中,行肿大淋巴结EBUSTBNA者42例,共穿刺108针,获取组织条83条(76.85%);行病灶EBUS-TBNA者12例,其中有2例左肺肿物、7例右肺肿物以及3例纵隔肿物,共穿刺31针,获取组织条25条(80.65%);有2例患者肿大淋巴结和病灶均行EBUS-TBNA。C-ROSE组75例患者中,行肿大淋巴结EBUS-TBNA者56例,共穿刺152针,获取组织条116条(76.32%);行病灶EBUS-TBNA者21例,其中有4例左肺肿物、14例右肺肿物以及3例纵隔肿物,共穿刺50针,获取组织条41条(82.00%);有2例患者肿大淋巴结和病灶均行EBUS-TBNA。2组镜下肿大淋巴结或病灶直径、平均穿刺针数、平均穿刺深度、平均穿刺淋巴结个数以及穿刺淋巴结位置分布差异均无统计学意义(P>0.05),见表 2~3。
表2 2组患者穿刺情况(±s)

表2 2组患者穿刺情况(±s)
组别 肿大淋巴结EBUS-TBNA 病灶EBUS-TBNA短径/cm 穿刺个数/个 穿刺针数/针 穿刺深度/cm 直径/cm 穿刺针数/针 穿刺深度/cm非C-ROSE组 2.63±0.75 1.98±0.51 2.57±0.56 2.01±0.36 3.70±1.52 2.58±0.61 2.23±0.39 C-ROSE组 2.59±0.72 2.07±0.57 2.71±0.68 1.98±0.33 3.76±1.59 2.38±0.54 2.26±0.43 t值 0.267 0.809 0.295 0.428 0.106 0.977 0.199 P值 0.790 0.421 0.768 0.669 0.916 0.336 0.843
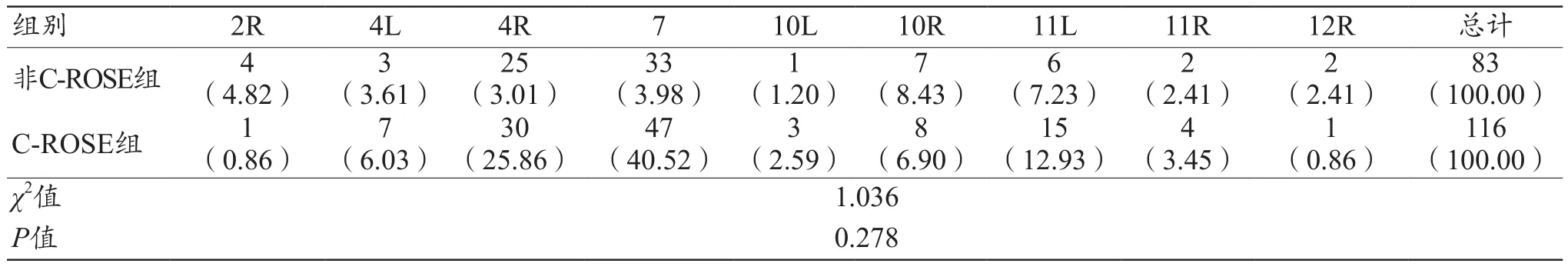
表3 2组患者穿刺淋巴结位置分布[n(%)]
2.4 2组患者穿刺标本合格率
非C-ROSE组有1例仅抽吸出细胞液标本进行细胞学检查,共有5例穿刺标本不合格,合格率为90.38%;C-ROSE组有4例仅抽吸出细胞液标本进行细胞学检查,共有1例穿刺标本不合格,合格率为98.67%,2组差异有统计学意义(χ2=4.680,P=0.031)。
2.5 2组患者并发症情况
非C-ROSE组和C-ROSE组术中均有多例患者出现极少量(<5 mL)和轻度出血(5~20 mL),经简单局部处理后即停止出血,未对后续操作造成影响,不再作为并发症进行统计。非C-ROSE组,淋巴结EBUS-TBNA术中中度出血(20~100 mL)者有2例,病灶EBUSTBNA术中中度出血者有2例;淋巴结EBUS-TBNA术后10 d内有1例出现明显皮下气肿,病灶EBUS-TBNA术后2 h内有1例大咯血(>150 mL)。C-ROSE组,淋巴结EBUS-TBNA术中未有中度出血(20~100mL)发生,病灶EBUS-TBNA中度出血者有1例,术后无并发症发生。非C-ROSE组并发症总发生率为11.54%,C-ROSE组并发症总发生率为1.33%,2组差异有统计学意义(χ2=6.141,P=0.013)。
2.6 最终诊断结果
非C-ROSE组52例患者中,有29例经肿大淋巴结EBUS-TBNA后获得病理明确诊断,8例经病灶EBUSTBNA后获得病理明确诊断,共37例患者获得术后明确病理诊断为肺癌;15例未获得病理明确诊断的患者中,经进一步有创操作取样后确诊为肺癌4例、淋巴结结核2例、胸腺细胞肿瘤1例、肺结节病1例;随访后有7例经影像学提示高度可疑,进一步确诊为肺癌4例、炎性假瘤3例。非C-ROSE组共有肺癌45例、炎性假瘤3例、淋巴结结核2例、胸腺细胞肿瘤1例、肺结节病1例。
C-ROSE组75例患者中,有49例经肿大淋巴结EBUS-TBNA后获得C-ROSE明确诊断,18例经病灶EBUS-TBNA后获得C-ROSE明确诊断,共67例患者获得术后C-ROSE明确病理诊断为肺癌;8例未获得C-ROSE明确诊断的患者中,经组织病理学确诊为肺癌1例,接受有创操作取样后获得明确诊断的有4例,其中淋巴瘤2例、肺结节病2例;随访后有2例确诊为肺癌、1例为炎性假瘤。C-ROSE组共有肺癌70例、炎性假瘤1例、淋巴瘤2例、肺结节病2例。
2.7 EBUS-TBNA联合C-ROSE取样对肺癌的诊断价值
非C-ROSE组诊断率为71.15%,C-ROSE组为89.33%,差异有统计学意义(χ2=6.843,P=0.009)。非C-ROSE组和C-ROSE组分别有37例和67例真阳性、7例和5例为真阴性、8例和3例为假阴性,无假阳性结果出现。2组特异性、阳性预测值均为100.00%,阴性预测值差异无统计学意义(P>0.05)。C-ROSE组对肺癌的诊断的敏感度和准确度均高于非C-ROSE组,差异有统计学意义(P<0.05),见表4。

表4 EBUS-TBNA联合C-ROSE取样对肺癌的诊断价值(%)
2.8 2组患者诊断肺癌的一致性
非C-ROSE组ROC曲线提示曲线下面积(Area Under Curve,AUC)为 0.812,Kappa系数 0.555(95%CI:0.300~0.810),与最终诊断结果的一致性中等(t=4.467,P<0.001);C-ROSE组 ROC 曲线提示 AUC 为 0.846,Kappa系数 0.749(95%CI:0.479~1.019),与最终诊断结果的一致性较强(t=6.698,P<0.001),见图2。
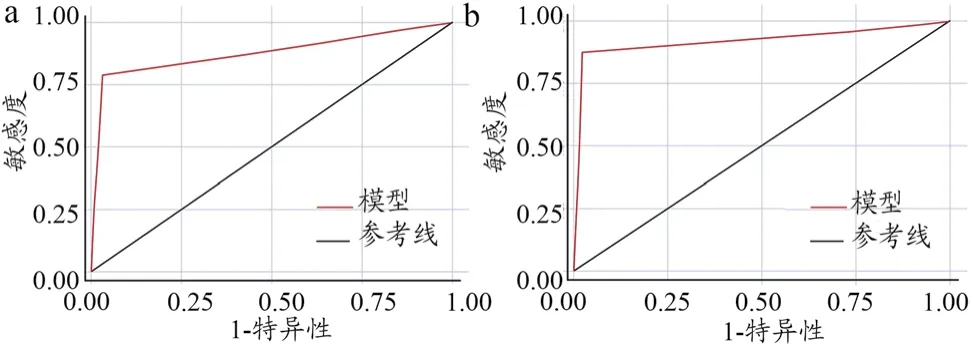
图2 非C-ROSE组(a)与C-ROSE组(b)ROC曲线
3 讨论
作为一种近年新兴的胸部微创诊断技术,EBUSTBNA在胸部疾病诊断中发挥着越来越重要的作用[12-13],其通过将超声学与内镜学相结合,经超声探头的引导,清晰而准确地辨认肺部解剖结构,确保穿刺路径准确无误。EBUS-TBNA不仅适用于肺癌淋巴结分期的诊断,还能用于诊断肺内和纵隔肿瘤以及不明原因的肺门纵隔淋巴结肿大。然而EBUS-TBNA所用穿刺针较细,常导致标本取材不甚满意,一方面穿刺标本太少是穿刺失败的主要原因,另一方面穿刺针无法与支气管壁保持垂直,易使穿刺点落在气管软骨上,穿刺针被软骨组织阻塞后无法获取满意的标本。作为一项细胞形态学的快速诊断技术,C-ROSE可通过现场对穿刺物进行立即制片、染色及观察,以及时准确地评价取材质量,进而决定是否继续穿刺,甚至作出初步病理诊断。
C-ROSE早已在国外现代化介入肺脏病诊疗中广泛使用,尽管有研究表明EBUS-TBNA联合ROSE受益并不十分明显,但却对减少并发症和提高确切诊断的效率极为有利。本研究中,尽管非C-ROSE组和C-ROSE组的平均穿刺针数和穿刺深度差异无统计学意义,但C-ROSE组穿刺标本合格率明显提高,并发症总发生率明显降低。该结果与向青等[14]报道的在疑诊肺癌中,EBUS-TBNA联合C-ROSE能提高穿刺标本的合格率、减少并发症的结果一致。分析认为,C-ROSE组没有为了减少穿刺针数而停止穿刺,而是在保证安全的同时,依据C-ROSE结果决定;阴性时需改变穿刺部位;阳性结果但临床所需标本更多或恶性细胞比例低且无并发症发生时,则在原部位继续穿刺,这样在提高穿刺标本质量的同时,还能避免采用胸腔镜、纵隔镜以及开胸手术等更大创伤的操作取材,进而减轻患者疼痛、减少并发症。有文献推荐EBUS-TBNA穿刺3~5针[1],而本研究非C-ROSE组平均穿刺针数偏少,可能造成结果的偏倚;本研究为回顾性分析,纳入的样本量不够大以及其他混杂因素可能均对结果造成一定影响。
Ravaioli等[15]在评估经TBNA或EBUS-TBNA获得的273例肺癌患者的细胞学标本中,相比组织病理结果,ROSE准确率可达90%~97%。Caupena等[16]通过一项前瞻性研究表明ROSE诊断与最终诊断符合率较高,且在EBUS-TBNA过程中联合使用ROSE能够提高标本的合格性。杨芳等[17]在对外周肺感染性病变肺结核的检查中发现,超细支气管镜联合ROSE系统具有较高的诊断率。沈青等[18]采用EBUS-GS技术结合ROSE诊断肺外周结节的结果表明,ROSE组诊断恶性病变的特异性为85.71%、敏感度为93.54%、阴性预测值为75%、阳性预测值为96.66%,且与组织病理学结果一致性较强。本研究结果进一步佐证了上述报道,C-ROSE组诊断率、敏感度、准确度均较高,与最终诊断结果的一致性较强。分析原因为,C-ROSE既能对EBUSTBNA所取样本的质量进行把关,进而获取符合要求的样本,又能在组织标本损失量少的情况下快速得到诊断结果,使分流送检更加合理,样本利用率得到有效提高,进而利于疾病的诊断以及诊疗。然而EBUS-TBNA联合C-ROSE使用的局限性在于,不但需要专业的气管镜医师,还需要病理学医师进行现场阅片[14]。有研究表明,专科的细胞病理学医师C-ROSE评估的准确率为92%,而经过ROSE检查系统培训3个月的临床操作医师准确率为80%[19]。
综上,EBUS-TBNA联合ROSE诊断肺门纵隔淋巴肿大,可提高穿刺标本质量、减少并发症,提高诊断率、敏感度以及准确度。本研究仍存在一定的不足之处:① 研究为单中心回顾性分析且纳入的病例数不够多;② 诊断结果中未对肺癌进行详细分期和分型;③ 未归纳总结C-ROSE镜下病变细胞的形态学特点。今后将通过扩大研究中心、加大样本量前瞻性分析EBUS-TBNA联合C-ROSE对肺癌分期和分型的诊断价值,并进一步总结C-ROSE镜下不同肺癌细胞的形态学特点,以期为临床应用提供指导。

