一氧化氮合酶抑制剂减轻哮喘模型小鼠气道炎性反应
王 斐,李文轩,丁俊琼,刘 珍,王晓明,杨 菊,王大连*
复旦大学附属上海市第五人民医院 1.儿科;2.病理科,上海 200240
哮喘(asthma)是一种慢性变应性炎性气道疾病,由多种炎性细胞、气道结构细胞及细胞组分参与,伴有气道高反应性[1]。一氧化氮(nitric oxide, NO)是哮喘气道炎性反应的特征性分子之一[2]。NO通过形成毒性活性氮(reactive nitrogenspecies, RNS)可能促进气道炎性反应及损伤[3]。一氧化氮合酶(nitric oxide synthase, NOS)是NO的重要来源,有3种类型:诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、内皮型一氧化氮合酶(endothelial nitric oxide syn-thase, eNOS)和神经型一氧化氮合酶(neuronal nitric oxide synthase, nNOS)[4]。目前关于NOS抑制剂是否能改善哮喘尚未完全明了,本研究拟通过建立小鼠哮喘模型探讨NOS抑制剂在哮喘中的治疗作用。
1 材料与方法
1.1 材料
1.1.1 实验动物: 50只SPF级雌性BABL/c小鼠,4~6周龄,体质量12~16 g(北京斯贝福生物技术有限公司)。所有动物已获得复旦大学实验动物科学部动物福利和伦理小组批准(动物伦理审查编号:2018五院JS003)。
1.1.2 主要试剂:卵清蛋白(ovalbumin, OVA)、氢氧化铝、S-甲基异硫脲硫酸盐(S-methyl isothiourea sulfate, SMT)和N-硝基-L-精氨酸甲酯(N-nitro-L-arginine methyl ester, L-NAME)(Merck公司);NG-单甲基-L-精氨酸(NG-monomethyl-L-arginine, L-NMMA)(Thermo Fisher公司);白细胞介素2(IL-2)、白细胞介素4(IL-4)、白细胞介素17(IL-17)和肿瘤坏死因子α(TNF-α)ELISA试剂盒(BD公司);一氧化氮检测试剂盒、苏木精染液和伊红染液(上海碧云天生物技术有限公司)。
1.2 实验方法
1.2.1 小鼠的分组及处理:将小鼠随机分为对照组(n=10)和模型组(n=40)。用OVA雾化吸入致敏激发制作哮喘模型小鼠。实验第1、7、14天将小鼠一次性腹腔注射OVA混悬液2 mL(OVA 100 mg,氢氧化铝100 mg)以致敏,休息1周,第22天起,以 2% OVA溶液按最大雾化量进行超声雾化,小鼠自然吸入40 min,诱发哮喘,每天1次,共持续7 d。以烦燥、挠鼻、抓身、咳嗽、喷嚏、呼吸急促深快及点头运动等症状的出现,并利用小动物气道阻力和肺顺应性检测系统来验证。对照组小鼠进行0.9%氯化钠溶液腹腔注射和雾化。将40只成功建模的小鼠随机分为哮喘组(n=10)、SMT(iNOS抑制剂)组(n=10)、L-NAME(eNOS抑制剂)组(n=10)、L-NMMA(总NOS抑制剂)组(n=10)。哮喘组给予0.9%氯化钠溶液雾化,其余3组分别予2% SMT、2% L-NAME、2% L-NMMA雾化,每次40 min,1 d 1次,持续7 d。
1.2.2 气道高反应的测定:末次干预后24 h内,腹腔注射戊巴比妥液麻醉小鼠后,充分暴露气管,剪开气管前壁并插入专用气管插管套管,气管插管与压力传感器相连,测量肺内压力。使用流量传感器测定气流和潮气量。先记录1 min基线呼吸肺阻力(pulmonary/lung resistance,RL)(baseline)(cmH2O s/mL),等基线平稳后,依次给予0、1.5、3、6、12和24(mg/mL)的乙酰甲胆碱液进行雾化30 s,记录雾化后5 min内的呼吸情况,取检测值的平均值作为该激发浓度下的肺阻力RL(response)值。RL的计算方法是用肺内压力除以气流。将实测的RL值换算成肺阻力增加的相对倍数(fold increase)作为评价气道高反应性的指标,公式如下:Fold increase of RL=[RL(response)/RL(baseline)]-1。
1.2.3 收集血液、支气管肺泡灌洗液(bronchial lavage fluid, BALF)和计数细胞:气道高反应检测后摘眼球取血备用。处死小鼠,用100 mL PBS冲洗肺,左气管插管收集BALF,向肺内注入3 mL PBS,抽吸3次。将细胞悬液4 ℃ 1 000 r/min离心10 min,然后重悬于1 mL 0.9%氯化钠溶液中。对BALF中的白细胞进行Wright-Giemsa染色并计数。
1.2.4 HE染色检测肺组织炎性反应:取右肺固定于10%的多聚甲醛溶液中,然后采用梯度乙醇进行脱水处理,包埋于石蜡,苏木精-伊红(HE)染色,显微镜观察并采图。
1.2.5 ELISA检测血浆、BALF和肺组织匀浆NO、IL-2、IL-4、IL-17、TNF-α水平:按照ELISA试剂盒说明进行。
1.3 统计学分析
2 结果
2.1 小鼠肺阻力(RL)的变化
与对照组相比,乙酰甲胆碱激发后,哮喘组的气道阻力明显增加(P<0.05);与哮喘组相比,各NOS抑制剂组气道阻力均减小(P<0.05),尤其SMT组。乙酰甲胆碱浓度呈剂量依赖性减轻哮喘小鼠的肺阻力(图1)。

图1 小鼠气道高反应的变化
2.2 小鼠BALF细胞计数
与对照组相比,哮喘组小鼠支气管肺泡灌洗液中细胞总数及各分类均明显增加(P<0.05)。与哮喘组相比,SMT组细胞总数及分类均明显减少(P<0.05);L-NAME组细胞总数明显减少(P<0.05),中性粒细胞、淋巴细胞、嗜酸粒细胞、巨噬细胞计数无明显下降;L-NMMA组细胞总数、嗜酸粒细胞计数、巨噬细胞计数明显减少(P<0.05),中性粒细胞、淋巴细胞计数无明显下降(表1)。

表1 小鼠BALF细胞计数
2.3 NOS抑制剂对肺组织炎性反应的影响
与对照组比较,哮喘小鼠气管及血管旁有大量炎性细胞浸润,以中性粒细胞、嗜酸性粒细胞、单核细胞为主;可见支气管黏膜皱襞延长增多,平滑肌增厚,部分管腔缩窄、杯状细胞增殖、黏液分泌增加。上述表现在使用NOS抑制剂后有所改善,尤其是在SMT组(图2)。

图2 小鼠肺组织的病理变化
2.4 NOS抑制剂可降低血浆NO及炎性因子浓度
与对照组比较,哮喘组NO、IL-2、IL-4、IL-17、TNF-α明显升高 (P<0.05)。与哮喘组比较,SMT组NO、IL-2、IL-4、IL-17、TNF-α明显降低(P<0.05)。与哮喘组比较,L-NAME组NO、IL-2、IL-17、TNF-α明显降低(P<0.05)。与哮喘组比较,L-NMMA组NO、IL-2、IL-4、IL-17、TNF-α明显降低(P<0.05)(表2)。

表2 血浆NO及细胞因子浓度变化
2.5 NOS抑制剂降低BALF中NO及炎性因子的浓度
与对照组比较,哮喘组NO、IL-2、IL-4、IL-17、TNF-α明显升高 (P<0.05)。与哮喘组比较,SMT组NO、IL-2、IL-4、IL-17、TNF-α明显降低(P<0.05)。与哮喘组比较,L-NAME组NO、IL-2、IL-17、TNF-α明显降低(P<0.05)。与哮喘组比较,L-NMMA组NO、IL-2、IL-4、IL-17、TNF-α明显降低 (P<0.05)(表3)。

表3 BALF中NO及细胞因子浓度变化
2.6 NOS抑制剂降低肺组织匀浆NO水平
与对照组比较,哮喘组NO明显升高 (P<0.05)。与哮喘组比较,SMT组及L-NMMA组NO明显降低(P<0.05),以SMT组为甚;L-NAME组NO浓度无明显降低(图3)。
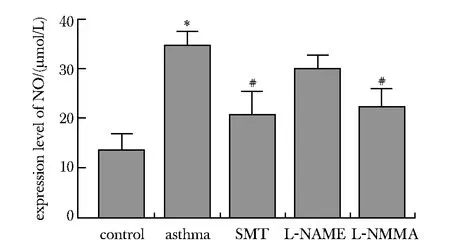
*P<0.05 compared with control group; #P<0.05 compared with asthma group
3 讨论
哮喘是儿童最常见的慢性呼吸道疾病,粒细胞浸润与哮喘严重程度有密切关系,当前哮喘的长期治疗仍以糖皮质激素抗炎为主,但存在激素依赖或抵抗,且仍有部分患者不能得到有效控制,故切断哮喘气道粒细胞炎性反应的发生发展是重要的研究方向。哮喘小鼠气道中存在多种炎性细胞[5],其中中性粒细胞出现时间更早于嗜酸性粒细胞[6]。中性粒细胞能分泌广泛的细胞因子,参与先天和适应性免疫。NO作为一种多效性信号分子, 在哮喘中的作用可能是多方面的。儿童哮喘的严重性与气道高反应性、气道嗜酸性粒细胞升高和高呼出气一氧化氮分数相关[7]。NO还具有调节多种中性粒细胞功能,如黏附、趋化、吞噬、细菌杀伤、活性氧生成、胞外诱捕网形成等[6]。坏死的中性粒细胞释放多种胞内容物加重炎性反应,募集更多的炎性细胞产生炎性因子,对周围的组织产生损伤,并延迟炎性反应的消除。本研究也证实在NO浓度较高时,气道的炎性细胞浸润明显,血清和BALF中 IL-2、IL-4、IL-17、TNF-α浓度明显升高,且存在气道高反应的增加。
一氧化氮在人体由一氧化氮合酶(NOS)催化L-精氨酸脱胍基所产生,有3种亚型:神经元型NOS (nNOS)、诱导型NOS (iNOS)和内皮型NOS (eNOS)。iNOS在气道上皮细胞和巨噬细胞中特异性表达,受细胞因子和/或促炎物质刺激,不依赖于钙浓度激活NO[9]。SMT是一种iNOS抑制剂,L-NAME是一种eNOS抑制剂,L-NMMA是一种总NOS抑制剂。有研究显示,iNOS抑制剂能减低哮喘患者的呼出气一氧化氮水平,但并未改善气道高反应性或炎性细胞的数量[10]。另外的研究表明[11],NOS抑制剂能降低哮喘气道高反应性、触发抗炎效应,这跟本研究一致。还有一些研究中[12],iNOS在气道反应性或炎性反应方面似乎不太可能为哮喘提供益处。在本研究中,加入3种NOS抑制剂,NO含量下降,且绝大部分细胞因子的水平降低,气道高反应也有改善,这在SMT组更明显。
综上所述,本研究表明NOS抑制剂,尤其是SMT能有效减轻哮喘气道炎性反应,为研发新的哮喘治疗药物提供了理论依据。

