HL-J6抗耐甲氧西林金黄色葡萄球菌基因转录组学研究*
段 浩,刘婧怡,曹 宇,张珊珊,李海波,马 雷
(1.佳木斯大学临床医学院,黑龙江 佳木斯 154007;2.中国人民解放军陆军军医大学药学与检验医学系微生物与生化药学教研室,重庆 400038;3.重庆市沙坪坝区陈家桥医院检验科,重庆 400038;4.佳木斯大学附属第一医院,黑龙江 佳木斯 154007)
金黄色葡萄球菌为葡萄串状的革兰阳性菌,败血症、脓毒血症、坏死性筋膜炎等多种临床疾病都可能由金黄色葡萄球菌感染所致[1]。耐甲氧西林金黄色葡萄球菌(MRSA)是临床常见的耐药菌,其造成的感染已成为世界三大难治感染性疾病之一[2]。近年来,抗生素滥用导致其对金黄色葡萄球菌的疗效逐渐变差,耐药问题变得十分严重[3]。万古霉素治疗MRSA不仅会产生耐药性,还会导致低血压、中性粒细胞减少等不良反应,剂量不足和治疗时间延长还会升高最低抑菌浓度(MIC),从而导致疗效欠佳或治疗失败等情况[4],故常与利福平联用,然而耐利福平金黄色葡萄球菌分离株出现的频率逐年升高,有研究发现,金黄色葡萄球菌对利福平产生耐药性可能与rpoB基因的突变相关[5]。通过基因转录组测序(RNA-seq)技术可了解化合物作用于金黄色葡萄球菌后发生了相应变化的基因,再通过基因本体论(GO)富集分析、京都基因与基因组百科全书(KEGG)通路富集分析可了解其功能,从而揭示特定生物学过程及疾病发生过程的分子机理。与其他技术相比,RNA-seq有灵敏度高、高通量、高分辨率、成本相对较低等显著优势[6]。近年来,新型吲哚苯醌类药物HL-J6被认为具备高MRSA抑制性能。该药物对MRSA有抗菌活性,具备一定的临床应用价值,有望为临床防治MRSA提供新思路、新途径。但其抗菌的具体机制尚未明晰。因此,本研究中采用RNA-seq技术对经药物处理和未经处理MRSA菌株的基因转录组水平进行分析后,根据NCBI,UniProt等网站的功能注释,对表达产生变化的基因进行研究,从而探讨HL-J6抑制MRSA可能的机制。现报道如下。
1 材料和方法
1.1 仪器、试药与菌株
仪器:HFSAFE-1500型生物安全柜(力康生物医疗科技控股有限公司);ZWY-211C型恒温培养振摇器(上海智城分析仪器制造有限公司);CFX96 Touch型荧光定量聚合酶链反应仪(百乐科技有限公司)。
试药:苯唑西林(北京索莱宝生物科技有限公司,批号为O8350);头孢唑林(上海吉至生化科技有限公司,批号为C29510);氨苄西林(上海生工生物工程股份有限公司,批号为A610028-0025);万古霉素(上海易恩化学技术有限公司,批号为1404-93-9);利奈唑胺(批号为L830356)、莫匹罗星(批号为M812891),均购自上海麦克林生化科技有限公司;HL-J6(四川大学华西药学院何菱教授团队合成);MHB培养基(北京索莱宝科技有限公司,批号为M8556)。
菌株:耐甲氧西林金黄色葡萄球菌MRSA252;甲氧西林敏感的金黄色葡萄球菌(MSSA)标准菌株ATCC25923,均购于美国菌种保藏中心(ATCC)。
1.2 方法
菌株培养:从-80℃冰箱中取出甘油保种冻存的MRSA252和ATCC25923,分别接种至MHB固体培养基中,37℃培养24 h,随后挑取单菌落接种至MHB液体培养基中,37℃培养过夜,取200μL菌液至20 mL培养基中,37℃摇动培养5~6 h(此时细菌活力最强),备用。
MIC和最低杀菌浓度(MBC)测定:采用微量肉汤稀释法检测苯唑西林、头孢唑林、氨苄西林、万古霉素、莫匹罗星、利奈唑胺、HL-J6对上述2种菌株的MIC。将2种菌株菌液稀释至105cfu/mL,取196μL于96孔板中,随后加入4μL上述各药液稀释,使其最终质量浓度为128.0,64.0,32.0,16.0,8.0,4.0,2.0,1.0,0.5μg/mL。37℃培养24 h后,肉眼观察MHB培养基的浑浊度,无浑浊时的药液最低质量浓度即为该药物的MIC[7]。吸取肉眼观察无细菌生长的96孔板中的液体100μL,接种至MHB培养皿中,培养过夜,观察培养皿上的菌落数[7],以无细菌生长固体培养基对应的药液质量浓度为MBC。
细菌样本制备及RNA-seq:首先,挑取三段划线法接种的MRSA252单菌落,接种至MHB液体培养基中活化后,取200μL菌液加入20 mL培养基中,37℃振摇培养5~6 h。随后分别取4 mL菌液,各依次加入0.5,0.625,0.75,0.875,1倍MIC的HL-J6,37℃振摇培养3 h,由于0.75倍MIC是不抑制细菌生长的最高药物质量浓度,故取加入0.75倍MIC的菌液2 mL作为实验组放入保种管中急冻,并与对照组(未经任何药物处理的菌液)一起交由诺禾致源公司进行RNA-seq。为保证分析数据质量,首先筛选数据,即过滤原始数据中低质量的读数,使clean reads所占比例不低于80%。测定并计算鸟嘌呤(G)和胞嘧啶(C)含量以检测有无A(腺嘌呤)和T(胸腺嘧啶)、GC分离现象(该现象可能由测序或建库造成,且会影响后续的定量分析),GC含量>65%或<35%时均会增加测序难度。测序错误率可反映数据质量,通常Q20>90%,Q30>85%为正常情况。
富集分析:包括GO富集和KEGG通路富集分析。其中GO富集分析包括生物过程、细胞组成、分子功能3个部分。通过对差异基因的分析,可了解经HL-J6处理的MRSA在遗传水平上的变化;通过KEGG通路富集分析可了解经HL-J6处理后差异基因所富集的通路,根据通路中各基因表达的变化从而推测出该药物对MRSA产生的影响以及药物对MRSA作用的方式。
实时逆转录聚合酶链反应(real-time RT-PCR):该方法对基因的相对表达量进行评估以验证RNAseq数据。首先用RNAprep pure Cell/bacteria Kit RNAprep pure来提取MRSA252的总RNA,再用TaKaRa primeScriptTMRT Reagent Kit将RNA反转录成cDNA,最后,使用TaKaRa SYBR Premix Ex Taq进行real-time RT-PCR。所用基因及引物见表1。

表1 基因及引物Tab.1 Gene and primer sequences
1.3 统计学处理
采用SPSS 22.0统计学软件分析,Graphpad Prism 9.0软件作图。两组间比较行t检验。P<0.05为差异有统计学意义。
2 结果
2.1 MIC和MBC
前述7种药物对ATCC25923的MIC分别为2,2,32,1,0.5,1,4μg/mL,MBC分别为4,4,32,2,0.5,1,8μg/mL;对MRSA252的MIC分别为>128,>128,128,0.5,1,0.5,2μg/mL,MBC分别为>128,>128,128,1,1,1,8μg/mL。说明HL-J6不仅可抑制MSSA,还可抑制MRSA的生长,虽然其MIC高于万古霉素、利奈唑胺等临床一线药物,但仍有较强的抑菌效果。
2.2 转录组谱的一般特征
本研究中,对照组(样本编号a,b,c)和实验组(样本编号d,e,f)的cDNA文库中分别得到了24,150,404和24,70,982个clean reads。
2.3 GC含量和测序错误率情况
结果见表2。
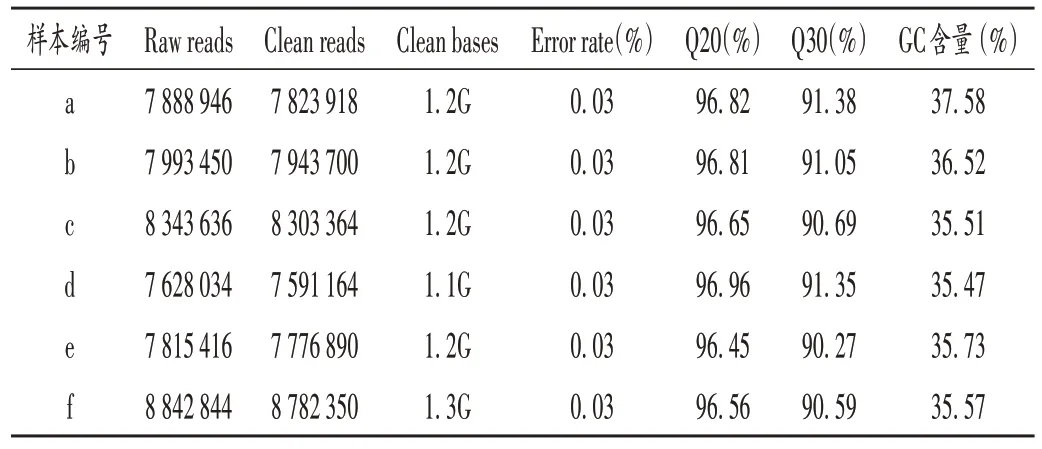
表2 测序数据质量情况Tab.2 Quality of sequencing data
2.4 MRSA中的差异表达基因
为明确HL-J6处理前后MRSA252中基因表达的变化,|log2(fold change)|>0.264(即|fold change|>1.2008)且P<0.05为有差异的基因。结果差异基因共630个,其中包括288个表达上调基因,342个下调基因。在差异表达的基因中,|log2(fold change)|>2的差异基因共25个,其中14个表达显著上调,11个显著下调,见图1 A。
2.5 差异基因聚类分析
聚类分析用以衡量基因或样本之间表达是否有相似性,分析结果见图1B,表达模式相近的基因或样本会被聚在一起,这些基因可能参与了共同的信号通路,也可能有相同功能。在聚类图中,横坐标代表样本的聚类,每列都代表1个样本,样本中基因表达越相似,则会越靠近。纵坐标代表基因聚类,每行代表1个基因,同样,表达越相似,越靠近。
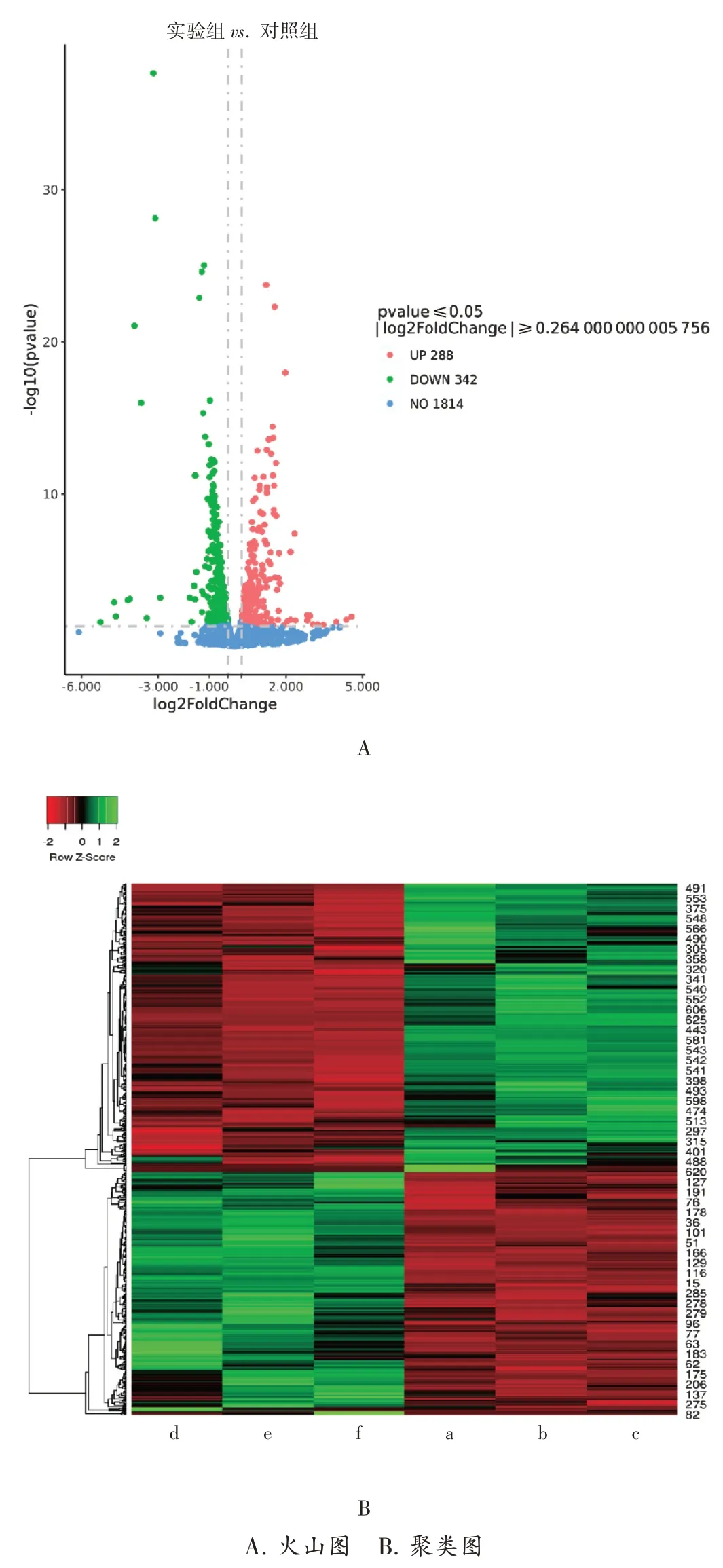
图1 差异基因的特征A.Volcano map B.Cluster mapFig.1 Characteristics of differential genes
2.6 富集分析
差异基因GO富集分析结果见图2A(图中展示了较显著的30个条目)。KEGG通路富集中,实验组共富集到62条通路,其中较显著的20条通路见图2B。与MRSA生长有关的通路如下。
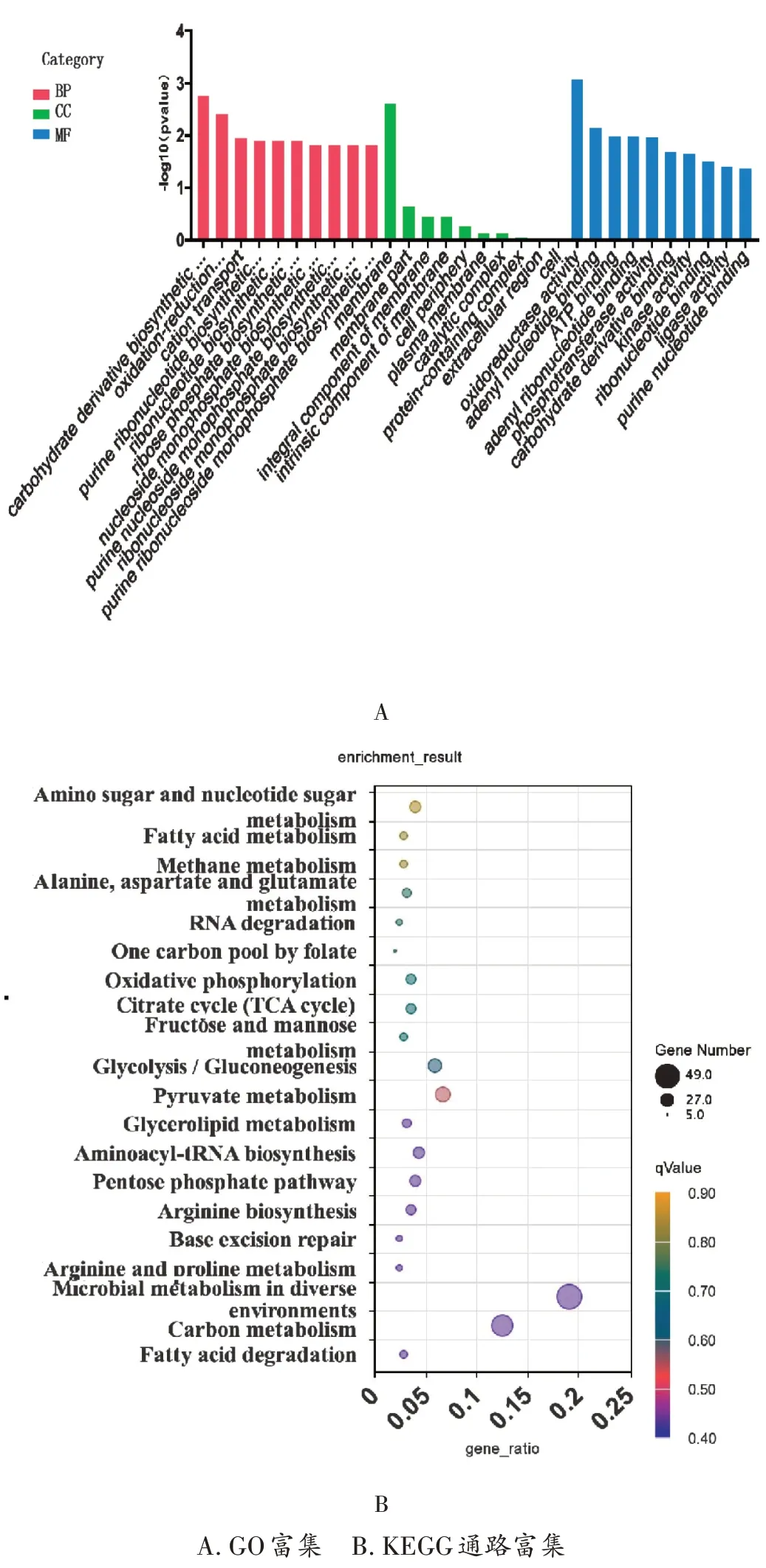
图2 差异基因富集分析A.GO enrichment B.KEGG pathway enrichmentFig.2 Enrichment analysis of differential genes
HL-J6影响肽聚糖生物合成相关通路:结果见图3。金黄色葡萄球菌的细胞壁是由肽聚糖和磷壁酸组成的,某些抗生素,例如磷霉素可通过干扰肽聚糖的生物合成来抑制MRSA的生长。在经过HL-J6处理后,发现肽聚糖生物合成相关基因发生了变化。其中,UDP-N-乙酰氨基葡糖烯醇式丙酮酸转移酶(MurA)下调1.77倍,MurD下调1.28倍,MraY和MurG分别下调1.27倍和1.35倍。说明HL-J6可能通过干扰细胞壁合成而抑制MRSA的生长。
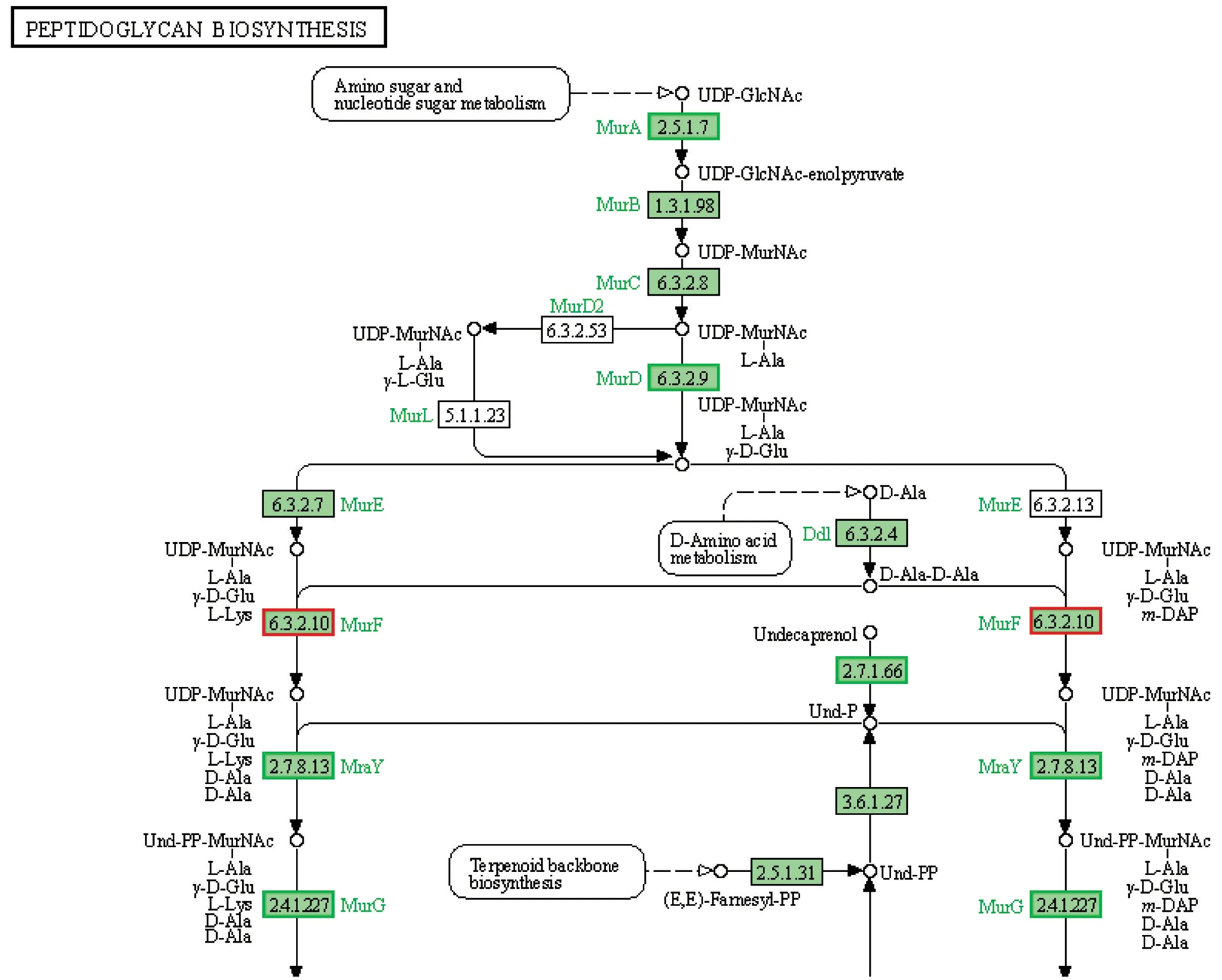
图3 HL-J6影响的肽聚糖生物合成相关通路Fig.3 Peptidoglycan biosynthesis-related pathways affected by HL-J6
HL-J6影响叶酸生物合成途径:叶酸在合成代谢中起到了不可或缺的作用,其可为核苷酸和氨基酸的生物合成提供不同氧化水平的单碳单位[8]。其中,二氢叶酸还原酶(DHFR)是一种催化二氢叶酸(DHF)为四氢叶酸(THF)的酶,它在叶酸合成和DNA复制中是必需的,也是常见的抗生素靶点[9]。如图4A所示,dfrB编码DHFR,该基因与对照组相比表达下调1.70倍,由此推断,HL-J6可能通过抑制DHFR从而抑制叶酸的合成,进而对MRSA产生杀伤作用。
HL-J6影响甘油磷脂代谢:磷脂酰甘油(PG)是存在于细菌以及动植物中的关键阴离子,在金黄色葡萄球菌中的含量十分丰富,同样也是金黄色葡萄球菌细胞膜的主要成分。磷脂酰甘油磷酸合酶(pgsA)定位于细胞膜上,是PG合成的关键酶,从图4B中可知,pgsA表达下调1.33倍。
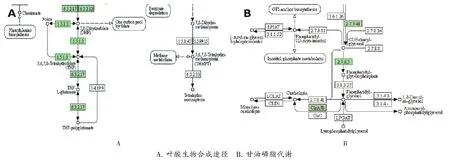
图4 HL-J6影响的KEGG通路A.Folic acid biosynthesis pathway B.Glycerolipid metabolismFig.4 KEGG pathway affected by HL-J6
HL-J6影响ABC转运途径:ABC家族几乎存在于所有生物中,参与细胞内外物质的转运,各种各样的ABC转运蛋白有助于细菌运输对自己有利的物质而排出对自己不利的物质[10]。MntC为金属结合蛋白,与细菌必需的金属离子Mn2+相结合。由图5A可知,与对照组相比MntC表达下调1.48倍。同时,SAOUHSC_01991、SAOUHSC_01990分别下调8.69,9.09倍。
HL-J6影响细菌分泌系统:Sec依赖性蛋白转位酶由SecYEG和SecDF·YajC作为膜蛋白的寡聚体复合物组成,而SecA作为ATP酶发挥作用,它是一种定位于细胞质和细胞膜上的可溶性蛋白质[11],为Sec依赖性蛋白转位提供能量[12-13]。结果见图5B,其中SecA表达下调l.62倍。
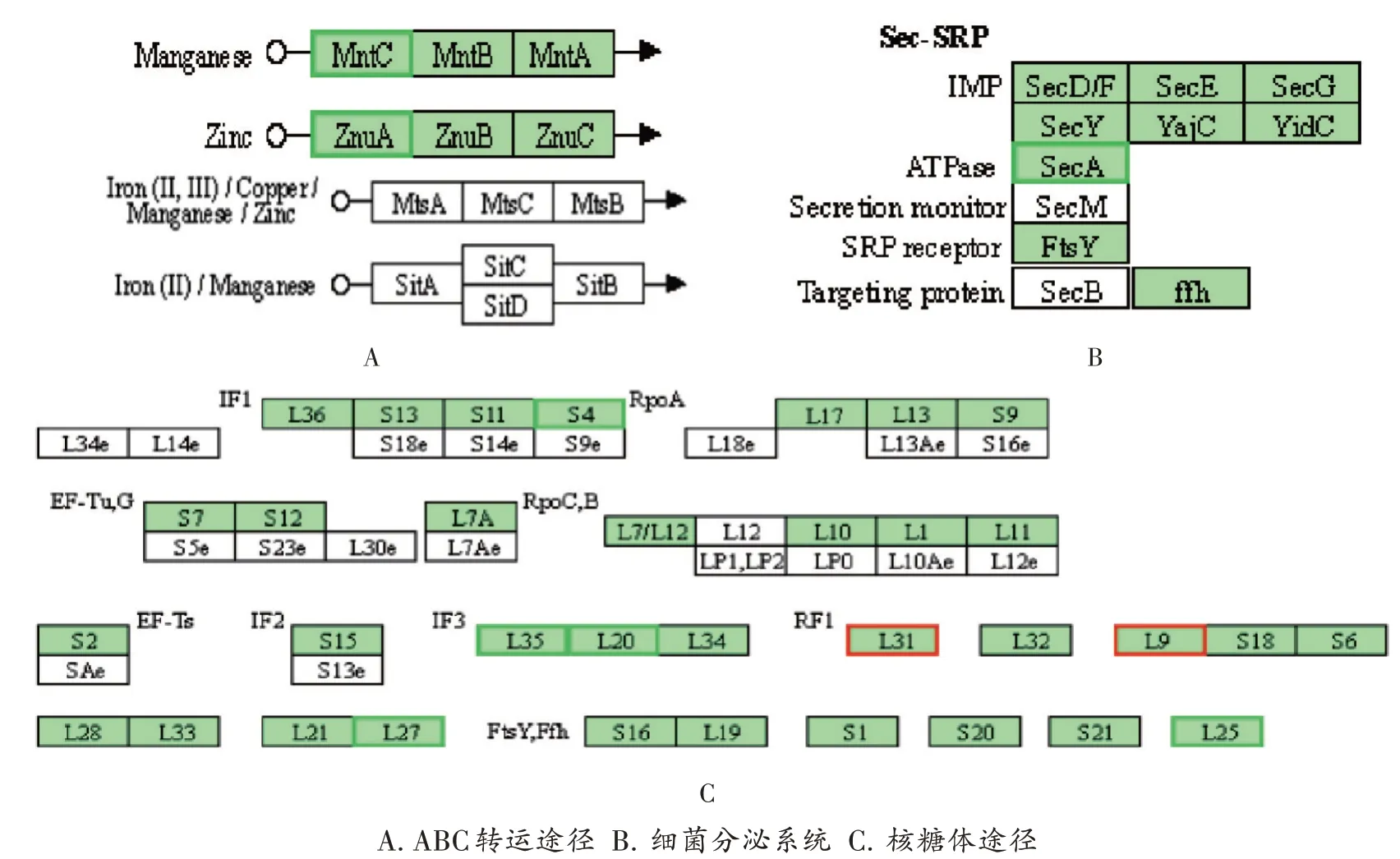
图5 HL-J6影响的KEGG通路A.ABC transport route B.Bacterial secretory system C.Ribosomal pathwayFig.5 KEGG pathway affected by HL-J6
HL-J6影响核糖体途径:核糖体在细菌中负责蛋白质合成,它由亚基50S和30S组成,其中50S亚基为大亚基,由23s和5sRNA以及其他蛋白质组成;而30S亚基为小亚基,由16sRNA和另外20个蛋白质组成。假如细菌蛋白质的合成过程被打断,其生长就会受到相应影响,所以细菌的核糖体就显得尤为重要。经研究发现,实验组核糖体合成相关基因rpsD,rpmI,rplT等分别下调1.23,1.68,1.64倍,提示HL-J6可能通过作用于细菌蛋白质合成相关的基因来杀灭细菌,如图5C所示。
2.7 real-time RT-PCR验证
经验证后,0.5倍MIC组与对照组相比,细胞壁相关基因MurA和MurD表达均显著下调,说明化合物HL-J6可通过抑制MRSA细胞壁的生长而抑制该细菌活力。详见图6。
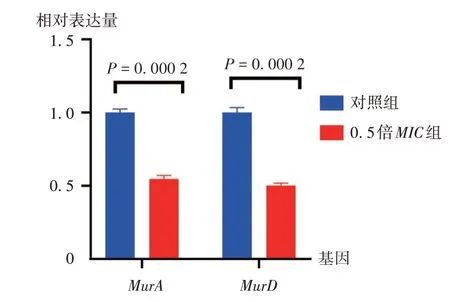
图6 Mur A、MurD的相对表达量Fig.6 Relative expression quantity of MurA and MurD
3 讨论
金黄色葡萄球菌严重危害人类健康[14],可定殖于人体各部位,且对多药具有耐药性,这也是目前其感染后久治不愈的原因,故被称为“超级细菌”。目前,公认对其疗效较好的药物为万古霉素,但近年来耐万古霉素的菌株不断出现,传统抗生素或已不能满足临床治疗需求。
本研究中发现,HL-J6对MRSA的确存在良好的抑菌效果,验证实验结果表明,与对照组相比,0.5倍MIC组的MurA、MurD基因表达下调,与RNA-seq结果一致。并重点讨论了差异基因经KEGG富集分析所得通路。
细菌细胞壁的主要成分为肽聚糖[15],是由短肽聚合而成的多层网状结构,又称球囊。球囊既可参与细菌的生长和分裂,又可保护细菌形态的完整性;且有研究发现,肽聚糖的生物合成途径可作为抗生素的靶点之一。MurA是肽聚糖进行生物合成第一步反应的催化酶,它可催化UDP-N-乙酰氨基葡萄糖(UDP-GlcNAc)与磷酸烯醇丙酮酸(PEP)反应生成UDP-N-乙酰氨基葡萄糖烯醇丙酮酸盐[16]。CHABÁN等[17]研究发现化合物鼠尾草酚、鼠尾草酸20-甲基、鼠尾草酸-γ-内酯对金黄色葡萄球菌的抗菌作用与MurA有关,因此MurA可能成为研发新型抗生素的一个良好药物靶点。在本研究中,HL-J6作用于MRSA后,MurA表达也呈下调趋势,说明HL-J6有可能通过抑制MurA来阻断MRSA的生长。另外,MraY通过催化磷酸-MurNAc-五肽从UDP-MurNAc-五肽转移和附着到脂质载体十一碳烯磷酸酯上,从而形成UMP和十一碳二烯二磷酸-MurNAc-五肽,说明在肽聚糖的生物合成过程中,MraY对细菌生存也存在重要影响,是目前抗菌药物的候选靶点之一[18]。KWAK等通过制备基于环戊烷的莫雷霉素类似物发现类似物20(JH-MR-23)可有效抑制MraY,对金黄色葡萄球菌有抑制作用。该研究通过对类似物的SAR分析表明,亲脂性侧链对于抑制MraY和抗菌有十分重要的作用[19]。根据RNA-seq的结果,MRSA生存相关肽聚糖合成基因MraY与对照组相比下调达1.27倍。因此HL-J6很可能通过干扰细胞壁的合成从而影响MRSA生存。但具体是何结构导致了MraY,MurA的下调,将在后续实验中进一步探讨。
除细胞壁合成相关基因外,叶酸合成相关基因也有所下调。叶酸是所有细菌生长所必需的一种重要物质,因此参与细菌叶酸合成的关键酶可能成为抗菌药物作用的靶点之一[20]。已有研究发现,甲氧苄啶(TMP)和磺胺甲噁唑均可抑制细菌叶酸合成,然而,ZANDER等[21]发现,上述抗生素对叶酸的抑制可因细菌对胸苷的利用而产生拮抗作用,从而导致治疗失败。只有与核苷类似物联用并在胸苷存在的情况下,才有杀菌活性。根据NCBI可知dfrB编码DHFR,该基因在本次实验中下调1.70倍。在后续实验中,将会继续探究胸苷在本药物抑制叶酸中是否存在影响,若产生了影响,则会考虑与其他药物联用以克服这种影响。
腺苷三磷酸结合盒转运蛋白(ABC转运蛋白)是一组跨膜糖蛋白,在许多生理生化过程中扮演重要角色[22]。MntC即为ABC转运蛋白系统成分之一,由309个氨基酸组成,分子质量为34.7 kDa,是一种表面蛋白,具有锰转运蛋白和黏附素活性[23]。HANDKE等[24]通过测定甲基紫精(一种可产生胞内超氧自由基的化合物)的MIC来评估MntC对金黄色葡萄球菌氧化应激的抵抗力,该实验表明,MntC的失活导致两种金黄色葡萄球菌株对甲基紫精的敏感性增加,而MntC未失活的菌株都表现出对甲基紫精的抵抗性。AHUJA等[25]利用工程抗体片段抑制MntC的活性,发现金黄色葡萄球菌对氧化应激的敏感性同样有所增加,这更加说明HL-J6可能通过ABC转运途径阻碍金黄色葡萄球菌生长。
金黄色葡萄球菌细胞膜由PG、赖氨酸磷脂酰甘油以及心磷脂等多种脂质组成[26]。虽然未发现赖氨酸磷脂酰甘油、心磷脂相关基因的变化,但PG相关基因PgsA发生了下调。其中,pgsA位于细菌的细胞膜上,是PG合成的关键酶,位于胞膜和胞质之间,可将胞苷二磷酸-二酰基甘油(CDP-DAG)转化为磷脂酰甘油磷酸(PGP),PGP被磷酸酶去磷酸化,去除末端磷酸基团从而产生PG[27]。LU等[28]通过蛋白质谱、转录谱发现己苯乙烯酸(CSA)类似物化合物5b正是以pgsA为靶点,对细菌膜产生影响从而产生抗菌活性。因此,pgsA可能为HL-J6的靶点。
除上述基因的下调外,本研究中还发现SecA也有一定程度的下调。SecA负责分泌一些重要的蛋白质,在细菌中高度保守,对细菌的生长有重要影响[29]。CUI等[30]的研究表明,孟加拉玫红或二碘曙红(RB)类似物是SecA的抑制剂,对N315,Mu3,Mu50 3种金黄色葡萄球菌株均有良好的抑菌作用。而另一种SecA抑制剂SCA-50的MIC为4μg/mL,也有良好的抑菌作用。因此,SecA是非常有效的的MRSA抗菌靶点。在我们的研究中,SecA同样有所下调,说明HL-J6可能为SecA的抑制剂。
此外,负责核糖体合成的相关基因rpsD,rpmI,rplT也发生了下调,说明本次药物的作用靶点还可能有rpsD、rpmI、rplT。细菌的细胞内存在许多核糖体,它们负责细菌蛋白质的生物合成[31],在细菌中,50S和30S亚基一起组成了70S核糖体,30S亚基结合mRNA并促进解码,而50S亚基的作用为催化肽基转移中心(PTC)处的肽键形成[32]。有研究表明,利奈唑胺是针对金黄色葡萄球菌的有效药物,该药物的靶点即为50S和30S亚基,它可通过影响氨酰-tRNA与50S亚基的结合来杀灭金黄色葡萄球菌[33]。因此,HL-J6对MRSA的抑制作用可能与核糖体合成的相关基因rpsD,rpmI,rplT的下调有关。
另外,在本研究中还发现了上调基因SAOUHSC_00202及SAOUHSC_02258,下调基因SAOUHSC_02925,SAOUHSC_02426,SAOUHSC_00718,SAOUHSC_01292
等基因编码假设蛋白。其功能目前尚未确定,它们在HL-J6抑制金黄色葡萄球菌过程中所起的作用还有待深入研究。
综上所述,新型吲哚苯醌类药物HL-J6可以较低质量浓度对金黄色葡萄球菌产生杀伤作用。推测该药物的机制可能是通过干扰细胞壁的合成、影响DHFR的合成、影响蛋白质的合成和影响细菌细胞膜重要组分的合成来抑制MRSA生长。

