非典型股骨假体周围骨折的诊疗进展
曾 羿,黄 锴
四川大学华西医院骨科,骨科研究所,成都 610041
Odvina等[1]2005年第一次报道了5例在接受阿仑膦酸钠治疗后发生低能量性股骨骨折的病例,认为这种非典型股骨骨折(atypical femoral fracture,AFF)可能是长期接受阿仑膦酸钠治疗后的一种潜在并发症。之后陆续有文献表明长期的双磷酸盐治疗可能造成AFF,这也引起了广大研究者的关注。2010年,美国骨骼与矿物质研究协会(American Society for Bone and Mineral Research,ASBMR)组织了一个多学科特别专家组,通过回顾AFF相关报道,第一次正式定义了AFF疾病种类,并制定了具体的诊断标准[2]。2013年,第二届ASBMR大会中,特别专家组回顾了2010—2013年新发表的研究,对AFF的诊断标准进行了修订与更新,更加清晰地阐述了AFF与普通骨质疏松性股骨骨折的区别[3]。但不论是第一版还是修订版,诊断标准中均未将关节置换术后的股骨假体周围骨折(periprosthetic femoral fracture,PFF)归于AFF的范畴内。
PFF是关节置换手术最严重的并发症之一,虽然诊断并不困难,但处理较为棘手,且术后关节功能恢复及预后往往不佳[4-5]。最新研究发现,一些接受双磷酸盐治疗的PFF具有与AFF相似的临床病史和影像学特征(图1),临床上初步将其定义为非典型股骨假体周围骨折(atypical periprosthetic femoral fracture,APFF)。除本身被排除在AFF的定义之外,这类骨折满足AFF诊断标准的所有条件。相对于普通的PFF,APFF的治疗难度更大、术后并发症发生率更高[6-7]。尽管目前学术界对APFF的关注越来越多,但相关研究仍然较少,其规范化的临床管理仍缺乏共识。本文将回顾既往APFF相关文献并结合笔者自身临床工作经验,对APFF的诊疗进展进行阐述,供广大骨科医师在临床工作中参考。
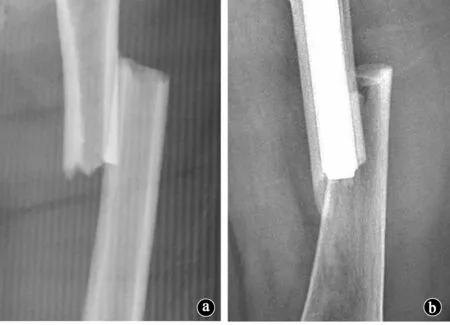
图1 APFF与AFF有许多相似的影像学特征。a.AFF;b.APFF
1 APFF定义
ASBMR特别专家组制定了一个详细而具体的AFF诊断标准和管理规范。修订版的AFF诊断标准中(表1)[3],AFF必备诊断标准:骨折位于从小转子远端到髁上突近端之间的股骨干区域。此外,其诊断还需至少满足以下5个主要标准中的4个,包括:(1)无创伤或微小创伤导致的低能量性骨折;(2)骨折线起源于外侧皮质,呈横形或短斜形;(3)不完全性骨折仅累及外侧皮质,而完全性骨折则延伸至两侧皮质,并可能伴有内侧突起;(4)骨折为非粉碎性或微粉碎性;(5)骨折部位的外侧皮质存在局限性“喙状”骨膜或骨内膜增厚。
许多学者认为APFF可以被视为具有与AFF相似临床病史和影像学特征的PFF特殊类型,应当考虑修订AFF的诊断标准,并将APFF包括在内[7-9]。回顾既往APFF相关研究,APFF的诊断需要满足:(1)患者既往有髋关节置换病史,骨折位于股骨假体周围;(2)需满足AFF诊断标准中的必备标准和至少4个主要标准。然而,由于目前关于APFF的文献较少,且缺少前瞻性、高证据等级的研究,学术界对APFF的标准定义仍未达成共识。

表1 2013年ASBMR修订版的AFF诊断标准
2 APFF的流行病学
越来越多年轻、活动度大的患者选择全髋关节置换手术(total hip arthroplasty,THA)。据统计,2005—2030年美国初次THA的需求量预计将增长1.74倍[10]。人口老龄化及预期寿命的增加,使得接受THA且合并复杂基础疾病及骨质疏松的老年患者急剧增多。此外,随着THA患者数量的增多,翻修患者也有所增长。初次THA的PFF发生率0.7%~11.1%,而翻修手术的PFF发生率达到1.19%~18%[8]。因此,在多种原因的作用下,PFF发病率将有所上升,这也间接提高APFF的发病率。
然而,同AFF比较,目前对APFF的发病率仍知之甚少。笔者查阅文献后发现,除一些个案报道外,迄今为止只有6篇回顾性研究报道了APFF在PFF中的发病率(5.1%~12.2%)[7-9,11-13]。笔者单位统计结果发现,在115例非Vancouver A或B3型PFF中有11例被认定为APFF,其发病率约为9.6%。笔者认为在不同研究中APFF发病率差异一方面可能是由于研究样本量过小,另一方面则在于没有统一的APFF诊断标准,导致纳排标准存在不同。
3 APFF的危险因素与发病机制
3.1危险因素 第一版ASBMR的AFF定义中,一些并存疾病(如维生素D缺乏症、类风湿性关节炎、甲状旁腺机能减退)与药物暴露史(如双磷酸盐、糖皮质激素、质子泵抑制剂)被认定为诊断AFF的次要标准[2]。尽管他们在修订后的AFF次要标准中被删除,但这些因素仍被视为AFF的危险因素[3]。APFF有着与AFF类似的“不典型”骨折模式,其危险因素可能与AFF类似。然而,受APFF相关研究数量的限制,目前APFF发生的危险因素仍不太明确。
双磷酸盐的使用史及使用持续时长与AFF的发病率关系紧密。在仅有的7篇关于APFF的回顾性研究中,6篇研究表明APFF的发生与双磷酸盐的使用显著相关[6-9,11-12],且随着双磷酸盐使用时长的增加,APFF的发病率也更高[6-7,9,12]。此外,笔者发现女性似乎较男性更易发生APFF,考虑到女性使用双磷酸盐比男性更频繁,APFF中性别的差异可能是受到了使用双磷酸盐的影响[8]。
THA假体的固定方式是否影响APFF的发生目前还存在争议。虽然Baba等[6]发现APFF组的骨水泥柄使用比例显著高于普通PFF组(30.2%vs.6.7%,P<0.001),但在其他研究中却未见显著差异[8-9,11-12]。Lee等[12]和 Dózsai等[9]还探究了类风湿性关节炎、甲状腺疾病等并存疾病对APFF的作用,结果显示上述疾病在APFF组与普通PFF组之间未见显著差异。Leclerc等[11]和Dózsai等[9]研究中,糖皮质激素或质子泵抑制的使用在APFF组与普通PFF之间也未见显著差异。
3.2发病机制 目前关于AFF或APFF这类“非典型”骨折的发病机制尚不清楚。一些学者认为是另一种形式的骨质疏松性骨折。然而,同AFF类似,APFF的某些临床和影像学特征提示与普通PFF其发病机制的不同。临床特征方面,APFF可能累及双侧股骨干,并伴有单侧或双侧前驱性疼痛;影像学方面,APFF的骨折线起源于外侧皮质,呈横形或短斜形,骨折呈非粉碎性或微粉碎性,骨折部位存在局限性的骨皮质增厚,这些特征提示APFF更像是一种应力性或不全性骨折。“应力性骨折”意味着正常骨骼遭受异常或过度的负荷,“不全性骨折”则提示异常或缺陷骨骼承受正常的负荷,而下肢则是发生应力性或不全性骨折最常见的部位。随着时间的推移,疲劳损伤在骨皮质内发展并无法进行及时有效地修复,损伤以微裂纹的形式积累并进一步合并,当微裂纹增长到一个临界尺寸时,外界一个微小的刺激均有可能导致骨折的发生[3]。
3.2.1骨重塑抑制:发展中的应力性骨折最初是通过骨内膜和骨膜桥接骨痂来稳定的,随后是正常的骨重塑过程,使得微裂纹可以在完全骨折发生之前得到修复。双膦酸盐能与骨质中的羟基膦灰石特异性结合,抑制破骨细胞活性并促进其凋亡,最终降低骨转化,抑制骨重塑。实际上,双膦酸盐并没有减少骨内膜和骨膜桥接骨痂的形成,但由于其骨重塑的抑制作用,可以促进微裂纹的积累和扩大,当微裂纹增长到临界尺寸时,轻微的创伤便可使微裂纹进展成为完全骨折[4-15]。Schilcher等[16]发现如果停止双膦酸盐治疗,AFF一年内的发生风险将下降70%,这也间接支持了这一机制假说。
3.2.2下肢几何形状:髋关节和股骨近端的几何形状在一定程度上决定了股骨皮质外侧所承受的压力。AFF或APFF可能累及双侧股骨干且双侧骨折处于相似的部位,提示下肢的形状与力线可能与“不典型”骨折存在一定的联系[17]。一篇以日本人群为对象的研究中,AFF患者的股骨干弯曲度明显大于经过年龄、性别匹配的对照组[18]。因此,整个下肢的几何形状可能是股骨外侧皮质应力改变的潜在因素,它同其他危险因素协同作用,可能导致AFF或APFF这类“不典型”骨折的发生。
4 APFF的诊断
病史采集和体格检查是APFF诊断的第一步,对于不完全性骨折尤是如此。病史采集过程中,应特别注意患者既往或目前正在服用的药物、受伤机制及可能出现的前驱症状。其中,双磷酸盐的使用及持续时长是问诊时的重点,因为大多数APFF患者都伴有3年以上的双磷酸盐药物使用史。APFF通常是自发或由低能量性创伤引起,即骨折常常无明显诱因或由低能量暴力所致。APFF患者可能伴有前驱症状,如腹股沟区或大腿部位的钝痛或酸痛,通常于患者过度活动或负重时出现,休息后可缓解。
影像学检查对APFF的诊断至关重要。股骨正侧位X线片通常足以显示APFF的特征性表现。然而,APFF的发生是一个随着时间的推移不断发展的连续过程,对一些存在双磷酸盐使用史或(和)前驱症状但股骨X线片未确诊的潜在APFF患者,一些更先进的成像技术,如计算机断层摄影(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)或骨扫描(bone scintigraphy,BS),可能更有助于检测早期或细微的骨折前特征[19]。其中,CT在检测细微的反应性骨膜新骨形成、骨折演变时的透光度与局灶性皮质内骨吸收等方面非常有用;MRI对评估骨皮质增厚区域高度敏感,可以显示出骨折周围的骨水肿;BS虽然特异性较低,但敏感性较高,可以识别出不完全性或隐匿性骨折。此外,APFF可能表现在双侧股骨干,在发现一侧APFF时,对侧股骨的影像学检查也十分必要,以免漏诊。
5 APFF的分型
Vancouver分型(表2)综合考虑了骨折部位、假体稳定性与剩余骨量等因素,是目前认可度最高、运用最广泛的PFF临床分型[20],同样也适用于APFF。然而,由于Vancouver分型的适用范围是所有PFF,有必要对其做一定的调整以满足APFF的诊断标准。
大部分学者选用Vancouver分型来描述APFF,但对纳入的具体分型还存在着一些争议。Vancouver A型骨折位于假体近端,主要累及股骨转子区域,不满足AFF定义中的必备标准(股骨干区域),因此被排除在APFF的定义范围内。Vancouver B型骨折线位于假体柄周围。其中B1型骨折假体柄固定牢固,无明显骨量丢失,大部分学者认为APFF可以在B1型骨折中寻找。B2型骨折虽无明显骨量丢失,但存在假体柄松动,学者们对其是否被纳入APFF中尚未达成共识。Mondanelli等[8]认为B2型骨折的假体柄要么在骨折前已经松动,要么随着骨折的发生一起松动,这种骨折模式不属于“不典型”。相反,Leclerc等[11]和Moya-Angeler等[21]认为只要B2型骨折满足AFF的诊断标准(除开PFF本身),就应该被认为是APFF。笔者认为,应将B2型骨折纳入至APFF的选择范围内。B3型骨折表现为假体松动伴明显的骨量丢失,两者均可能导致骨折的发生,因此B3型骨折不应被视为APFF。Vancouver C型患者骨折线位于假体柄以远,尽管Dózsai等[9]把它排除在APFF之外,但笔者认为C型骨折属于股骨干骨折,具有AFF的影像学特征,且没有其他原因可以解释骨折本身的发病机制,应当纳入APFF的定义范围内。

表2 关于PFF的Vancouver分型
6 APFF的临床管理及治疗
APFF正确的诊断,是确保患者及时接受治疗的关键。相比PFF,APFF的手术治疗更具挑战性,且更容易出现延迟愈合、不愈合、内固定失败再骨折等不良预后[6-7]。不仅如此,APFF较AFF也需要更长的骨折愈合时间[13],考虑到髓腔内植入的假体柄对股骨血供的影响,这一结果并不令人惊讶。尽管APFF治疗难度大、预后较差,但目前仍缺乏对APFF规范化临床管理的建议或指导。笔者认为鉴于APFF有着与AFF相似的临床病史和影像学特征,在既往APFF相关研究的基础上,可以参考并借鉴AFF相关临床管理的经验。
6.1APFF的早期预防与诊断 同AFF类似,APFF的发生与双磷酸盐的使用密切相关,且APFF的发病率与双磷酸盐使用时长也呈正相关。因此,对于长期服用双磷酸盐的患者,建议定期去医院随访,行X线片检查,动态观察股骨是否出现APFF相关影像学特征。此外,如果患者出现腹股沟或大腿疼痛的前驱症状但X线片尚无特征性表现时,可以进一步完善MRI、BS等检查以防漏诊。
6.2非手术治疗 一旦确诊APFF,应立即停止使用双磷酸盐等抑制骨吸收药物,而选用其他类型的抗骨质疏松药物。特立帕肽是合成的多肽激素,被证明可以通过促进骨重塑、加快新骨形成来加速AFF的骨愈合[22]。关于APFF病例报道的系统综述中,4例不完全性APFF患者在接受特立帕肽非手术治疗后,3例被证实有效[23]。因此,类似于AFF,APFF的非手术治疗也是基于停用双磷酸盐、使用特立帕肽与避免负重等方案。对于不完全性APFF,如果患者疼痛可以忍受且不伴进一步加重,在向患者充分沟通病情及可能出现完全性骨折的风险后,可以采取非手术治疗。密切随访十分重要,若非手术治疗过程中患者疼痛无法缓解或进行性加重,或出现骨折不愈合,甚至发展成为完全性APFF,则建议积极行手术治疗。
6.3手术治疗 对于完全性APFF或非手术治疗失败的不完全性APFF,应积极行手术治疗。髓内钉固定是AFF首选且有效的手术方式[24],但由于APFF患者股骨髓腔有假体柄的存在,髓内钉对其并不适用。APFF的骨折线呈横形或短斜型,骨折断端高度旋转不稳定,单纯单钢板固定或同种异体皮质骨板移植可能因无法抵抗骨折带来的轴向旋转力和剪切力而出现内固定失败。使用双钢板或同种异体皮质骨板移植联合加长柄假体翻修可以增加骨折断端稳定性,进而改善预后[25-27]。此外,APFF较普通PFF或AFF骨愈合时间更长,在复位过程中应尽可能使骨折断端对齐[27]。
在既往文献中,长锁定钢板是APFF最常用的内固定方案(图2)。然而,由于APFF常累及骨质条件较差且因双磷酸盐使用所致骨重塑能力减退的老年患者,长锁定钢板存在骨折端血供破坏大、骨折不愈合概率增加的风险。此外,由于髋关节置换术后股骨柄与骨皮质的弹性模量不同,假体柄远端周围皮质是应力集中区域[28],APFF也多发生在假体柄最远端[8]。因此,笔者所在关节中心倾向于选择同种异体皮质骨板移植联合股骨加长柄翻修的方式对APFF进行手术,随访结果令人满意(图3):从生物力学角度,同种异体皮质骨板捆绑联合加长的股骨假体柄,跨过了骨折区,可以有效抵抗骨折断端带来的轴向旋转力和剪切力,提供足够力学支撑,有助于骨折断端稳定;从骨折愈合角度,同种异体皮质骨板具有较好的生物相容性,不但可以促进骨折修复愈合,还可以增加骨量贮备。应当注意,股骨加长柄的植入可能会影响骨折部位髓腔内血供,影响骨折愈合,因此笔者推荐术后联合使用促骨形成药物特立帕肽。当然,较普通钢板内固定方案而言,同种异体皮质骨板植入的手术难度更大,对外科医师的技术要求更高;且目前关于APFF手术方式的选择还缺少文献支持,亟需更多前瞻性、高质量的研究为临床工作提供指导。
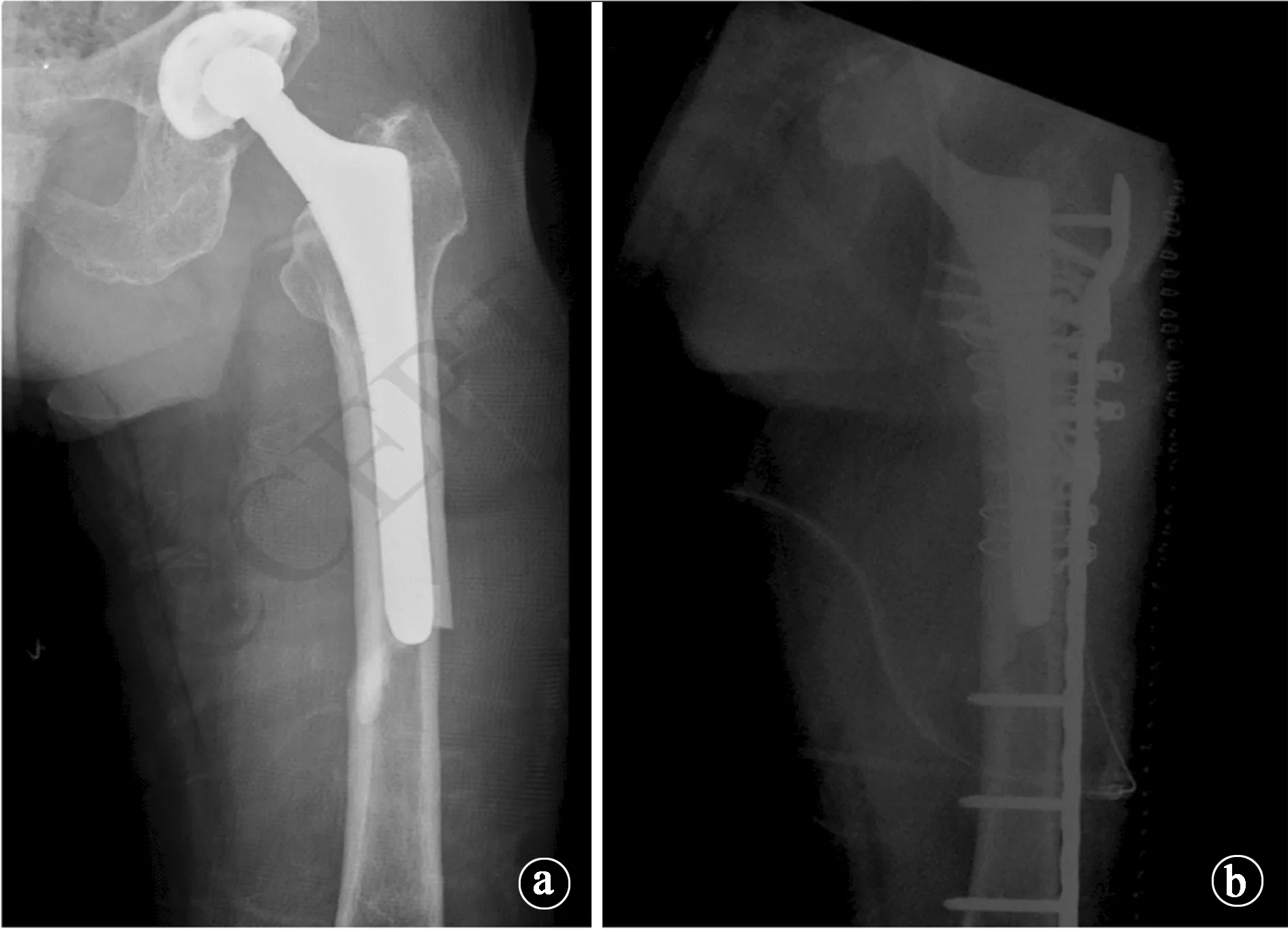
图2 患者女性,80岁,既往10年双磷酸盐使用史,并发生了APFF。a.术前X线片示APFF可能性;b.接受“长锁定钢板”内固定方案手术后的X线片
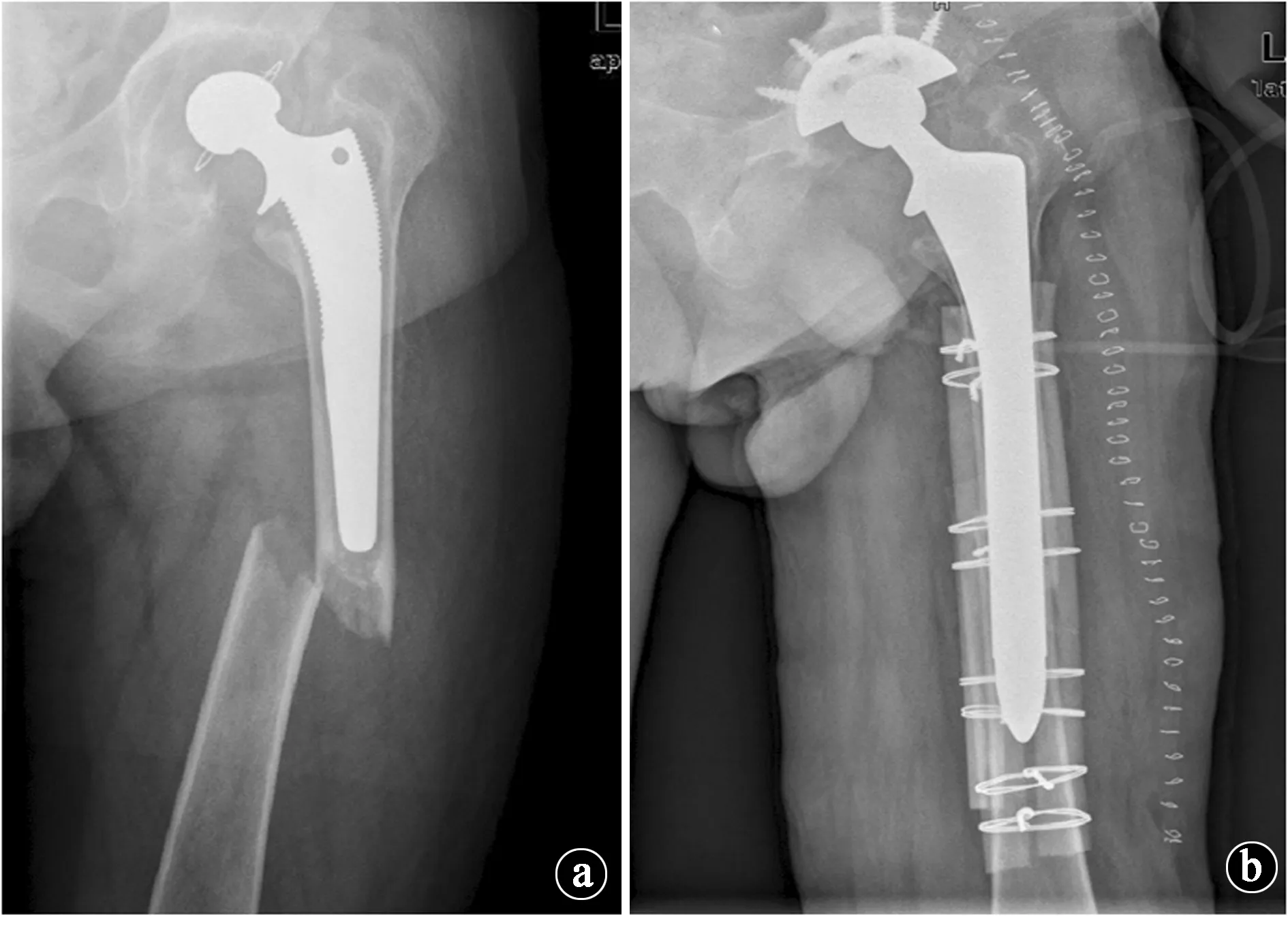
图3 患者男性,73岁,既往8年双磷酸盐使用史,无明显暴力情况下出现左大腿疼痛伴活动受限。a.术前X线片示左股骨柄远端横行骨折,提示APFF可能性;b.患者接受“同种异体皮质骨板移植联合加长股骨柄假体”的翻修方案,术后X线片示骨折复位良好,断端稳定性好
7 展望
APFF是一组特殊的PFF,具有与AFF相似的临床病史和影像学特征。这类骨折相对罕见,更易在长期接受双磷酸盐的女性患者中被发现。随着PFF发病率的逐年上升,APFF的发病率也将上升。相较于普通的PFF,APFF的手术治疗更具挑战性,且更容易出现延迟愈合、不愈合、内固定失败再骨折等不良预后。因此,早期的准确诊断是确保患者接受及时有效治疗并获得良好预后的关键。参考AFF的治疗原则,笔者建议根据APFF患者的具体情况采取非手术(停用双磷酸盐、使用特立帕肽与避免负重等)和手术治疗的综合方案。然而,目前仍缺乏关于APFF规范化诊断和临床管理的权威指南,亟需更多前瞻性、高质量的研究来不断充实、深化这一领域。
作者贡献声明:曾羿:文章撰写、审阅及修订;黄锴:文章起草、文献检索及修订

