血浆循环游离DNA 含量及完整性在乳腺癌中的临床价值
樊丽壮,王博,徐爱兰,刘艳佳
(佳木斯大学附属第一医院肿瘤科,黑龙江 佳木斯 154000)
乳腺癌(breast cancer)是发病率最高的癌症,也是癌症死亡的主要原因[1]。研究显示[2,3],转移性乳腺癌的生存率下降至25%以下,早期诊断可以降低20%的死亡率。循环游离DNA(circulating cell-free DNA,cf-DNA)是一种血液或体液中游离于细胞之外的DNA[4]。cf-DNA 检测属于液体活检的一种,对于诊断原发性肿瘤或难以提取样本的组织转移性病变的阶段,可以提供可靠的替代方案[5];同时也可以与乳房X 线检查相结合作为一种有价值的临床实践工具,从而更好地筛选出适合活检或随访乳腺癌候选者。近年来,随着基因组测序自动化,基因芯片技术日趋成熟,利用分子生物学技术作为乳腺癌的辅助诊断成为一种趋势[6]。研究表明[7],基因和分子生物标记物进行分类有助于预测单个肿瘤的病程,是肿瘤下一步采取治疗的方法。目前,cf-DNA 在临床应用价值已得到证实[8-10]。但受初始样本、提取及检测方法、仪器灵敏度、实验操作等多方面的影响,cf-DNA 含量及完整性检测结果各有不同,对临床使用价值的判定也不同。本研究通过检测乳腺癌患者外周血液中cf-DNA Alu 序列长、短片段(241 bp、100 bp)含量及cf-DNA 完整性(Alu 241/100),探讨循环游离DNA 在乳腺癌辅助诊断中的临床价值,现报道如下。
1 资料与方法
1.1 一般资料 收集2020 年9 月-2021 年7 月佳木斯大学附属第一医院收治的女性乳腺癌患者血液样本56 例作为病例组,年龄35~75岁,平均年龄55岁;合并淋巴结转移39 例、无淋巴结转移17 例。纳入标准:①经影像学及病理组织学穿刺活检确诊为乳腺癌患者;②临床资料齐全且自愿入组;③无其他肿瘤病史;④术前均未接受放化疗、内分泌治疗及靶向治疗。排除标准:①合并其它系统疾病或者恶性肿瘤者;②妊娠期或哺乳期者;③临床资料不完整者。同时收集佳木斯大学附属第一医院体检中心体检健康者20 名的血液样本作为对照组,均为女性,年龄25~65岁,平均年龄45 岁。两组年龄比较,差异无统计学意义(P>0.05),可对比。本研究通过医院伦理委员会审批,所有研究对象均知情同意并签署知情同意书。
1.2 主要仪器和试剂 超低温冰箱(Thermo Fisher Scientific,美国),Qubit 4 Fluoromete(Thermo Fisher Scientific,美国),离心机(Thermo Fisher Scientific,美国),PCR 仪(Thermo Fisher Scientific,美国),实时荧光定量PCR 仪(Thermo Fisher Scientific,美国),High Pure PCR Template Preparation Kit(Roch,中国),Qubit dsDNAHS Assay Kit(Invitrogen,美国),探针引物(睿博兴科生物技术有限公司,中国)。
1.3 方法
1.3.1 标本采集和DNA 提取 用柠檬酸钠(1∶9)蓝色真空采血管在手术前一天早晨7∶30 空腹收集10 ml 肘正中静脉血液,室温静置30 min后,4 ℃3000 r/min离心10 min 粗离血浆;取上清血浆至1.5 ml 灭菌洁净离心管中,4 ℃8000 r/min 第2 次离心15 min 获得无血细胞成分的纯血浆。用1.5 ml 灭菌洁净离心管分装(每管200 μl),采用High Pure PCR Template Preparation Kit,按照试剂盒说明书进行操作提取DNA,放置于-80 ℃备用。采用Qubit dsDNAHS Assay Kit 对DNA 进行浓度测定,同时采用Qubit 4 Fluoromete 测定吸光度(A260/280)值,取比值为1.6~1.8的DNA 样本,提取的DNA-20 ℃保存。为保证试验精确性,均采用同一批号的试剂盒提取所有血浆标本。
1.3.2 血浆循环游离DNA 完整性的检测 引物序列由睿博兴科生物技术有限公司合成,PCR 引物序列及循环参数[11]见表1。引物按照说明书操作完成,配置成10 μmol/ml 的溶液于-20 ℃保存。

表1 PCR 引物序列及循环参数表
1.3.3 配置标准品 用T-A 克隆技术,构建不同hTERT DNA 片段的质粒及内参β-actin 的质粒,提取质粒DNA,测其浓度并换算成拷贝数,10 倍梯度稀释后作为标准品。每个标本检测3 次后再取平均值。根据扩增后得到的Ct 值绘制标准曲线。
1.3.4 荧光定量PCR 体系 按照表2 进行配制体系,于冰上或冰盒中添加至qPCR 专用96 孔板中。

表2 配置PCR 反应体系表
1.3.5 PCR 循环参数 95 ℃预变性5 min;95 ℃变性10 s,55 ℃退火20 s,72 ℃延伸31 s,40 个循环扩增;最后72 ℃延伸31 s 结束反应,溶解曲线阶段仪器默认设置。为评估血浆DNA 含量及完整性指数,对乳腺癌的cf-DNA 分别扩增其基于β-actin 和基因hTERT 长、短片段质粒标准品的扩增曲线,并以长、短片段扩增产物比值作为DNA 完整性指标。
1.4 统计学方法 采用GraphPad Prism 8 版软件对所有实验数据cf-DNA 分析和检验、作图。计量资料用[M(P25,P75)]表示,组间比较采用秩和检验。使用受试者工作特征(receiver operating characteristic,ROC)曲线来评估血浆循环游离DNA 在乳腺癌诊断上的作用。使用Fisher 精准检验分析乳腺癌患者临床病理参数与cf-DNA 完整性的关系。双侧P<0.05表示差异有统计学意义。
2 结果
2.1 两组长、短片段血浆cf-DNA 含量比较 长片段241 bp 在病例组和对照组血浆中表达水平分别为[7.57(5.07,10.97)]和[3.72(1.08,6.56)],组间比较,差异有统计学意义(P<0.05);短片段100 bp 在病例组和对照组血浆中表达水平分别为[33.99(16.36,58.44)]和[14.22(12.11,16.61)],组间比较,差异有统计学意义(P<0.05),见图1。

图1 两组长、短片段血浆cfDNA 含量比较
2.2 两组血浆cf-DNA 完整性比较 病例组血浆cf-DNA 完整性水平为[0.38(0.30,0.62)],高于对照组的[0.24(0.08,0.36)],但差异无统计学意义(P>0.05),见图2。

图2 两组血浆cf-DNA 完整性比较
2.3 ROC 曲线分析 通过对血浆长片段241 bp 和短片段100 bp 含量及cf-DNA 完整性的ROC 曲线分析,241 bp hTERT 区间曲线下面积为0.79(95%置信区间为0.64~0.94,P<0.0001),cut-off 值为5.96,敏感度为70.00%,特异度为90.00%;100 bp hTERT区间曲线下面积为0.99(95%置信区间为0.98~1,P<0.0001),cut-off 值为16.13,敏感度为100.00%,特异度为95.00%;cf-DNA 完整性曲线下面积为0.59(95%置信区间为0.46~0.73,P=0.1985),cut-off 值为0.29,敏感性44.46%,特异度85.00%,见图3。
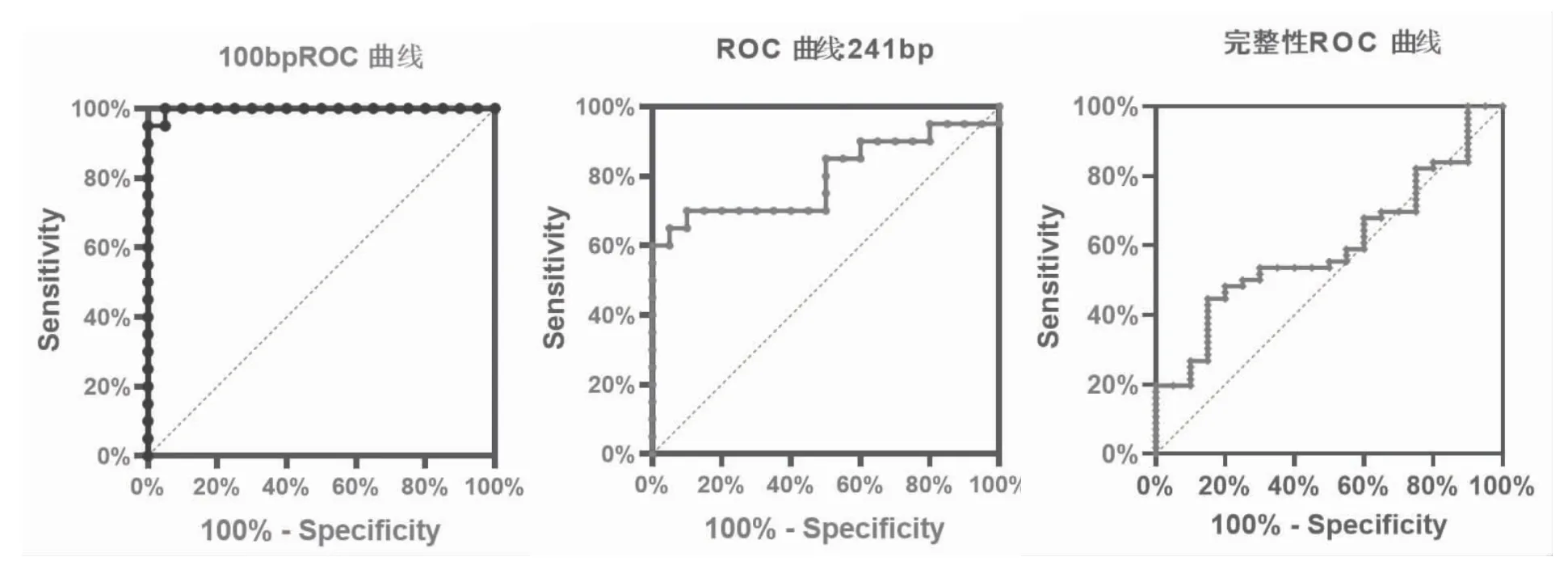
图3 ROC 曲线分析图
2.4 标准曲线的建立 构建成β-actin 及241 bp、100 bp 质粒标准品的扩增曲线,β-actin 标准曲线的线性决定系数(R2)=0.9583,扩增效率达93.40%;100 bp 标准曲线的线性决定系数R2=0.8745,扩增效率达91.70%;241 bp 标准曲线的线性决定系数R2=0.9695,扩增效率达99.30%。内参β-actin 及100 bp 及241 bp 目的基因熔解曲线出现微量杂峰,见图4。

图4 目的基因扩增曲线和熔解曲线图

图4 目的基因扩增曲线和熔解曲线图(续)
2.5 有、无淋巴结转移乳腺癌患者血浆cf-DNA 完整性比较 无淋巴结转移乳腺癌患者血浆cf-DNA 完整性为[0.18(0.13,0.22)],有淋巴结转移的乳腺癌患者血浆cf-DNA 完整性为[0.33(0.22,0.63)],组间比较,差异有统计学意义(P<0.05),见图5。

图5 有、无淋巴结转移血浆cf-DNA 完整性比较
3 讨论
癌症会随着时间的推移改变形状和形式,故乳腺癌早期诊断对于降低癌症相关死亡率至关重要[12,13]。血浆cf-DNA 被认为是诊断癌症的新型标志物,可以提供潜在临床相关信息的生物来源,满足在精准医学领域上方便微创的进步需要[14]。以上原因使得cf-DNA 分析成为肿瘤分子生物学领域的研究热点。当机体处于癌症状态时,外周血浆cf-DNA 增多[15,16]。因此,可通过无创性血浆cf-DNA 检测来早期诊断乳腺癌。
本研究选取Alu 序列241 bp 和100 bp hTERT目的基因作为扩增的长短片段,分析病例组与对照组中血浆cf-DNA 长短片段的含量,发现病例组血浆cf-DNA 含量高于对照组,差异有统计学意义(P<0.05),与Miao Y等[17]研究结果一致,分析原因可能为自噬和坏死将更高浓度的基因组DNA 从肿瘤细胞释放到循环中,此外癌症患者血清中的DNA 酶活性受到抑制,而健康受试者则没有。有学者报道[18],高水平的血浆cf-DNA 与侵袭性分子肿瘤谱和癌症的代谢活性有关。本研究对病例组和对照组血浆cf-DNA 完整性的进一步分析发现,病例组cf-DNA 完整性高于对照组,差异有统计学意义(P<0.05),其结论与Kamel AM等[19]结果相似,考虑可能归因于肿瘤组织中的高坏死活性,吞噬细胞无法全部清除凋亡和坏死细胞,从而升高了血液中长DNA 片段的浓度,引起血浆cf-DNA 完整性显著升高。然后,使用ROC 曲线评估血浆循环游离DNA 在乳腺癌诊断上的作用,再分析血浆循环游离DNA 含量和完整性后发现,241 bp hTERT 区间曲线下面积为0.79,cut-off 值为5.96,敏感度为70.00%,特异度为90.00%;100 bp hTERT 区间曲线下面积为0.99,cut-off 值为16.13,敏感度为100.00%,特异度为95.00%;cf-DNA 完整性曲线下面积为0.59,cut-off值为0.29,敏感性44.46%,特异度85.00%,说明血浆cf-DNA 的长短片段和完整性的敏感度、特异度均较高,与Cao G等[20]结果类似,其研究也发现血浆cf-DNA 的敏感性和特异性以及完整性高于传统肿瘤生物标志物,提示血浆cf-DNA 可以起到健康筛查与辅助诊断的作用。
研究表明[21],在淋巴和远处转移性患者中,乳腺癌血浆cf-DNA 完整性直接定量显示升高。本研究结果显示,无淋巴结转移乳腺癌患者血浆cf-DNA 完整性为[0.18(0.13,0.22)],有淋巴结转移的乳腺癌患者血浆cf-DNA 完整性为[0.33(0.22,0.63)],组间比较,差异有统计学意义(P<0.05),分析认为发生肿瘤转移后肿瘤负荷、血管分布、细胞生长更加旺盛[22],提示cf-DNA 完整性可用作乳腺癌的动态监测。不同的机构未采用统一标准的操作前分析流程(样本收集,DNA 提取方法,试剂盒的应用),导致研究结果存在差异,因此对于血浆cf-DNA 片段大小、完整性与实体肿瘤、肿瘤标志物及肿瘤分期、类型等的关系还需要深入研究。
综上所述,血浆cf-DNA 作为液体活检的一种标志物,其含量和完整性可以作为乳腺癌辅助诊断的潜在生物学指标,在乳腺癌临床实践中可提高乳腺癌患者的诊断率。同时淋巴结转移与完整性相关,乳腺癌淋巴结完整性高于无转移者,但其机制仍尚未明确,且其诊断价值与肿瘤负荷的关系也存在争议。癌症中血浆cf-DNA 片段的大小分布可能是另一个信息参数,代表不同的释放机制和细胞外代谢过程。采用不同的血浆循环游离定量方法导致缺乏标准水平范围,并且与临床数据和终点相比,会出现差异结果。总而言之,cf-DNA 液态活检是未来可期的技术,虽然目前面临着一些研究和临床应用的难题,但随着医学相关技术的快速发展,相信cf-DNA在临床疾病诊断方面具有应用前景。

