菲律宾蛤仔对沉积物-水界面营养盐交换通量的影响
魏祥涛,刘召君,葛长字,宋建达,黄国强,侯文昊,荣博文
(1 山东大学海洋学院,山东 威海 264209;2 广西中医药大学海洋药物研究院,广西 南宁 5302003)
菲律宾蛤仔(Ruditapesphilippinarum,简称蛤仔)广布于中国沿海,是高密度底播增、养殖的对象[1]。大规模、高密度的蛤仔底播增、养殖,使得出现沉积物中硫化物和有机质含量增加、饵料生物短缺等问题[2-3],这些问题几乎都与营养盐在沉积物-水界面的扩散有关。蛤仔营养盐排泄率被用于评估其对水体营养盐的贡献[4-5],但底栖贝类排泄的营养盐仅部分直接排放到水体中,仅依据排泄率估算将高估其对水层营养盐的贡献[6]。
此外,蛤仔在黄、渤海的分布区与鳗草(Zosteramarina)的分布区部分重叠[7],蛤仔和其他贝类往往是海草床边缘大型底栖动物的优势种[8],他们有重要的生态作用,如难以建成的鳗草实生苗在有蛤仔的区域大量建成。实生苗建成需要一定的营养条件,即沉积物-水界面的营养盐迁移可能影响其建成。因此,有必要研究蛤仔对营养盐在沉积物-水界面迁移的影响。蛤仔的生物扰动与其规格密切相关,如其代谢率随规格增大而加快[9];丰度效应所致的竞争普遍存在[10],如丰度增加加大种间竞争。底播、采捕影响蛤仔的生物活性,蛤仔的生物活动有稳定、不稳定之分。故蛤仔影响营养盐在沉积物-水界面的交换通量的作用与其规格、丰度和活动的稳定性有关。蛤仔生物量影响沉积物-水界面的生源要素迁移[6],营养盐交换通量随贝类丰度增加而增加[11],但均未区分规格、丰度及活动稳定性的作用。
在蛤仔活动的稳定、非稳定期研究营养盐在沉积物-水界面的交换通量,结果有助于评价不同养殖工况下蛤仔养殖的环境效应、制定蛤仔养殖的管理策略,探究蛤仔对鳗草生态修复的潜在生态效应、构建蛤仔—鳗草综合养殖系统,尤其是基于蛤仔生境改造作用的鳗草实生苗培育工程体系等,促进生物互作视角下的渔业资源养护工程体系建设,提升蛤仔养殖、鳗草生态修复管理的水平。
1 材料和方法
1.1 材料
蛤仔和沉积物采自广西北海近岸滩涂。曝晒沉积物48 h,拣除可见杂物等,与粗沙、细沙按1∶1∶2(沉积物∶粗沙∶细沙)的比例混合而得试验沉积物。滩涂沉积物、粗沙、细沙的粒径分别为185.01、455.54、218.42 μm。
1.2 微宇宙实验
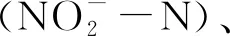

表1 蛤仔影响营养盐在沉积物-水界面交换通量的试验
1.3 计算方法
营养盐在沉积物-水界面的交换通量(F)按下式计算,
(1)
Δρ=Ct-Ct-1
(2)
式中:F为营养盐在沉积物-水界面的交换通量[mg/(m2·h)];Δρ为前后时间的上覆水的营养盐质量浓度差(mg/L);V、S、Δt、Ct和Ct-1分别为上覆水体积(L)、微宇宙面积(m2)、时间(h)、t和t-1时刻营养盐质量浓度(mg/L)。
1.4 统计分析
如仅考虑生物量的作用,进行单因素方差分析;若解析丰度、规格的作用,进行两因素方差分析。方差齐性时,以LSD法进行多重比较;否则,进行数据转换,如转化后满足方差齐性,以LSD法多重比较,否则以Dunnett’s-T3检验进行比较。为确定蛤仔活动稳定性的作用,对第13、19天的交换通量进行T检验。此外,对交换通量与溶氧(DO)等的关系进行相关分析。差异显著性水平为0.05,数据以均值±标准误差表示。
2 结果
2.1 蛤仔生物量的效应

图的交换通量

图的交换通量

图3 NH3-N的交换通量

图4 TN的交换通量
图的交换通量

图6 TP的交换通量
如图7所示,第13天,上覆水pH为8.42±0.01,最高出现在第一次取样12 h后的T10下,最低在第一次取样24 h后的T12下。第19天,上覆水pH为8.31±0.01,最高在第一次取样12 h后的T7下,最低在第一次取样24 h后的T6下。
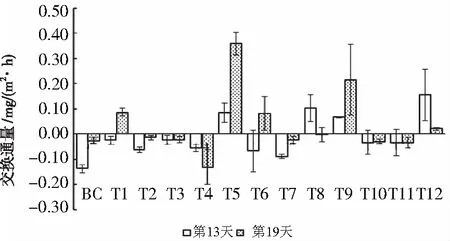
如图8所示,第13天,上覆水DO含量6.96±0.05 mg/L,最高在第一次取样24 h后的BC,最低在第一次取样24 h后的T12。第19天,上覆水DO含量6.99±0.05 mg/L,最高在第一次取样12 h后的BC,最低在第一次取样12 h后的T6。
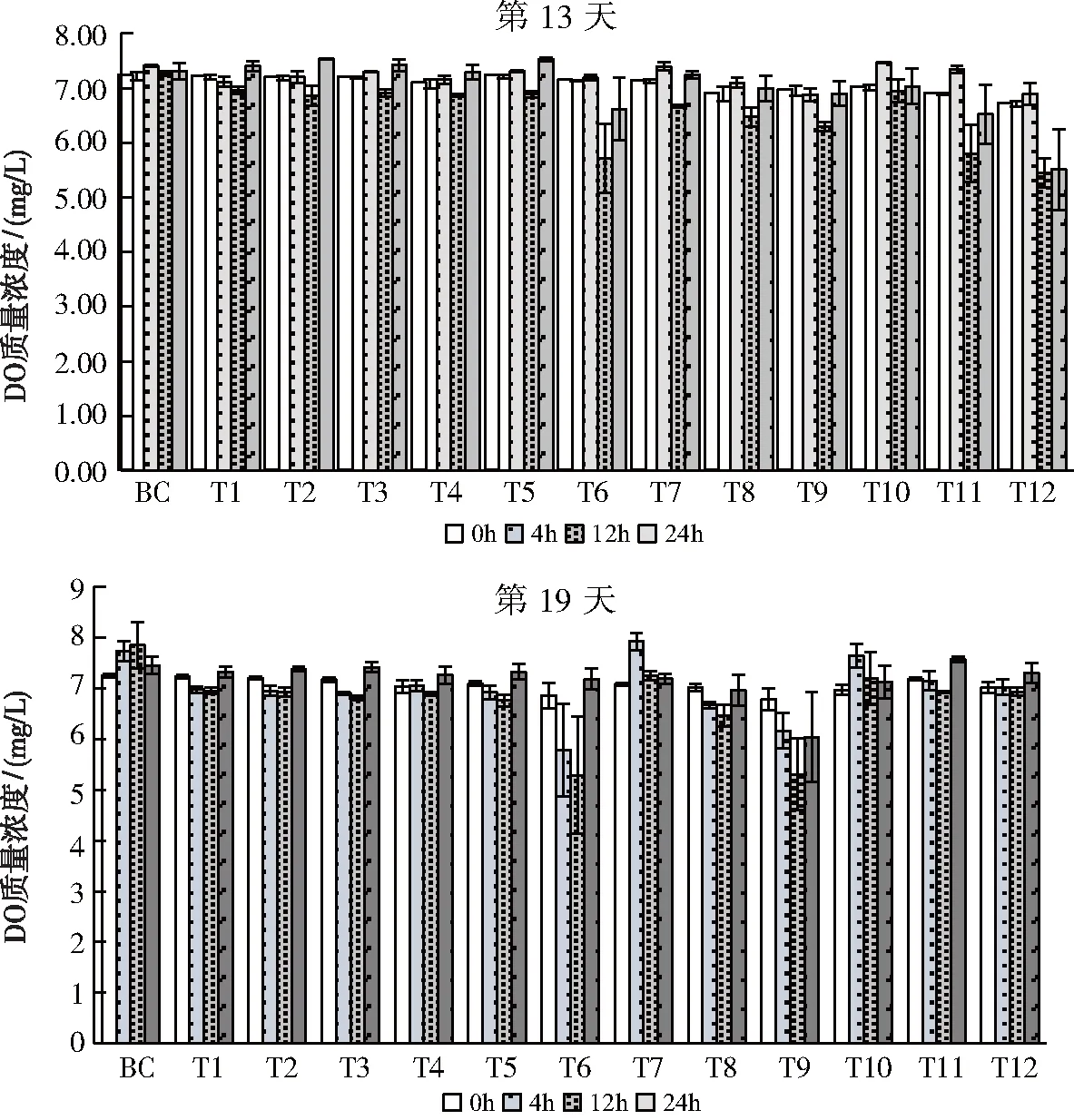
图8 上覆水DO质量浓度
2.2 规格、丰度效应

表2 蛤仔规格、丰度对营养盐交换通量影响的方差分析
3 讨论
3.1 生物量对营养盐交换通量的影响
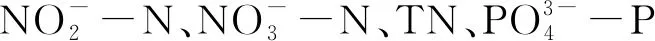
蛤仔呼吸[19]和生物沉积物等的降解产生质子而降低pH,故大部分有蛤仔处理的上覆水pH有所下降(图7),第13天的pH与生物量负相关(P<0.05)。

图7 上覆水pH



3.2 规格对营养盐交换通量的影响

3.3 丰度对营养盐交换通量的影响

3.4 规格与丰度的交互效应对营养盐交换通量的影响

4 结论
蛤仔丰度和规格及两者交互作用影响沉积物-水界面营养盐交换通量,且这种作用与蛤仔的活跃性有关,蛤仔对生源要素的迁移扩散受自身生物量、规格、丰度及活性的作用,评估滤食性贝类环境容量、贝类与海草的互作时,需要综合考虑这些作用。
□

