葛花解酲方作用于CCL2、BIRC5调控自噬治疗肝细胞癌的研究
王 羿,张学武,林登梅,安明宇,李 军*
(1.贵州中医药大学 基础医学院,贵州 贵阳 550025;2.贵州中医药大学 药学院,贵州 贵阳 550025)
0 引言
肝细胞癌(Hepatocellular carcinoma,HCC)是一种常见的恶性肿瘤,占所有肝癌患者的85%,其发病率和死亡率分别在全球排第六和第三位,其中,2020年约有新发病例90.6万、死亡病例83万[1]。据临床报道,HCC的危险因素有乙型肝炎病毒(HBV)感染、丙型肝炎病毒(HCV)感染、吸烟、饮酒、肥胖、黄曲霉素和代谢异常等[2]。目前,HCC治疗手段主要有肝移植或切除、经导管动脉化疗栓塞(TACE)、射频消融(RFA)、免疫治疗、抗血管靶向治疗等[3-7]。 虽然手术治疗被认为是最有效的手段,但因该病发病隐匿、潜伏期长、进展迅速、恶性程度高等原因,确诊时已属中晚期,不但死亡率较高,术后5年的复发率高达60%以上[8-9]。
自噬是一种在自噬相关基因的调控下引发细胞程序性死亡的一种方式,细胞将其受损的细胞器和大分子物质运送到溶酶体进行消除和降解[10]。这一过程最终抑制癌细胞凋亡或诱发癌细胞死亡,自噬和诱导的程度(又称自噬通量)与肿瘤进展所处的阶段有关[11]。在一些研究中,自噬可以在肿瘤形成的早期阶段通过消除基因组不稳定性、受损细胞器和突变细胞来抑制肿瘤的发生[11-12]。
GHJCF是传统的经典药方,出自李东垣的《脾胃论》,是治疗“饮酒过伤”之剂。该方由葛花、人参、茯苓、木香、白术、干姜、豆蔻等药物组成,全方具有分消酒湿、温中健脾、消补兼施之效。课题组前期研究发现,GHJCF对HCC有一定的抑制作用[13-14],但其发挥抗肿瘤作用的活性成分以及作用机制尚未阐明。研究运用网络药理学结合生物信息学知识,探究GHJCF通过介导自噬进而干预肝细胞癌进展的潜在机制,以期为GHJCF的药物开发以及临床应用提供理论证据。
1 材料与方法
1.1 GHJCF活性成分及靶标的获取
检索TCMSP[15](http://tcmspw.com/tcmsp.php)数据库,收集GHJCF中葛花、人参、茯苓、木香、白术、干姜、豆蔻的活性成分的相关信息,并提取相关活性成分作用的蛋白靶点。接着在Uniprot[16](https://www.uniprot.org)蛋白数据库将化合物作用的靶点蛋白转化为靶点基因名。
1.2 HCC疾病和潜在自噬基因获取
从GEO[17](https://www.ncbi.nlm. nih.gov/geo)数据库获取HCC数据集GSE87630和GSE45267。GSE87630分别包含HCC患者组织样本64例,癌旁组织样本30例,GSE45267数据集包含HCC患者样本41例和健康对照(HCC)样本46例。GSE87630与GSE45267芯片研究类型为 expression profiling by array, 种属为 homo sapiens,平台分别为GPL6947、GPL570。通过GEO2R在线分析工具分析芯片数据,设置P<0.05,|logFC|>1 为筛选条件,获得肝癌差异表达基因。人类自噬数据库(Human autophagy database, HADb)收录了222个与人类自噬密切相关的基因/蛋白信息。此外,基因的信息包括DNA序列、mRNA序列和已知的各种转录本等等。
1.3 构建“药物-成分-靶点-HCC-自噬”网络
将获取到的GHJCF活性成分对应的靶点与HCC差异基因以及自噬相关基因,导入到Venny2.1.0[18](https://bioinfogp.cnb.csic.es/tools/venny/)在线工具取交集以获取交集基因。再将交集靶点与药物、成分、疾病一一对应后导入Cytoscape 3.9.0软件构建“药物-成分-靶点-HCC-自噬”网络图。
1.4 蛋白与蛋白相互作用网络构建
将交集靶点导入该STRING[19](https://string-db.org)数据库,构建交集靶点蛋白的相互作用网络图。
1.5 基因差异表达分析
使用R 3.6.3语言进行统计分析,其中ggplot2包用于可视化。涉及的统计方法有Mann-Whitney U检验(Wilcoxon rank sum test)。 Mann-Whitney U检验是一个非参数的假设检验方法,一般用于2组不满足正态性的情况。疾病为肝细胞肝癌,数据来源于TCGA[20](https://portal.gdc.cancer.gov/ ) LIHC(肝细胞肝癌)项目中 level 3 HTSeq-FPKM格式的RNAseq数据。
1.6 免疫组化学分析
利用基于人蛋白质图谱[21](THPA) (www.proteinatlas.org)的免疫组织化学来验证关键基因及其诊断价值。THPA 提供对 32 种人体组织及其蛋白质表达谱的访问,并使用抗体谱来准确评估蛋白质定位。此外,THPA 还提供 RNA 水平的测量。
1.7 临床相关性分析
使用R 3.6.3语言的ggplot2对关键基因的临床相关信息进行可视化处理。涉及的统计方法有Kruskal-Wallis test。Kruskal-Wallis test是利用多个样本的秩和来推断各样本分别代表的总体的位置有无差别。 一般用于多组样本不满足正态性的情况。
1.8 生存预后分析
进行K-M生存分析[22](http://kmplot.com/analysis/)分析关键基因表达与HCC患者生存天数之间的关系。将关键基因输入该数据库以获得K-M生存曲线图。计算对数秩P值和风险比。P值<0.05 被认为具有统计学意义。
1.9 分子对接
从PDB[23](https://www.pdbus.org/)数据库中获取上述分析后关键基因的人源蛋白,然后通过TCMSP[15](https://old.tcmsp-e.com/tcmsp.php)数据库获取GHJCF中关键基因对应化合物的3D结构,将蛋白及化合物的3D结构导入Discovery Studio 2016 Client软件进行分子对接检验其蛋白与活性成分的亲和性。
2 结果
2.1 差异基因筛选结果
R语言软件对GSE45267和GSE87630基因表达数据进行标准化处理的结果见图1(A)和图1(B)。GSE45267数据集有1 305个差异基因,其中上调基因486个,下调基因819个。GSE87630数据集有1 250个差异基因,其中上调基因359个,下调基因891个。2组数据集差异基因的可视化结果见图 1(C)和图1(D)。
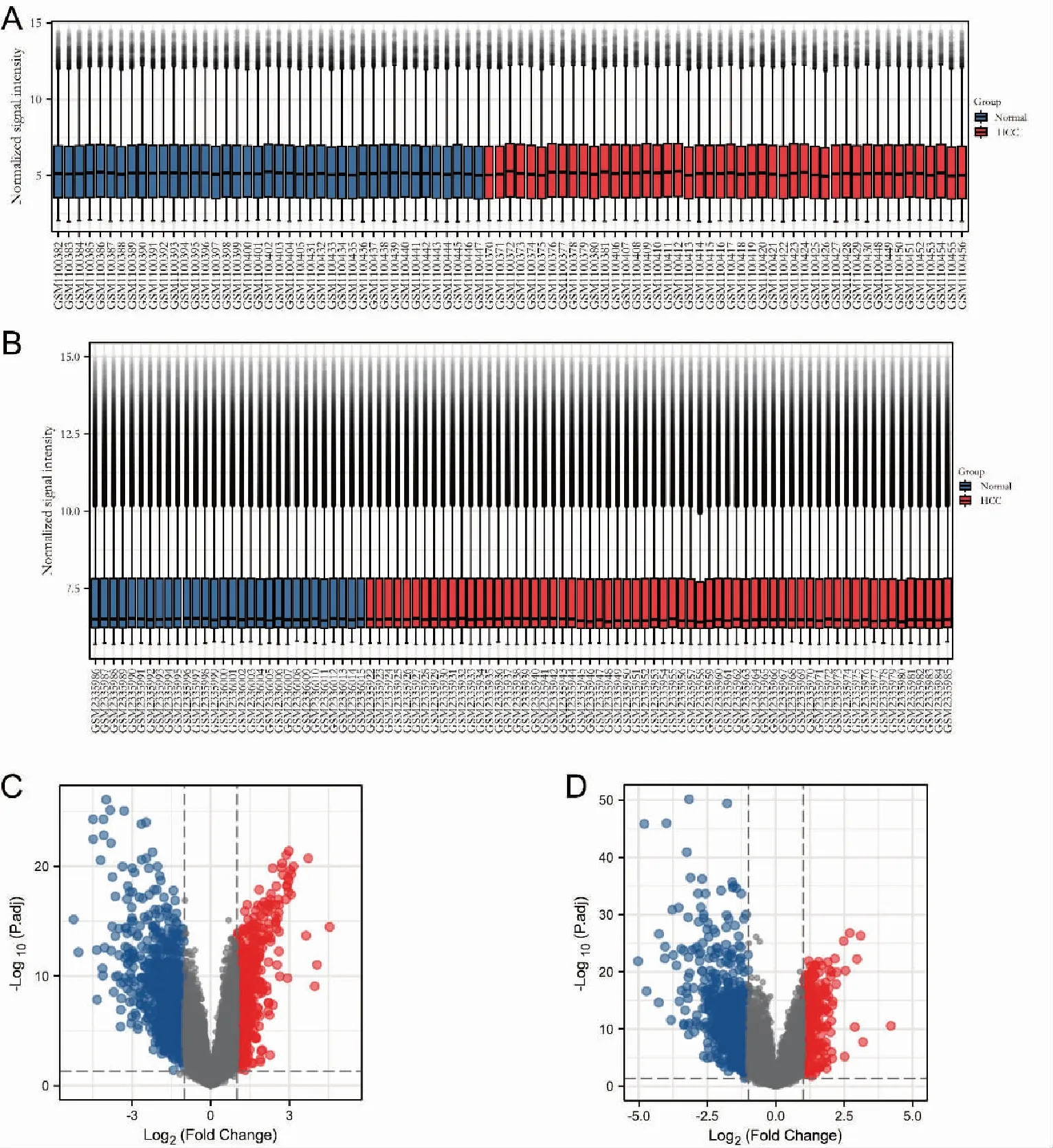
图1 A:GSE45267数据集的标准化处理结果;B:GSE87630数据集的标准化处理结果; C:GSE45267差异基因火山图;D:GSE87630差异基因火山图Fig.1 A:Normalization results of GSE45267 dataset;B:Normalization results of GSE87630 dataset;C:GSE45267 differential gene volcano map;D:GSE87630 differential gene volcano map
2.2 靶点基因筛选结果及蛋白交互PPI网络的构建
在HADb数据库中筛选出222个基因组与自噬相关。用韦恩图可视化其与GHJCF的靶点及HCC数据集的差异基因的交集,筛选得到3组数据的共同差异基因5个,见图2(A)。将差异基因导入至STRING数据库得到一个含6条边和5个节点的PPI网络图,用Cytoscape3.9.0软件构建蛋白交互网络图(PPI)。根据每个靶点degree值大小确定每个靶点大小,见图2(B)。
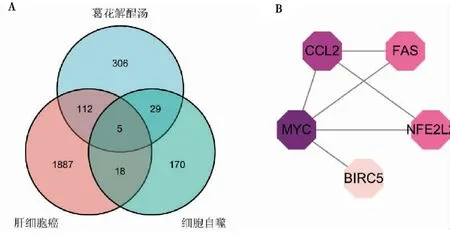
图2 A:GHJCF-自噬-HCC交集基因的韦恩图;B:PPI网络图Fig.2 A: Venn diagram of GHJCF-autophagy-HCC intersection genes; B: PPI network diagram
2.3 “药物-活性成分-靶点-HCC-自噬”网络构建
将7味中药、74个成分、13个靶点在Cytoscape中进行分析、作图(图3)。
图3 药物-成分-靶点-疾病-自噬作用网络图Fig.3 Drug-component-target-disease-autophagy action network diagram注:GH,葛花;RS,人参;FL,茯苓;MX,木香;BZ,白术;GJ,干姜;DK,豆蔻。
2.4 关键基因的表达差异分析
结果显示,与癌旁正常组织相比,肿瘤患者CCL2基因的mRNA表达显著下调,而NFE2L2、FAS和BIRC5基因的mRNA表达显著上调(图4)。
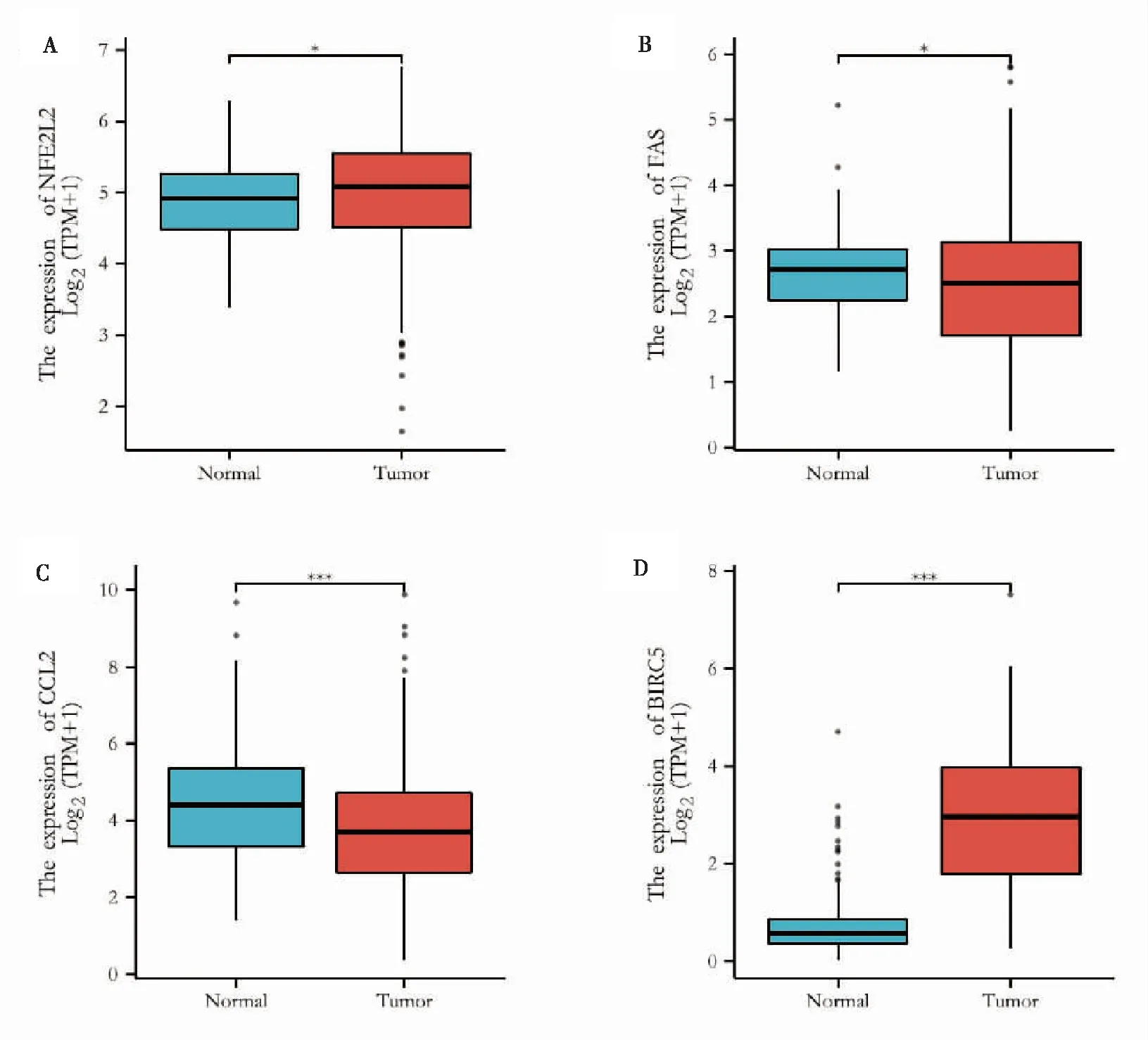
图4 4个显著差异关键基因在正常组织和肿瘤组织表达情况Fig.4 Expression of 4 significantly different key genes in normal and tumor tissues注:*P<0.05,**P<0.01,***P<0.001。
2.5 人类蛋白质图谱分析
使用人类蛋白质图谱(THPA)网站分析了HCC样品中NFE2L2、FAS、CCL2和BIRC5表达的免疫组织化数据,免疫组织化数据显示肝癌样品中的NFE2L2、CCL2和BIRC5高表达;FAS中表达(图5)。
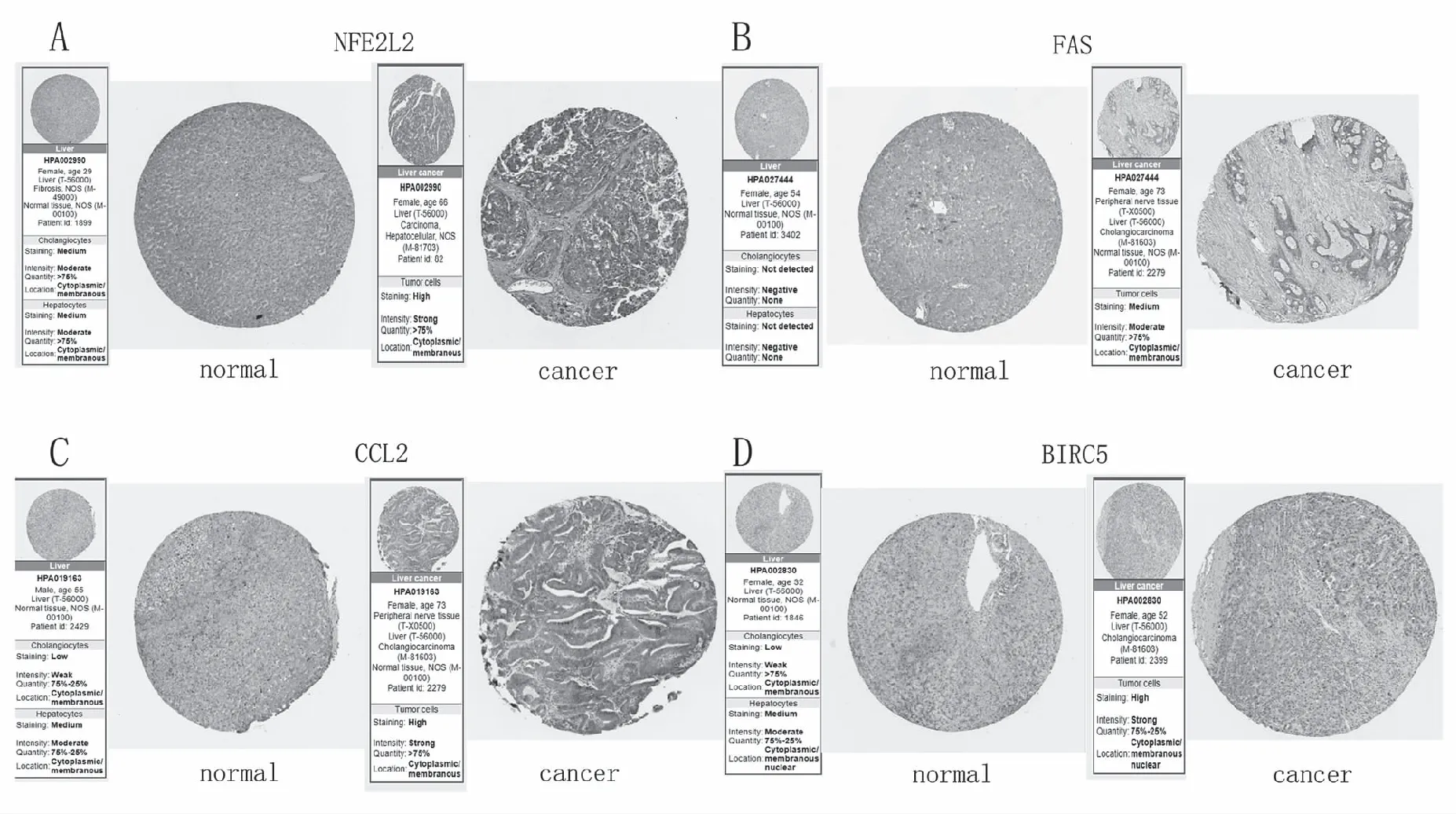
图5 4个关键基因在肝癌组织中的免疫组织化图Fig.5 Immunohistochemical map of 4 key genes in liver cancer tissue
2.6 临床因素相关性分析
分析了CCL2和BIRC5在具有不同临床特征的HCC中的表达水平。结果如图6所示,发现CCL2在患者性别、不同癌症分期和淋巴结转移状态的正常组表达水平显著高于肿瘤组。而BIRC5在患者性别、不同癌症分期和淋巴结转移状态的正常组表达水平显著低于肿瘤组。
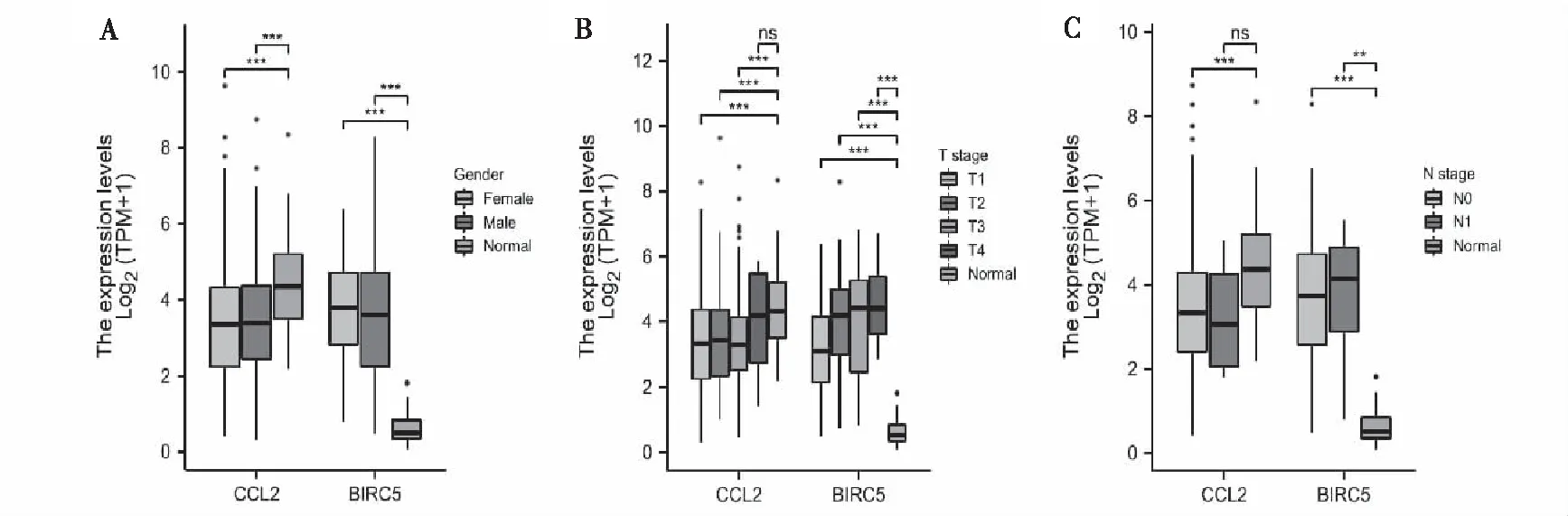
图6 根据患者性别A、个体癌症分期B和淋巴结转移状态C 3个关键基因在HCC中的表达情况Fig.6 Expression of 3 key genes in HCC according to patients' gender A, individual cancer stage B and lymph node metastasis status C注:P≥0.05,*P<0.05,**P<0.01,***P<0.001。
2.7 生存预后分析
通过Kaplan-Meier绘图仪数据库分析了CCL2和BIRC5在HCC中的预后价值,见图7。发现CCL2的过表达与HCC患者较差的总生存(OS)和无进展生存期(PFS)有关。而BIRC5的低表达与HCC患者较差的总生存(OS)和无进展生存期(PFS)有关。

图7 2个显著差异关键基因高、低表达与总生存率的曲线(A1、B1), 2个显著差异关键基因高、低表达与无进展生存期的曲线(A2、B2)Fig.7 Curves of 2 significantly different key genes with high and low expression versus overall survival (A1、B1), and 2 significantly different key genes with high and low expression versus progression-free survival (A2、B2)
2.8 分子对接
分子对接的结果如表1所示,LibDock 评分越高,亲和力越高。结果表明,相应的化合物可以与CCL2和BIRC5相互结合,并且最高的6个LibDock 评分对接模型显示在图8。

表1 分子对接LibDock评分Tab.1 Molecular docking LibDock scores
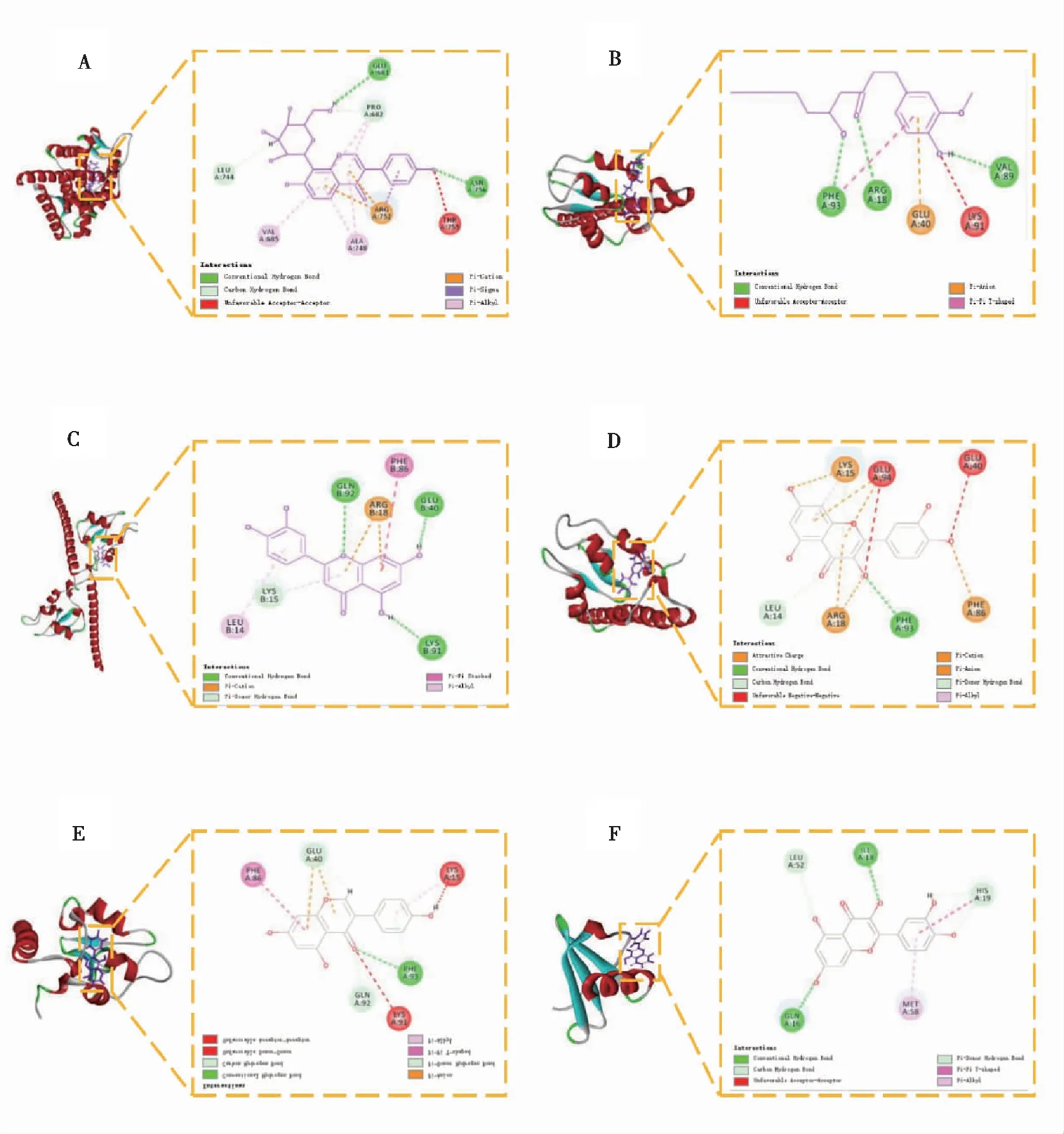
图8 活性化合物与核心靶点的分子对接示意图Fig.8 Molecular docking of active compounds with core targets注:A:葛根素与BIRC5的分子对接;B:[6]-姜酚与BIRC5的分子对接;C:木犀草素与BIRC5的分子对接;D:槲皮素与BIRC5的分子对接;E:染料木素与BIRC5的分子对接;F:槲皮素与CCL2的分子对接。
3 讨论与结论
HCC是原发性肝癌的常见组织学类型之一,在发展过程中,一系列渐进的事件与多种蛋白质或途径有关,其特点是死亡率高[24-25]。与西药“一药一靶”不同,由于中药成分的复杂性,多种成分和靶点之间具有协同作用,故在治疗 HCC 方面显示出一定优势[26]。随着生物信息学的快速发展,基于大型数据库的新兴网络药理学已成为从分子水平到路径水平详细描述复杂药物系统作用机制的常用工具,是研究中医药作用机制和开发新药前期高效的一种预测方法[27]。研究基于网络药理学和生物信息学,初步确定了GHJCF通过调节自噬干预肝细胞癌的作用机制。
通过GSE87630、GSE45267数据集分别获得1 250、1 305个差异表达基因,收集GHJCF 治疗HCC的活性成分27个,靶点452个,以及自噬相关基因222个,最后获得药物、疾病、铁死亡的共同靶点5个。通过生物信息学分析,我们确定了4个靶点作为GHJCF干预HCC机制的潜在靶标,差异表达分析结果显示,CCL2的表达水平显著低于正常组,而NFE2L2、FAS和BIRC5表达水平显著高于正常组。THPA验证NFE2L2、CCL2和BIRC5蛋白在癌症组织中的表达水平高,FAS在癌症组织中的表达水平中等。临床相关性研究表明,CCL2和BIRC5都与性别、个体癌症分期、淋巴结转移状况等临床指标相关。生存分析表明,CCL2的低表达与HCC患者的不良预后有关,BIRC5的高表达与HCC患者的不良预后有关。
此外,利用分子对接将CCL2和BIRC5与GHJCF有效成分进行分子对接。结果显示,BIRC5蛋白与GHJCF中的染料木素、槲皮素、葛根素和木犀草素成分结合分数较高,CCL2与槲皮素成分结合分数较高。研究表明,染料木素可有效降低患者的HCC风险,通过触发细胞凋亡来抑制胃癌和肝癌细胞的生长、通过调控AMPK防止HCC的发生并抑制其发展等作用[28-30]。槲皮素通过细胞自噬或凋亡诱导抑制肝细胞癌的生长[31]。葛根素可通过干预MAPK途径促进HCC的凋亡发生[32]。木犀草素可通过调控TGF-β1通路、p53通路、Fas/Fas-配体通路、内质网应激和AKT/OPN通路的多种信号通路抑制HCC细胞的生长[33-35]。通过综合分析,最终我们确定CCL2和BIRC5是GHJCF调控自噬干预HCC的最佳靶点。
研究表明,CCL2与肿瘤的发生密切相关,并与HCC的不良预后有关[36]。据报道,BIRC5在HCC中的表达增加会抑制细胞凋亡,促进肿瘤细胞增殖,并增加HCC细胞对放疗的抵抗力[37]。
综上,通过以上生物信息学分析,结合临床数据相关性,GHJCF可能通过染料木素、槲皮素、葛根素和木犀草素作用于BIRC5、CCL2,调节HCC的自噬,进而对HCC有抑制作用。

