范可尼贫血基因治疗研究进展
习必鑫 胡 群 刘爱国
华中科技大学同济医学院附属同济医院儿童血液科(湖北武汉 430030)
范可尼贫血(Fanconi anemia,FA)是一种罕见的常染色体隐性遗传或X连锁遗传的骨髓衰竭(bone marrow failure,BMF)综合征,与DNA 损伤修复缺陷和染色体不稳定密切相关,在人群中的发病率为(1~5)/100 万,新生儿患病率约为(0.5~2.5)/10万,全球范可尼贫血基因的携带频率约为1/300[1]。儿童范可尼贫血的临床特征包括进行性骨髓衰竭、先天性躯体异常、对DNA 交联剂高度敏感和易发展为恶性肿瘤[2]。进行性骨髓衰竭是FA 的主要特征,多见于5~10岁的患儿,且血小板减少或白细胞减少通常早于贫血症状的出现。15 岁的FA 患者中有80%会出现进行性造血功能衰竭,而年龄≥40岁的FA患者发生骨髓衰竭的风险超过90 %[1-2]。先天性躯体异常可见于60 %~70 %的范可尼贫血患儿,其中骨骼异常(髋部、脊柱侧凸、肋骨异常)、小眼症、皮肤色素沉着(咖啡斑)、性腺功能减退、身材矮小或生长发育迟缓、生育能力低下和肾脏异常等出现频率较高[1]。FA 还具有恶性肿瘤易感性[1-2],比如FANCD1或FANCN突变的FA患儿可能在5岁之前就死于急性髓系白血病或者骨髓异常增生综合征或者其他儿童实体肿瘤。年龄在5~15岁的FA患儿容易发展为急性髓系白血病,其发病风险约是普通患儿的800 倍;而年龄>15 岁的FA 患儿发生头颈部/食管鳞状细胞癌、肝癌或者妇科恶性肿瘤的风险更高。
儿童FA 的治疗主要包括异基因造血干细胞移植、口服雄激素、粒细胞集落刺激因子注射、输注血制品等,其中异基因造血干细胞移植是目前唯一可以治愈范可尼贫血的治疗方式,但是移植相关的并发症,比如移植物抗宿主病、病毒感染、继发恶性肿瘤等,仍然严重影响着患者的生活质量和远期预后[2]。近些年来,随着基因治疗技术的不断发展与完善,越来越多的研究证实它不仅可以改善FA患儿的血液学异常,还可以克服异基因造血干细胞移植治疗的诸多局限。本文通过FA基因治疗的相关文献及临床研究进行回顾,分析总结近30 年儿童FA 基因治疗的研究历程与进展。
1 FA基因治疗的概述
1.1 基因治疗的定义
基因治疗是通过载体或非载体途径对患者体内异常的遗传物质(DNA 或RNA)进行修改或补偿,实现矫正基因的持久表达,从而达到改善或治愈疾病的目的[3]。与传统的治疗方式相比,基因治疗具有靶向性好、毒副作用小、治疗更彻底、住院时间短等优势,是一种应用前景广阔的新型治疗策略[3]。
1.2 FA的分子学特征
FA是由FANC基因突变所引发的单基因缺陷类疾病。到目前为止,研究人员已经鉴定了22种FANC基因[4],包括FANCA,FANCB,FANCC,FANCD 1/BRCA2,FANCD2,FANCE,FANCF,FANCG/XRCC9,FANCI,FANCJ/BRIP 1,FANCL,FANCM,FANCN/PALB 2,FANCO/RAD 51 C,FANCP/SLX 4,FANCQ/ERCC 4,FANCR/RAD 51,FANCS/BRCA 1,FANCT/UBE 2 T,FANCU/XRCC 2,FANCV/REV 7,FANCW/RFWD 3,其中任何一种常染色体隐性遗传的纯合突变或者X 连锁遗传的FANCB突变或者显性遗传的FANCR/RAD51突变均可引起FA的发生。在这些FANC基因中,突变频率最高的是FANCA、FANCC、FANCG/XRCC 9三种,约60 %的FA 为FANCA突变所引起[1]。这22 种FANC基因编码的蛋白在FA/BRCA通路中协同负责DNA 链间交联(interstrand cross-links,ICLs)的修复,而FANC基因突变则会导致DNA 损伤修复的缺陷及对二环氧丁烷、丝裂霉素C等DNA链间交联剂高度敏感,这是范可尼贫血最重要的分子学特征[1]。因此,通过基因治疗矫正FANC基因突变来治疗范可尼贫血的策略或许是未来可以替代异基因造血干细胞移植的一种新型低毒性治疗方式。
2 FA基因治疗的早期尝试
2.1 第一阶段临床研究
1992—2007 年的16 年间(表1),通过携带正常FANC基因的γ-逆转录病毒载体对FA 患者的造血干细胞进行体外基因转导后再体内回输的临床试验共3 项。1999 年Liu 等[5]发表的研究结果显示,4 例接受正常FANCC基因治疗的患者中,其中3 例(11~14 岁的儿童)外周血和骨髓中FANCC功能正常的细胞数量和对链间交联剂的耐药性均表现出短暂的增加,但是并未观察到造血干细胞基因缺陷的长期矫正效应。第4 例患者在输注一次转基因造血干细胞后+50 d,被诊断为外阴鳞状细胞癌。2000 年6 月5 日至2005 年6 月24 日期间在美国明尼苏达大学进行了γ-逆转录病毒介导正常FANCC基因体外转导外周血自体造血干细胞后治疗FA 的临床试验[6],目前暂未公布相关研究结果。2007年Kelly等[7]发表的研究结果显示,7例FANCA基因型受试者(0.92~15.25 岁)中,只有2 例患儿(FAGT 1001 是0.92 岁,FAGT 1003 是4.5 岁)在输注了经过体外基因矫正的造血干细胞后表现出了血红蛋白含量和血小板计数的短暂升高,且未发生基因治疗相关的严重不良事件;而另外5 例受试者即使在足量粒细胞集落刺激因子动员后也未能采集到足量数量的CD 34+细胞。这几项研究均表明,携带正常FANC基因的γ-逆转录病毒载体体外转导造血干细胞后体内回输虽然可以短暂改善FA 患者的造血功能,但是均未能显示出任何长期的临床疗效。

表1 范可尼贫血基因治疗的第一阶段临床研究
2.2 γ-逆转录病毒介导基因治疗的局限
然而,2004 年Gaspar 等[8]研究人员采用γ-逆转录病毒体外转导造血干细胞的策略对4例X连锁重症联合免疫缺陷病患儿进行基因治疗,治疗后所有患儿的临床和免疫学特征均明显改善,而且细胞免疫和体液免疫也得到了较好恢复。那么,同样是采用γ-逆转录病毒载体体外转导造血干细胞的治疗策略,为什么对FA患者的基因治疗最终均失败?可能的原因包括以下4 个方面[9]:①FANC基因缺陷会导致所有造血干/祖细胞的染色体不稳定,易凋亡,可以采集的CD 34+数量非常少。②范可尼贫血患者的造血干细胞在体外培养的过程中,多种因素会导致有限的CD34+细胞迅速凋亡,比如干扰素γ、肿瘤坏死因子α、白细胞介素-1B、活性氧及体外培养时间>24小时等,而其他单基因缺陷病的造血干细胞体外培养条件则与之明显不同。③逆转录病毒载体转导效率低下,且仅能转导处于分裂期的造血干细胞,而不能转导处于静止期的造血干细胞。④FA患者的骨髓造血微环境功能缺陷,也会导致造血干细胞的再植入困难。
3 FA基因治疗的研究现状
3.1 第二阶段临床研究
从2008年至2021年的近14年间,全球一共有7项一期/二期临床试验运用慢病毒载体转导FANCA基因来治疗FA 患者(表2),其中2 项临床试验已经发表了相关研究成果,而另外5 项研究仍在招募FANCA基因型受试者,暂未发表相关研究成果。2018年Adair等[10]发表的研究结果证实,只有高表达CD 34+的造血干细胞才具有体外增殖和体内造血重建的能力;体外清除CD 3+、CD 14+、CD 16+、C D 1 9+的造血干细胞,不仅可以纯化≥6 0 %原始CD 34+细胞,还不影响体外慢病毒载体转导FANNA基因和异种体内植入的效率。2019 年Río等[4]研究人员使用粒细胞集落刺激因子和普乐沙福对FANCA基因型受试者进行造血干细胞动员,获取了足量的CD34+细胞;然后运用携带PGK-FANCAWPRE 调控元件的慢病毒载体在短时、低氧等条件下体外转导自体造血干细胞;最后在没有进行预处理化疗的情况下,将这些造血干细胞再回输给FA受试者(4例患儿年龄:3~8岁)。其研究结果证实,慢病毒介导的造血干细胞基因治疗不仅可以成功纠正FA患者外周血和骨髓细胞的特征性表型,还能持续改善造血干细胞的体内再植入和增殖能力。此外,该研究的FANCA基因插入位点的分析还显示慢病毒介导的FA基因治疗不存在FANCA插入基因相关的遗传毒性。

表2 范可尼贫血基因治疗的第二阶段临床研究
回顾儿童FA 基因治疗的整个研究历程[11],我们发现在第一阶段临床研究中,有2 项临床试验的研究对象均为FANCC基因突变型患者,治疗后均未显示出长期的临床益处;而在第二阶段临床研究中,7 项临床试验的研究对象均为FANCA基因突变型患者,且其中一项试验已获得成功。那么,FANC突变的基因型是否会影响逆转录病毒或者慢病毒介导基因治疗的效果,目前尚不清楚。Shakeel等[12]发表的研究结果显示,FANCA蛋白处于范可尼贫血核心蛋白复合体的外围,而FANCC蛋白则位于核心蛋白复合体的内部,更靠近DNA复制叉,FANCA突变比FANCC突变导致FA核心蛋白复合体形成受阻的概率小很多。因此,这也可能导致基因治疗矫正FANCC突变的成功率比FANCA突变低。
3.2 慢病毒介导基因治疗的发展与困境
现阶段范可尼贫血基因治疗的最重要技术进步包含以下3 个方面:①携带有自我灭活序列和调控正常FANC基因表达元件的人类免疫缺陷病毒-1(HIV-1)慢病毒载体不仅可以转导处于分裂期的造血干细胞,还可以转导处于静止期的造血干细胞,且转导效率显著提高[9]。②造血干细胞体外培养条件的改进[9],比如体外培养时间<24 小时,培养基中加入抗肿瘤坏死因子α 抗体、抗干扰素γ 抗体、转化生长因子β 抑制剂、抗氧化剂,低氧(氧浓度<5%)等可以明显降低体外范可尼贫血基因缺陷细胞的凋亡。③粒细胞集落刺激因子和普乐沙福的应用[13],有效增加了可采集的CD34+细胞数量。尽管目前运用慢病毒载体体外纠正FANC基因缺陷的技术日臻完善,但是体外矫正基因缺陷仍始终面临着转导效率低、造血干细胞凋亡增加及体内再植入困难等难题。因此,设计更完善的载体结合更高效的体内靶向转导策略将有助于彻底解决这些难题,也将为FA基因治疗开辟更广阔的前景。
4 FA基因治疗的展望
自2016年以来,欧洲和美国药品管理局先后批准了6种用于基因治疗的产品[3],其中2种是治疗B系淋巴细胞白血病的嵌合抗原受体T细胞(chimeric antigen receptor T cells,CAR-T)免疫治疗产品;另外4 种产品则用于治疗单基因缺陷引发的疾病,包括输血依赖型β-地中海贫血、脊髓性肌萎缩症、遗传性视网膜营养不良和重症联合免疫缺陷症。目前,CAR-T治疗在国内发展迅速,已被广泛用于治疗儿童难治复发的B 系急性淋巴细胞白血病、非霍奇金淋巴瘤等恶性肿瘤性疾病,显著改善了患儿的预后。此外,全球尚有800多种基因治疗处于I期/II期临床试验阶段[3],治疗范围涵盖了多种以前无法治愈的疾病,比如杜氏肌营养不良症、亨廷顿氏病、血友病、FA等。
目前,FA基因治疗的临床研究仍处于体外矫正基因缺陷的阶段,虽然部分临床试验已经获得了成功,但是体外矫正缺陷基因的策略始终面临着转导效率低、造血干细胞凋亡率高及体内再植入困难等难题。因此,FA基因治疗的第三阶段临床研究主要集中于将携带正常FANC基因的高选择性的慢病毒载体直接注射到动物模型体内进行基因治疗[6],且已经取得了部分进展,该基因治疗策略完善后将逐步过渡到范可尼贫血体内矫正基因缺陷的阶段。未来通过CRISPR/Cas 9 技术与携带有SCF-RD 114 包膜的非整合型SIN-LV 载体的结合来进行体内基因矫正或许能成为第四阶段范可尼贫血基因治疗的理想策略[14]见表3。
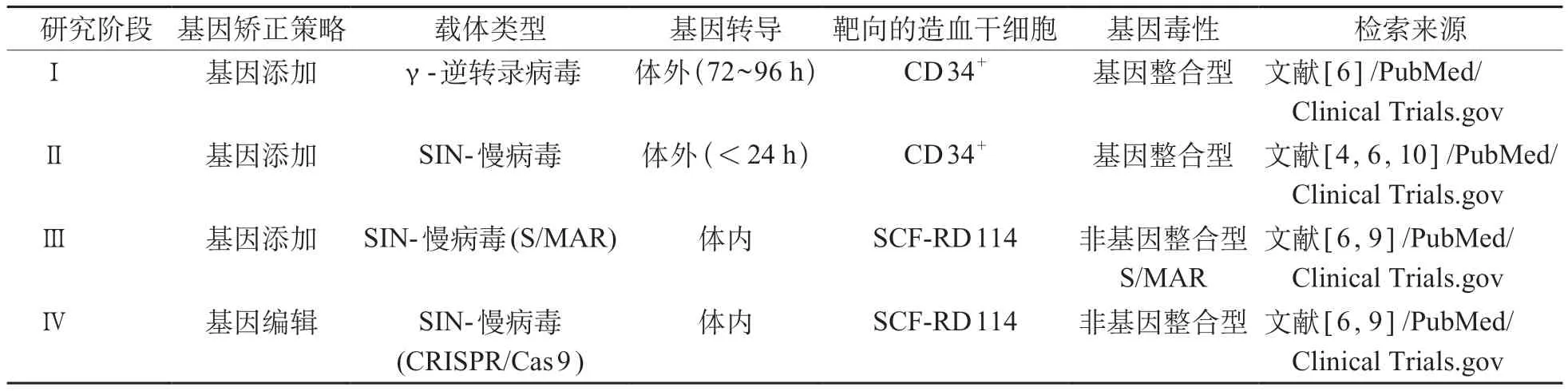
表3 范可尼贫血基因治疗的临床研究
综上所述,基因治疗是一种未来可以替代异基因造血干细胞移植治疗FA 的新型低毒性治疗方式,但是目前仍然面临着诸多安全风险[15]和伦理风险。其中基因治疗的安全性问题主要来自机体对病毒载体或递送的遗传物质的免疫反应及插入基因异常整合引发新肿瘤的风险。而基因治疗的伦理学问题则主要体现在基因信息的隐私侵犯、基因歧视及基因武器化等风险,其中基因武器威胁人类和平,甚至可能引发灾难。因此,基因治疗任重而道远,仍需要我们共同努力来解决其面临的各种挑战和争议。

