基于网络药理学的桑白皮治疗2型糖尿病的作用机制
李艳,李子雯,李利民,汪梦霞,张鹏,吴正治*
(1.深圳大学第一附属医院 深圳市转化医学研究院,广东 深圳 518035;2.深圳市老年医学研究所,广东 深圳 518020)
2型糖尿病(type 2 diabetes mellitus,T2DM)是以高血糖和胰岛素抵抗为主要病理特征的疾病。通常认为是一种侵袭性疾病,疾病的进展常常导致心血管疾病、微血管并发症、肾病、视网膜病变及神经病变等多项并发症风险飙升[1]。研究数据显示全球范围内T2DM的发病率在不断上升,到2030年全球糖尿病人数预计增长到5.11亿人,而到2045年糖尿病人数将跃升至7亿人[2]。。
中医药治疗复杂疾病具有安全、低毒、高效等独特优势[3-4]。中医学将糖尿病归属于“消渴”的范畴,认为消渴的基本病机为阴津亏损,燥热内生[5]。《素问·奇病论》中首次出现“消渴”之名,曰:“脾瘅……此人必数食甘美而多肥也,肥者令人内热,甘者令人中满,故其气上溢,转为消渴。”消渴病变的部位主要与五脏有关,尤以肺、胃(脾)和肾为关键。肺的宣发肃降功能,与现代医学中胰岛素促进肝外胰岛素敏感组织的血糖代谢作用相似。中医临床中有运用“泻肺”法来治疗消渴病,多以清肺热、滋肺阴为主[6]。桑白皮为桑科植物桑MorusalbaL.的干燥根皮,始载于《神农本草经》,其性寒,入肺经,具有泻肺平喘、利水消肿的功效[7-8]。现代药理学研究表明桑白皮具有抗炎、抗病毒、抗菌、抗糖尿病以及神经保护作用等[9-12]。仝小林教授认为,桑叶、桑白皮和桑枝分别散中上焦、肺胃和四旁经络及皮腠之火,其中桑白皮有“小白虎汤”之美誉,三味药临床上均具有明确的降糖疗效[13-14]。陈春光[15]研究发现桑白皮煮水代茶饮能够有效降低糖尿病患者的血糖、减少胰岛素使用剂量。目前临床应用桑白皮及其复方治疗T2DM及其并发症有较好的疗效[16],但其详细的作用机制尚不明确。
近年来,网络药理学被广泛用于中医药治疗复杂疾病的机制研究中,如新型冠状病毒肺炎、癌症、心脑血管疾病等[17-18]。网络药理学将药物、化合物、靶点、疾病之间的连接形成网络,从整体考虑了药物之间的相互作用,实现了多组分、多靶点网络的新模式。本研究运用网络药理学方法预测桑白皮治疗T2DM的活性化合物、潜在的蛋白靶点和通路,同时通过分子对接从受体与配体方面验证桑白皮活性成分干预T2DM关键靶点的有效性,为其临床应用提供科学依据。
1 材料与方法
1.1 桑白皮活性成分的筛选
在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database andanalysis platform,TCMSP)(https://tcmspw.com/tcmsp.php)以“桑白皮”为关键词,检索其所有活性成分。参考文献[18]方法,以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18为筛选条件,进一步获得桑白皮的主要活性成分。
1.2 桑白皮活性成分-靶点网络构建
通过TCMSP数据库对桑白皮的主要活性成分进行靶点预测,得到所有活性成分对应的靶点,并利用UniProt(https://www.uniprot.org/)数据库筛选出人源(Home sapiens(Human))靶蛋白,再将靶蛋白转化为对应的靶基因,最终得到桑白皮所有靶点的基因名称。然后采用Cytoscape 3.6.1软件,导入上述获得的活性成分及靶点关系,构建活性成分-靶点网络图。
1.3 T2DM疾病靶点与桑白皮共同靶点的获取
使用疾病数据库DrugBank(https://go.drugbank.com/)、GeneCards(https://www.genecards.org /)和TTD(http://db.idrblab.net/ttd/),通过输入关键词“Type 2 diabetes”,得到疾病的相关靶点。经过去除重复、获得2型糖尿病的相关靶点。通过维恩分析,得到桑白皮治疗T2DM的潜在作用靶点,构建活性成分-潜在靶点网络图。
1.4 蛋白质-蛋白质相互作用网络构建
通过STRING数据库分析桑白皮治疗T2DM潜在作用靶点间的相互作用,研究物种设置为人类,从而获取靶点蛋白之间的蛋白质-蛋白质相互作用(protein-protein interaction ,PPI)网络关系。再将其TSV格式文件导入Cytoscape3.6.1软件,并使用cyto Hubba插件对网络进行分析,计算度值(degree),最终获得PPI网络图,其网络图由内而外度值依次减小,颜色由深及浅。
1.5 GO和KEGG通路富集分析
Matascape网站(http://metascape.org)集成了四十多个生物信息数据库,在内容上包含了生物通路分析、PPI网络结构分析以及丰富的基因注释功能,让生物学家轻松获得全面的数据解析。将桑白皮治疗2型糖尿病的潜在靶点基因输入Matascape功能注释工具中,选定物种(H.sapiens),进行基因本体(gene ontology,GO)分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,得到并保存结果。其中P值Cutoff为0.01,并使用 Banjamini-Hochberg方法进行P值校正。根据P值大小进行排序,绘制条形图和气泡图,分析药物治疗疾病的可能机制。
1.6 活性成分-关键靶点分子对接验证
从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载化合物(槲皮素、山奈酚、β-谷甾醇、鸢尾甲黄素B和光果甘草酮)2D结构的mol2格式文件,即小分子配体。从RCSB PDB数据库(http://www.rcsb.org/)中保存AKT1,IL-6、VEGFA,CASP3靶点的3D结构PDB格式,即蛋白受体;用Autodock tools处理小分子和靶点蛋白,并生成pdbqt格式文件。通过AutoDock vina软件验证化合物与靶蛋白之间的亲和力和结合模式,分析了100次对接结果并选择最低能量打分进一步分析,应用Pymol软件绘制靶点蛋白受体和活性成分之间的结合模式图。
2 结果
2.1 桑白皮的活性成分及活性成分-靶点网络
通过TCMSP数据库搜集桑白皮中的化学成分共194个,筛选得到活性成分31个。通过对上述活性成分进行作用靶点预测,发现有6个成分未找到对应靶点,删除重复靶点后,则25种成分共获得预测靶点191个。根据OB大小进行排序,前10位主要活性成分及靶点数目见表1(全表OSID科学数据与内容附表1)。
研究建立了一个各个节点密切联系的活性成分-靶点网络关系图(图1),该网络图由217个节点和454条边线组成。通过Network Aanlysis对每个节点进行分析,得到网络图中各个节点的度值。在活性成分中度值越大,表示该活性成分对应的靶点数目越多;而在靶点中度值越大,表示能与该靶点发生作用的活性成分越多。通过分析结果可以看出,度值最高的活性成分为槲皮素(S20),对应的靶点有153个,其次为山奈酚(S24)、β-谷甾醇(S13)、鸢尾甲黄素B(S14)、光果甘草酮(S19),对应的靶点个数分别为62、37、21和20个。通过表1与图1共同体现了桑白皮具有多活性成分、多作用靶点、各药物之间具有丰富共同作用靶点、可协同发挥治疗疾病作用的药理学特点。
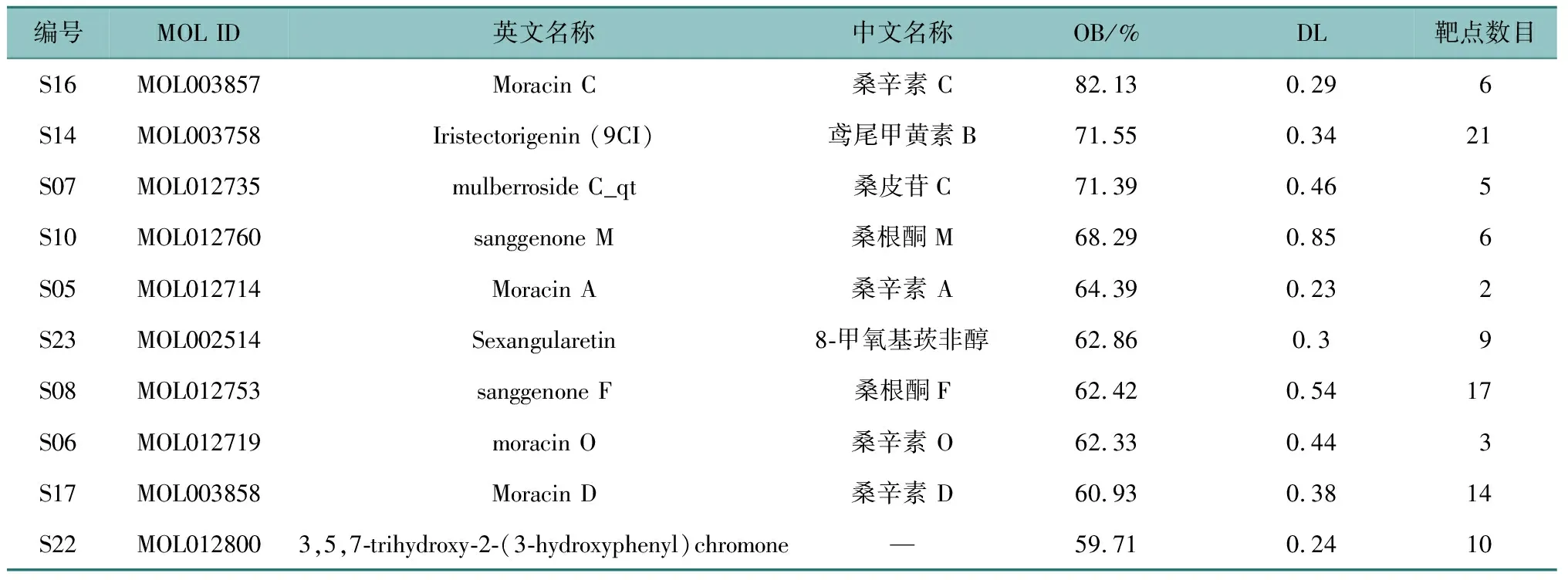
表1 桑白皮的主要活性成分及靶点数目Table 1 Active ingredients and number of targets of Mori Cortex

图1 桑白皮活性成分-靶点网络图Fig.1 Active ingredient-target network of Mori Cortex
2.2 桑白皮治疗T2DM潜在靶点的筛选
应用DrugBank、GeneCards和TTD数据库检索T2DM的疾病靶点,合并所获得的靶点并删除重复、整合后,共得到2 147个疾病靶点。将疾病相关靶点与桑白皮的预测靶点取交集后,共得到126个潜在靶点,主要包括PTGS2、AR、PTGS1、ESR1、PRSS1、PPARG等。通过Cytoscape3.6.1软件构建活性成分-潜在靶点网络图(图2)。该图中包含节点149个,边线286条。提示桑白皮治疗T2DM的作用机制可能与这126个潜在靶点有关。

图2 桑白皮活性成分-潜在靶点网络图Fig.2 Active ingredient-potential target network of Mori Cortex
2.3 潜在靶点的PPI网络构建与分析
将桑白皮治疗T2DM的126个潜在靶点导入STRING数据库获取PPI关系,再导入Cytoscape软件绘制PPI图(图3)。该图中包含126个节点,2 364条边,平均节点度值为37.5。该网络图由内而外度值依次减小,颜色由深及浅,其中度值大于37.5的靶点有58个,前10位见表2(全表见OSID科学数据与内容附表2)。度值大小排名前10位的靶点分别为AKT1、IL-6、TNF、VEGFA、TP53、CASP3、JUN、MAPK1、EGF、MMP9。推测这10个靶点为桑白皮治疗T2DM的关键靶点。
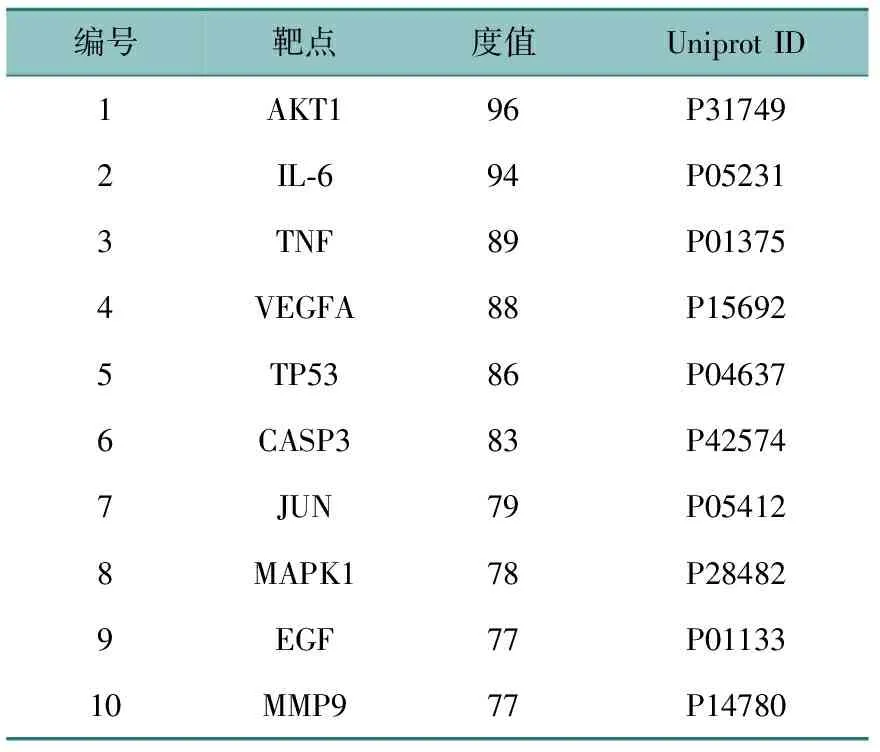
表2 桑白皮部分潜在靶点信息(度值大于37.5)Table 2 Information of potential targets of Mori Cortex(degree>37.5)
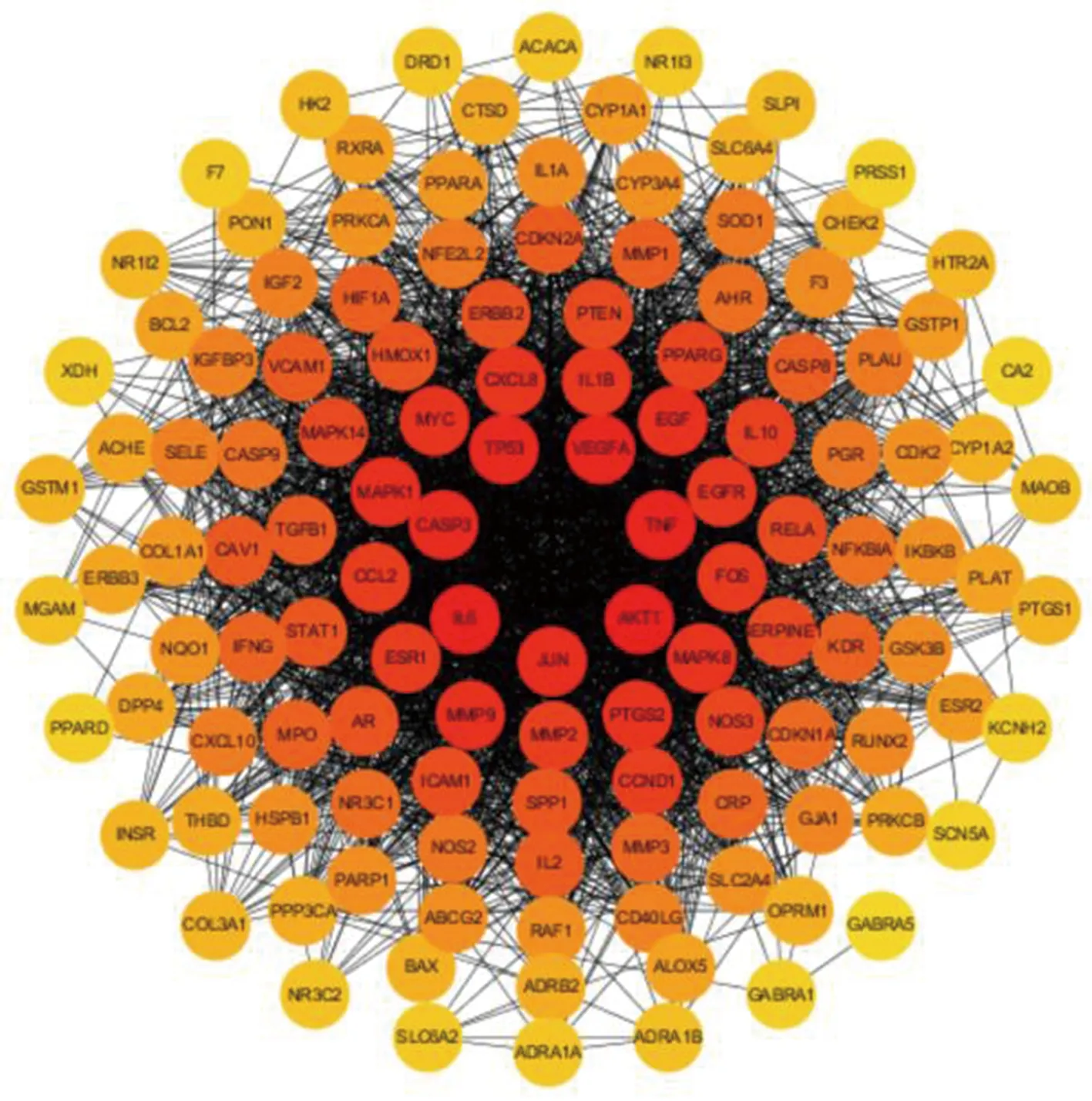
图3 桑白皮治疗T2DM的关键靶点PPI 网络Fig.3 PPI network of key targets of Mori Cortex in the treatment of T2DM
2.4 潜在靶点的GO功能及KEGG通路富集分析
对桑白皮治疗T2DM的潜在靶点进行GO分析和KEGG通路富集分析,见OSID科学数据与内容附图1。GO分析主要从基因的生物学过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)3个方面提供了详细的基因功能注释。通过分析可知,BP主要涉及对脂多糖、细菌起源分子、无机物质、有毒物质、脂质的反应等;CC主要涉及膜筏、膜微结构域、膜区等;MF主要涉及转录因子结合、蛋白激酶结合、酶结合等。KEGG通路分析表明,桑白皮治疗T2DM涉及的通路主要包括AGE-RAGE信号通路在糖尿病并发症中的作用、癌症通路、流体切应力和动脉粥样硬化、乙型肝炎、IL-17信号通路、TNF信号通路、HIF-1信号通路、内分泌抵抗、PI3K-Akt信号通路等,见OSID科学数据与内容附图2。
2.5 桑白皮活性成分和关键靶点分子对接验证
将筛选得到的桑白皮活性成分与其关键蛋白使用AutoDock软件进行分子对接验证,以直观的方式展示了成分的最佳构型和关键靶点之间的相互作用。对接结果如表3所示,分子与靶点蛋白的最低结合能均不超过-23.43 kJ/mol,表现出较强的结合活性。其中槲皮素与AKT1的结合能最低,而光果甘草酮与IL-6、VEGFA、CASP3的结合能最低,分别为-31.80、-29.71、-35.15 kJ/mol。2D与3D结合模式显示,槲皮素与AKT1蛋白结合时,

表3 桑白皮活性成分与关键靶点分子对接分数Table 3 Molecular docking fraction of core active ingredients and key targets of Mori Cortex
通过AKT1的Trp80结构上的苯环与底物的共轭结构之间的π-π相互作用,以及这种共轭结构与一些极性氨基酸之间的超共轭效应相互作用,较好地结合在了AKT1的活性中心。此外,槲皮素与AKT1复合物活性位点中的许多残基相互作用形成了氢键网络。如羟基上氢的化学结构与一些容易形成氢键的氨基酸(分别为Gln 79、Ser 205、Thr 211和Tyr 272)形成氢键相互作用,起到关键作用。光果甘草酮与IL-6蛋白结合时,结合到了由Glu100、Lys121、Gln125、Gln128、Asn145、Ala146这些提供范德瓦耳斯力的氨基酸的口袋中,Leu93、Glu96、Val97、Ile124、Pro142提供疏水作用力,Thr139与glabrone形成了3.3 Å的氢键。光果甘草酮与VEGFA蛋白结合时,光果甘草酮结合到了由Asp34、Ile35、Glu42、Ile46、Phe47、Ser50这些提供范德瓦耳斯力的氨基酸的口袋中,Phe36、Ile43、Pro85提供疏水作用力,与Tyr45形成了2.8 Å的氢键。光果甘草酮与CASP3蛋白结合时,主要是通过范德瓦耳斯力与疏水作用力结合在Casp3的口袋中,Arg64、Ser120、His121、Ala162、Ser205、Ser213、Ser251、Asp253提供范德瓦耳斯力,Cys163、Trp206、Arg207、Phe256提供疏水作用力。槲皮素、光果甘草酮与AKT1、IL-6、VEGFA、CASP3的分子对接可视化结果见图4。
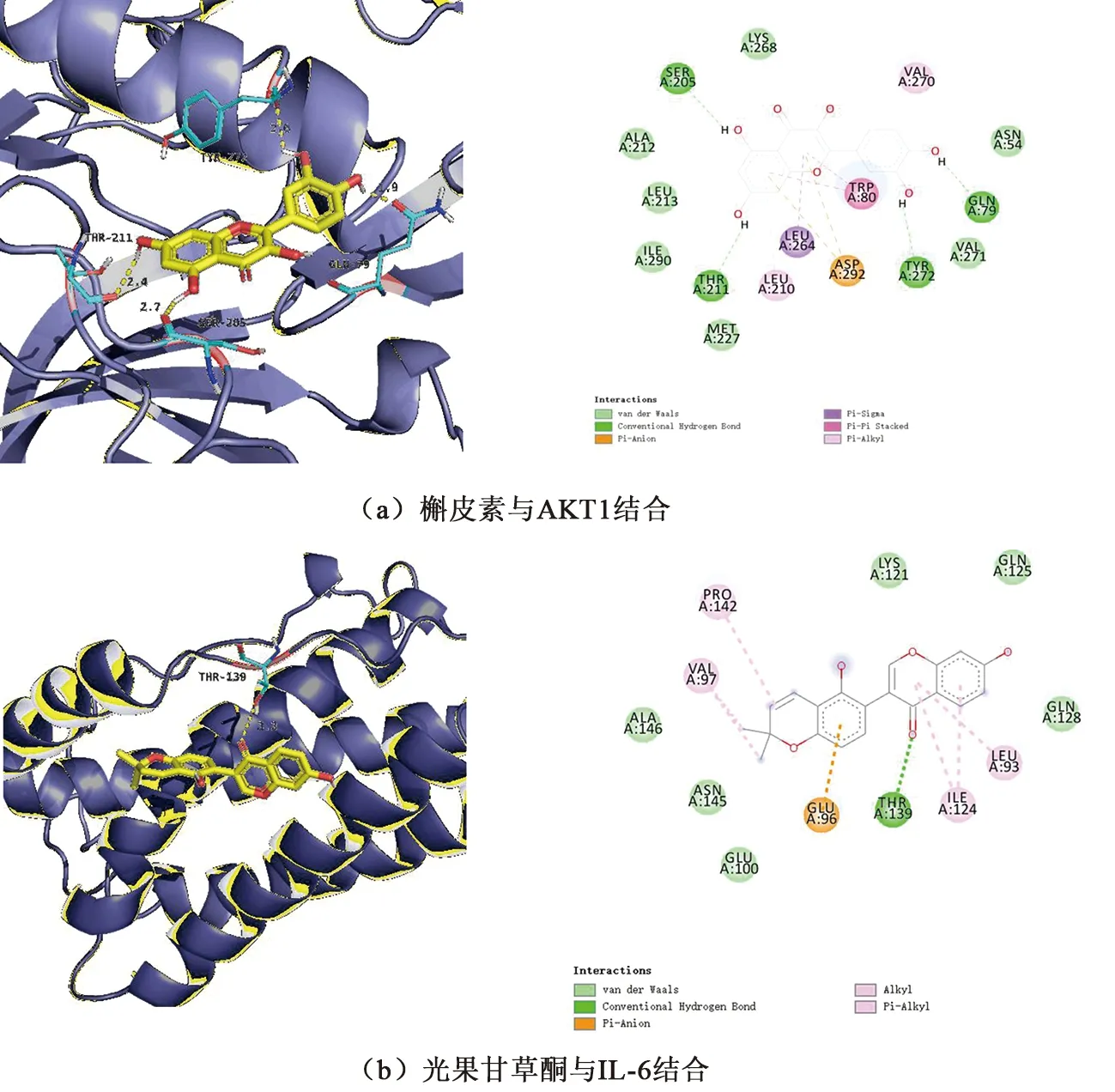

图4 槲皮素、光果甘草酮与AKT1、IL-6、VEGFA、CASP3的分子对接可视化结果Fig.4 Visual results of molecular docking of quercetin and glabrone with AKT1, IL-6, VEGFA and CASP3
3 讨论
本研究运用网络药理学的方法初步探讨了桑白皮治疗T2DM的作用机制,筛选其活性成分、作用靶点及相关生物学通路,为临床“从肺论治消渴”提供科学依据。预测得到桑白皮有效活性成分25个,药物-疾病交集靶点126个,借助PPI网络分析筛选到10个较为重要的靶点AKT1、IL-6、TNF、VEGFA、TP53、CASP3、JUN、MAPK1、EGF、MMP9。GO分析主要涉及细胞因子信号转导通路、对脂质的反应和凋亡信号通路等生物过程;KEGG通路分析主要涉及AGE-RAGE信号通路在糖尿病并发症中的作用、癌症通路、流体切应力和动脉粥样硬化、IL-17信号通路、TNF信号通路、HIF-1信号通路、内分泌抵抗、PI3K-Akt等信号通路。
研究表明,AKT1参与细胞凋亡和葡萄糖代谢在内的细胞过程,与糖尿病、肿瘤、类风湿关节炎等多种疾病的发生发展密切相关[19-20]。T2DM可能是细胞因子介导的炎症反应,IL-6、TNF在T2DM患者体内显著升高,进而可导致胰岛素分泌功能障碍的发生[21]。细胞周期与凋亡蛋白CASP3,肿瘤相关基因如TP53、MAPK1和MMP9等也在肥胖、糖尿病等疾病中发挥重要作用[22-23]。此外,AGE-RAGE信号通路可激活下游核转录因子(NF-KB),刺激产生血管内皮生长因子(VEGF),在糖尿病肾病、糖尿病足、糖尿病周围神经病变等疾病的发生发展中发挥重要作用[24]。PI3K-Akt信号通路是胰岛素的主要下游分子通路,其表达下降在糖尿病和胰岛素抵抗发病机制中起重要作用[25-26]。
桑白皮活性成分槲皮素、山奈酚、β-谷甾醇、鸢尾甲黄素B、光果甘草酮等可能通过PI3K-Akt、TNF等相关信号通路作用于AKT、IL-6、TNF等靶点而起到抗T2DM作用。现代研究表明,槲皮素是一种天然黄酮类化合物,具有抗炎、抗氧化等作用,可治疗糖尿病及糖尿病肾病、糖尿病性周围神经病变等多种并发症[27-28]。张煜敏等[27]研究表明槲皮素可通过激活AKT/FOXO3信号通路减少糖尿病大鼠心肌细胞凋亡。山奈酚可通过上调骨骼肌PI3K-AKT-GLUT4信号通路,改善自发型T2DMKKAy小鼠的胰岛素抵抗[29]。β-谷甾醇可通过下调炎症因子TNF-a和IL-6水平改善急性肺损伤[30]。鸢尾甲黄素B是肝脏X受体(LXR)调节剂,可增加巨噬细胞RAW264.7中ABCA1和ABCG1的表达,从而调节胆固醇稳态[31]。光果甘草酮是一种异黄酮,具有抗流感活性和显著的PPAR-γ配体结合活性[32]。作为天然的异戊烯基黄酮类化合物,桑辛素A、B、C、D等一系列化合物也表现出显著的抗癌、抗氧化等生理活性[33]。Guo等[34]研究发现桑辛素M可通过PI3K/AKT/mTOR信号通路抑制脂多糖诱导的炎症反应。在分子对接方面,山奈酚、β-谷甾醇、鸢尾甲黄素B和光果甘草酮与AKT1、IL-6、VEGFA、CASP3均具有较好的结合活性,其中光果甘草酮与对应靶点的结合能最低。
综上所述,根据中药网络药理学的研究方法,本文初步阐述了桑白皮治疗T2DM的潜在活性成分、可能作用靶点及信号通路。由于光果甘草酮对T2DM的基础研究甚少,未来将对其进行分子生物学和体内体外实验验证,为光果甘草酮的临床应用提供科学依据。

