猪细小病毒分子生物学研究进展
夏 娜,黄 凯,王 瑜,楚电峰
(青岛易邦生物工程有限公司,山东青岛 266032)
猪细小病毒(PPV)是一种无包膜的细小病毒,被认为是引起世界范围内猪繁殖障碍的主要原因之一,其特征是不孕、流产、死胎、畸形胎和木乃伊胎,通常用首字母缩写为SMEDI(死产、木乃伊、胚胎死亡和不孕)。PPV 一直是养猪业的全球性问题,给全球养猪业造成了巨大的经济损失[1]。从历史上看,商品猪的繁殖损失在20 世纪60 年代很高,当时与饲养环境、营养、遗传和有毒物质等问题有关[2]。首次猪细小病毒是从培养猪瘟病毒的猪肾原代细胞和睾丸原代细胞培养中获得的,发现了持续的小颗粒污染(22~23nm)[3]。这些颗粒类似于克氏大鼠病毒(一种细小病毒)[4]。由于该病毒在猪的细胞系中具有复制能力,因此有可能分离并分类为猪细小病毒[5]。猪细小病毒病被认为是世界上大多数地区的地方病,在所有猪群种类中都可以检测到。据国际病毒分类委员会(ICTV)的最新发布的分类,该病毒是细小病毒科、细小病毒亚科和蹄类细小病毒1 型的成员。
1 病毒分子生物学
所有细小病毒的基因组都代表一个约5kb 的单链DNA 分子。在病毒的两个末端序列中,一个120~200 个碱基的复发的回文结构是DNA 复制所必需的,而猪细小病毒的基因组能进行自主复制[6]。PPV 基因组使用选择性剪接来扩展编码蛋白质,编译2 条结构多肽(VP1 和VP2),VP1 分子量为84ku,VP2 分子量为64ku。较小的蛋白质(VP2)与VP1 蛋白通过从相同的RNA 模板反转录而产生,VP1 有729 个氨基酸残基中120 个形成氨基末端的独特部分(其中VP2中没有)[7]。第三种结构蛋白VP3 是VP2 的翻译后修饰产物,分子量为60ku[8]。PPV 中的主要的非结构蛋白是NS1,NSl 的基因大小为1989bp,有663 个氨基酸序列,具有3 个不同的潜在糖化点。该非结构蛋白是PPV 基因组通过自身编译的反式蛋白,在病毒的复制过程中发挥重要的作用[9]。编译猪细小病毒的结构蛋白和非结构蛋白的基因组贯穿整个DNA 结构中,导致的病毒粒子在非常小的空间能够生存[10]。
如图1 所示,PPV 衣壳是一个球形外壳(直径约28nm),由60 个编码的PPV 结构蛋白(VP)组装而成右侧开放阅读框(RORF),二十面体对称排列[11]。PPV 有序的VP 单体由核心的八链(βB~βI)反向平行β-桶基序和构成衣壳内表面的BIDG 片组成[6]。该β-桶结构由该单体由八条反平行的β-链组成是病毒衣壳的一种常见结构,在目前所有脊椎动物细小病毒的衣壳中都是保守的,其中细小病毒还由1 个α-螺旋和4 个环组成[6]。在PPV 由5 个DE 环组装而成,VR 3D 构象位于二十面体5 倍体对称轴的通道上使其赋予了细小衣壳属的特征。围绕着5 倍体对称轴将衣壳内部与外部连接起来,该通道的凹陷处被称为峡谷区,在细小病毒的复制过程中起着重要的作用。凸起位于包围着二十面体的3 倍体轴上,由2 种或3 种VP 单体的环/VRs 组装而成,由大约90%的VP2 和10%的VP1 分子构建[12]。2 倍体对称轴和3 倍体对称轴主要由位于单体环中的氨基酸组成[12]。病毒与不同宿主因子的相互作用主要由3 倍体轴表面环介导而成,包括病毒与受体和抗体的相互作用[13]。2 倍体对称轴上可以观察到凹陷其在不同种属内的深度和宽度是可变的,主要是由于侧链方向的差异导致的[6]。

图1 猪细小病毒的衣壳结构
2 病毒的细胞生物学
PPV 的主要复制发生在淋巴组织中,其次病毒可以通过病毒血症在全身分布。目前还不清楚PPV 是如何穿过胎盘屏障到达胎儿的,因为6 个组织层完全分隔了母猪和胎儿的血液循环,并且这些细胞紧密相连,甚至不允许小分子如抗体通过[14]。很可能由于病毒在被巨噬细胞吞噬后仍能保持感染性,它可以利用巨噬细胞穿过猪的上皮绒毛膜胎盘感染胎儿[15]。
胎儿感染后,由于胎儿组织中的细胞具有有丝分裂的活性,为PPV 提供易受感染和病毒复制的环境[16]。PPV 进入细胞仍不清楚,但包括网格蛋白介导的胞吞作用或调节型外排途径的胞吐运输,胞内运输和酸化对于PPV 进入细胞核是必不可少的[10],因为衣壳的可逆修饰允许病毒从核内体逃逸[17]。但有研究表明,PPV 可以和细胞表面糖蛋白上的唾液酸受体结合后,利用网格蛋白介导的胞吞作用和胞饮途径进入细胞,独立的病毒粒子通过网格蛋白介导的胞吞作用进入胞内,而在pH 小于8 的情况下PPV 具有聚集性的趋势,并且趋向于通过胞饮作用侵入[18]。病毒到达细胞核后,细小病毒通过利用宿主细胞进行复制,主要在细胞核内进行复制利用了转录和复制酶系统。PPV 复制过程降低了线粒体膜电位,随后的氧化损伤也导致细胞毒性蛋白如细胞色素c 从线粒体释放到胞质溶胶,引发细胞凋亡,导致病毒性疾病中的细胞死亡和组织损伤[19]。在PPV 感染过程中,猪细小病毒的非结构蛋白能与自噬相关蛋白和RAB2A 互作[20]。VAMP7能通过介导来自高尔基体和溶酶体的囊泡与质膜的融合来调节自噬小体的形成从而维持线粒体的稳态[21]。PPV 感染能够诱导PTCs 发生自噬,PPV 感染的早期NS1 通过与RAB2A 相互作用影响了RAB2A 与VAMP7 介导的自噬体和溶酶体融合,而在PPV 感染的后期,NS2 能同RAB2A 和VAMP7 都发生互作来促进RAB2A 和VAMP7 介导的自噬体与溶酶体融合,诱导细胞形成完全自噬[22]。目前报道的猪细小病毒的出核方式主要是依赖于核输入受体蛋白CRM1 介导的出核方式,CRM1 是importinβ 家族成员之一。结果表明,B19V 在感染过程中通过11kDa 蛋白与CRM1发生互作促进病毒出核[23]。
PPV 的毒力特性似乎与病毒蛋白基因有关,PPV的两个原型菌株NADL-2 株和Kresse 株在体内和体外的致病能力都有很大差异,使用来自致病性(Kresse株)和非致病性(NADL-2 株)PPV 的重组病毒的体外研究表明,它们的基因组序列几乎相同(13 个单核苷酸取代和一个127 个核苷酸非编码重复序列),基因组之间的比较显示非编码区几乎相同。对于非结构基因区(NS1/NS2),发现的所有差异都是沉默的,而在结构基因(VP1/VP2)中,8 个差异中的6 个导致氨基酸取代,衣壳蛋白中的单个氨基酸影响PPV 在某些细胞系中的复制能力[24,25]。在PPV 感染过程中VP2能参与病毒基因组的入核和成熟病毒粒子的组装,具有抗原特性以刺激宿主免疫反应[26]。VP1 是病毒衣壳的次要成分,也参与病毒复制[27]。NS1 是一种重要的非结构蛋白,参与病毒基因组复制、转录调控和宿主细胞致病性[28]。NS2 已被确定参与衣壳组装和核出口[29]。
在大多数情况下,PPV 感染本身不会导致未怀孕的成年猪或仔猪以及公猪不产生肉眼可见的损伤,损伤仅在胚胎或胎儿中明显[30,31]。低致病性和疫苗弱毒株(如NADL-2 株和MSV 株)不能像高致病性强毒株(如Kresse 株和27A 株)那样有效地穿过胎盘屏障,因此弱毒株对妊娠的有害影响不能像强毒株被检测出的频繁高,但将NADL-2 株直接注射到羊水中可能会导致胎儿死亡[1]。
猪细小病毒感染免疫9~22 周龄的猪,抗体会被动地保护仔猪数周和直到成年。动物应被动保护仔猪(绿线),直到9~22 周龄。先接种母源抗体后再接种的动物,长期免疫是靠接种疫苗维持的。先接种后母体抗体耗尽,长期免疫是对易受感染的胚胎(红线)加强免疫,直到发育维持加强免疫,见图2。PPV 感染胎儿感染的结果随母猪妊娠的进展而变化,有研究发现胎儿(妊娠开始时)受到透明带的保护,不易被PPV 感染。在胚胎阶段PPV 感染(直到大约妊娠35天)导致胚胎死亡和再吸收。胎儿(妊娠第35 天)骨骼开始骨化,胎儿器官发生基本完成,PPV 感染通常导致胎儿死亡,随后木乃伊化。最后,在妊娠第70天之后,感染的胎儿能够建立有效的免疫反应并消除病毒,通常会在感染后存活,小猪出生时带有抗PPV抗体[32],见图2。
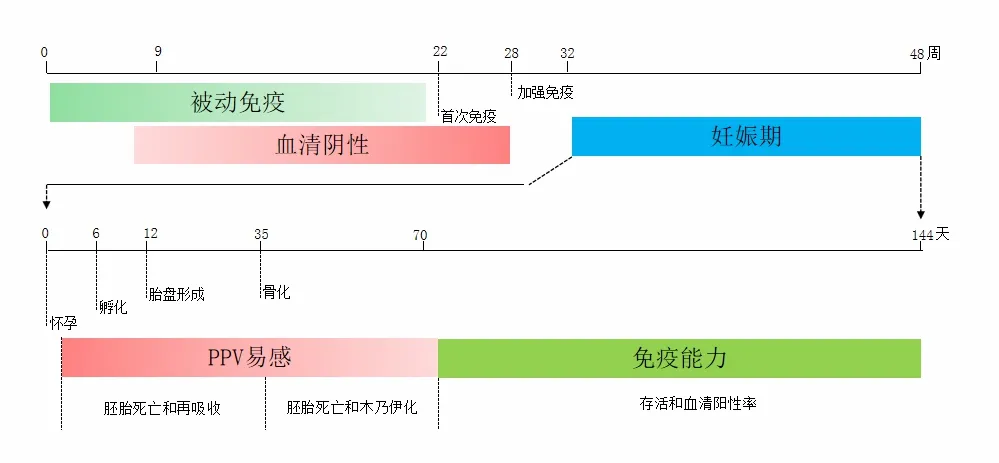
图2 猪细小病毒(PPV)感染和免疫反应的主要时间点
PPV 感染后各项指标的变化,猪在初次感染后5~10d 内可观察到中度和短暂的淋巴细胞减少,与性别和年龄无关[1]。PPV 感染最常见以胚胎死亡以及随后的体液和软组织吸收为主要病变,其中病变还包括不同程度的充血、水肿和出血,并伴有体腔内浆液血性液体积聚。胎儿死亡后,由于出血导致皮肤变色,使胎儿肤色变暗。最后,组织的逐渐脱水导致木乃伊化。胎盘可能脱水,颜色从褐色变为灰色,胎外液量减少[33]。
在胎儿的组织病理学变化广泛存在于不同的组织中,并且主要导致发育器官的细胞坏死,出血出现在皮下组织和肌肉块中,坏死和僵化常见于肺、肾和骨骼肌特别是在肝脏和心脏中[34]。在存活胎儿变得具有免疫活性后,显微镜下的损伤主要是子宫内膜肥大和单核细胞浸润[32,35]。妊娠晚期分娩的PPV 感染的活胎儿或死产小猪,出现脑膜脑炎的特征是在血管周围出现增生的外膜细胞、组织细胞和一些浆细胞,这些细胞存在于大脑和软脑膜的灰质和白质中[36]。
母畜在PPV 感染后病理学病变包括邻近子宫内膜和固有层深层的单核细胞的局灶性积聚,以及大脑、脊髓和眼睛脉络膜中浆细胞和淋巴细胞的显著血管周聚集[34]。跨胎盘屏障的PPV 感染可导致妊娠母猪子宫内膜炎、上皮细胞死亡和胎儿感染,尤其是引起内皮组织损伤[37]。
3 小结
20 世纪初期我国以及国际对PPV 的研究主要集中于病原学、理化性质、防治等方面,21 世纪以来各国的研究者逐渐加强了关于PPV 分子结构和基因组学等方面研究。目前,针对PPV 结构研究可以通过3D模型技术进行反应。其中转录和翻译图谱技术的应用为PPV 分子生物学研究奠定了基础。目前针对PPV研究得还不够深入,仍然有许多工作亟待进行。我国关于PPV 的分子生物结构学和基因组学方面的研究少之又少,目前还是不清楚胎儿如何通过胎盘屏障感染该病毒的机制,这也给我国兽医科技工作者提出了一个新的课题。

