红掌新品种‘阳光红心’组织培养与快繁技术研究
DOI:10.20023/j.cnki.2095-5774.2023.05.007
收稿日期:2023-05-06
基金项目:福建省林业科技计划项目(2017FKJ03)
作者简介:彭金彬(1977-),男,高级工程师,主要从事森林经营、种苗培育研究工作,E-mail:1539572250@qq.com
摘要要:【目的】建立红掌新品种‘阳光红心种苗繁育技术体系。【方法】以阳光红心为试验材料,开展不同外植体、激素组合对其组织培养过程中诱导、增殖和生根的影响。【结果】适宜建立阳光红心无菌系的外植体是叶片,初代诱导培养基为改良MS + 1.0 mg/L 6-BA + 0.2 mg/L NAA,最高诱导率为56.5%;最佳继代培养基组合为改良MS + 2.0 mg/L BA + 0.5 mg/L NAA + 0.5 mg/L KT,繁殖系数达5.8;最佳的生根培养基为1/2 MS+0.5 mg/L NAA,生根率达100%;泥碳土:珍珠岩:椰糠=532的基质组合最有利红掌的移栽生长,移栽成活率为94.8%。【结论】建立阳光红心组织培养快繁技术体系,为红掌植物的规模化繁殖提供理论依据。
关键词:红掌;外植体;组织培养;快繁技术
中图分类号:S682.14 文献标识码:A 文章编号:2095-5774(2023)05-0354-04
Tissue Culture and Rapid Propagation Techniques of a New Anthurium andraeanum
Cultivar ‘Yangguang Hongxin
Peng Jinbin
(Natural Resources Bureau of Luojiang District,Quanzhou,Fujian 362010,China)
Abstract:【Objective】Establish a technology system of seedling propagation of a new Anthurium andraeanum ‘Yangguang Hongxin.【Method】Using‘Yangguang Hongxinas the experimental material,the effects of different explants and hormone combinations on the induction,proliferation,and rooting in its tissue culture process were studied. 【Result】Suitable explant for establishing sterile line of‘Yangguang Hongxinwas leaf,and the initial induction medium was improved MS + 1.0 mg/L 6-BA + 0.2 mg/L NAA,the highest induction rate was 56.5%;The optimal combination of subculture medium was improved MS + 2.0 mg/L BA + 0.5 mg/L NAA + 0.5 mg/L KT,
and the propagation coefficient reached 5.8. The optimal rooting medium was 1/2 MS + 0.5 mg/L NAA,and rooting rate reached 100%. The substrate combination of peat soil,perlite and coconut bran with ratio of 532 was the best for transplanting and growth of Anthurium andraeanum,and the survival rate was 94.8%.【Conclusion】 Establishment of a tissue culture and rapid propagation technology system could provide theoretical basis for the large-scale propagation of Anthurium andraeanum plants.
Key words:Anthurium andraeanum L.;Explant;Tissue culture;Rapid propagation techniques
紅掌(Anthurium andraeanum L.)系天南星科花烛属多年生草本植物,又称为花烛、火鹤花、安祖花。红掌原产于南美地区,性喜温润气候,花型奇特,佛焰苞亮丽鲜艳,色彩多样,花期较长,叶形颜值高,可作观花亦可作观叶之用,已成为全世界比较流行的热带花卉种类,具有广阔的市场前景[1-3]。‘阳光红心红掌是以‘莱尼为亲本,进行自交育种而得到的红掌新品种(品种权号:CNA20110426.9),其株型紧凑,易长吸芽,丛生性好,佛焰位为红色、小型、高于叶面,肉穗花序为红色。因其具有较高的观赏价值,受到广大消费者的欢迎,已推广到华东、西南等主要花卉市场,市场供不应求。
阳光红心和其他红掌品种一样,不易结实,一般采用分株繁殖[4],但其肉质根系生长缓慢、不易分蘖,繁殖率偏低,难以应用到产业化生产当中。而组培快繁方式被认为是花卉生产中快速繁殖的理想途径。目前,通过组培方式繁殖红掌种苗已有不少报道[5-8],而红掌品种阳光红心组培技术研究方面尚未见报道。本试验对外植体部位、激素配方进行摸索,以期建立阳光红心组培生产的技术体系,为其规模化生产提供技术支撑。
1 材料与方法
1.1 试验材料
供试材料为红掌品种阳光红心开花株,种植于泉州市泉美生物科技有限公司温室内,栽培管理技术按照常规方法进行。
1.2 试验方法
1.2.1 外植体的选择
选取生长健壮、无病虫害的植株,分别采集新生叶片(未完全展叶)、叶柄和顶芽作为外植体,进行消毒处理和初代诱导。外植体先用清水冲洗干净,再用洗涤剂漂洗,后用流水冲洗20~30 min,在超净工作台上用75%酒精消毒10~20 s,再用0.1% HgCl2消毒10 min,最后用无菌水清洗3次。
1.2.2 诱导培养基的筛选
以改良MS为基础培养基,设计3种不同的外源激素组合,分别为1.0 mg/L 6-BA + 0.2 mg/L NAA(T1处理)、2.0 mg/L 6-BA + 0.2 mg/L NAA(T2处理)、3.0 mg/L 6-BA + 0.2 mg/L NAA(T3处理),每处理接种外植体100个,重复3次。接种后观察外源激素对初代诱导的影响,30 d后统计诱导率。
1.2.3增殖培养基的筛选
将诱导培养基中诱导出的芽体分离成带芽的单芽,转入增殖培养基上。以改良MS作为基本培养基,配置1.0 mg/L 6-BA + 0.5 mg/L NAA(Z1处理)、2.0 mg/L 6-BA + 0.5 mg/L NAA(Z2处理)、
1.0 mg/L 6-BA + 0.5 mg/L NAA + 0.5 mg/L KT(Z3处理)、2.0 mg/L 6-BA + 0.5 mg/L NAA + 0.5 mg/L
KT(Z4处理)等4组增殖培养基配方。每处理100个单芽,重复3次。定期观察其生长状况并记录,40 d后统计增殖系数。
1.2.4生根培养基的筛选
將生长到2.5 cm以上的丛芽进行分离,切成单个芽苗,再转移到生根培养基上。以1/2 MS为基本培养基,配置0.5 mg/L NAA(S1处理)、
1.0 mg/L NAA(S2处理)、0.5 mg/L IBA + 0.5 mg/L NAA(S3处理)、0.5 mg/L IBA + 1.0 mg/L NAA(S4处理)等4种生根培养基配方;每处理100个单芽,3次重复。10 d后幼苗萌发,30 d后统计幼苗生根率。
1.2.5 培养条件
本试验以改良MS培养基为基本培养基,添加蔗糖3%、卡拉胶6%,培养基pH值5.8,光照强度500~800 lx,光照时间14 h/d,培养温度21~23℃。
1.2.6 组培苗移栽
在选取生根苗高2 cm以上、生长正常、叶色浓绿、根系发达的组培苗,待炼苗后分别种植于田园土(Y1处理)、50%田园土+ 50%河沙(Y2处理)、70%泥炭土+ 30%珍珠岩(Y3处理)、50%泥炭土+ 30%珍珠岩+ 20%椰糠(Y4处理)、80%椰糠+ 20%珍珠岩(Y5处理)等5种栽培基质中。
2 结果与分析
2.1 不同外植体和培养基对阳光红心组培苗诱导的影响
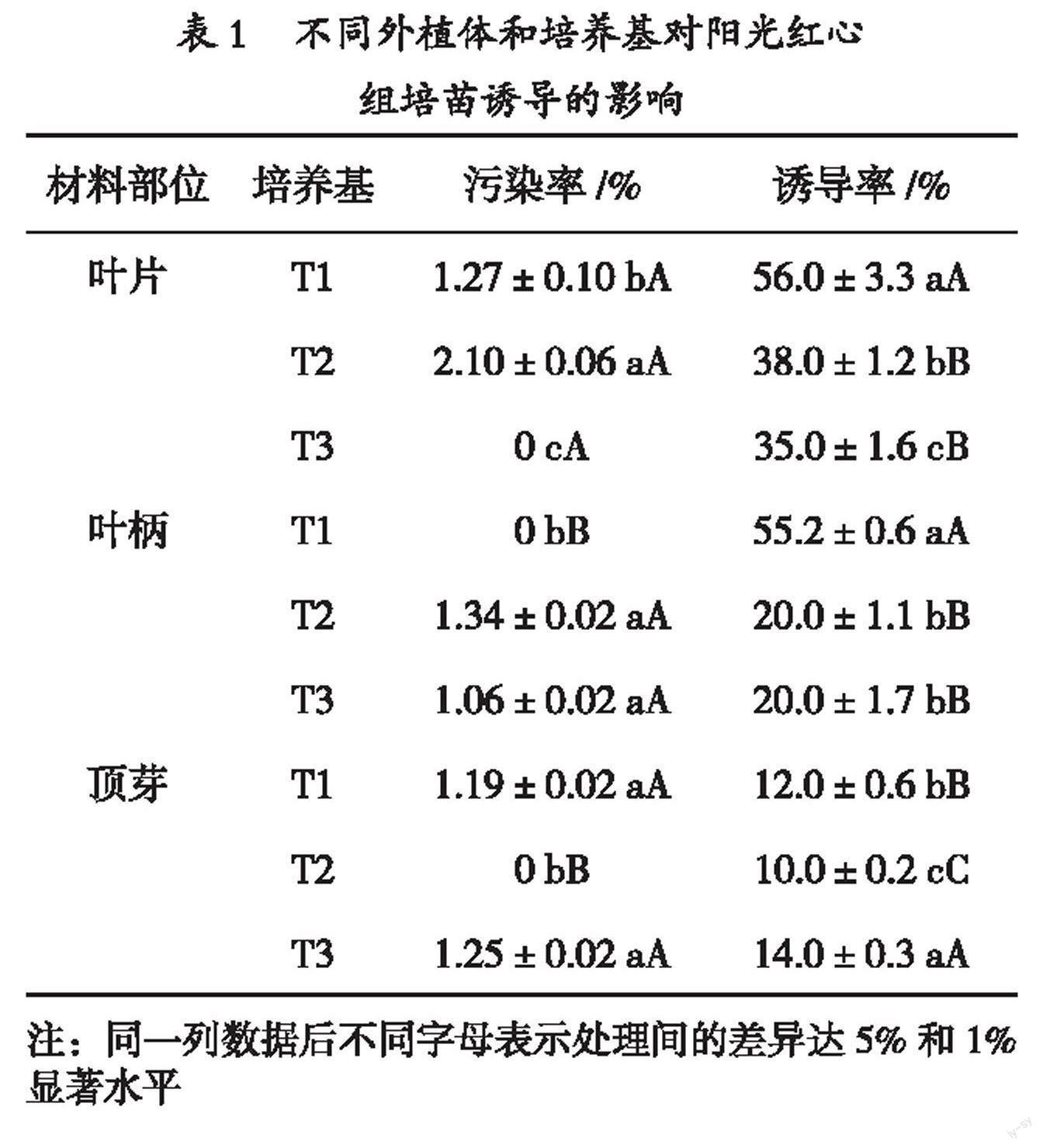
不同部位外植体诱导阳光红心红掌组培苗的结果如表1所示,不同外植体的污染率均<2.16%。外植体诱导率大小依次为:叶片>叶柄>顶芽。T1处理是本试验最佳的诱导培养基配方,即改良MS + 1.0 mg/L 6-BA + 0.2 mg/L NAA的诱导率最高,为56.5%,形成愈伤组织所需时间约60 d(封二 图6)。
表1 不同外植体和培养基对阳光红心
组培苗诱导的影响
材料部位 培养基 污染率/% 诱导率/%
叶片 T1 1.27±0.10 bA 56.0±3.3 aA
T2 2.10±0.06 aA 38.0±1.2 bB
T3 0 cA 35.0±1.6 cB
叶柄 T1 0 bB 55.2±0.6 aA
T2 1.34±0.02 aA 20.0±1.1 bB
T3 1.06±0.02 aA 20.0±1.7 bB
顶芽 T1 1.19±0.02 aA 12.0±0.6 bB
T2 0 bB 10.0±0.2 cC
T3 1.25±0.02 aA 14.0±0.3 aA
注:同一列数据后不同字母表示处理间的差异达5%和1%显著水平
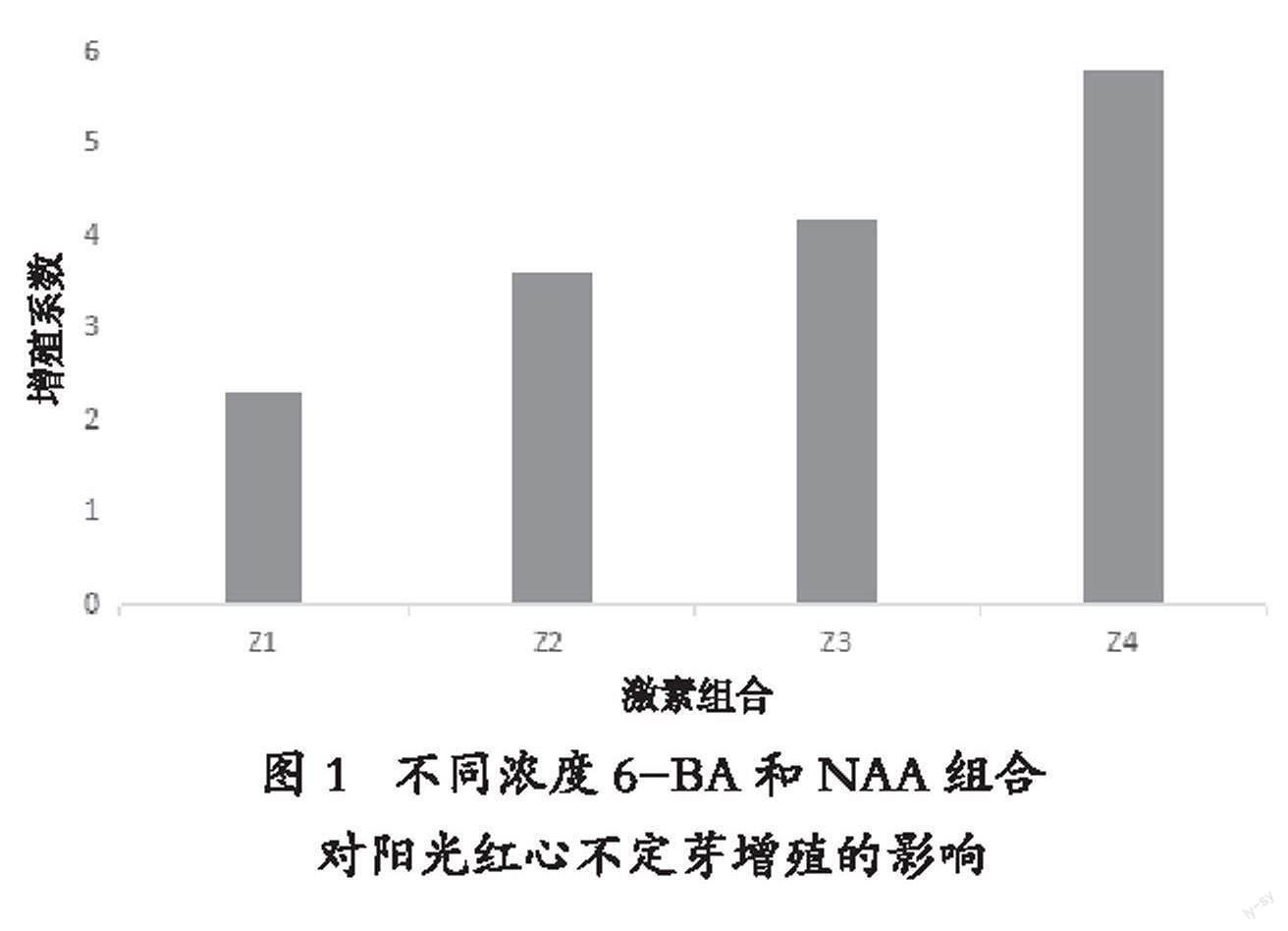
2.2 不同激素组合对阳光红心不定芽增殖的影响
不同浓度6-BA和NAA组合对阳光红心不定芽增殖的影响如图1所示,改良MS +2.0 mg/L BA + 0.5 mg/L NAA+ 0.5 mg/L KT培养基(Z4处理)最适合阳光红心增殖,增殖率最高,达5.8倍,芽壮,叶色绿,无畸形,节间伸长(封二 图7)。
图 1 不同浓度6-BA和NAA组合
对阳光红心不定芽增殖的影响
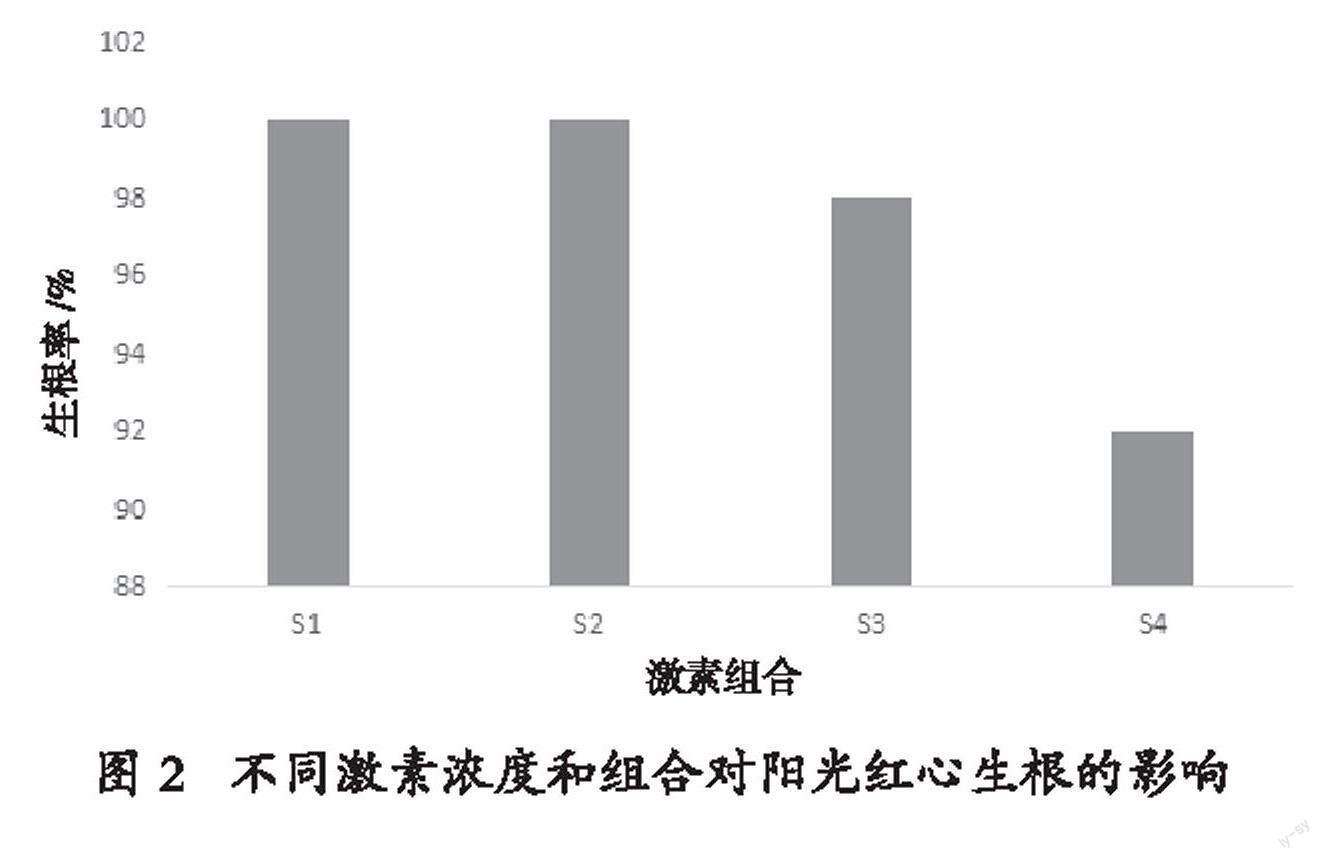
2.3 不同激素组合对阳光红心继代苗生根的影响
当继代苗长到2.5 cm以上时,接种到生根培养基,放在弱光下培养10 d左右,小苗的基部形成白色突起,并逐渐伸长,形成明显幼根,长成完整小植株,之后逐步增加散射光照强度使小苗更粗壮(封二 图8)。不同激素浓度和组合对阳光红心生根的影响如图2所示,生根培养基以1/2 MS + 0.5 mg/L NAA (S1处理)或1/2 MS + 1.0 mg/L NAA(S2处理)为佳,生根率100%,根数多,根系发达,小苗生长好。而当添加IBA时,阳光红心生根苗的叶片出现偏黄,芽切口易变黑,长势较差,且生根率略有下降。出于对生产成本的考量,最终选择1/2 MS + 0.5 mg/L NAA作为生根培养基配方。
图 2 不同激素浓度和组合对阳光红心生根的影响
2.4 移栽基质对阳光红心组培苗移栽成活的影响
移栽30 d后的统计分析结果表明,阳光红心组培苗在不同基质中的移栽存活率存在较大差异。如图3所示,阳光红心更喜欢疏松、半干燥、湿润的土壤,以50%泥炭土+ 30%珍珠岩+ 20%椰糠(Y4处理)为最佳移栽基质组合,移栽存活率达94.8%,幼苗生长良好(封二 图9)。此外,
图 3 栽培基质对阳光红心移栽成活的影响
研究还发现,在含椰糠多的基质处理,如80%椰糠+ 20%珍珠岩(Y5处理)中,小苗生长良好,成活率较不加椰糠的好,但容易发生霉病,导致小苗死亡,这可能与椰糠难以完全灭菌引起的污染有关。
3 讨论与结论
外植体的筛选是关系到红掌组培快繁能否成功的关键因素。本试验中阳光红心红掌的不同外植体诱导率大小依次为叶片>叶柄>顶芽。何贵整等[9]认为,以茎段为外植体,用以芽繁芽诱导无菌芽技术比通过愈伤组织获得无菌增殖芽材料更快、更容易,且能有效避免继代增殖过程中出现的变异;不同部位外植体的污染程度不同,顶芽污染率最高、超过80%,其次为茎段。关丽霞等[10]研究表明,红掌愈伤组织增殖以改良MS + 1.5 mg/L
6-BA为红掌愈伤组织的诱导和分化为最佳激素比。朱强等[11]发现红掌愈伤组织增殖以改良MS + 0.60~1.0 mg/L 6-BA为宜;而本试验中改良MS + 1.0 mg/L 6-BA + 0.2 mg/L NAA为阳光红心红掌的最佳诱导培养基。在增殖培养方面,本研究在添加6-BA的基础上增加NAA进行增殖培养,结果表明MS + 2.0 mg/L BA + 0.5 mg/L NAA + 0.5 mg/L KT最适合阳光红心红掌增殖培养,增殖率达5.8倍,达到芽壮、节间伸长,叶片正常、叶色绿的生长状态。
本试验结果中阳光红心红掌在1/2 MS + 0.5 mg/L NAA和1/2 MS + 0.5 mg/L NAA生根培养基生根率达到100%。朱强等[11]研究表明,壮苗生根以1/2 MS + 0.5 mg/L NAA为最佳,与本试验结果一致。移栽试验发现,泥碳土:珍珠岩:椰糠=532的基质对红掌移栽生长最好,阳光红心移栽成活率达94.8%,小苗生长良好。谢晓琼等[12]研究表明对高山地区红掌品种进行栽培基质优化,结果表明裁培基质以草炭土、泥炭土、珍珠岩的混合基质(体积比为223或231)最适合红掌生长,其株高、叶片数、面积、植株鲜重等指标均优于其他基质处理组合。本试验认为,泥炭土、椰糠等富含营养物质,且通透性好,有利于红掌生长。
参考文献:
[1]汪希强,陶佩琳,张旭东,等.红掌组培快繁技术优化研究[J].安徽农业科学,2012,40(33):16052-16053,16080.
[2]中国花卉协会. 2018中国花卉产业发展报告[M]. 北京:中国林业出版社,2020.
[3]韩伟,马丽霞. 红掌组织培养技术研究进展[J]. 现代农业科技,2013 (2):172-173,183.
[4]刘翠兰,孙蕾,李双云,等.花烛属观赏植物的繁殖与栽培技术[J]. 山东林业科技,2004,34(5):34.
[5]张晓英,谢炳乾,郭伟.红掌的组织培養技术[J]. 陕西林业科技,2019,47(5):57-58.
[6]刘玉冬,刘艳军,杨静慧.巨型红掌茎尖组织培养及快繁技术的研究[J].安徽农业科学,2009,37(12):5358-5359.
[7]薛其勤,李美芹,裴华丽,等.不同红掌品种愈伤组织诱导及高效再生体系的建立[J].北方园艺,2012(10):130-132.
[8]王晶. 红掌组培苗优质高效繁殖技术的研究[D]. 苏州:苏州大学,2014.
[9]何贵整,陈丽文,时群,等. 红掌组培快繁技术研究[J]. 北方园艺,2012(22):115-118.
[10]关丽霞,谢永刚,彭世勇,等. 红掌叶不同部位愈伤组织的诱导及植株再生[J]. 辽宁农业职业学院学报,2007,9(1):25-27.
[11]朱强,周媛,田丹青,等. 红掌组培体系的比较与优化[J]. 浙江农业科学,2021,62(10):2008-2010,2058.
[12]谢晓琼,杨芮,李斌奇,等.高山地区红掌品种筛选及其栽培基质的优化[J]. 莆田学院学报,2017,24(2):13-17.
(责任编辑:冯 新)

