底泥中降解邻苯二甲酸二甲酯菌群的特性研究*
周 婷 王宏杰,2,3# 董文艺,2,3 黄 潇 杨 墨
(1.哈尔滨工业大学(深圳)土木与环境工程学院,广东 深圳 518055;2.哈尔滨工业大学环境学院,城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090;3.深圳市水资源利用与环境污染控制重点实验室,广东 深圳 518055;4.南京信息工程大学环境科学与工程学院,江苏 南京 210000)
邻苯二甲酸二甲酯(DMP)由于用途广泛[1],加上溶解度低、对颗粒物具有较强亲和性[2],在河道底泥中的检出率较高[3],其中深圳市某感潮河道底泥就受到了DMP污染。目前用于去除底泥中DMP的方法主要有植物法和土著微生法,但是前者受天气等环境影响较大,对DMP利用不稳定[4],而土著微生物法具有廉价、绿色无污染、受环境影响小等优点[5],是修复受DMP污染底泥的好方法[6]。
土著微生物法可以用单一菌株,也可以用混合菌群。DMP结构比较复杂,其中间代谢产物也表现出稳定性和一定的微生物毒害作用,多数单一菌株只能对DMP进行初步降解,无法对其实现完全矿化[7]。深圳市某感潮河道盐度较高,重金属、有机物等污染物种类繁多,且pH、温度、盐度对微生物生长代谢所需酶类物质的活性影响较大,对物质进出细胞的速率等也有影响[8],因此单一菌株较难适应此类复杂环境。与单一菌株相比,土著混合菌群的生态系统更稳定,对环境适应能力更强[9],可以实现对难降解有机物的彻底矿化[10]。HE等[11]驯化得到的混合菌群HD-1对邻苯二甲酸二丁酯(DBP)的降解效果相较于单一菌株就更具优势。
本研究从深圳市某感潮河道底泥中富集驯化出具有DMP降解功能的土著混合菌群,对其群落结构进行分析,分析pH、温度和盐度对其降解DMP的影响,研究其对DMP的降解途径,并用于模拟底泥中DMP的降解,以拓宽该菌群的应用范围。
1 材料与方法
1.1 实验材料
1.1.1 底泥样品采集
驯化混合菌群所用底泥取自深圳市某感潮河道,取样深度为0~60 cm,采集到的底泥避光运回实验室,冷库中保存。
1.1.2 无机盐培养液(MSM)
MSM成分:2 g/L (NH4)2SO4,0.098 g/L MgSO4,0.011 g/L CaCl2,0.594 g/L Na2HPO4,1.5 g/L KH2PO4,0.5 g/L NaCl,1 mL/L微量元素。微量元素中含:1.093 g/L FeSO4,2.544 g/L MnCl2,1 g/L ZnCl2,0.545 g/L CoCl2,1.090 g/L NiCl2,0.320 g/L CuSO4。
1.1.3 模拟底泥
模拟底泥用校园内洁净土壤配制,使用前对其进行121 ℃高温灭菌。配置后pH为6~7,含砂率15%~20%,DMP质量浓度为0~100 mg/kg,含水率41%~57%。
1.2 实验方法
1.2.1 土著混合菌群的富集驯化
取10 g采集的底泥样品溶于20 mL去离子水中,在25 ℃的恒温摇床中以140 r/min振荡搅拌1 d后静置,得到底泥浸出液。接种1 mL底泥浸出液于100 mL MSM中,加入DMP使其质量浓度为1 mg/L,在25 ℃的恒温摇床中以140 r/min振荡培养7 d。静置后,取2 mL上清液接种于100 mL MSM中,加入DMP使其质量浓度为5 mg/L,在25 ℃的恒温摇床中以140 r/min振荡培养7 d;重复以上操作,其中MSM中DMP质量浓度逐次增大,依次为5、10、20、50、100 mg/L,实现富集驯化的目的。最后一次培养7 d后,检测培养液中DMP的残余量。将最终富集驯化得到的功能菌群命名为ZM。
1.2.2 菌悬液的制备
将菌群ZM培养至对数生长期后,转移至已灭菌的50 mL离心管中离心分离并过滤掉上清液;用50 mL无菌磷酸盐缓冲液(Biosharp 1×PBS,pH=7.4)重悬浮菌体沉淀物后继续离心。待上清液透明后即完成离心,用MSM重悬浮再次离心得到的菌体沉淀物即为菌悬液,4 ℃密封保存,备用。
1.2.3 菌群ZM的降解性能研究
(1) 环境因子影响实验
将100 mL含有一定DMP的MSM加入三角烧瓶中,接种2 mL菌悬液,用封口膜封住瓶口后,在恒温摇床中以140 r/min振荡培养,pH研究了4、5、6、7、8、9、10共7个水平(30 ℃,盐度0,30 mg/L DMP);培养箱温度研究了15、20、25、30、35、40 ℃共6个水平(pH=6,盐度0,100 mg/L DMP);盐度研究了0、0.05%、0.10%、1.00%、2.00%、3.00%、4.00%共7个水平(pH=6,35 ℃,100 mg/L DMP)。每个处理设置3组平行实验,定时取样并检测DMP残余量,计算残余率。
(2)菌群ZM对DMP的降解途径探析
将1 L DMP质量浓度约为100 mg/L的MSM(pH=6,盐度0.05%)加入三角烧瓶中,接种2 mL菌悬液,用封口膜封住瓶口后,在35 ℃的恒温摇床中以140 r/min振荡培养,定时取样并分析中间产物。
(3) 模拟底泥中菌群ZM对DMP的降解
配制不同初始DMP含量的模拟底泥,加入底泥质量3%的菌悬液,搅拌均匀后用封口膜封住瓶口,置于35 ℃恒温箱培养。设置3组平行试验,定时取样检测DMP残余量,并计算降解量和降解率。
1.2.4 分析检测方法
(1) 初始底泥微生物群落结构检测
群落结构由美吉生物公司进行检测。
(2) 培养液中DMP及其中间代谢产物的检测
检测仪器用超高效液相色谱仪(UPLC,Acquity H-Class),色谱柱为C18(1.7 μm,2.1 mm×100 mm),采用甲醇和水(体积比3∶2)作为流动相,测样前需过膜处理。通过对比标准样品的保留时间,在240 nm波长下检测DMP、邻苯二甲酸单甲酯(MMP)和邻苯二甲酸(PA),在226 nm波长下检测原儿茶酸(PCA)。
(3) 底泥中DMP的检测
样品前处理包括冷冻干燥、微波萃取及浓缩。其中,冷冻干燥使用冷冻型高通量高速离心机(Eppendof,Centrifuge 5810R),干燥时长为48 h。微波萃取方法如下:将2.000 g冻干底泥和15 mL乙腈混合于萃取罐中,微波萃取参数设置参考文献[12],萃取时间改为30 min;冷却后,上清液过玻璃纤维滤膜,保留萃取液;底泥重复萃取1次,合并萃取液,通过旋转蒸发、氮吹浓缩至约1 mL,定容至2 mL,待上机检测。
检测仪器用气相色谱—质谱联用仪(GC—MS),色谱柱为硅熔毛细管柱(30 m×0.25 mm×0.25 μm),进样口温度为290 ℃,电子电离,离子源温度为230 ℃。柱温箱初始温度为50 ℃,1.00 min后,开始升温,11.33 min后达到220 ℃,保持1.00 min后,继续升温2.40 min达到280 ℃,保持1.00 min。底泥中DMP的加标回收率为80%~110%。
2 结果与分析
2.1 菌群ZM的群落结构分析
菌群ZM与初始底泥微生物多样性指数见表1。两者的Coverage指数均为0.999,说明本次测序的微生物相对丰度与实际相符,结果可信。初始底泥微生物的Ace指数和Shannon指数均大于菌群ZM,说明初始底泥中物种丰富度较高,群落多样性也非常大,而菌群ZM的物种丰富度和群落多样性明显降低,这是由于在富集驯化过程中始终以DMP为单一碳源,DMP降解菌大量生长、逐渐成为优势菌,而不能降解DMP的菌因缺乏碳源而逐渐被淘汰。

表1 菌群ZM与初始底泥微生物的多样性指数Table 1 Diversity indexes of ZM consortium and origin sediment microorganisms
菌群ZM和初始底泥微生物在不同水平上的群落组成如图1所示。由图1(a)可知,初始底泥微生物主要包括10个门,而菌群ZM主要由变形杆菌门(80.2%)、疣微菌门(15.8%)和拟杆菌门(3.7%)3个门组成。经过富集驯化后,变形杆菌门相对丰度增加了2.47倍,疣微菌门增加了16.95倍。相关研究表明,变形杆菌门、拟杆菌门中多种微生物具有DMP降解能力,但针对疣微菌门的相关报道相对较少[13-14],推测是因为疣微菌门中存在与DMP降解菌共生的微生物。

图1 菌群ZM与初始底泥微生物的群落微生物相对丰度Fig.1 Community microorganism relative abundance of ZM consortium and origin sediment microorganisms
由图1(b)可知,经过富集驯化后,在纲水平上,微生物的菌纲数量从17(初始底泥微生物)降至5(菌群ZM)。其中,γ-变形菌纲(16.2%)相对丰度增大了0.82倍,α-变形菌纲(7.4%)增大了5.86倍。目前已报道的多项研究中DMP降解菌多属于上述两种菌纲[15-17]。
由图1(c)可知,菌群ZM中85%的微生物属于新鞘氨醇杆菌属、代尔夫特菌属和Saccharimonadales,这些菌属中多种微生物被证明了具有DMP降解能力[18-20],而初始底泥微生物中这些菌属占比很低。
综上,推测菌群ZM中具有DMP降解功能的主要微生物属于变形杆菌门α-变形菌纲的新鞘氨醇杆菌属。
2.2 环境因子对菌群ZM降解DMP的影响
2.2.1 pH
pH对菌群ZM降解DMP的影响如图2所示。随着pH从4增至6,菌群ZM对DMP的降解能力是提升的;而继续增大pH,降解能力开始下降。菌群ZM在pH为6时,24 h后DMP残余率下降至5%;pH为10时,即使降解了96 h,DMP残余率依旧大于20%。这可能是因为微生物的细胞膜在碱性环境中会被改变,选择透过性受损导致[21]。而且,在碱性较强的条件下,微生物酶的空间结构也容易变形,活性降低,稳定性变差[22]。总体而言,在不同pH环境中菌群ZM对DMP始终保持有一定的降解能力。综上,菌群ZM在pH为6的环境中具有最好的DMP降解能力,同时也表现出一定的耐酸碱性。
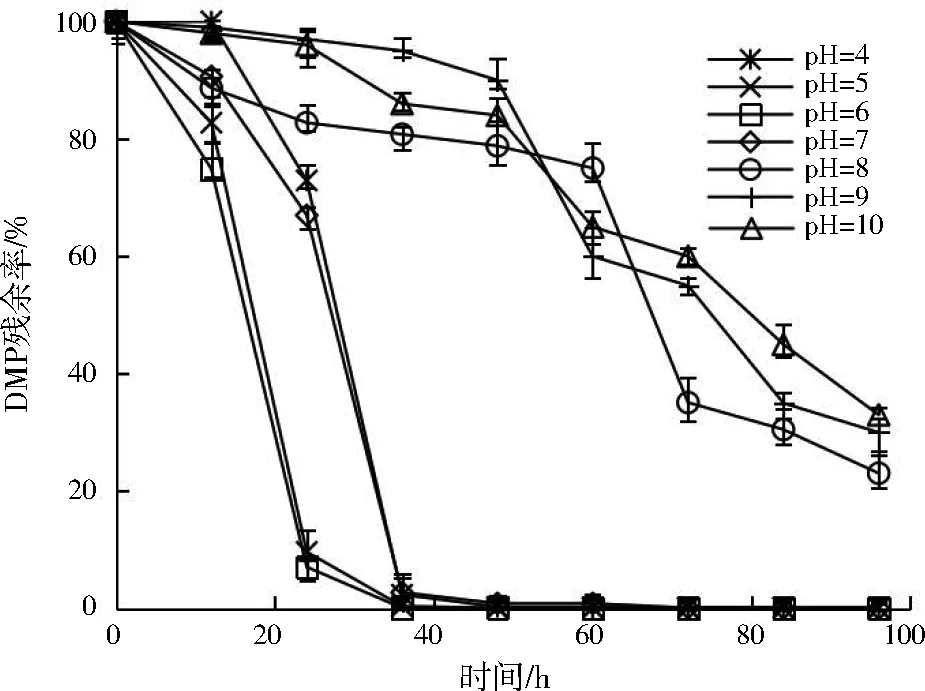
图2 pH对菌群ZM降解DMP的影响Fig.2 Influence of pH on DMP degradation by ZM consortium
2.2.2 温 度
温度对菌群ZM降解DMP的影响如图3所示。当温度从15 ℃逐渐升高到35 ℃,DMP降解速率显著提升;然而继续升温到40 ℃,反而略有降低。因此,菌群ZM在35 ℃时具有最佳的DMP降解能力,18 h即可将DMP完全降解,而在15 ℃时需要70 h才能将DMP完全降解。在15 ℃的低温环境下,菌群ZM的生命活动速率会变慢[23],DMP分子运动也会变慢,生化酶促反应会受到抑制[24]。综上,最适合菌群ZM降解DMP的温度为35 ℃。
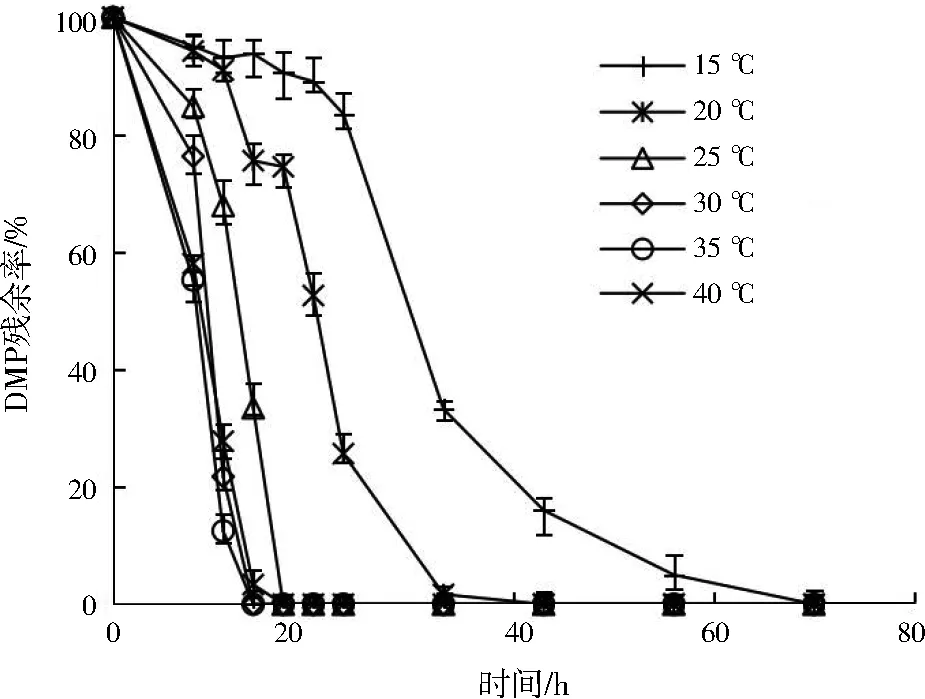
图3 温度对菌群ZM降解DMP的影响Fig.3 Influence of temperature on DMP degradation by ZM consortium
2.2.3 盐 度
不同盐度下菌群ZM降解DMP的能力差异明显(见图4)。当盐度低于1.00%时,盐度对菌群ZM降解DMP的能力表现出促进作用,盐度为0.05%~1.00%时16 h就可以将DMP完全降解,而盐度为0时DMP残余率约35%。然而,当盐度增加到4.00%时,菌群ZM几乎完全不能降解DMP,26 h后DMP残余率仍为100%。这可能是因为盐度超过一定范围后,蛋白质逐渐发生变性,酶活性受到抑制[25]。但是在3.00%盐度下,菌群ZM仍有一定的DMP降解能力,说明其对盐度有良好的耐受性。综上,菌群ZM在盐度为0.05%~1.00%的环境中具有很好的DMP降解能力,同时也表现出一定的盐度耐受性。
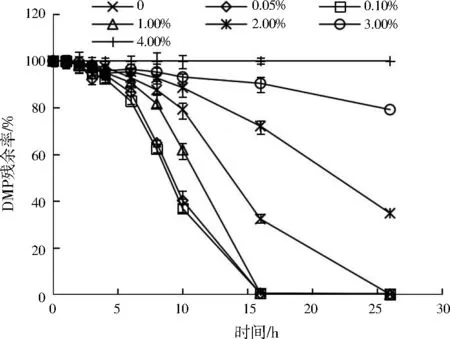
图4 盐度对菌群ZM降解DMP的影响Fig.4 Influence of salinity on DMP degradation by ZM consortium
2.3 菌群ZM对DMP的降解途径
由图5可见,DMP含量随着降解时间延长而逐渐降至零,而产生了MMP、PA和PCA 3种中间代谢产物,其中MMP含量相对较低,且只在前6 h呈现增加趋势,这可能是因为MMP会被红球菌属等微生物高效降解[26]。PA含量前4 h较少,然后呈先增后减趋势变化,其减少的原因推测是由于细杆菌属等微生物利用PA的速率比红球菌属生成PA的速率快[27]。另外,PCA的含量特别低,可能是因为PCA结构简单,且对微生物的毒害作用弱,易于被甲基杆菌属等微生物降解[28]。
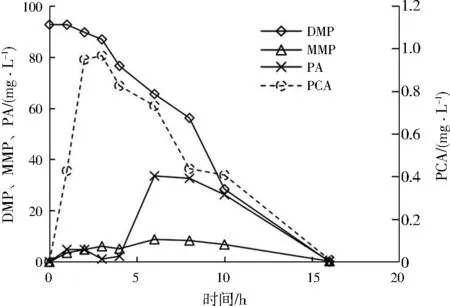
图5 菌群ZM降解DMP过程中各物质质量浓度变化Fig.5 Mass concentration changes of various substances during the degradation of DMP by ZM consortium
结合图5和文献[29]推测菌群ZM降解DMP的途径如下:通过转酯化作用,DMP被水解生成MMP;随后,MMP通过脱酯作用生成PA;PA最后转化为PCA,随后进入三羧酸循环,完成对DMP的完全降解,如图6所示。
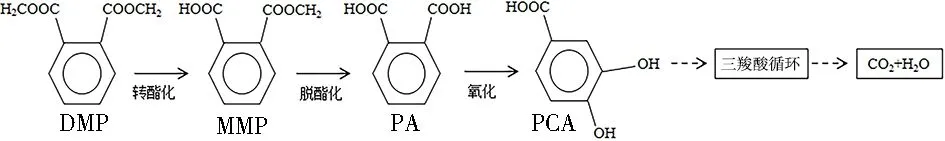
图6 菌群ZM对DMP的降解途径Fig.6 Degradation pathway of DMP by ZM consortium
2.4 菌群ZM对模拟底泥中DMP的降解
离开了土著环境,在模拟底泥中,菌群ZM对DMP仍有较好的降解能力(见图7)。在1~100 mg/kg,随着初始DMP含量增加,菌群ZM的DMP降解率先增后减;当初始DMP质量浓度为15 mg/kg时,1 d时即可降解约60% DMP。继续增大初始DMP含量,菌群ZM对DMP的降解速率受到抑制,但是在100 mg/kg条件下2 d后仍然达到了70%左右,且降解量一直在逐渐增加,说明菌群ZM对高浓度DMP具有一定耐受性。WANG等[30]从底泥中驯化得到了一个可以在48 h内将500 mg/L DBP完全降解的菌群LV-1,但是未对其在实际底泥中的降解效果进行验证。周长健[31]从环境中分离出一株邻苯二甲酸二辛脂(DEHP)降解菌JQ-1,该菌株需要42 d才能将模拟土壤中50 mg/kg DEHP降解至低浓度。YANG等[32]驯化得到的菌群B1在含有100 mg/kg DBP土壤中培养2 d后只能降解40%的DBP。对比分析可知,本研究中的菌群ZM在修复受DMP污染底泥方面具有一定的实际应用价值。

图7 菌群ZM对模拟底泥中DMP的降解Fig.7 Degradation of DMP in simulated sediment by ZM consortium
3 结 论
(1) 菌群ZM的最主要优势菌为变形杆菌门α-变形菌纲的新鞘氨醇杆菌属,属于DMP降解的功能菌。
(2) 菌群ZM最适合降解DMP的pH为6、温度为35 ℃,在0.05%~1.00%的盐度内具有较好的耐受性。
(3) 菌群ZM对模拟底泥中的高DMP仍保持优异的降解性能,2 d内可以降解70%初始质量浓度为100 mg/kg的DMP,具有较好的实际应用价值。

