从心肌能量代谢角度探讨射血分数保留的心力衰竭的治疗进展
赵惠奇,张青海,2,郑昭芬,2
心力衰竭是各种心血管疾病的严重表现或终末阶段,致残率高、死亡率高,其作为一种复杂的临床综合征,可由任何结构性或功能性心脏疾病引起,且这些疾病会损伤心室充盈或射血功能[1]。依据左心室射血分数可将心力衰竭分为三类,即射血分数降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)、射血分数轻度降低的心力衰竭(heart failure with mildly reduced ejection fraction,HFmrEF)和射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)[2]。目前,临床主要通过抑制肾素-血管紧张素-醛固酮系统、改善血流动力学等调节神经体液途径来改善心力衰竭患者预后[3]。但是,传统的心力衰竭药物如血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体阻滞剂、β-受体阻滞剂等仅能降低HFpEF患者心力衰竭住院率,不能改善其长期预后[4]。因此,亟需新的治疗措施来改善HFpEF患者的预后。近年来,心肌能量代谢引起了学者们的重视,其被认为是心力衰竭的潜在治疗靶点[5]。研究发现,减少脂肪酸的摄取和氧化、改善葡萄糖氧化代谢、增加酮体氧化及支链氨基酸代谢等措施可改善患者心肌能量代谢,故将心力衰竭的治疗方向从调节神经体液转向调节心肌能量代谢可能有助于降低HFpEF患者的死亡率,改善其预后[6]。本文对正常心肌能量代谢及HFpEF心肌能量代谢的特点、HFpEF的代谢疗法的最新研究进展进行综述。
1 正常心肌能量代谢的特点
维持心脏搏动需要大量且恒定的能量,其中脂肪酸是心脏搏动的主要能量来源,此外,葡萄糖、酮体、氨基酸等为心肌能量代谢的底物[1]。
1.1 脂肪酸 脂肪酸通过被动扩散或由蛋白质载体如脂肪酸转运蛋白CD36、脂肪酸转运蛋白1(fatty acid transport protein 1,FATP1)介导进入心肌细胞[7]。脂肪酸在心肌细胞中首先被活化为脂酰辅酶A,随后通过肉碱棕榈酰转移酶1(carnitine palmitoyl transferase 1,CPT1)转移至肉碱上,形成长链酰基肉碱,最后转运至线粒体中,再次活化为脂酰辅酶A。脂酰辅酶A经β氧化产生乙酰辅酶A,进入三羧酸(tricarboxylic acid,TCA)循环并代谢生成三磷酸腺苷(adenosine triphosphate,ATP)[8]。由脂肪酸代谢产生的ATP占心肌细胞线粒体产生ATP的40%~60%[8]。
1.2 葡萄糖 葡萄糖可通过有氧氧化及无氧糖酵解途经生成ATP,是最有效的能量代谢底物。葡萄糖由葡萄糖转运蛋白1(glucose transpoter 1,GLUT1)和葡萄糖转运蛋白4(glucose transpoter 4,GLUT4)介导摄取并进入心肌细胞,其中GLUT4是心脏中最主要的葡萄糖转运蛋白[9]。葡萄糖被转运至心肌细胞后,经己糖激酶磷酸化后生成葡萄糖-6-磷酸,经糖酵解生成丙酮酸和乳酸,其中丙酮酸可由线粒体丙酮酸载体(mitochondrial pyruvate carrier,MPC)转运至线粒体中。大部分丙酮酸进入线粒体后通过丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)转化为乙酰辅酶A,进入TCA循环并代谢生成ATP,少量丙酮酸通过丙酮酸羧化生成草酰乙酸,以补充TCA循环中间体。由葡萄糖有氧氧化产生的ATP占心肌细胞线粒体产生ATP的20%~40%,由葡萄糖无氧糖酵解产生的ATP占心肌细胞线粒体产生ATP的2%~8%[8]。
1.3 酮体 酮体包括乙酰乙酸、β-羟丁酸和丙酮。正常情况下,血浆中酮体水平较低,而在饥饿、血糖控制不佳、剧烈运动时,血浆中酮体水平升高[10]。酮体由肝脏中的脂肪酸氧化产生,其中β-羟丁酸是心脏中酮体氧化代谢的主要底物。酮体转运蛋白——溶质载体家族16成员1(solute carrier family 16 member 1,SLC16A1)可促进酮体转运至线粒体中,而后酮体由β-羟丁酸脱氢酶1(β-hydroxybutyrate dehydrogenase,BDH1)催化生成乙酰乙酸,乙酰乙酸则在琥珀酰辅酶A转移酶(succinyl-CoA transferase,SCOT)的作用下转化为乙酰乙酸辅酶A,之后经硫解反应生成乙酰辅酶A,最终进入TCA循环并代谢生成ATP。酮体较易经心脏代谢,如果循环中酮体水平升高,其可以成为心肌能量代谢的主要来源[11]。由酮体代谢产生的ATP占心肌细胞线粒体产生ATP的10%~15%[8]。
1.4 支链氨基酸 氨基酸也是心肌能量代谢的底物之一,支链氨基酸是氨基酸氧化代谢生成ATP的主要来源[12]。支链氨基酸包括亮氨酸、异亮氨酸和缬氨酸。支链氨基酸通过线粒体支链氨基酸转氨酶(branched chain amino transaminase,BCATm)的转氨反应生成谷氨酸,此步骤是可逆的。谷氨酸再由线粒体支链α-酮酸脱氢酶(branched chain α-keto acid dehydrogenase,BCKDH)介导氧化脱羧后生成乙酰辅酶A,进入TCA循环。由支链氨基酸代谢产生的ATP占心肌细胞线粒体产生ATP的1%~2%[8]。
2 HFpEF心肌能量代谢的特点
心肌能量代谢改变是心力衰竭的特征之一,研究显示,与健康心肌相比,心力衰竭时心肌中ATP的生成减少了30%~40%,而ATP生成减少与心肌能量代谢底物的改变有关[13]。不同类型心力衰竭如HFpEF与HFrEF的心肌能量代谢改变不尽相同[14-22],见表1。
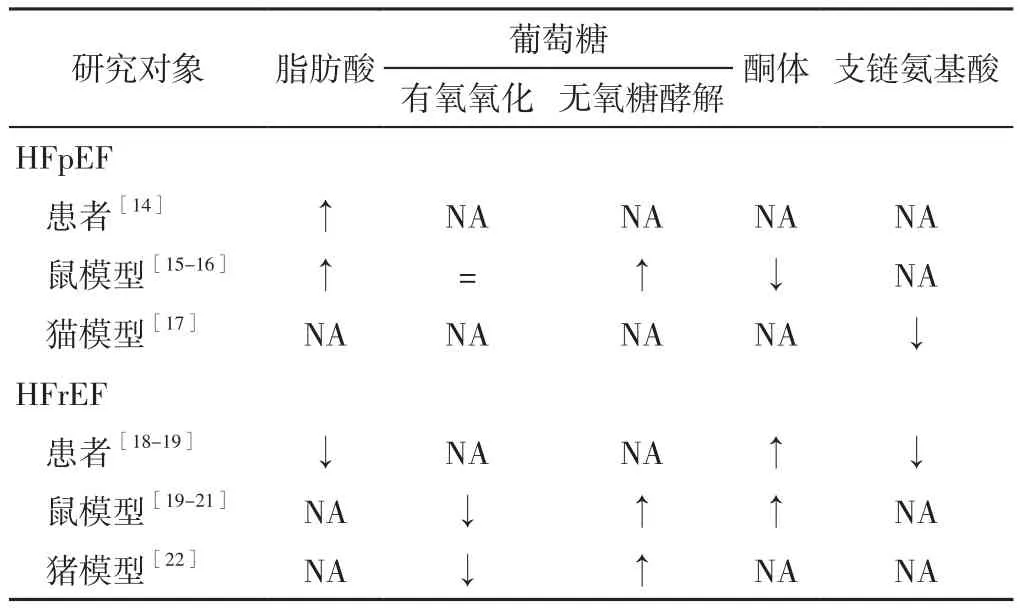
表1 HFpEF与HFrEF心肌能量代谢的变化Table 1 Characteristics of cardiac energy metabolism in HFpEF and HFrEF
2.1 脂肪酸的摄取与氧化能力增强 游离脂肪酸是脂肪分解的产物之一,血浆中游离脂肪酸水平与心力衰竭发生风险呈正相关,血浆中游离脂肪酸每增加0.2 mEq/L,心力衰竭发生风险增加12%[23],HFrEF患者心脏脂肪酸代谢的主要特点为线粒体中脂肪酸氧化代谢减少,且随着心力衰竭的进展,脂肪酸氧化率逐渐降低[18,24]。值得注意的是,游离脂肪酸结合蛋白(free fatty acid-binding protein,a-FABP)是循环中游离脂肪酸的运输载体,研究显示,HFpEF患者血浆a-FABP水平明显升高,且其与炎症及脂毒性相关的内皮功能障碍、心肌舒张功能、心肌纵向应变和心外膜脂肪组织厚度等密切相关[25-26]。此外,高脂饮食、高龄、脱氧皮质醇“三重打击”诱导下的HFpEF模型小鼠表现为心脏脂肪酸的摄取和氧化能力增强[15]。与动物实验结果相似,主动脉瓣狭窄所致重度左心室肥厚患者心脏脂肪酸的摄取能力也明显增强[14]。HFpEF与HFrEF心脏脂肪酸代谢的差异可能与心力衰竭严重程度、肥胖、胰岛素抵抗、代谢综合征等合并症相关[27],但脂肪酸摄取和氧化能力增强似乎并未完全增加心脏ATP的产生,即使HFpEF心脏脂肪酸摄取和氧化能力有所增强,但当脂肪酸摄取率大于线粒体中脂肪酸氧化速率时,机体开始出现脂质堆积及脂肪酸分解代谢产物如游离脂肪酸等,可促进活性氧的产生,导致心脏脂肪变性,使心脏功能进一步恶化,因而脂肪酸代谢相对减少,可在一定程度上减轻心脏脂毒性损伤[8]。
2.2 葡萄糖无氧糖酵解与有氧氧化解偶联 尽管心力衰竭时心脏对葡萄糖的摄取和代谢有所增加,但其主要特点表现为无氧糖酵解与有氧氧化解偶联,即产能效率较低的无氧糖酵解(2 ATP/分子葡萄糖)代谢率明显高于产能效率较高的有氧氧化(30~32 ATP/分子葡萄糖)[28]。在主动脉缩窄术诱导压力过载的HFrEF动物模型以及快速起搏诱导扩张型心肌病的HFrEF动物模型中,心脏对葡萄糖的有氧氧化减少,而无氧糖酵解增加[20,22]。与HFrEF动物模型相似,在经高盐饮食诱导的Dahl盐敏感大鼠模型中,心脏无氧糖酵解代谢率较基线增加300%,且随着HFpEF进展,无氧糖酵解代谢率持续升高,但无氧糖酵解后丙酮酸的有氧氧化代谢率并没有改变[16]。由此可见,无论是HFrEF还是HFpEF,心力衰竭发展过程中利用葡萄糖供能的效率均降低,如果增加心脏对葡萄糖的有氧氧化代谢率,促进葡萄糖有氧氧化代谢供能,可能延缓心力衰竭的进展。
2.3 酮体氧化代谢障碍 循环中β-羟丁酸水平升高与女性心力衰竭风险增加相关[29]。在主动脉窄缩术联合心肌梗死共同诱导的HFrEF小鼠模型中,心脏酮体氧化能力增强,这与介导酮体代谢的转运蛋白——SLC16A1表达增加有关,且随着HFrEF进展β-羟丁酸的氧化代谢也进一步增多[14,21]。研究显示,特异性敲除心肌细胞中SCOT或BDH1等酮体氧化相关酶基因的小鼠在心肌损伤后表现出更严重的左心室功能障碍和病理性重塑[30]。与上述研究结果不同的是,DENG等[15]研究发现,尽管HFpEF患者循环中β-羟丁酸水平有所降低,但在高脂饮食、高龄、脱氧皮质醇“三重打击”诱导下的HFpEF模型小鼠中,β-羟丁酸水平明显升高,而心脏酮体氧化代谢率降低50%,这可能与心肌组织中BDH1的表达下调有关。上述研究结果表明,与HFrEF不同的是,HFpEF心脏酮体氧化代谢率降低。
2.4 支链氨基酸氧化代谢障碍 心力衰竭常伴随支链氨基酸氧化代谢障碍,导致支链氨基酸堆积。UDDIN等[19]研究发现,扩张型心肌病患者左心室样本中支链氨基酸水平明显升高。同样,主动脉缩窄术构建的HFpEF雄性短毛猫模型心肌组织中支链氨基酸水平升高的同时线粒体功能亦受损[17]。另外,有研究表明,循环中支链氨基酸水平是心血管不良事件的独立预测因素,提示支链氨基酸代谢可能影响心力衰竭患者的临床结局[31]。尽管支链氨基酸并不是心肌能量代谢的主要来源,且目前有关HFpEF支链氨基酸代谢特点的证据尚有限,但已有的证据均提示增加支链氨基酸氧化代谢率可能对延缓心力衰竭的进展有益。
3 HFpEF的代谢疗法
基于HFpEF心肌能量代谢的特点,笔者指出,减少脂肪酸的摄取和氧化、改善葡萄糖氧化代谢、增加酮体及支链氨基酸氧化代谢率可进一步优化心肌能量代谢,对改善心力衰竭病情有益。HFpEF心肌能量代谢途径及代谢疗法示意图见图1。

图1 HFpEF心肌能量代谢途径及代谢疗法示意图Figure 1 Schematic diagram of energy metabolism pathway and metabolic therapy of cardiac myocytes in HFpEF
3.1 减少脂肪酸的摄取和氧化 脂肪酸是心肌产生能量的主要来源,尤其在HFpEF早期脂肪酸的摄取和氧化能力增强,使得脂肪酸氧化增多超过心脏生理需求,导致脂质堆积而产生脂毒性,加速HFpEF进展[32],故早期减少脂肪酸的摄取和氧化是治疗HFpEF的方向。CPT1为长链脂肪酸进入线粒体的关键酶,是脂肪酸氧化过程中的限速酶。CPT1抑制剂——依托莫西和哌克昔林可激活PDH、减少长链脂肪酸的摄取并增加葡萄糖的氧化[33-34]。但是,因为临床试验观察到CPT1抑制剂具有严重的肝脏毒性,且易超过治疗窗,需严格地监测药物浓度,故CPT1抑制剂在临床上使用受到限制[35]。曲美他嗪常用于治疗心绞痛,其可通过抑制线粒体中长链3-酮酰辅酶A硫解酶来降低脂肪酸氧化代谢率,该酶是长链脂肪酸氧化的关键酶,该过程可间接增加葡萄糖有氧氧化限速酶——PDH的活性,从而减少脂肪酸氧化,并增加葡萄糖的有氧氧化[36]。关于曲美他嗪与HFpEF患者的Ⅱ期临床试验正在进行,其可进一步证明改善心肌能量代谢在HFpEF治疗中的重要地位[37]。临床数据分析结果显示,服用他汀类药物可降低无缺血性心脏病的HFpEF患者的全因死亡风险和心血管死亡风险[38],如辛伐他汀可通过降低心力衰竭患者循环中胆固醇及脂肪酸水平而降低脂毒性,其还可介导内皮细胞信号通路、调节压力超负荷引起的适应不良的心脏重塑和功能异常[39]。非诺贝特是一种贝特类降脂药,可降低低密度脂蛋白胆固醇、总胆固醇和三酰甘油水平,并升高高密度脂蛋白胆固醇水平,起到心脏保护作用[40]。此外,SIRT6激活剂——MDL-800可抑制心肌内皮细胞对脂肪酸的摄取,减少HFpEF患者心脏中的脂质堆积,改善心脏舒张功能[41]。由此可见,减少脂肪酸的摄取和氧化,减少心脏脂质堆积及降低脂毒性,有利于延缓HFpEF进展。
3.2 改善葡萄糖氧化代谢 研究显示,二甲双胍可通过促进心肌细胞CLUT4的易位和增加葡萄糖的摄取、激活限速酶磷酸果糖激酶1(phosphofructokinase-1,PFK1)而增加无氧糖酵解、改善葡萄糖无氧糖酵解与有氧氧化解偶联,进而改善线粒体功能,增加ATP合成,且可减少脂肪酸的摄取,降低脂毒性[42]。此外,二甲双胍可改善HFpEF患者心脏舒张功能,延缓HFpEF进展,甚至降低患者死亡率[43-44]。吡格列酮是广泛使用的口服降糖药,可刺激核过氧化物酶体增殖物激活受体γ,提高葡萄糖和脂质代谢以及胰岛素的敏感性,但其因体液潴留可导致心力衰竭患者住院风险增加[45]。研究结果显示,低剂量吡格列酮(7.5 mg/d)与标准剂量吡格列酮相比可同等程度地提高葡萄糖和脂质的代谢率以及胰岛素的敏感性,降低水肿和心力衰竭发生风险[46],但其对心力衰竭尤其是HFpEF患者长期预后的影响仍需临床试验进一步验证。PDH抑制剂——二氯乙酸是丙酮酸类似物,研究表明,PDH抑制剂可通过刺激葡萄糖有氧氧化和增加葡萄糖无氧糖酵解与有氧氧化解偶联而减轻心肌缺血、再灌注损伤及心肌肥大[47]。二氯乙酸也可通过调节PGC-1α和SIRT3基因表达、改善线粒体功能、抑制氧化应激和细胞凋亡等方式而对心脏发挥保护作用[48]。人参皂苷可增加葡萄糖摄取并抑制心肌重构,其也可刺激脂肪酸氧化和改善线粒体功能,是一个潜在的抑制心力衰竭进展的药物[49]。目前越来越多的降糖药物被证实可通过改善心肌能量代谢、增加线粒体氧化而降低心力衰竭住院率及全因死亡率,尤其是钠-葡萄糖协同转运蛋白2抑制剂(sodiumglucose cotransporter 2 inhibitor,SGLT2i)已被证实治疗HFpEF有效,这是HFpEF治疗方面里程碑式的突破。有荟萃分析表明,二甲双胍可降低HFpEF患者心血管死亡率[43],故降糖药物通过其非降糖作用治疗心力衰竭的前景可观。
3.3 增加酮体氧化代谢 酮体作为一种潜在的心脏“超级燃料”,易被心肌细胞氧化,可以为心力衰竭心脏提供能量[10]。此外,酮体还可以发挥超出心肌能量学的额外作用,如通过减轻炎症、氧化应激和心肌重塑而促进心脏功能恢复[50-51]。值得注意的是,SGLT2i可增加循环中酮体水平[52],也可通过升高循环中酮体水平来调节NLRP3炎症小体,进而减轻心脏的炎症反应[53]。EMPEROR-Preserved临床试验表明,SGLT2i——恩格列净可降低HFpEF患者心血管死亡或因心力衰竭住院的综合风险,是第一个可改善HFpEF患者心血管结局的药物[54]。禁食、生酮饮食、中链三酰甘油、酮盐或酮酯补充剂或SGLT2i治疗可减少HFpEF中促炎因子诱导的线粒体功能障碍和心肌纤维化,降低心力衰竭动物模型死亡率,延长小鼠寿命[15,55]。上述证据表明,SGLT2i或生酮饮食等改善酮体氧化代谢的措施均可降低心力衰竭心血管结局,尤其对于缺乏治疗手段的HFpEF。
3.4 增加支链氨基酸氧化代谢 支链氨基酸氧化代谢障碍可加重氧化应激及代谢紊乱,加速心力衰竭进程,同时长期高水平的支链氨基酸可导致心律失常[56-57]。支链氨基酸氧化代谢障碍同时可促进胰岛素抵抗,而给予支链氨基酸氧化刺激剂——BT2治疗可改善胰岛素抵抗、促进心肌支链氨基酸氧化代谢,同时改善心脏功能[56,58]。增加支链氨基酸氧化代谢、限制支链氨基酸及支链酮酸的累积等方式可改善缺血性心脏病和心力衰竭患者心脏功能,靶向支链氨基酸氧化代谢也是一种有前景的心力衰竭治疗方法[59]。
3.5 其他 甲状腺素、松弛素、雌激素等激素类药物被广泛应用于心脑血管疾病的治疗,但目前仍无相应激素可直接治疗心力衰竭,有研究表明,松弛素-2可延长急性心力衰竭患者的生存期,分析机制可能与内源性长链多不饱和脂肪酸的合成、氨基酸修饰中的能量代谢和心血管结构调节有关[60]。卡维地洛是一种α1-受体阻滞剂和β-受体阻滞剂,具有舒张血管作用,通常用于治疗轻度或中度高血压患者。一项临床研究表明,长期使用卡维地洛可以提高非缺血性心力衰竭患者的生存率,较高剂量(7.5 mg/d)卡维地洛可以提高HFrEF患者的生存率,但是卡维地洛对HFpEF患者无效[61]。近年来,天然产物成为心血管疾病治疗方面的研究热点,其中多酚类、皂苷类、多糖、生物碱类、中药专利方剂大多是通过减少炎症因子和脂质过氧化而发挥心脏保护作用[13],其与能量代谢关系的报道相对较少,仍需进一步研究证明其是否与心肌能量代谢直接相关。
4 小结与展望
综上所述,心力衰竭发生发展过程中的心肌能量代谢变化是复杂的。尽管HFpEF心肌能量代谢及代谢疗法的直接证据相对有限,但已有的研究表明,HFpEF与HFrEF的心脏葡萄糖和支链氨基酸代谢改变基本相似,表现为葡萄糖无氧糖酵解与有氧氧化解偶联及支链氨基酸氧化代谢障碍。值得注意的是,HFpEF心脏脂肪酸及酮体代谢变化有其特殊性,表现为脂肪酸的摄取与氧化能力增强和酮体氧化代谢障碍。而心肌能量代谢靶向治疗可延缓心力衰竭进展。因此,减少脂肪酸的摄取和氧化、改善葡萄糖氧化代谢、增加酮体及支链氨基酸氧化代谢的代谢疗法可能有效改善HFpEF患者预后。
作者贡献:赵惠奇进行文章的构思和设计、文献的收集和整理以及论文撰写;张青海负责文献的整理和校对;张青海、郑昭芬负责文章的质量控制和审校,并对文章整体负责、监督管理。
本文无利益冲突。

