IL-6、hs-CRP和钙卫蛋白联合肠道菌群检测诊断炎性肠病及评估活动度的价值
黄晓文 李晓芳 陈兴英 袁梅 徐瑾
炎性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD),其发病机制尚未完全明确,可能与遗传、环境、免疫、感染等造成肠道黏膜慢性炎症反应因素所导致[1]。当患者机体免疫力下降或长期大量使用抗生素时,可使肠道菌群发生改变从而破坏肠道免疫屏障最终导致炎性肠病的发生[2]。随着人们生活习惯的改变以,中国IBD的患病率逐年增高[3]。IBD具有反复发作、慢性起病等特点,因此,早筛查、早确诊并能准确评估疾病状态,制定个性化治疗方案可明显改善患者预后[4]。本研究分析IL-6、hs-CRP和钙卫蛋白在IBD患者及健康人的水平,探讨以上指标对IBD诊断和活动度评估的价值。
1 资料与方法
1.1 临床资料 选取2019年5月至2021年5月本院炎性肠病患者62例(观察组)。纳入标准:符合2013年中华医学会消化病学分会的IBD诊断标准。排除标准:继发肿瘤;严重心、肝、肾功能疾病;既往有其他类型精神疾病不能配合完成研究;合并其他自身免疫疾病;有短肠综合征或结肠切除术后者;1个月内服用抗生素或益生菌者。另选取同期体检健康者31例为对照组。对照组男19例,女12例;年龄28~64(41.5±7.1)岁。观察组男39例,女24例;年龄25~66(42.1±6.7)岁。其中缓解期、活动期患者各31例,缓解期、活动期患者中均为克罗恩病患者15例,溃疡性结肠炎患者16例。本研究基线资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 (1)hs-CRP和IL-6检测方法:抽取患者静脉血2 mL EDTA-K2抗凝管中,使用迈瑞BC-5390CRP全自动血液分析仪,进行hs-CRP水平检测,其试剂均为配套;使用BD公司 FACS Canto Ⅱ流式细胞仪检测IL-6水平,其试剂为原装配套。(2)钙卫蛋白和肠道菌群检测方法:留取患者新鲜粪便标本,使用BUHLMANN公司生产的试剂盒,取100 mg粪便标本采用酶联免疫法检测其中钙卫蛋白的含量;采集新鲜粪便10 g保存于-80℃的冰箱中备用,按照 QIAamp DNA Stool Mini Kit粪便 DNA提取试剂盒说明书步骤进行操作,采用ABI7500 fast实时荧光定量PC仪对肠道菌群进行定量,测定其中拟杆菌、小梭菌、真杆菌、消化球菌、乳酸杆菌、双歧杆菌、酵母菌、肠球菌、肠杆菌数量,结果采用LgN(CFU/g)表示。
1.4 统计学方法 采用SPSS19.0统计软件。计量资料以(±s)表示,组间比较用t检验;计数资料以[n(%)]表示,组间比较用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 炎性肠病活动期和缓解期患者粪便菌群培养结果 活动期组、缓解期组、健康组,乳酸杆菌、双歧杆菌、拟杆菌、真杆菌、消化球菌数量依次增加,大肠杆菌、肠球菌、小梭菌数量依次减少(P<0.05);缓解期组与健康组比较,拟杆菌数量显著降低(P=0.04)。见表1。
表1 炎性肠病活动期和缓解期患者大便菌群培养结果比较[(±s),LgN(CFU/g)]
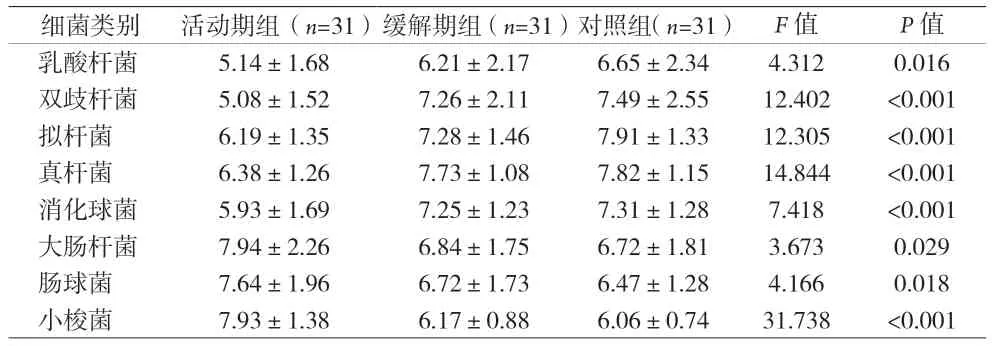
表1 炎性肠病活动期和缓解期患者大便菌群培养结果比较[(±s),LgN(CFU/g)]
细菌类别 活动期组(n=31)缓解期组(n=31)对照组(n=31) F值 P值乳酸杆菌 5.14±1.68 6.21±2.17 6.65±2.34 4.312 0.016双歧杆菌 5.08±1.52 7.26±2.11 7.49±2.55 12.402 <0.001拟杆菌 6.19±1.35 7.28±1.46 7.91±1.33 12.305 <0.001真杆菌 6.38±1.26 7.73±1.08 7.82±1.15 14.844 <0.001消化球菌 5.93±1.69 7.25±1.23 7.31±1.28 7.418 <0.001大肠杆菌 7.94±2.26 6.84±1.75 6.72±1.81 3.673 0.029肠球菌 7.64±1.96 6.72±1.73 6.47±1.28 4.166 0.018小梭菌 7.93±1.38 6.17±0.88 6.06±0.74 31.738 <0.001
2.2 炎性肠病活动期和缓解期患者IL-6、hs-CRP及钙卫蛋白表达水平的比较 活动期组、缓解期、对照组3组IL-6,hs-CRP和钙卫蛋白水平相比,差异具有统计学意义(F=172.278,453.726,1673.968,P<0.000),缓解期组IL-6,hs-CRP和钙卫蛋白水平与对照组相比,差异同样具有统计学意义(t=2.347,14.006,9.429,P=0.011,0.000,0.000)。见表2。

表2 炎性肠病活动期和缓解期患者IL-6、hs-CRP、钙卫蛋白表达水平比较
3 讨论
炎性肠病是一种病因不明的以肠道黏膜慢性、非特异性炎症反应为主要表现的疾病。炎症反应过程需要多种细胞因子的参与,如IL-6,hs-CRP等,且在炎症反应中所表达的意义不尽相同。如hs-CRP在急性感染时浓度迅速上升,是临床中最为常用的炎症指标,IL-6在感染者的体内可迅速表达且上升水平与炎症反应程度、组织损伤程度呈正相关[5]。此次研究中发现,活动期及缓解期患者IL-6,hs-CRP水平均较对照组明显升高,说明炎性肠病患者的病情严重程度和血清炎性因子的表达水平密切相关。
钙卫蛋白主要来源于中性粒细胞和巨噬细胞,是一种炎性标志物,具有免疫调节、抗炎等作用,当患者肠道存在严重反应时,粪钙卫蛋白含量可显著上升,炎性肠病患者钙卫蛋白含量普遍高于100 μg/g,若>170 μg/g时,其敏感度达100%,特异度为95%[6]。此次研究中活动期患者钙卫蛋白含量显著高于缓解组和对照组,且缓解组钙卫蛋白含量仍高于对照组,故钙卫蛋白含量的检测对炎性肠病的诊断、鉴别诊断,特别是判断炎性反应活动度具有重要的指导意义。
正常人体内肠道菌群种类及数量庞大,已知菌群数量多达600余种,多数存在于小肠末端和结肠中。菌多主要分为致病菌、机会致病菌以及优势菌群。当人体处于健康状态下,前2类菌群可被肠道内稳定的菌群排出或保持沉默,三种菌群的动态平衡是肠黏膜屏障的重要组成部分。当机体免疫力下降,或由于长期大量使用抗生素时肠道菌群结构出现失调,致病菌及机会致病菌迅速繁殖从而造成肠黏膜屏障功能发生紊乱进而降低机体的免疫防御力。本研究显示,活动期患者肠道菌群已严重失调,乳酸杆菌、双歧杆菌、拟杆菌等优势菌群数量明显下降且大肠杆菌、肠球菌、小梭菌等机会致病菌明显增多,从而使肠管黏膜的免疫屏障作用下降,最终引起肠管局部严重反应的发生[7]。
综上所述,炎性因子及肠道菌群结构的变化与炎性肠病患者的病情明显相关,通过对血液中的IL-6,hs-CRP、粪便标本中肠道菌群及钙卫蛋白多指标联合检测,对炎性肠病的诊断及疾病活动性评估具有重要临床意义。

