拥挤胁迫对银鲳幼鱼生长及消化酶活性的影响
孔煜夫,张晓东,周 彬,王丹丽,王亚军,2,徐善良,2
(1.宁波大学 海洋学院,浙江 宁波 315211; 2.水产生物技术教育部重点实验室(宁波大学),浙江 宁波 315211)
银鲳(Pampusargenteus)隶属于鲈形目(Perciformes),鲳科(Stromateidae),鲳属(Pampus),属暖水性中上层集群性经济鱼类。主要分布于中国、日本等亚洲海域,科威特、伊拉克海域的阿拉伯湾及印度孟加拉湾等印度洋和西太平洋[1]。但是近20年来,由于过度捕捞以及海洋环境的污染,使银鲳的野生资源受到了极大的破坏,其野生资源量日渐减少。为保护银鲳的种质资源,国内外学者对银鲳的人工繁育、养殖进行了诸多研究[2-6]。
随着银鲳人工育苗、养殖等一系列技术的突破,银鲳已成功实现人工养殖并逐步走向规模化养殖。养殖密度是决定养殖鱼类生长速度、产量和效益的主要因素之一,在大规模的集约化生产中往往通过增加养殖密度的方式来增加单位面积产量。然而,高密度的养殖会引起残饵和代谢废物的增加,导致水质恶化、水中有害物质含量增加等现象,这将对鱼类产生拥挤胁迫,常表现为鱼类对饲料的利用率降低、生长发育迟缓、免疫力降低等。高密度的养殖在带来较高经济效益的同时往往也增加了风险[7-10]。近年来,关于拥挤胁迫对鱼类生理与生长影响的报道较少,大多集中在饥饿、温度、盐度等方面[11-15]。消化酶作为动物体内的重要酶类,其活性的高低除反映动物消化能力的强弱外,还可以直接或间接地影响着鱼类的生长[16]。乔玮等[17]在进行大菱鲆(Scophthalmusmaximus)密度养殖试验时发现,饲养密度对大菱鲆的消化酶活性有着显著的影响,高密度饲养产生的拥挤胁迫抑制了大菱鲆的生长,使得高密度组的大菱鲆增重率和特定生长率显著低于中、低两个密度组。邓超准[18]在研究拥挤胁迫对星洲红鱼的影响时也同样发现,过高的饲养密度对其消化酶及生长性能有着显著影响。
因此,为探究不同密度下银鲳生长性能及消化酶活性的变化,本试验设置了3个密度梯度组(30、60 ind/m3和90 ind/m3),测定分析不同密度下银鲳肠、胃组织中的淀粉酶、脂肪酶、胰蛋白酶、胃蛋白酶活性的时空变化,从酶活性角度分析不同养殖密度对银鲳产生的胁迫影响;同时,测定不同密度条件下40 d后银鲳的特定生长率和增重率,分析不同密度对银鲳生长的影响。试验结果将作为优化银鲳幼鱼养殖密度的指标,为大规模养殖银鲳提供理论参考,提高养殖整体经济效益。
1 材料与方法
1.1 试验用鱼
试验在宁波大学梅山校区中试基地银鲳养殖中心进行,试验用鱼为人工培育的银鲳幼鱼,养殖密度为20 ind/m3。从同一池中选取健康活泼、同一批次培育的大小规格相近的个体810尾,平均体质量3.88±0.72 g。
1.2 试验设计
采用有效水体1 m3的PVC圆桶进行试验,试验分成3个密度处理组,分别为低密度组(30 ind/m3)、中密度组(60 ind/m3)、高密度组(90 ind/m3),每组三个平行。试验周期为40 d,试验期间连续充气,避光养殖,对三个密度组的水质进行调控,尽量使水质保持一致。所选用的饲料为自制的黏性团状饲料(日本产“鱼宝”牌饲料+新鲜鱼肉糜+海蜇的混合料),置于水中间的饵料台内。为保证营养不溶失,每隔2~3 h更换饲料。海水盐度24‰~26‰,pH值为7.9~8.1,水温(28±1)℃,溶解氧(DO)含量>7 mg·L-1。
1.3 样品采集及保存办法
在试验开始后的第0、5、10、20 d和40 d分别进行取样。取大小相近,活力较好,健康的幼鱼进行试验,每次每个处理组各取6尾(每个平行取2尾),取样后及时减少桶内水体积,以保持相应的密度。将取出的活鱼立即用MS-222麻醉,分别称量体质量和体长并记录,然后将鱼置于冰盘上快速解剖,取部分肠、胃置于-80 ℃冷冻保存。
1.4 测定方法
1.4.1 生长指标计算
增重率(WG, 单位: %)和特定生长率(SGR, 单位: %)计算公式如下:
WG=100×(mt-m0)/m0
(1)
SGR=100×(lnmt-lnm0)/t
(2)
式中:m0为试验开始时试验鱼的初始平均体质量,g;mt为结束时试验鱼的初始平均体质量, g;t为试验天数,d。
1.4.2 蛋白浓度的测定-BCA法 采用南京建成生物工程研究所生产的总蛋白定量测定试剂盒,组织中蛋白浓度采用BCA法测定,将20 μL待测液加入样品孔,再加入200 μL BCA工作液,37 ℃恒温箱保温20~30 min,用分光光度计在562 nm波长下测定各孔吸光值。
1.4.3 银鲳胃组织中胃蛋白酶酶活性的测定
准确称取组织重量,按重量(g)∶体积(mL)为1∶9的比例加入9倍体积的匀浆介质,然后用研磨棒在冰水浴条件下机械匀浆,制成10 %的匀浆。将离心机预冷,用离心机在2 500转/min下离心10 min,离心完成后取其上清液进行测定。酶活力测定采用南京建成生物工程研究所生产的胃蛋白酶测定试剂盒,依次添加试剂,最终在室温下用紫外分光光度计在660 nm处测量吸光度。胃蛋白酶酶活力定义:每毫克组织蛋白在37 ℃条件下每分钟分解蛋白质生成1 μg氨基酸相当于1个酶活力单位。
计算公式:胃蛋白酶活力(U/mg)=(测定管OD值-对照管OD值)/(标准管OD值-空白管OD 值)×标准品浓度(50 μg/mL)/反应时间(10 min)×反应液总体积(0.64 mL)/取样量(0.04 mL)/待测样本蛋白浓度(mg/mL)。
1.4.4 银鲳胰脏组织中胰蛋白酶活性的测定
准确称取组织重量,按重量(g)∶体积(mL)为1∶9的比例加入9倍体积的匀浆介质,然后用研磨棒在冰水浴条件下机械匀浆,制成10 %的组织匀浆,将离心机预冷,用离心机在2 500转/min下离心10 min,离心完成后取其上清液进行测定。酶活力测定采用南京建成生物工程研究所生产的胰蛋白酶测定试剂盒,将0.015 mL待测样品和1.5 mL胰蛋白酶底物应用液快速混匀,室温下用紫外分光光度计在253 nm处测量吸光度。胰蛋白酶酶活力定义:在pH值为8.0,温度为37 ℃条件下,每毫克蛋白质中含有的胰蛋白酶每分钟使吸光度变化0.003即为一个酶活力单位。
计算公式:胰蛋白酶活性(U/mg)=[(测定管A2-测定管A1)-(空白管A2-空白管A1)]/20 min/0.003×反应液总体积(1.5 mL+0.015 mL)/样本取样量(0.015 mL)/[样本中蛋白浓度(mg/mL)×样本取样量(0.015 mL)]。
1.4.5 淀粉酶活力的测定
准确称取组织重量,按重量(g)∶体积(mL)为1∶9的比例加入9倍体积的匀浆介质,然后用研磨棒在冰水浴条件下机械匀浆,制成10 %的组织匀浆,将离心机预冷,用离心机在2 500转/min下离心10 min,离心完成后取其上清液进行测定。酶活力测定采用南京建成生物工程研究所生产的α-淀粉酶(AMS)测试盒,将0.5 mL底物缓冲液和0.1 mL待测样品混合,之后依次加入碘应用液和双蒸水,室温下用酶标仪在660 nm处测量吸光度。淀粉酶酶活力定义:组织中每毫克蛋白质在37 ℃条件下与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位。
计算公式:淀粉酶活力(U/mg)=(空白管OD值-测定管OD值)/空白OD值×0.4×0.5/10×30 min/7.5 min/[取样量(0.1 mL)×待测样本蛋白浓度(mg/mL)。
1.4.6 脂肪酶活性的测定 准确称取组织重量,按重量(g)∶体积(mL)为1∶4的比例加入4倍体积的生理盐水(自配),然后用研磨棒在冰水浴条件下机械匀浆,制成20 %的组织匀浆,将离心机预冷,用离心机在2 500转/min下离心10 min,离心完成后取其上清液进行测定。酶活力测定采用南京建成生物工程研究所生产的脂肪酶(LPS)测定试剂盒,将2 mL底物缓冲液和25 μL 20 %组织匀浆混合,加入25 μL试剂四,室温下用酶标仪在420 nm处测量吸光度。脂肪酶酶活力定义:在温度为37 ℃下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶活力单位。
计算公式:脂肪酶活力(U/g)=(A1-A2)/AS×标准管浓度(454 μmol/L)×反应液总体积(2.05 mL)/取样量(0.025 mL)/反应时间(10 min)/待测样本蛋白浓度(g/L)。
式中:A1为样本待测溶液在石英比色皿中,波长为420 nm下,准确计时30 s时读取的吸光值;A2为样本待测溶液在37 ℃水浴锅中水浴10 min后倒回比色皿中,波长420 nm处,计时30 s时读取的吸光值;As为2 mL底物缓冲液和50 μL生理盐水充分混合后,在波长为420 nm处测量吸光值。
1.4.7 数据的处理与统计分析 试验数据均以平均值±标准差来表示。所测数据采用“SPSS version 19.0”软件进行单因素方差分析(one-way ANOVA);统计间若有显著差异,再用Duncan法进行多重比较,P<0.05表示差异显著。
2 结果
2.1 养殖密度对银鲳生长的影响
3个密度组银鲳幼鱼的增重率、特定生长率如图1、图2所示。中密度组(60 ind/m3)银鲳幼鱼的增重率与特定生长率分别为(235.19±10.23)%、(4.03±0.10)%,显著高于低密度组(P<0.05),高密度组(90 ind/m3)幼鱼的增重率与特定生长率分别为(196.00±24.25)%、(3.61±0.27)%,均略低于中密度组,但无显著性差异(P>0.05),从增重率和特定生长率这两个指标来看,中密度组>高密度组>低密度组。
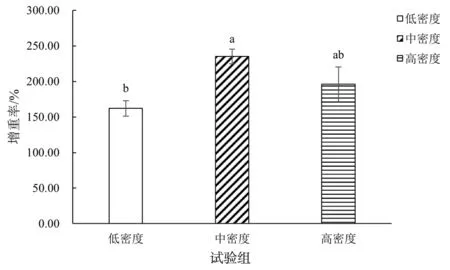
注:不同字母表示差异显著(P<0.05),下同。图1 养殖密度对银鲳增重率的影响

图2 养殖密度对银鲳特定生长率的影响
在养殖周期内,不同密度组下银鲳幼鱼的生长方程曲线如图3所示。其中低密度组生长方程为W=-0.007 2t2+0.478 3t+6.242,R2=0.826;中密度组生长方程为W=-0.002 8t2+0.364 9t+5.362 1,R2=0.938;高密度组生长方程为W=-0.004 6t2+0.397 1t+4.903 6,R2=0.939。在0~5 d时,银鲳幼鱼的增长幅度最大,其中低密度组增长率为132.6%,为同时期中密度组的1.09倍,高密度组的1.36倍。之后,不同密度组的增重率均有所放缓。至5~10 d时,低密度组的增重率为16.0%仍高于中密度组。而在10~20 d、20~30 d、30~40 d这几个周期内,中密度组的增长率分别为21.2%、15.4%和26.3%,均高于同时期的低密度组和高密度组。根据生长方程预测,三个密度组在0~5 d时都处于快速增长时期,20 d后低密度组增重变得缓慢,高密度组的增重较中密度组有所下降,而中密度组仍保持相对稳定的增长。
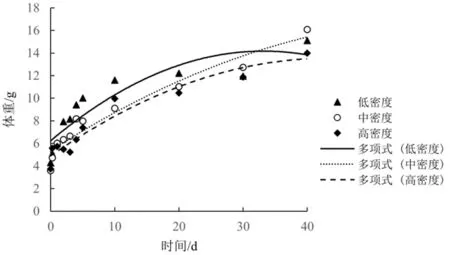
图3 不同养殖密度下银鲳幼鱼的生长方程曲线
2.2 养殖密度对银鲳四种消化酶活性的影响
2.2.1 胃蛋白酶 如图4,随着养殖时间的变化,低密度组的胃蛋白酶活性整体呈现升高的趋势,且变化显著(P<0.05); 40 d后,低密度组的胃蛋白酶活性显著高于中密度组和高密度组(P<0.05)。高密度组随着时间的变化呈现出先上升后下降的变化,在5 d时,胃蛋白酶活性达到峰值,为11.69 U/mg,为40 d时胃蛋白酶活的2.75倍;之后一直呈现下降的趋势,在40 d时达到最低值,为4.89 U/mg。中密度的酶活变化趋势与高密度组相一致,同为先上升后下降的变化,于5 d时达到峰值为9.36 U/mg,显著低于高密度组(P<0.05);于40 d时达到最低值,与高密度组差异不显著(P>0.05)。10 d前,高密度组银鲳幼鱼的胃蛋白酶活性最高;10 d后,低密度组银鲳幼鱼的胃蛋白酶活性最高。
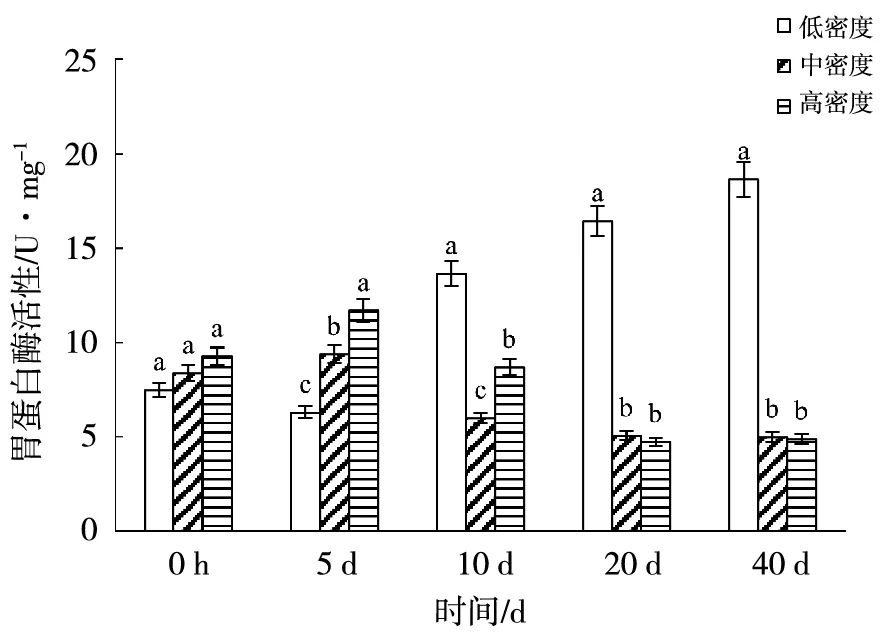
注:不同字母表示组间差异显著(P<0.05),下同。图4 养殖密度对银鲳胃蛋白酶活性的影响
2.2.2 胰蛋白酶 如图5,刚出生的幼鱼在3个密度组中都表现出较高的胰蛋白酶活性。5 d后,胰蛋白酶在高密度组与低密度组中变化相一致,均呈现先下降后上升再下降的变化,且变化显著(P<0.05);其中,低密度组胰蛋白酶活性在10 d时达到高峰值,为287.55 U/mg;而高密度组在20 d时达到高峰值,为281.00 U/mg,峰值比低密度组更晚到来。在0 h~10 d时,低密度组胰蛋白酶活性始终高于中密度组和高密度组;20~30 d时高密度组胰蛋白酶活性显著高于中密度组和低密度组,但低于初始水平(P<0.05)。

图5 养殖密度对银鲳胰蛋白酶活性的影响
2.2.3 淀粉酶 如图6,在养殖过程中,低密度组淀粉酶活性呈现先下降后上升再下降的变化,在20 d时达到最大值,为1032 U/mg。中密度组淀粉酶的活性呈现先上升后下降的变化,其在5 d时达到最大值,为1 074 U/mg,10 d后,淀粉酶活性处于较低水平,且较初始水平有所下降。0~20 d高密度组酶的活性呈现先上升后下降再上升的变化,40 d后,淀粉酶活力显著高于中密度和低密度组(P<0.05)。
2.2.4 脂肪酶 如图7,刚出生的幼鱼在3个密度组中都表现出较高的脂肪酶活性。此后,低密度组呈现先下降后上升再下降的变化,且变化差异显著(P<0.05),在5 d时达到最小值,为26.37 U/mg;在20 d时达最大值,为66.55 U/mg。中密度组的脂肪酶活性变化趋势与低密度相一致,在10 d时降至最小值,为33.00 U/mg;在20 d时升至最大值,达到60.55 U/mg。高密度组脂肪酶活性在0 h~10 d无显著变化(P>0.05),10~20 d酶活急剧下降,降至16.05 U/mg,20 d后酶活无显著变化。40 d后高密度组的脂肪酶活性低于中密度和低密度组,且差异极其显著(P<0.01)。
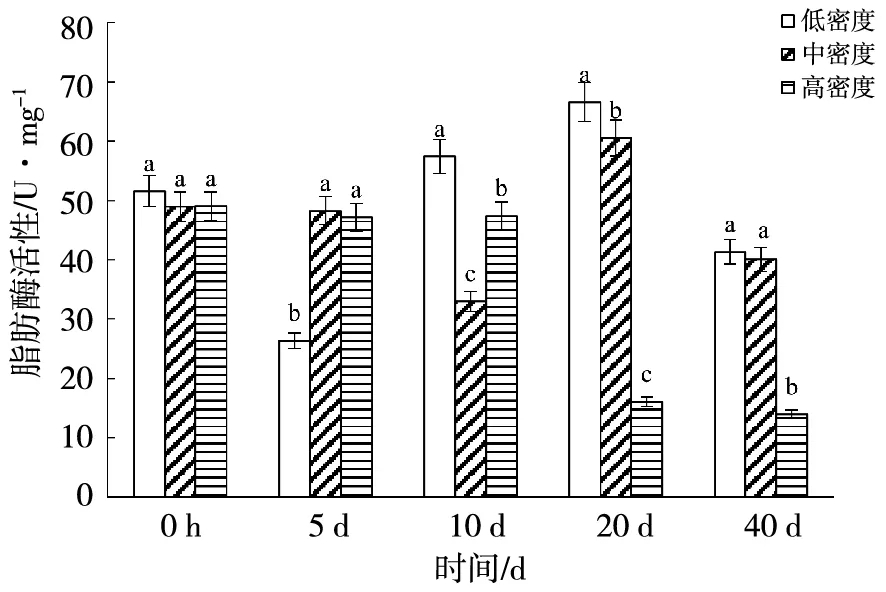
图7 养殖密度对银鲳脂肪酶活性的影响
3 讨论
3.1 拥挤胁迫对鱼类生长的影响
一般认为,除了饵料、遗传、环境条件等因素之外,养殖密度被认为是影响野生或养殖鱼类生长和性成熟最重要的因素之一。在一般情况下,随着养殖密度的增大,鱼类由于竞争关系的加剧会产生更多的活动耗能,具体表现为高密度养殖条件下易出现食物资源不足的现象,此时,个体间争食和攻击行为会明显增强,这会使摄入的能量更多地被用于这类非生长因素,生长速率自然随着养殖密度的增加而出现降低,两者之间往往存在着负相关的关系。此外,高密度的养殖环境会对鱼类产生一种胁迫作用,迫使鱼体长期处于一种生理应激状态,使得其生理功能发生紊乱,从而影响其个体的生长。一般情况下,鱼类应对环境胁迫时的应激反应主要有:警惕性提高、活动增强、喜欢集群游动进而表现为无休止游动等。因此,可以看出高密度养殖引起的生理应激行为往往具有抑制作用。曹阳等[7]为研究俄罗斯鲟(Acipensergueldenstaedtii)在不同密度下的生存状态,设计了低(0.8 kg/m3)、中(1.6 kg/m3)和高(3.2 kg/m3)三个不同密度组。研究结果显示,经过56 d的饲养,不同密度对幼鱼的成活率未造成显著的影响(P>0.05)。随着养殖密度的升高,中密度组俄罗斯鲟的增重率和肥满度显著高于高密度组,但与低密度组无显著差异。Li[19]研究史氏鲟(Amursturgeon)时发现,在高密度条件养殖下,鱼体的生长率与增重率往往和养殖密度呈负相关,高密度组的生长率和增重率显著低于低密度组。黄宁宇等[20]研究瓦氏黄颡鱼(Pelteobagrusvachelli)时,分别设置5个养殖密度(80 、160、240、320 ind/m3和400 ind/m3)。经过30 d的试验,结果显示,养殖密度和温度的确会对瓦氏黄颡鱼幼鱼的生长产生显著影响。瓦氏黄颡鱼幼鱼的日增重、特定增长率、生长效率均随密度的增大而减小,净增重240 ind/m3和160 ind/m3两密度组最高,与本试验结果相近。江仁党[21]研究虹鳟(Oncorhynchusmykiss)时也得出了类似结果,试验设4个密度组, 初始密度分别为250、200、150尾和100尾,分别放入4个网箱中,分别于7月22日、8月14日、9月15日和10月15日对其进行生长测定,每次测量30尾。结果得出,在高密度条件养殖下,鱼体的生长率与增重率往往和养殖密度呈负相关,高密度组的生长率和增重率显著低于低密度组,与上述学者研究结果相一致。
也有学者发现,过低的养殖密度也会对鱼类产生明显的抑制作用。例如邹雄等[22]对点篮子鱼(Siganusguttatus)的研究发现,密度为4.95 kg/m3组的点篮子鱼生长要优于密度为2.48 kg/m3组,且显著高于7.80 kg/m3组和10.20 kg/m3组。逯尚尉等[23]研究也认为,密度为2.1 kg/m3组的增重率最大,过高或过低的养殖密度都会对点带石斑鱼(Epinephelusmalabaricus)生长产生抑制。本试验中高密度组(90 ind/m3)的增重率与特定生长率均低于中密度组(60 ind/m3),说明高密度的养殖条件确实对银鲳产生一定的胁迫作用;但本试验中中密度组(90 ind/m3)的增重率与特定生长率高于高、低密度组,与邹雄、逯尚尉等的研究结果相一致。分析认为可能是因为点篮子鱼、点带石斑鱼、银鲳这类鱼属于群居鱼类,具有集群行为,过低的养殖密度对其产生了抑制作用。李大鹏等[24]也研究证实,过低的养殖密度往往会导致群居鱼类出现食欲下降、生长减缓、行为异常等现象,而当其集群生活时,则会恢复为行为活泼、积极进食、生长加快的状态。这一点上从试验中体重生长方程中也可看出,试验中低密度组银鲳幼鱼在发育到20 d后,增重幅度显著下降,明显低于中密度组。高密度组的银鲳幼鱼增重幅度相较于中密度组也呈现一定程度的下降。
3.2 拥挤胁迫对银鲳消化酶活性的影响
鱼类受到外界不良环境因素刺激时,面临生存压力,其体内会发生一系列的生理改变,导致其体内消化酶活性、激素水平等内分泌系统的活性发生变化,这一般称为适应性综合征,又称为应激反应。生理学家Selye H等[25]于1936年首先提出了应激的概念,并将其分为警告期、抵抗期和疲惫期三个阶段。学者Pickering[26]研究报告表明,鱼类对外界胁迫确实存在一定的适应性反应,大致分为以下三个阶段,即最初的机体神经内分泌活动的变化到由此引发的生理、生化及免疫的系列反应变化,最终反映在行为上的改变。
高密度养殖往往会导致水产动物生活空间的减小,进而加剧水产动物对空间和饵料的竞争,导致水产动物机体能量消耗增多,具体表现为各类酶活性的变化[27]。消化酶是动物体内一大重要的酶类,其活力的高低可以直接反映动物体内消化能力的强弱。同时,消化酶作为鱼类消化系统中极其重要的一类功能性物质,在鱼类生长发育的过程中,对其适应食物变化的能力和摄取营养物质的能力具有显著影响[16]。
在大菱鲆(Scophthalmusmaximus)的研究中,乔玮等[17]对大菱鲆进行3个密度组养殖处理。研究发现,随着养殖密度的增加,大菱鲆的总蛋白酶(TMP)和淀粉酶(AMS)活力整体呈下降趋势;且随着时间的变化,每个密度组的TMP和AMS活力也呈现出下降趋势,120 d后,低密度组和中密度组的TMP和AMS活力表现均显著低于高密度组。本试验中,养殖进行到40 d时,高密度组中银鲳胃蛋白酶、胰蛋白酶显著低于0 h时水平,说明高密度养殖使得银鲳的胃蛋白酶、胰蛋白酶下降,蛋白质消化吸收能力下降,这将是导致高密度下银鲳生长缓慢的重要因素之一,这与乔玮等人的研究结果相一致。且本试验中低密度组和高密度组中的胰蛋白酶活性在0 h~40 d之间发生了一致且显著的先下降后上升再下降的变化,且低密度组的高峰期比高密度组更快到来,Bolasina等[28]研究牙鲆(Paralichthysolivaceus)时也发现了相同现象,牙鲆的高低密度组胰蛋白酶活性出现显著的升降变化,且低密度组的高峰期也出现在高密度组之前。邓超准等[18]在研究星洲红鱼时,对星洲红鱼进行5个密度组处理(M1、M2、M3、M4、M5),养殖30 d后测定其肝胰腺、肠、胃中的淀粉酶、蛋白酶、脂肪酶活力。结果发现在M3、M4这样的较高密度组中,三种组织中的四种消化酶的活力均显著高于M1组。Liang等[29]有关鲢(Hypophthalmichthysmolitrix)的研究结果也发现,高密度组鲢的AMS活力显著高于低密度组鲢。本试验中,在对银鲳幼鱼进行为期40 d的养殖后,高密度组银鲳幼鱼的淀粉酶、胰蛋白酶活力均显著高于低密度组,低密度组银鲳幼鱼的胃蛋白酶活性明显(P<0.05)高于中、高密度组,可见拥挤胁迫对胃蛋白酶的活性影响较大,养殖密度增大,酶的活性甚至低于初始的酶的活性水平。此外,养殖40 d后的高密度组中脂肪酶活性却显著低于中密度组和低密度组,这可能是拥挤胁迫使得银鲳的脂肪的消化能力大大下降,这也是本试验中高密度组银鲳生长率和增重率显著低于中密度组和高密度组的重要原因。研究表明,在高密度条件下,鱼类为了获取食物和协调种间关系,需要消耗更多的能量来对抗这些因素影响,这不仅会导致耗能活动增加,还会导致代谢水平的提高[30]。这可能是本试验中高密度组淀粉酶活力、胰蛋白酶活力显著高于低密度组的原因。
4 结论
综上所述,养殖密度对银鲳幼鱼的生长存在影响。试验中养殖密度为60 ind/m3的银鲳幼鱼的生长状况最好,而过高或过低的养殖密度都会对银鲳的生长造成不利影响。银鲳的体重生长方程表明20 d后,低密度组的生长速率明显下降,而高密度组也表现出低于中密度组的增重速率。关于消化酶水平的研究发现,养殖进行到40 d时,高密度组银鲳幼鱼淀粉酶和胰蛋白酶活力均显著高于低密度组,而胃蛋白酶和脂肪酶活力相较于中、低密度组明显下降。其中,胃蛋白酶和脂肪酶活性水平的下降可能揭示了高密度养殖环境下银鲳幼鱼因对食物中蛋白和脂肪的利用率较低而导致的增重率和特定生长率较低的问题。而另一方面,淀粉酶和胰蛋白酶活力的提高反映出银鲳幼鱼在高密度养殖条件下代谢水平的提高,这也会进一步加剧能量消耗,导致体重的增加减少及生长受到一定抑制。

