右美托咪定混合罗哌卡因用于程控硬膜外间歇脉冲式分娩镇痛的效果及对产时发热的影响
陈 磊,薛美,葛志平,蒋秀红,韩传宝*
1南京医科大学第一附属医院麻醉与围术期医学科,2产科,江苏 南京 210029
分娩时的疼痛引发机体一系列神经内分泌应激反应,可导致孕产妇机能与代谢的改变,从而影响子宫胎盘的血流灌注,对母婴产生不利影响。硬膜外分娩镇痛不仅能有效减轻分娩时的疼痛程度,提高孕产妇的分娩体验,而且可以降低剖宫产率,改善新生儿结局[1-3]。然而,随着硬膜外分娩镇痛的日益普及,产时发热的问题越来越引起临床关注。报道显示,硬膜外分娩镇痛相关产时发热(epiduralrelated maternal fever,ERMF)的发生率平均约20%[4]。ERMF 不仅影响产程的管理,而且由于母婴代谢率升高,体内酸性代谢产物蓄积,易引发酸碱平衡和电解质紊乱,严重者可威胁母婴的生命安全。目前,ERMF 的原因尚不明确,有非炎性学说,有局部麻醉药促进内源性致热源(前炎性因子)的释放等学说[3-4]。临床上不同药物的干预性研究报道日渐增多[5]。右美托咪定(dexmedetomidine,Dex)是一种高选择性α2肾上腺素能受体(α2-AR)激动药,具有镇静、镇痛、抗交感等多种药理作用,硬膜外腔应用Dex,可增强局麻药镇痛镇静的效果,同时可能有抑制寒战反应、抑制体温上升的作用。本研究拟在分娩镇痛中应用Dex,评价Dex 混合罗哌卡因用于程控硬膜外间歇脉冲式分娩镇痛的效果及对产时发热的影响,为临床用药提供参考。
1 对象和方法
1.1 对象
选取2022 年2—6 月自愿要求分娩镇痛患者104例,所有患者均例行常规产前检查,无硬膜外穿刺禁忌,无妊娠合并症或近期使用镇痛镇静药史,无神经精神类疾病史。本研究经南京医科大学第一附属医院伦理委员会批准(批准号:2021-SR-580),所有患者均签署知情同意书。
纳入标准:①年龄20~35岁,初产妇;②B 超示足月妊娠,单胎头位;③体重60~85 kg;④ASA Ⅰ~Ⅱ级;⑤宫口开至2~3 cm,经产科医生评估可以试产;⑥患者自愿要求实施分娩镇痛。排除标准:①分娩镇痛前鼓膜温度>37.3 ℃;②血小板计数异常、凝血功能障碍;③穿刺部位感染,严重腰腿疼痛、脊柱畸形;④严重心肺肝肾功能障碍或自身免疫性疾病者;⑤近期使用镇痛镇静类药物或麻醉药物过敏者。剔除标准:①硬膜外穿刺或镇痛失败(实施分娩镇痛后30 min内疼痛无缓解)者;②镇痛过程发生严重不良反应或意外情况者;③中转剖宫产者。根据随机数表,将研究对象分为两组,每组52例。由专门一人配制镇痛输液泵,用标签贴在镇痛泵电池盖里侧,分娩镇痛实施者和观察者对患者分组及镇痛泵配方均不知情。实验结束时,打开镇痛泵电池盖揭盲。
1.2 方法
所有纳入的研究对象待宫口开2~3 cm时,经产科医生再次评估确认可以试产,进入分娩镇痛间。室温设定24 ℃。开放外周静脉,常规行心电图、无创血压、脉搏血氧饱和度监测,并快速补液6~8 mL/kg。左侧卧位,选L2~3间隙穿刺。阻力消失法确定硬膜外腔,向头端置入硬膜外导管,并留置硬膜外腔导管长度4 cm。通过硬膜外导管注入1%利多卡因(批号:B200423101,河北天成药业有限公司)3 mL(含1∶20万肾上腺素),排除脊麻或血管内注射征象后,连接并开启程控间歇脉冲式输液泵(批号:2022022401,江苏爱朋医疗科技股份有限公司)。RD 组配方为0.1%罗哌卡因(批号:EE2114,浙江仙琚制药股份有限公司)混合0.5 μg/mL Dex(批号:201219BP,江苏恒瑞医药股份有限公司);RF 组配方为0.1%罗哌卡因混合1 μg/mL 芬太尼(批号:01D05241,宜昌人福药业有限责任公司),药液总量均为150 mL。设置脉冲剂量10 mL,间歇60 min,PCA 5 mL/次,锁定时间25 min,极限量30 mL/h。宫口开全时停药。
记录分娩镇痛前(T0)、给予负荷量后30 min(T1)、1 h(T2)、2 h(T3)、4 h(T4)、6 h(T5)、宫口开全时(T6)、胎儿娩出后2 h(T7)共8 个时点的疼痛视觉模拟评分(visual analogue scale,VAS)(0分无痛,10分为难忍剧痛)、鼓膜温度(≥38.0 ℃定义为发热)。记录起效时间(硬膜外首剂量输注结束至VAS≤3分)。记录T1和T6时的Ramsay 镇静评分(1 分:不安静、烦躁;2 分:安静合作;3 分:嗜睡,能听从指令;4 分:睡眠状态,但可唤醒;5 分:对呼唤反应迟钝;6 分:深睡,对呼唤无反应。Ramsay 评分大于4分为过度镇静)和Bromage分级(0级:无运动神经阻滞;1级:不能屈髋;2级:不能屈髋、屈膝;3级:不能屈髋、屈膝、踝关节)。分别于T0和T7两个时点,于非输液侧抽取肘静脉血3 mL,检验血白细胞计数和C 反应蛋白水平。胎儿娩出时,行脐动脉血气分析。记录爆发痛(在VAS<3 分的基础上,突发短时性的疼痛,VAS 评分≥4 分)、不良反应(尿潴留、头晕、恶心呕吐、皮肤瘙痒、寒战)情况和新生儿1 min、5 min Apgar评分。当鼓膜温度≥39.0 ℃时,口服对乙酰氨基酚0.5 g;血压低于基础值的80%时,静脉注射麻黄碱5 mg。
1.3 统计学方法
采用SAS 9.1 软件进行统计学处理。根据预实验组结果,参照文献[6]鼓膜温度降低0.5 ℃有临床意义,根据两样本均数比较样本量的计算公式:n1=n2=,设定σ=0.7,采用双侧检验,拟定检验标准α=0.05,检验效能1-β=90%,允许脱落率10%,计算每组样本量至少46例。计量资料采用均数±标准差()表示,组间比较采用独立样本t检验,组内比较采用重复测量设计的方差分析。计数资料采用χ2检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
2.1 患者一般情况比较
共纳入104 例研究对象,其中RD 组有2 例镇痛失败,1 例中转剖宫产;RF 组有2 例中转剖宫产,剔除后,共收集有效分析数据99 例(RD 组49例,RF 组50 例)。2组患者的年龄、身高、体重、孕周比较差异均无统计学意义(P>0.05,表1)。
表1 两组产妇年龄、身高、体重及孕周比较Table 1 Comparison of maternal age,height,weight,and gestational week between the two groups ()
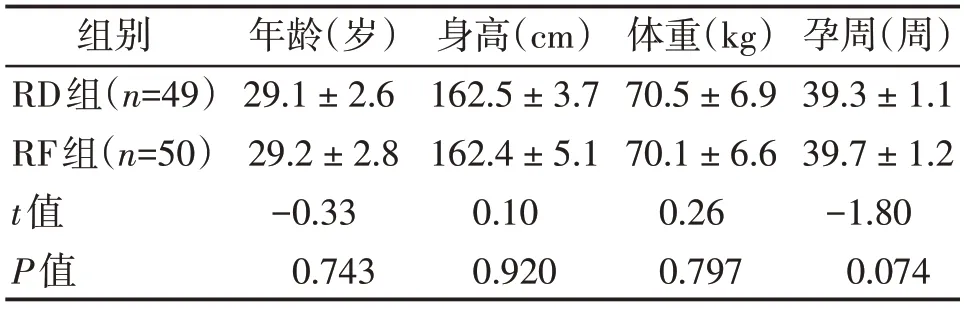
表1 两组产妇年龄、身高、体重及孕周比较Table 1 Comparison of maternal age,height,weight,and gestational week between the two groups ()
2.2 患者镇痛情况比较
2组均没有过度镇静(Ramsay评分>4分)。Bromage 评分均为0 分。RD 组镇痛起效时间明显短于RF组。分娩镇痛前,两组患者VAS评分均>7分,组间比较差异无统计学意义(P>0.05);镇痛后,2 组各时点的VAS 评分均明显下降(P<0.01),组间比较,RD 组T2~T6时点的VAS评分分别低于RF 组(P<0.05,表2)。
表2 两组患者镇痛起效时间和不同时点VAS评分的比较Table 2 Comparison of analgesic onset time and VAS scores at different time points between the two groups ()

表2 两组患者镇痛起效时间和不同时点VAS评分的比较Table 2 Comparison of analgesic onset time and VAS scores at different time points between the two groups ()
与T0比较,aP <0.05;与RF组比较,bP <0.05。
2.3 患者产时发热情况比较
与T0时比较,镇痛后2 组患者鼓膜温度均呈升高的趋势,至T6时达峰。组间比较,RD组T4~T7时点的鼓膜温度分别低于RF 组(P<0.05)。RD 组的发热率低于RF组(P<0.05,表3)。
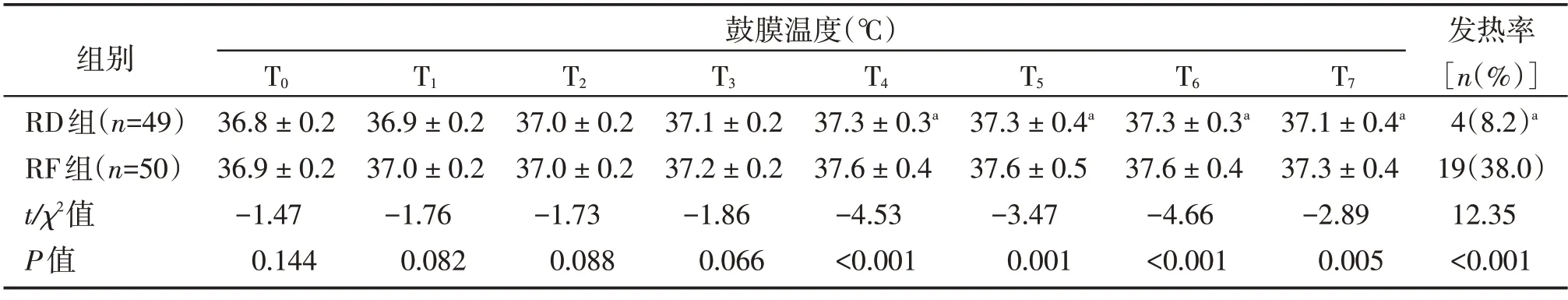
表3 两组患者鼓膜温度和发热情况的比较Table 3 Comparison of tympanic membrane temperature and fever status between the two groups
与T0时比较,两组患者T7时的白细胞计数和C反应蛋白水平均明显升高(P<0.01);各时点组间比较,差异均无统计学意义(P>0.05,表4)。
表4 两组患者血白细胞计数、C反应蛋白水平比较Table 4 Comparison of blood leukocyte counts and C-reactive protein levels between the two groups ()
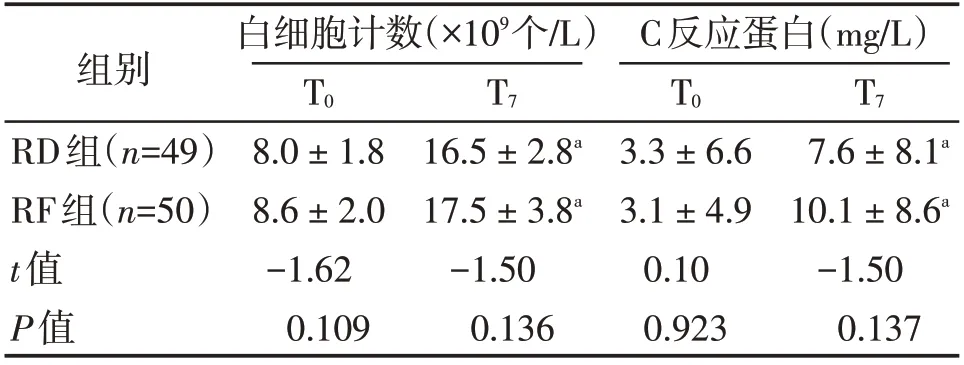
表4 两组患者血白细胞计数、C反应蛋白水平比较Table 4 Comparison of blood leukocyte counts and C-reactive protein levels between the two groups ()
与T0比较,aP <0.05。
2.4 新生儿情况比较
2 组新生儿1 min、5 min Apgar 评分,体重和脐动脉血气分析的比较差异均无统计学意义(P>0.05,表5)。
表5 两组新生儿情况和脐动脉血气分析比较Table 5 Comparison of neonatal status and cord arterial blood gases between the two groups ()
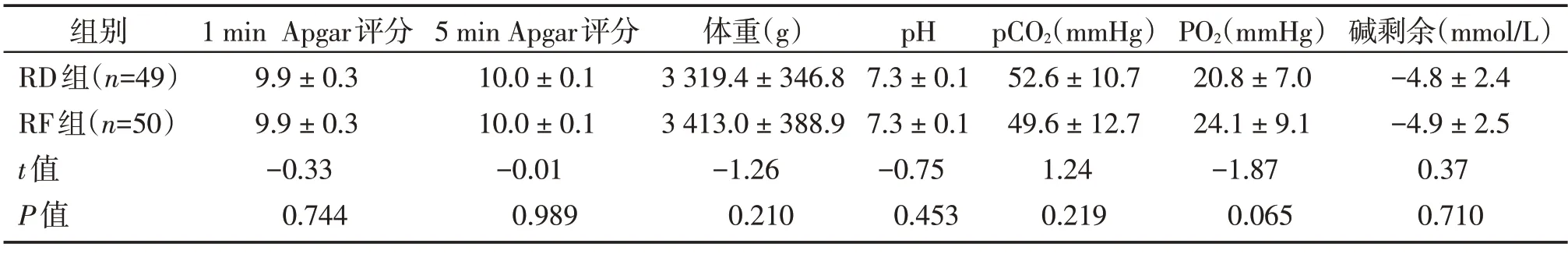
表5 两组新生儿情况和脐动脉血气分析比较Table 5 Comparison of neonatal status and cord arterial blood gases between the two groups ()
2.5 不良反应比较
与RF 组比较,RD 组皮肤瘙痒和爆发痛的发生率低(P<0.05,表6)。
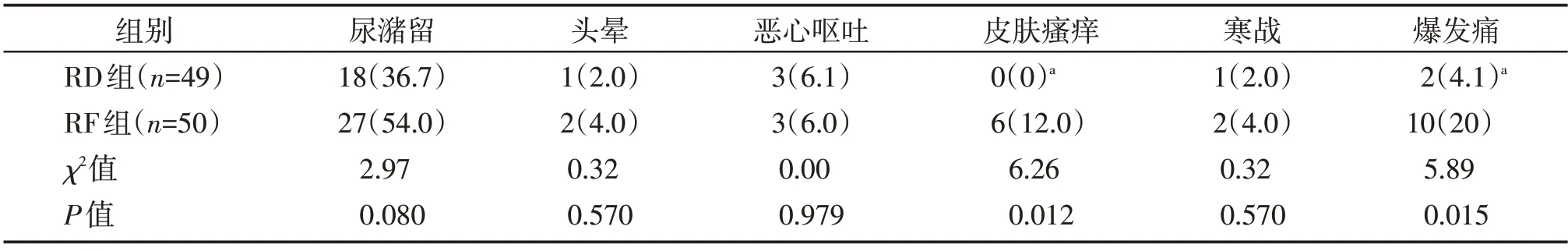
表6 两组不良反应和爆发痛发生情况比较Table 6 Comparison of adverse events and the incidence of breakthrough pain between the two groups [n(%)]
3 讨论
硬膜外自控镇痛是国内外公认的最安全有效的分娩镇痛方式。近年来,由于程控硬膜外间歇脉冲输注模式下局麻药液在硬膜外腔分布更广、镇痛效果更好而在分娩镇痛中的应用越来越多[7]。然而,这种输注模式对降低ERMF 的效果并不明显。因此,合理选用药物,降低ERMF 的发生率,延缓或抑制体温上升的幅度,具有更为重要的临床意义[4]。
本研究显示,RD组镇痛起效快、VAS评分低、爆发痛发生率少,说明Dex 可增强罗哌卡因硬膜外的镇痛效果,这与Qian 等[5]研究的结果相一致。分析可能的机制为:①Dex 激动突触前膜α2-AR,抑制突触前膜去甲肾上腺素的释放,同时激动突触后膜α2-AR,细胞膜发生超极化,从而抑制疼痛信号的转导;②Dex 激动α2-AR 亚型α2B受体引起微循环血管收缩,延缓药物吸收,并可阻断敏感性电压门控性钠通道,抑制神经细胞膜动作电位,产生局麻药样效应;③Dex脂溶性高,易被硬膜外腔脂肪组织吸收入血,产生镇静作用,从而降低机体对疼痛刺激的兴奋性。
越来越多的临床观察发现,硬膜外分娩镇痛相关产时发热是临床常见的现象,但具体机制尚不明确。Neal等[8]对潜伏期和活跃期患者检测中性粒细胞和炎性细胞因子,经比较分析后推测,分娩本身可能就是一个炎症的过程。Del Arroyo 等[9]研究认为,硬膜外镇痛中局麻药的免疫调节作用可促进体内促炎因子的释放,从而放大这一炎症过程。Zhao等[10]回顾687例ERMF患者,并与687例非ERMF患者比较分析,发现入院时患者血清白细胞计数和C反应蛋白水平并不能预测ERMF 的发生,而预防性应用抗生素也未能降低ERMF 的发生率(38%vs.40%,P=0.68),提示ERMF 可能是一种非感染性炎症。本研究两组患者分娩镇痛分娩后血白细胞计数和C 反应蛋白水平明显高于分娩镇痛前,也提示了硬膜外分娩镇痛可能是一个炎症的过程,但由于这一过程的影响因素繁杂,除了上述分娩过程中个体炎症反应的强弱和硬膜外镇痛放大炎症过程的程度差异外,其他如破膜时间的长短、羊水污染的程度、阴道检查的次数[11],以及尽管镇痛评分相似但个体对局麻药反应的差异等,致使两组间白细胞计数和C反应蛋白水平并没用统计学差异。然而,大量的临床观察显示,进入产程孕产妇的体温呈进行性升高,硬膜外镇痛后体温升高更为明显[12],平均约为0.06 ℃/h[9]。因此建议,如同逐渐接受椎管内分娩镇痛致第二产程延长一样,相应建立与产程相关的正常体温参考值范围[12]。
实际上,不论是硬膜外分娩镇痛,还是连续蛛网膜下腔分娩镇痛,两者都有相似的分娩镇痛相关的发热率(11.1%vs.9.9%)[13]。推测其原因,除了上述可能的原因和传统的产热散热失衡以及主流的非感染性炎症机制外,还可能与镇痛平面的出现,导致下丘脑体温调节中枢对镇痛平面与非镇痛平面感知的差异,出现了体温调节的偏差有关,而且这种偏差有随着硬膜外腔局麻药浓度的增加而出现调节偏差增大的现象[14]。本研究中,RD 组发热率和发热程度均低于RF组,可能的原因有:①Dex激动中枢α2-AR,抑制母体体温调节中枢;②Dex 激动中枢α2-AR,抑制神经元放电和单胺类神经递质的释放,抑制肌颤或寒战反应,减少产热;③Dex混合罗哌卡因镇痛效果好,同时产生中枢镇静、抗交感作用,产热减少;④Dex具有抗炎作用,抑制IL-6、TNF-α等炎症因子的表达[15]。另外,动物实验显示,敲除小鼠α2-AR受体基因,Dex 的低温效应也被消除[16]。
大量研究显示,硬膜外腔使用阿片类药物虽然可以增强镇痛效果,但会增加皮肤瘙痒等不良反应的发生率。这可能是RD组皮肤瘙痒的发生率低于RF组的主要原因。
综上所述,Dex 可增强罗哌卡因硬膜外分娩镇痛的效果,降低硬膜外分娩镇痛相关产时发热的几率和程度,而对母婴无不良影响。

