赤泥硫酸铵焙烧浸出液水解制备偏钛酸的研究
潘思呈,徐红彬,张红玲,董玉明,张宏军,娄太平
(1.东北大学,辽宁沈阳 110819;2.中国科学院绿色过程与工程重点实验室,北京 100190;3.中国科学院过程工程研究所战略金属资源绿色循环利用国家工程研究中心,北京 100190;4.中国科学院大学,北京 100049;5.甘肃锦世化工有限责任公司,甘肃张掖 734500)
赤泥是氧化铝行业产生的一种大宗固体废弃物[1],根据铝土矿类型和生产工艺不同,生产1 t氧化铝会产生0.6~2.5 t赤泥。据统计,中国赤泥每年的排放量超过1亿t,累计堆存量超过10亿t[2]。由于赤泥细小且具有强碱性,常用的筑坝堆存处置方式存在较大的安全隐患和环境风险[3],亟待更多的赤泥处置方法来减少这些风险。赤泥中富含多种有价金属元素,如铝、铁、钠、钛、钪、钒、钇等,是一种可综合利用的二次资源。其中,赤泥中二氧化钛(TiO2)的质量分数为1.9%~21.2%[4],具有较高的提取利用价值。
目前,赤泥提钛方法已有较多报道,主要分为两类:湿法提钛和火法-湿法联合提钛[5]。研究表明,直接酸浸可有效回收赤泥中的钛,且浸出率较高[6],但是直接酸浸提钛的条件通常较为苛刻,控制不当将直接影响钛的浸出。另外,酸浸液中其他有价金属元素难以分离,且易产生大量含酸废液[7]。火法-湿法联合提钛是指在酸浸前对赤泥进行焙烧预处理,使其矿物结构发生改变,提高浸出选择性,然后再通过酸浸提钛。在提取钛的同时,其他有价金属元素也得到富集[8]。然而,火法-湿法联合提钛工艺存在流程长、能耗高、尾渣量大等问题,至今尚未实现工业化应用。
针对赤泥提钛存在的技术难题,中国科学院过程工程研究所提出了赤泥硫酸铵焙烧-水浸法同步回收赤泥中有价金属的技术路线[9]。该方法以硫酸铵为分解剂,通过低温焙烧酸解,将赤泥中的钛转化为可溶性硫酸盐,然后通过水浸法将钛转移至浸出液中,从而实现钛的高效提取。然而,在低温焙烧酸解过程中,赤泥中的其他有价金属如铁、铝、钠等也会进入溶液,导致浸出液成分复杂。同时,浸出液中含大量铵根(NH4+)和硫酸根(SO42-),导致其稳定性较差。因此,如何高效分离与回收赤泥硫酸铵焙烧浸出液中的钛是该技术实现产业化应用的关键。
目前,从酸性浸出液中分离回收钛的方法主要有溶剂萃取法和水解沉淀法[1]。溶剂萃取法具有选择性高、分离效果好的优点,已被广泛应用于酸浸液中钛的提纯与分离[10]。溶剂萃取法通常在低温下操作,而赤泥硫酸铵焙烧浸出液的低温稳定性较差,在萃取过程会发生结晶或沉淀反应,影响钛的分离[11]。水解沉淀法具有工艺简单、过程易于控制等优势,已实现工业化应用。然而,现有的水解技术主要围绕高浓度的钛液体系[12],而硫酸铵焙烧浸出液(NH4+-SO42--Al3+-Fe3+-Na+-Ti4+)为低浓度的复杂体系,水解沉淀法不适用于赤泥硫酸铵焙烧浸出液体系。因此,有必要深入研究赤泥硫酸铵焙烧浸出液中钛的选择性水解。
通过将浸出液中三价铁离子(Fe3+)转化为二价铁离子(Fe2+),然后控制水解条件实现赤泥硫酸铵焙烧浸出液中四价钛离子(Ti4+)的选择性水解,进而得到钛沉淀产物。通过电感耦合等离子体发射光谱仪(ICP-OES)、X射线衍射仪(XRD)、红外光谱分析仪(FT-IR)、扫描式电子显微镜(SEM)、激光粒度仪等表征手段研究了还原铁粉添加比、水解温度、水解时间、终点pH、晶种添加量等因素对Ti4+水解行为的影响,并对沉淀产物进行了分析表征。本工作为低浓度复杂体系钛的分离与回收提供技术基础与理论依据。
1 实验
1.1 实验原料与试剂
将河南某氧化铝厂生产的赤泥与硫酸铵进行混合、焙烧、浸出,得到实验所需的原料液[9]。表1为赤泥硫酸铵焙烧熟料浸出液的化学组成,由表1可知,赤泥硫酸铵焙烧浸出液主要成分为Ti4+、Fe3+、Al3+、Na+、SO42-、NH4+等,浸出液中钛含量远低于工业钛液,且浸出液中NH4+、Fe3+、Al3+及SO42-含量偏高。在常温状态下,赤泥硫酸铵焙烧浸出液中存在结晶现象导致其低温稳定性较差。根据硫酸法制备钛白粉的工艺条件,并结合浸出液的主要组成,得出赤泥硫酸铵焙烧浸出液中酸比值(F)为20.35,铁钛质量比为3.73,pH约为1。

表1 赤泥硫酸铵焙烧熟料浸出液的化学组成Table 1 Chemical compositions of leaching solution of roasted mixture of red mud and ammonium sulfate
1.2 实验方法
取一定量的硫酸氧钛溶于80 ℃去离子水中制得Ti4+质量浓度为50 g/L的硫酸氧钛溶液,待溶解完毕后升温至沸腾,保持沸腾状态10 min,然后在95 ℃下保温,当晶种稳定性在90~140 mL时,制得晶种[13]。
首先在通入氮气的条件下将赤泥硫酸铵焙烧浸出液加热至65 ℃;然后加入还原铁粉,搅拌20 min,使浸出液中的Fe3+充分还原为Fe2+;加入氨水调节浸出液pH,随后添加晶种并升温至设定温度后进行水解,水解过程不断调节浸出液pH;水解结束后,进行固液分离,得到偏钛酸颗粒和水解母液。
采用ICP-OES测试浸出液、水解母液中钛、铁含量;采用激光粒度分析仪测量偏钛酸的粒径;采用XRD、FT-IR表征分析偏钛酸的物相组成与结构;采用SEM分析偏钛酸的表观形貌;采用热重-差热分析法(TG-DTA)分析偏钛酸的热分解过程。
根据公式(1)和(2)计算钛的水解率及铁的损失率。

式中:ηTi、ηFe分别为钛的水解率和铁的损失率,%;C0Ti、C1Ti分别为水解前后溶液中钛的质量浓度,g/L;C0Fe、C1Fe分别为水解前后溶液中铁的质量浓度,g/L;V0、V1分别为水解前后溶液体积,L。
根据公式(3)和(4)计算还原铁粉添加比及晶种添加量。

式中:R为还原铁粉添加比;A为晶种添加量,%;m铁粉为还原铁粉添加量,g;m理论为浸出液中Fe3+全部还原为Fe2+所需的还原铁粉理论量,g;mTi晶种为加入晶种溶液的钛量,g;mTi浸出液为浸出液中的总钛量,g。
2 结果与讨论
2.1 赤泥硫酸铵焙烧浸出液中钛的水解
2.1.1 还原剂添加量对钛水解率的影响
以还原铁粉为还原剂,在水解温度为140 ℃、水解时间为3 h、水解终点pH=2.0的条件下,考察还原铁粉添加比对钛水解率及铁损失率的影响,结果如图1所示。由图1可知,增大还原铁粉添加比,钛水解率升高,溶液中铁损失率降低。当还原铁粉添加比为1时,钛的水解率达96.98%,铁损失率为3.28%。由分析可知,赤泥硫酸铵焙烧浸出液中Fe3+和Ti4+在水解条件下分别形成黄铵铁矾和偏钛酸,同时释放出H+。因此,Fe3+和Ti4+的水解过程存在竞争关系,使得Ti4+的水解率受Fe3+浓度影响[14]。此外,Ti4+水解形成的偏钛酸粒子比表面积较大,黄铵铁矾易吸附在偏钛酸粒子的表面上,作为不良结晶位点,抑制偏钛酸的成核过程及Ti4+的水解过程[15]。随着还原铁粉添加比的增大,溶液中Fe3+浓度降低,Fe3+对Ti4+水解的影响减弱,从而提高了钛水解率。但是,当还原铁粉添加比为1.1时,钛水解率急剧下降,这主要是因为过量的还原铁粉将浸出液中的Ti4+还原为Ti3+,从而造成浸出液中钛水解率的降低[16]。

图1 还原铁粉添加比对钛水解率及铁损失率的影响Fig.1 Effect of addition ratio of reduced iron powder on hydrolysis efficiency of Ti and loss ratio of Fe
图2为不同还原铁粉添加比下钛水解产物的XRD谱图。由图2可知,当还原铁粉添加比小于0.6时,水解生成的产物中含有明显的黄铵铁矾衍射峰(PDF#26-1014),推测在水解过程中,Fe3+与钛共同水解使得产物中杂质较多;当还原铁粉添加比为0.8及以上时,黄铵铁矾的杂质峰消失;当还原铁粉添加比为1.0时,在2θ=17°及2θ=28.54°处出现了一些归属于Fe2+的水解聚合物的杂峰;当还原铁粉添加比为1.1时,根据离子还原顺序得知,体系中不存在Fe3+,同时XRD谱图中未检测出明显的杂质峰,这可能是因为杂质含量较少,杂质衍射峰被遮盖,因而检测不出相应的杂质衍射峰。以上结果说明,还原铁粉的添加可以有效降低水解产物中铁的含量,提高水解反应中选择性分离钛的效果,因此最佳的还原铁粉添加比为1。

图2 不同还原铁粉添加比下钛水解产物的XRD谱图Fig.2 XRD patterns of titanium hydrolysates with different addition ratios of reduced iron powder
2.1.2 水解温度对钛水解率的影响
在水解终点pH=2.0、还原铁粉添加比为1、水解时间为3 h的条件下,考察水解温度对钛水解率的影响,结果如图3所示。由图3可知,随着水解温度的升高,钛水解率也随之升高。钛水解反应过程是吸热过程,当水解温度为110 ℃时,钛的水解率为36.68%。这是因为当温度较低时,溶液中分子间的有效碰撞行为较缓和,能量不易聚集到结晶中心,使得Ti4+水解过程中的形核生长期较长,导致钛水解速率较低[17]。当水解温度达到140 ℃时,溶液处于微沸状态,在此温度下,钛水解率达86.43%。这主要是因为升高温度后,溶液中粒子间的无规则运动速率加快,反应活化分子数量增加,提高了Ti4+与H2O的有效碰撞,加快了晶体形核速率,使得钛水解率提高。继续升高温度,沸腾加剧,钛水解率仍继续增大,但升高幅度不大。因此,最佳水解温度为140 ℃。
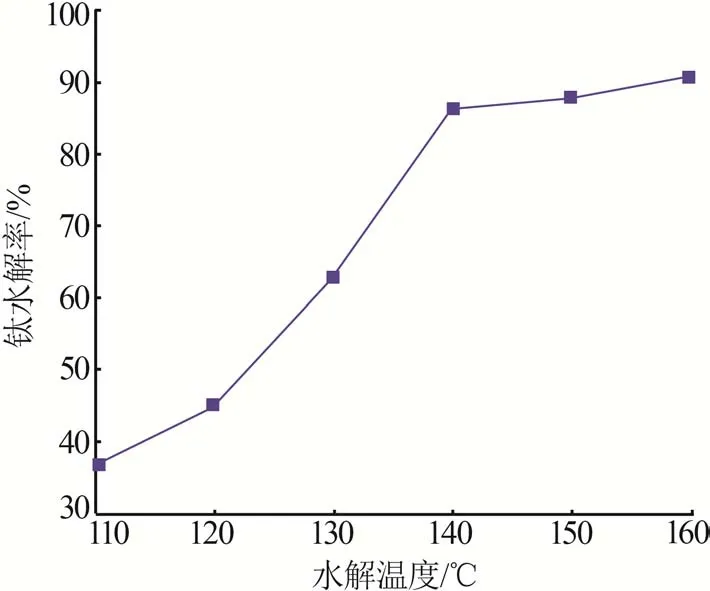
图3 水解温度对钛水解率的影响Fig.3 Effect of hydrolysis temperature on hydrolysis efficiency of Ti
2.1.3 水解时间对钛水解率的影响
在终点pH=2.0、水解温度为140 ℃、还原铁粉添加比为1的条件下,考察水解时间对钛水解率的影响,结果如图4所示。由图4可知,随着水解时间的延长,钛的水解率逐渐升高。根据文献[18]报道,硫酸钛液的水解过程包括3个阶段:晶核形成阶段、晶核成长与沉淀形成阶段、偏钛酸粒子凝聚沉析阶段。当水解时间为1 h时,钛水解率仅为44.06%,但水解速率较高,此时钛的水解处于晶体形核阶段,在此阶段,反应自发生成晶核,其他Ti4+以晶核为中心生长,钛水解率不断增大;当水解时间为2~3 h时,水解率最高达87.23%,但水解速率有所减缓,此阶段主要为偏钛酸的长大与凝聚阶段,水解粒子的生长降低了其表面活性[19],导致水解速率降低;继续延长水解时间至6 h,钛水解率缓慢提高至93.92%,此阶段以偏钛酸的团聚为主。因此,最佳水解时间为4 h。
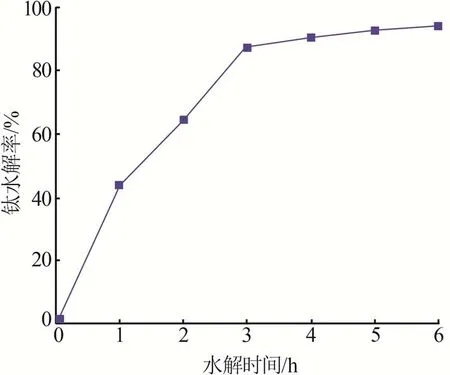
图4 水解时间对钛水解率的影响Fig.4 Effect of hydrolysis time on hydrolysis efficiency of Ti
2.1.4 终点pH对钛水解率的影响
在水解温度为140 ℃、水解时间为4 h、还原铁粉添加比为1的条件下,考察终点pH对钛水解率的影响,结果如图5所示。由图5可知,提高水解终点的pH,钛水解率逐渐增大,当终点pH为2.0时,钛水解率达到96.34%,继续提高终点pH,钛水解率下降。当终点pH由1.6调节至2.0时,水解率逐渐上升,这是由于Ti4+水解是羟基的脱氢聚合过程,随着水解反应的进行,体系中H+含量增加,使得水解体系的酸度增大,从而抑制水解反应的进行,因此提高pH可以促进Ti4+水解反应向正方向进行。当继续提高水解终点pH至2.4时,钛水解率逐渐降低,这是由于赤泥硫酸铵焙烧浸出液成分复杂,且Al3+、Fe2+等杂质浓度较高,钛、铁水解反应平衡常数分别为KTi=1×1015、KFe=0.25×1024,在实际水解过程中,较高pH下均可发生沉淀反应[14],且KFe远大于KTi,所以随着pH升高,Fe优先发生水解沉淀,在一定程度上阻碍了Ti4+的水解反应,导致钛水解率下降[20]。因此,最佳终点pH为2.0。
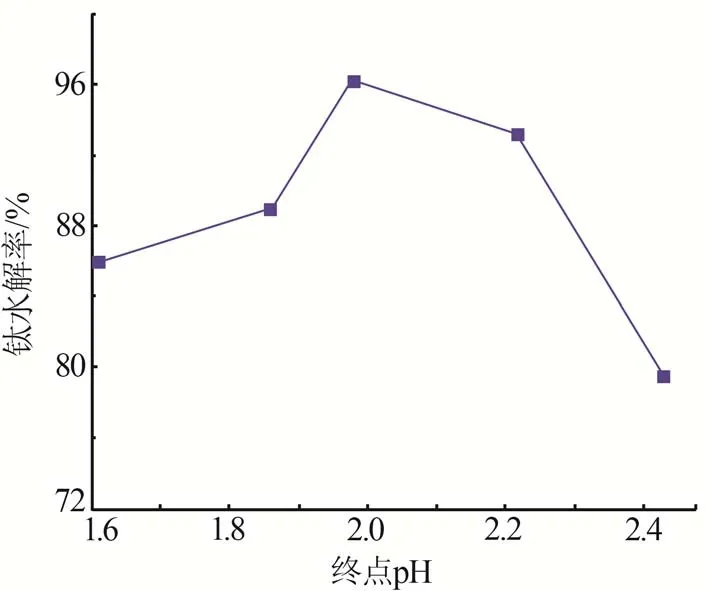
图5 终点pH对钛水解率的影响Fig.5 Effect of end point pH on hydrolysis efficiency of Ti
2.1.5 晶种添加量对钛水解率的影响
在终点pH为2.0、水解温度为140 ℃、水解时间为4 h、还原铁粉添加比为1的条件下,考察晶种添加量对钛水解率的影响,结果如图6所示。由图6可知,随着晶种添加量的升高,Ti4+水解率也呈上升趋势。晶种的加入降低了偏钛酸的生长活化能,即随着水解反应的进行,水解产物直接以晶种为反应中心进行结晶聚合并长大,减少了反应体系中自生晶种所需的生长活化能,因此添加晶种可诱导水解反应的进行。当晶种添加量在0~5%时,钛水解率增加较为缓慢;当晶种添加量超过5%时,钛水解率升高的幅度较快;当晶种添加量超过9%时,钛水解率维持在95%。分析可知,当加入晶种过少时,晶体诱导中心不足,水解过程还需要依靠自身反应形成的结晶中心,导致水解反应过程较慢,水解率偏低。因此,最佳的晶种添加量为9%。
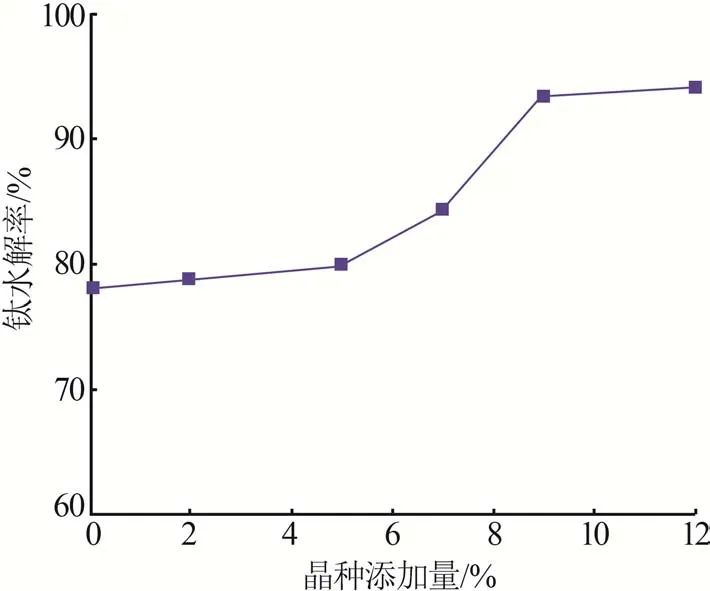
图6 晶种添加量对钛水解率的影响Fig.6 Effect of additive amount of seed on hydrolysis efficiency of Ti
2.2 最优水解产物分析表征
图7为最优水解条件(水解温度为140 ℃、水解时间为4 h、还原铁粉添加比为1、终点pH=2.0)下所得产物的XRD谱图。由图7可知,水解所得沉淀产物的衍射峰较宽,衍射强度较低,表明偏钛酸的结晶度较低,对比标准卡片(PDF#00-001-0562)可以看出产物具有锐钛矿晶型结构。这是由于在硫酸氧钛溶液体系中,水解初期所生成的偏钛酸具有锐钛型微晶结构,随着水解反应的进行,偏钛酸在硫酸根的作用下加速凝聚并沉降析出,造成水解过程中偏钛酸的聚集速率大于结晶速率,导致新生成的偏钛酸粒子不能均匀地在初始晶核上沉析,使得水解产生的偏钛酸呈现锐钛矿结构但结晶度较低[21-22]。

图7 Ti水解产物的XRD谱图Fig.7 XRD patterns of hydrolysate of Ti
图8为最优水解条件下所得产物的SEM照片。由图8看出,水解产物主要由直径为0.5~1 μm的球状体颗粒及当量直径为1~3 μm的有棱角、不规则团聚块状聚集体构成。团聚现象的出现是由于在水解反应过程中,浸出液中的杂质离子使偏钛酸粒子在成核过程中产生晶面缺陷,导致新的晶体以此为中心生长,进而发生团聚[23-24]。

图8 Ti水解产物的SEM照片Fig.8 SEM image of hydrolysate of Ti
图9为最优水解条件下所得产物的红外光谱图。由图9可知,在3 400 cm-1附近存在一个不对称的宽峰归属于Ti—OH的—OH伸缩振动,1 630 cm-1处的峰归属于水的—OH弯曲振动,1 055 cm-1处的峰为自由HSO4-的谱峰,1 120 cm-1处的峰为化学吸附的SO42-伸缩振动峰,568 cm-1处存在一个不对称的宽峰归属于无定型的Ti—O结构[25]。由此可以推测,水解产物具有偏钛酸结构,且存在一些吸附残留的硫酸。

图9 Ti水解产物的红外光谱图Fig.9 FT-IR spectrum of hydrolysate of Ti
图10 为最优水解条件下所得产物的TG-DTA曲线。由图10可以看出,水解产物偏钛酸的质量损失分为3个阶段。第一阶段为30~120 ℃,此阶段处于100 ℃左右的低温段,质量损失为偏钛酸产物快速脱去吸附水所致,120 ℃的DTA曲线上也呈现出较强的吸热峰,该阶段质量损失约为4.3%;第二阶段为120~530 ℃,质量损失约为8.7%,失重主要原因为氢氧化物脱羟基分解[26];第三阶段为530~800 ℃,质量损失约为6.4%,失重主要原因为水解产物中硫酸根的分解,该阶段的DTA曲线也呈现出较为明显的吸热峰,同时该阶段还伴随着水解产物晶体由无定型转变为锐钛矿晶相的过程[27-28]。综合以上分析,确定产物中的吸附水、结晶水、SO42-与TiO2的质量比为0.55∶1.1∶0.8∶10,根据质量比推测水解产物的主要分子式为TiO2·0.7H2O·0.08SO3。

图10 Ti水解产物的TG-DTA曲线Fig.10 TG-DTA curves of hydrolysate of Ti
3 结论
本文探究了赤泥硫酸铵焙烧浸出液中钛选择性水解生成偏钛酸的过程,采用ICP-OES考察了不同水解条件对钛水解率的影响,并通过FT-IR、XRD、SEM、TG-DTA等表征方法分析了偏钛酸产物的结构特征,具体结论如下:1)还原铁粉的添加可以有效分离水解产物中的铁杂质,提高产物的纯度,实现浸出液中钛的有效分离回收。2)赤泥硫酸铵浸出液选择性水解生成偏钛酸的最优水解工艺:还原铁粉添加比为1、水解温度为140 ℃、水解时间为4 h、终点pH=2.0、晶种添加量为9%,此时水解率可以达到95%。3)水解产物是结晶度低的锐钛矿晶型偏钛酸;水解产物形貌呈不规则的圆形球体及块状聚集体;热分解过程主要分为3个阶段,分别为吸附水的蒸发、结晶水的蒸发以及脱硫反应,偏钛酸吸附有一定量的硫酸盐,其组成为TiO2·0.7H2O·0.08SO3。

