NF3与CF4分离纯化技术路线研究进展
周言,钟强,刘倩,黄国强,2
(1.天津大学浙江研究院(绍兴),浙江 绍兴 312300;2.天津大学 化工学院,天津 300350)
三氟化氮(NF3)常温常压下是一种无色无味的气体,广泛用于电子行业中生产硫化磷(P4S3)、碳质薄膜、高能激光器、等离子蚀刻、等离子沉积室清洁剂和等离子晶片等[1]。NF3散装高纯电子气体中杂质四氟甲烷(CF4)的浓度水平已成为影响该气体纯度的最重要的工业问题之一。通常,对于半导体工业和集成电路(IC)等的大规模生产的工业应用,需要的NF3纯度至少达到99.999%(≥5N)[2]。当杂质CF4浓度超过20 mL/m3时就会导致电子器件出现严重的缺陷,进而产生非常低质量的等离子蚀刻产品以及不需要的残留物[3]。
由于NF3和CF4气体在物理和化学性质上的高度相似性,两者的分离通常存在困难。目前有许多用于纯化NF3的商业方法,包括使用沸石[4]、碳分子筛和5A分子筛[5],以及低温精馏等[6]。一般来说,当前的低温精馏技术会导致过高的冷却和公用工程成本;吸附法需要非常高的吸附剂维护和更换成本;膜技术也在选择性、渗透率、处理量、维护性和成本等方面受膜材料性能的限制。而就投资资本、运营成本和维护费用而言,吸收是迄今为止最经济的技术[7-9]。
本文通过进行详尽的文献回顾,总结了目前可用的5种NF3中的CF4杂质的分离纯化技术:低温精馏、吸附、膜分离、萃取精馏和溶剂吸收。指出了能够实现NF3与CF4分离纯化最合适的工艺技术路线。
1 物化特性
1.1 NF3的性质
NF3是一种无色且稳定的气体,键能较低,因而在高温下能够表现出氧化特性[10]。NF3分子具有三角锥型分子结构,其中氟原子和自由电子对的密集电子云产生的偶极矩为0.24[11]。NF3在环境温度下不与水反应,但在100 ℃的碱性水溶液中能够水解[10]。NF3与Fe、Bi和Cu等金属在≥300 ℃时反应生成金属氟化物和N2F4[12]。由于NF3具有氧化能力,在吸入后其会产生高铁血红蛋白,进而导致缺氧死亡[13]。大鼠实验表明,吸入后肾脏和肝脏有轻微的组织溶解,同时脾脏变黑和变大,推断有突变的可能性[14]。美国政府工业卫生专家协会(ACGIH)公布的NF3阈值限值(TLV)为 10 mg/m3[15]。与等于1的CO2相比,NF3的全球变暖潜能值(GWP)为1.72×104[16]。
1.2 CF4的性质
CF4是一种最简单的全氟碳气体化合物,4个C—F键和F的高电负性导致C在CF4中表现出明显的正电荷特征,能够通过提供外部的离子特性来增强和缩短C—F键,因而CF4具有相对高的键强度[16-17]。CF4具有四面体结构,周围均匀分布电子云[18]。C—F是有机材料中最稳定的单键,其通过极化Cδ+和Fδ-产生静电吸引力来获得高的强度,其可被归类为惰性全氟化碳化学品[17]。CF4在沸腾的强酸中依然能够保持完整,并表现出显著的热稳定性[19]。根据分子体积,CF4可溶解O2、N2和CO2等气体,且溶解度与温度成反比,这在医学科学及其应用中具有重要意义[20]。此外,CF4是一种GWP值为6 500的温室气体[19]。
1.3 NF3和CF4物理性质对比
CF4和NF3的物理性质对比见表1[21]。

表1 NF3和CF4的物理特性对比Table 1 Comparison of physical properties of NF3 and CF4
2 NF3与CF4分离纯化技术路线
当生产NF3时,除CF4杂质外,还可在NF3产品流中检测到其它痕量的杂质,如N2F2、N2O、CO2和H2O。N2F2可通过金属热表面的热解去除[22],而N2O、CO2和H2O则可以使用沸石去除[14]。由于NF3和CF4的物理性质极其相似,而且反应倾向也很小,因此它们的分离成本通常被认为相对过高并且分离过程非常复杂[23]。目前,可用于NF3纯化的技术路线汇总见表2。

表2 NF3纯化技术路线汇总Table 2 Summary of NF3 purification technology routes
2.1 低温精馏
将NF3与CF4进行分离最常用技术方法是低温精馏(制冷)。在该技术过程中,NF3与CF4混合物在-129 ℃下液化,并能够提纯至99.99%。虽然这个过程中可以产生高纯度的NF3气体,但由于操作温度极低,所以低温精馏是一个高度能源密集型的过程[27]。用于纯化NF3的低温精馏技术已通过添加HCl等洗涤液得到了进一步发展,这可以用于从气体混合物中脱除CF4以外的杂质(主要是氟化物),同时洗涤液可通过低温精馏过程实现回收再利用[24-25]。
Nagamura等[26]在专利中提出了一种耦合高低压过程的混合低温精馏工艺。首先对NF3原料气加压到0.6 MPa,并通过一个填充分子筛的常温吸附塔以除去其中的H2O和CO2杂质。然后,冷却该原料气至-70 ℃,并保持在填充活性氧化铝的吸附塔中进行低温吸附以脱除N2F2、N2F4、N2O和CF4。进一步地,剩余的混合物在-96 ℃下的中压精馏塔的再沸器中液化精馏。最后,中压精馏塔所得的产物混合物流经-150 ℃的低压蒸馏塔以获得 ≥99.999% 的超高纯度NF3作为最终产物。该工艺的优点是能够制备超高纯度的NF3。然而,由于需要在相对高的压力下提供NF3作为进料流而导致的高能量需求是其主要的缺点。
图1显示了从具有不同相对挥发度的气体混合物中纯化NF3的双塔低温精馏工艺示意图[28]。首先,将液化的原料混合物(NF3含量为30%)送入第一精馏塔以脱除N2O、N2和O2等高挥发性的轻组分杂质。然后,第一精馏塔底部获得的重NF3混合物送入第二精馏塔以脱除CF4等重组分杂质。该低温精馏过程在-192 ℃和0.3 MPa下运行,最终获得的NF3产品中总杂质浓度<10 mL/m3。
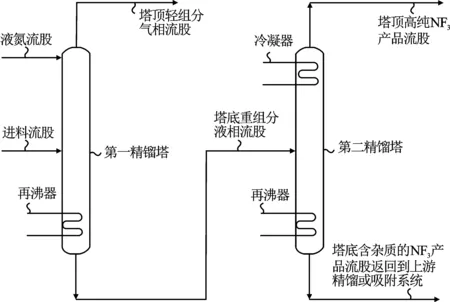
图1 双塔低温精馏纯化NF3工艺示意图Fig.1 Schematic diagram of two-tower cryogenic rectification purification process for NF3
2.2 吸附
用于NF3净化的物理吸附设备采用的吸附剂种类主要有沸石、分子筛和碳分子筛[4-5,22,29]。除了CF4杂质,NF3气流中还有其他几种杂质需要分离。沸石是最早用于此目的的吸附剂之一。N2F2是NF3生产中氧化和分解过程中生成的其他杂质之一,可以通过使用沸石进行脱除。但是这种吸附材料只在最初时有吸附效果,也会显著降低其他杂质的吸附能力,同时NF3也会被共吸附到沸石上,导致气体损失[22]。此外,由于N2F2的积累,可以在热的金属板材上引发NF3分解,从而产生大量热量。在极端的情况下,可能会发生爆炸。因此,N2F2需要先于其他杂质去除。作为候选,可以使用具有高熔点的元素周期表前三族的金属氟化物吸附剂从NF3气体中脱除N2F2杂质,这类吸附剂的操作范围通常在150~600 ℃[22]。
一些工业方法侧重于吸附NF3。例如,尺寸为0.49 nm的沸石(5A)可以在高于10 ℃的温度范围内选择性地吸附纯化NF3。图2中给出了使用这种尺寸的沸石分子筛进行NF3吸附纯化的工艺流程示例。在这种工艺流程中,NF3气体混合物被引入到具有结晶多孔的合成沸石中,收集解吸产生的NF3气体中最终的杂质为CF4,含量<40 mL/m3[4]。

图2 采用商业化的5A沸石纯化NF3的工艺流程示意图Fig.2 Schematic diagram of the process of purifying NF3 using commercial 5A zeolite
分子筛也已成功用于在低至-196 ℃的温度下选择性地吸附NF3。采用市售的分子筛能够将NF3气体混合物中的CF4净化至1 mL/m3以下[5,29-30]。采用填充林德A型分子筛(孔径范围为0.36~0.46 nm)的吸附柱的变压吸附工艺已证明可以完全纯化NF3中的杂质。
碳分子筛也被用于从NF3气流中脱除CF4杂质[5]。通过采用聚丙烯腈基碳分子筛(500~1 500 m2/g,1~1.5 nm)与含有0.01%~2%的CF4杂质的NF3气流接触,使杂质被筛子吸附而NF3没有显著吸附,在低于-39.3 ℃和0~1.4 MPa下持续接触15~25 s可将CF4杂质含量降低到1 mL/m3以下。
采用吸附法用于纯化NF3的总结见表3。

表3 用于纯化NF3的吸附方法总结Table 3 Summary of adsorption methods used to purify NF3
2.3 膜技术
膜技术在分离杂质含量相对较低的混合物方面表现出非常有效的潜力[36]。采用PI/ZIF-8型混合基质膜在纯化N2/NF3(90%/10%,质量分数)方面显示出良好的分离结果(分离选择性高达60)[37],这主要是由于与杂质N2相比,NF3分子的尺寸较小,因此目标气体NF3可以选择性地渗透通过混合基质膜。
对于NF3/CF4组成的气体混合物,采用无定形玻璃态全氟聚合物Hyflon AD60膜(美国苏威)和Teflon AF膜(特氟隆AF)显示出良好的分离能力(对NF3选择性介于3~13之间,渗透率介于 0.14~63),可将CF4杂质含量降低至 3 mL/m3,但该分离过程仍处于实验室研究阶段。这种分离过程所需的驱动力是不同分子间尺寸的差异,这与过滤器的作用类似。这些膜技术专为少量进料流而设计,因此可以纯化相对较高杂质浓度的目标气体(CF4进料浓度介于0~0.8%)[32]。图3展示了通过这种全氟聚合物膜从NF3中脱除CF4杂质的工艺流程示意图。其中,全氟聚合物膜被固定在对流形式的烘箱内以获得更精确的温度控制,同时使用串联的PDHID和TCD检测器以及双通道气相色谱法分别测量NF3和CF4的浓度[21]。

图3 用于NF3/CF4气体纯化的膜分离实验装置示意图Fig.3 Schematic diagram of membrane separation experimental device for NF3/CF4 gas purification
2.4 萃取精馏
萃取精馏是一种通过额外使用溶剂来改变待分离组分间的相对挥发性并因此提供组分分离可能性的精馏工艺。该技术通常用于分离组分间形成共沸物或沸点接近的混合物。分离剂或夹带剂或萃取剂能够改变待分离混合物间化学组分的逸度,从而产生排斥力,具有较高排斥力的组分很容易从液相混合物中脱离[38]。典型的萃取精馏工艺流程配置由两个塔组成,第一个塔用于从原料混合物中分离出第一种组分,另一个塔用于从底部产物中回收溶剂并在顶部得到第二种组分[39]。采用萃取剂(S)来分离两种组分(A+B)的典型的萃取精馏过程示意图见图4[39]。

图4 采用萃取溶剂(S)分离二元混合物(A+B)的 典型两塔萃取精馏过程示意图Fig.4 Schematic diagram of a typically two-column extractive distillation process using extraction solvent(S) to separate binary mixture (A+B)
萃取精馏塔设计中的溶剂选择主要分为两个阶段:官能团的识别以及各个候选溶剂的比较[40-41]。第一个阶段包括使用同系列、罗宾斯图、氢键特征和极性特征,其中主要包括分子间的相互作用分析;第二个阶段包括基于已识别溶剂之间的比较,通常考虑到沸点差异、无限稀释选择性和实验测量结果[40-41]。
采用萃取蒸馏工艺,并通过引入HCl作为形成共沸物(7%~9%HCl和93%~9%CF4)的萃取剂,可以将NF3中的CF4杂质降低至1~10 mL/m3,其中通过测试一系列来自全氟化合物(PFCs)、氯氟烃(CFCs)、烃类、氧化物和制冷剂等的不同化学家族的16种不同的萃取剂,所呈现的最佳结果是采用HCl作为萃取剂的情况。但是,使用萃取剂需要超低温(几乎是低温条件:-110~-40 ℃)才能获得理想的分离效果。其次,HCl是一种酸,从其处理的角度来看会带来严重的设备腐蚀问题,因而仍需要寻求更加节能环保的萃取剂。此外,由于该分离过程需要大量的平衡级(120~250级)以及高达1.0×106的大量回流比,因而所提出的方法在规模化生产上似乎是不现实的[6]。
此外,还可以采用一系列离子液体作为萃取剂来分离NF3和CF4[33]。在这种方法中,根据所选择的离子液体萃取剂(氟化阳离子和[SbF6]-阴离子),NF3或CF4可以被选择性地吸收,最终能够将CF4杂质水平降至10 mL/m3以下。由于NF3具有的氧化特性,其可能与离子液体发生作用(取决于热条件),从而有可能引发爆炸状态。此外,该方法中所采用的离子液体价格高昂,距离工业规模化生产有一段时间。
2.5 吸收
吸收是一种液体和气体之间的同时发生传质和传热的过程,随后在汽提塔中进行解吸,从而从气体混合物中去除一种或多种成分(例如在NH3生产中去除CO2杂质),并在液体成分中获得目标气体以新的混合物或化学反应生成物形式存在。这与吸收过程同等重要[42]。
在适用的情况下,吸收技术是迄今为止在气体分离过程(如CO2捕获)中获得的最广泛的应用。这是由于其高效率、低资本投资、低运营和维护成本以及该技术的先进发展[43-44]。吸收过程通过升高压力和降低温度来进行改进,这与需要加热和冷却介质以及利用压缩机来加压气体的汽提过程相反[45]。吸收塔根据其内部结构的不同可分为填料塔、湿壁塔、板式塔和喷淋塔。表4中总结了不同吸收塔结构的优缺点[46]。

表4 不同类型吸收塔的优缺点总结Table 4 Summary of the advantages and disadvantages of different types of absorption towers
吸收塔的设计过程中需要考虑和优化几个主要因素包括压力和流速。虽然建议吸收过程采用高的操作压力是有益的,但同时也意味着需要更高的功率输入,这通常可以通过成本效益分析来阐明[47]。此外,随着溶剂流速的增加,对于板式塔需要的塔板数量会减少,但这同时会导致更高的溶剂成本和更大的吸收塔直径。最佳的流速需要在塔板数量和溶剂成本之间进行权衡。低的化学吸收效率导致传质较弱,直接带来的结果是需要更大的吸附塔尺寸[47]。
相平衡数据是所有设计吸收和汽提塔的基本要求。迄今为止还没有NF3的高压气液平衡(HP-VLE)数据的报道,唯一得到的数据包括NF3在低压范围内在一系列高卤和全氟溶剂中的溶解数据[34]并进一步介绍了压力高达1.3 MPa的吸收塔设计,包括八个平衡级,气体流速为7.8 kmol/h,吸收剂流速为1.6 kmol/h。通过该方法,可将NF3/CF4进料中最初含有3 000 mL/m3的杂质CF4浓度降低到最终产品中的10 mL/m3[35]。虽然吸收法在纯化NF3的应用中看起来很有前景,但纯化过程的NF3浓度范围很窄(99.967%~99.999%)[48]。
3 结语与展望
NF3以其在半导体制造中展现出的优异的刻蚀效率和选择性以及不留任何残留物的清洗性能,已成为目前市场容量最大的电子特气产品。但是在NF3生产中会不可避免地引入CF4杂质,而NF3与CF4两者之间在物理和化学性质差别很小。因此,开发出NF3中的CF4杂质的纯化工艺技术成为制备高于99.999%的高纯NF3电子特气的主要难题之一。目前,可用于NF3中杂质纯化的商业化技术主要有5种,各有优缺点。这些技术包括低温精馏、分子筛吸附剂的吸附、膜技术、萃取精馏和吸收。
低温精馏技术除了其复杂的工艺过程,相较于吸收技术通常需要2倍的投资成本,而且需要在非常低的温度条件下运行(低至-192 ℃)。膜技术存在浓差极化、膜堵塞、膜寿命短、选择性差、气体处理量低、建设和维护成本高等缺点。由于NF3具有的氧化特性及与离子液体的相互作用,使用离子液体作为萃取剂的萃取精馏过程存在着火和爆炸的可能性,此外离子液体高的价格使它在商业规模上的可用性受限制。此外,也不建议使用HCl作为萃取剂,因为HCl的酸性可能会造成设备腐蚀和环境处置问题。吸附装置大多设计为在低流速下运行,并且在吸附剂再生过程中需要工厂停机进行清洁的间歇模式中运行。在针对NF3/CF4组成的特定系统,提出的不同类型的分离纯化技术方法中,主要目标是采用最有效的方法获得纯度等级为 99.999%的高纯NF3电子特气产品。通过调研相关可用的分离技术的文献报道,基于吸收和萃取精馏的方法是最佳的用于从NF3中纯化CF4杂质的工艺技术路线,理由如下。
(1)可以使用商业化的溶剂设计和运行吸收塔或萃取精馏塔。
(2)不需要像吸附和膜技术那样关闭工厂来回收吸收剂或萃取剂。
(3)除膜外,吸收剂或萃取剂不会变质,只需要回收溶剂并补偿溶剂损失。
(4)吸收或萃取精馏技术可以设计成以高的流速产生NF3。
更具体地说,吸收或萃取精馏技术可以在接近环境条件的温度下运行,克服了传统低温精馏和吸附技术方法所需的苛刻的低温问题。这降低了从工业级到高纯级的NF3生产的非常高的能源需求。但是,由于溶剂都会存在一定的腐蚀性而导致腐蚀的可能性。此外,溶剂的低生物降解性以及溶剂再生的高能量需求也是该技术存在的另外两个缺点。

